met het verwonden van gezond weefsel ontvouwt zich een voorspelbare progressie van fysiologische gebeurtenissen. Deze vooruitgang kan in de fasen van ontsteking, proliferatie, en rijping worden verdeeld. Elke fase wordt gekenmerkt door de opeenvolgende uitwerking van onderscheidende cytokines door specifieke cellen. Zie onderstaande afbeeldingen.
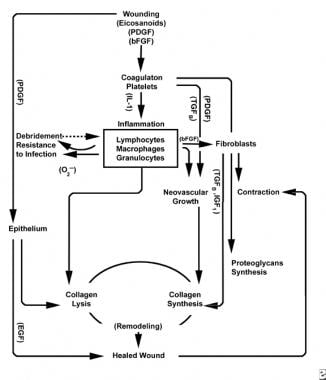 schema ‘ s van het wondgenezingsproces.
schema ‘ s van het wondgenezingsproces. 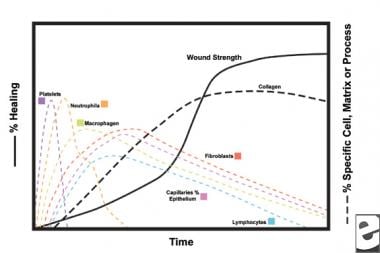 cellulaire kenmerken van het wondgenezingsproces.
cellulaire kenmerken van het wondgenezingsproces. - de ontstekingsfase
- de proliferatieve fase
- de rijpingsfase
- acute wonden gaan over het algemeen door middel van een ordelijk en tijdig herstelproces dat resulteert in een duurzaam herstel van anatomische en functionele integriteit. Nochtans, kunnen diverse fysiologische en mechanische factoren de helende reactie beà nvloeden, resulterend in een chronische wond die er niet in slaagt om door de gebruikelijke stapsgewijze vooruitgang te gaan. Lokale infectie, hypoxie, trauma, vreemde lichamen, of systemische problemen zoals diabetes mellitus, ondervoeding, immunodeficiëntie, of medicijnen zijn het vaakst verantwoordelijk.
de ontstekingsfase
de ontstekingsfase lanceert gelijktijdig hemostatische mechanismen en routes die de klinisch herkenbare hoofdverschijnselen van ontsteking creëren: rubor( roodheid), calor (warmte), tumor (zwelling), dolor (pijn) en functio laesa (functieverlies).
de verwonding aan vasculair weefsel initieert de extrinsieke coagulatiecascade door intracellular calcium en weefselfactor vrij te geven die factor VII activeren. de resulterende fibrinestop bereikt hemostase die door reflex vasoconstrictie wordt geholpen. Deze Stop fungeert als een rooster voor de aggregatie van bloedplaatjes, de meest voorkomende en “handtekening” celtype van de vroege ontstekingsfase.
bloedplaatjes werken een aantal pro-inflammatoire stoffen, zoals adenosinedifosfaat, weefsel groei factor beta (TGF-ß), en bloedplaatjes-afgeleide groeifactoren (PDGF). Deze de groeifactoren werken op omringende cellen in en bevorderen chemotaxis van neutrofielen, monocytes, en fibroblasten aan het gebied van verwonding.
verwonde weefsels, door geactiveerde phospholipase A, katalyseren tegelijkertijd arachidonzuren om vasoactieve prostaglandinen en thromboxaan te produceren, collectief bekend als eicosanoïden. Eicosanoïden bemiddelen activiteit beà nvloeden plaatjesplug vorming, vasculaire permeabiliteit, en cellulaire chemotaxis om wondgenezing te beà nvloeden. Thromboxane A2 bemiddelt bijvoorbeeld vasoconstrictie en bloedplaatjesaggregatie.
Na initiële vasoconstrictie manifesteren de klassieke tekenen van ontsteking zich door een verhoogde vasculaire permeabiliteit. Rubor is het resultaat van vasodilatatie, gemedieerd door prostacycline (PGI2), prostaglandine A (PGA), prostaglandine D (PGD) en prostaglandine E (PGE). Tumor en calor ontwikkelen als vasculaire endotheliale gaten te vergroten, waardoor de uitgang van plasma-eiwit en vloeistof in de interstitiële ruimte. Deze veranderingen worden versterkt door PGE2 en prostaglandine F2a (PGF2a) en staan het binnendringen van ontstekingscellen in het gebied van verwonding toe, met inbegrip van cellen die uitwerken. Dolor wordt waargenomen als pgi2, PGE en PGE2 werken op perifere nociceptoren.
in de tweede fase van de ontstekingsfase vervangen leukocyten bloedplaatjes als het dominante celtype, aangetrokken door chemotaxis. Witte bloedcellen (WBC ‘ s) zijn de belangrijkste cellen gedurende de eerste 3 dagen na verwonding; hun aantal piekt na ongeveer 48 uur. Polymorfonucleocytes (PMNs) zijn de eersten om bactericide activiteiten te beginnen gebruikend ontstekingsmediatoren en metabolites van zuurstof vrije radicalen. Echter, normale wondgenezing kan optreden zonder PMNs. Een andere leukocyt, de helper T-cel, werkt interleukine-2 (IL-2) uit. IL-2 bevordert verdere de celproliferatie van T om de immunogenic reactie op verwonding te vergroten.
aangezien pmn leukocyten na 24-36 uren beginnen af te nemen, gaan circulerende monocytes de wond in en rijpen in weefselmacrofagen. Deze cellen debride de wond op het microscopische niveau en produceren een grote verscheidenheid van belangrijke substanties, zoals IL-1 en fundamentele fibroblastgroeifactor (bFGF). IL-1 bevordert de proliferatie van ontstekingscellen en bevordert angiogenese door endothelial celreplicatie. bFGF is een chemotactische en mitogene factor voor fibroblasten en endotheelcellen. In tegenstelling tot PMNs, tast de uitputting van de macrofaag het gekronkelde helen ernstig aan, aangezien debridement, fibroblastproliferatie, en angiogenese allen verminderen.
tegen het einde van de ontstekingscyclus interageren de zich ontwikkelende milieu van eicosanoïden in de wond met de aanwezige celtypes, resulterend in fibroblastsynthese van collageen en gemalen substantie (van verhoogde Verhouding van PGF2a aan PGE2). Bovendien, zijn de macrophage-afgeleide de groeifactoren nu op optimale niveaus, die sterk de instroom van fibroblasten en dan keratinocytes en endothelial cellen in de wond beà nvloeden. Aangezien mononucleaire cellen WBCs en macrofagen blijven vervangen, begint de proliferatieve fase.
de proliferatieve fase
twee tot drie dagen na verwonding migreren fibroblasten naar binnen vanuit de wondranden over de fibrineuze matrix die tijdens de ontstekingsfase is vastgesteld. Tijdens de eerste week, beginnen de fibroblasten glycosaminoglycans en proteoglycans, de gemalen substantie voor granulatieweefsel, evenals collageen, in reactie op macrophage-samengesteld bFGF en TGF-ß, evenals PDGF te produceren.
fibroblasten worden al snel het dominante celtype, met een piek na 1-2 weken. Zij produceren niet alleen collageenmolecules maar ook cytokines zoals PDGF , TGF-ß, bFGF, de factor van de keratinocytegroei, en insulinlike de groeifactor-1. Fibroblasten assembleren ook collageenmolecules in vezels, die cross-linked zijn en in bundels worden georganiseerd. Collageen is de belangrijkste component van acute wond bindweefsel, met netto productie voortgezet voor de komende 6 weken. Het toenemende gehalte aan wondcollageen correleert met toenemende treksterkte.
Keratinocytes en endothelial cellen verspreiden zich ook tijdens deze tijd, uiteindelijk veroorzakend autocrine de groeifactoren die hun groei handhaven. De Endothelial uitbreiding draagt tot angiogenese bij, aangezien de intacte schepen knoppen in granulatieweefsel produceren. Neovascularisatie vergemakkelijkt de groei van de oprukkende lijn van fibroblasten in de wond, waardoor ze de nodige voedingsstoffen en cytokines krijgen.
de afbraak van het fibrinestolsel en de voorlopige matrix gaat gepaard met de afzetting van granulatieweefsel (gemalen stof, collageen, haarvaten), die doorgaat tot de wond bedekt is. Het verminderen van hyaluronzuur (in gemalen stof) niveaus en het verhogen van chondroïtinesulfaat niveaus vertragen fibroblast migratie en proliferatie terwijl het induceren van fibroblast differentiatie, overgang naar de rijpingsfase van wondgenezing.
de rijpingsfase
gedurende de eerste 6 weken domineert nieuwe collageenproductie het wondgenezingsproces, dat willekeurig wordt afgezet in acuut wondgranulatieweefsel. Aangezien de wond rijpt, wordt collageen verbouwd in een meer georganiseerde structuur met verhoogde treksterkte. Geleidelijk vervangt type I collageen type III totdat de normale huidverhouding van 4: 1 is bereikt. Aangezien het remodelleren doorgaat, bereikt de collagenolysis van matrijsmetalloproteinase een steady state met collageensynthese. Treksterkte plateaus bij 80% van de oorspronkelijke sterkte ongeveer 1 jaar najury.
oppervlakkig aan deze activiteit, epitheliale cellen blijven naar binnen migreren van de wondrand totdat het defect is bedekt. Op dit punt, veroorzaakt de contactremming transformatie van fibroblasten in myofibroblasten, die contractiele actinvezels bevatten. Daarna volgt wondcontractie, waarbij het beschadigde weefselvolume wordt vervangen door nieuw weefsel, hoewel de exacte rol van het myofibroblast niet volledig is opgehelderd.
acute wonden gaan over het algemeen door middel van een ordelijk en tijdig herstelproces dat resulteert in een duurzaam herstel van anatomische en functionele integriteit. Nochtans, kunnen diverse fysiologische en mechanische factoren de helende reactie beà nvloeden, resulterend in een chronische wond die er niet in slaagt om door de gebruikelijke stapsgewijze vooruitgang te gaan. Lokale infectie, hypoxie, trauma, vreemde lichamen, of systemische problemen zoals diabetes mellitus, ondervoeding, immunodeficiëntie, of medicijnen zijn het vaakst verantwoordelijk.
alle wonden zijn besmet, maar het meest succesvol weerstaan invasieve infectie. Wanneer de concentratie meer dan 100.000 (105) organismen per gram weefsel of het immuunsysteem wordt gecompromitteerd, infectie volgt vaak. Cellulitis verlengt de ontstekingsfase door het handhaven van hoge niveaus van pro-inflammatoire cytokines en weefselproteasen, die granulatieweefsel en weefselgroeifactoren afbreken, en door het uitstellen van collageenafzetting.
Debridement (chirurgisch, enzymatisch en/of door verbandveranderingen) en antibiotica zijn de pijlers van antibioticabehandeling. Debridement verwijdert gedevitaliseerd weefsel, dat een bron van endotoxinen kan zijn die de migratie van fibroblast en keratinocyten in de wond remmen. Vreemde lichamen kunnen ook verwijdering vereisen, aangezien de aanwezigheid van een zijdehechting het aantal bacteriën vermindert dat nodig is om infectie 10.000-voudig aan te zetten. (Voor een gedetailleerde beschrijving van de techniek, zie Medscape referentie artikel wond vreemd lichaam verwijdering.)
cellulaire hypoxie vertraagt wondgenezing door verschillende middelen. Collageenfibrilcrosslinking vereist zuurstof aan hydroxylate proline en lysine en faalt wanneer de weefseldruk Onder 40 mm Hg is. De bactericide potentie van leukocyten oxidatieve phosphorylation lijdt ook in een hypoxisch milieu, die de drempel voor besmetting verminderen. Maatregelen om de zuurstoftoevoer te verbeteren zijn afhankelijk van de etiologie. Het gebruik van tabak, dat vasoconstrictie veroorzaakt en de hechting van bloedplaatjes verhoogt, moet worden gestopt. Angioplastiek of arteriële bypass enten kan nodig zijn voor perifere vasculaire ziekte. Adjuvante maatregelen ter verbetering van de systemische perfusie in gevallen van hartfalen kunnen geïndiceerd zijn. Hematocriet waarde minder dan 15% moet worden behandeld en euvolemie hersteld, indien nodig. Veneuze stasis of lymfatische insufficiëntie kan worden verbeterd met druk kleding.
systemische ziekte kan de wondgenezing dramatisch verlengen of onderbreken. Glycosylatie bij diabetes mellitus tast neutrofiel en macrofaagfagocytose van bacteriën aan, waardoor de ontstekingsfase wordt verlengd. De proliferatieve fase wordt ook verlengd in dezelfde ziekte aangezien de erytrocyten minder buigzaam en minder bekwaam worden om zuurstof aan de wond voor weefselmetabolisme en collageensynthese te leveren.
ondervoeding resulteert in verminderde fibroblastproliferatie, verminderde neovascularisatie en verminderde cellulaire en humorale immuniteit. Wonden hebben verhoogde metabolische eisen, vooral in granulatieweefsel. Aminozuren zoals methionine, proline, glycine en lysine zijn essentieel voor de normale celfunctie en het herstel van huidwonden. De vetzuren zijn kritieke bestanddelen van celmembranen en zijn het substraat voor eicosanoïden die het ontstekingsproces bemiddelen. Essentiële vetzuren linoleenzuur en linolzuur MOETEN in het dieet worden geleverd, aangezien het menselijk lichaam niet in staat is van de novo synthese van deze molecules.
er moeten voldoende vitaminen en mineralen beschikbaar zijn voor het celmetabolisme, die als cellulaire signalen en cofactoren fungeren. Vitamine C (ascorbinezuur) en ijzer zijn nodig voor de hydroxylering van lysine en proline, die de drievoudige helixstructuur van collageen crosslink en stabiliseren; koper speelt ook een rol in het stabiliseren van collageen. Vitamine A (retinoïnezuur) speelt een belangrijke rol bij het moduleren van collageenproductie en-afbraak en is vooral belangrijk bij epithelialisatie. Een krachtige antioxidant, vitamine E (alfa-tocoferol) lijkt te versnellen dermale en bot genezing bij dieren, en suppletie kan een rol spelen bij de mens. Sporenmetaal, in het bijzonder zink, deficiëntie wordt ook geassocieerd met slechte wondgenezing; dit moet worden aangevuld, indien van toepassing.
Ovidius schreef, ” medicijnen genezen soms, soms doden.”Dit geldt zeker voor wondgenezing. Corticosteroïden stompen de processen van de gehele ontstekingsfase. Vitamine A (plaatselijk of 25.000 IE/dag oraal) vermindert de schadelijke genezende effecten van corticosteroïden, maar hepatotoxiciteit kan het gevolg zijn van langdurig gebruik (d.w.z. >1 maand). Niet-steroïdale anti-inflammatoire medicijnen (NSAID ‘ s) interfereren ook met arachidonzuurmetabolisme en daarom wondgenezing. Bovendien remmen NSAID ‘ s de bloedplaatjesfunctie, één van de vroegste processen in de ontstekingsfase.
een studie door Sutcliffe et al suggereerde dat upregulatie van de Gap junction protein connexin gemeenschappelijk is aan chronische wonden. Bij het onderzoeken van connexin in drie soorten wonden-veneus been, diabetische voet en decubitus-vonden de onderzoekers dat elk type wond upregulation van epidermale connexin 43, connexin 26, en connexin 30, evenals dermal connexin 43 vertoonde.