Inleiding
Healthcare-associated infections (HAIs) als bacteriëmie veroorzaakt door multiresistente Pseudomonas aeruginosa stammen resulteren in een verhoogde morbiditeit en mortaliteit, de verlenging van de ziekenhuisopname en hogere kosten in vergelijking met die van infecties veroorzaakt door gevoelige stammen.1-3 infecties veroorzaakt door deze resistente micro-organismen worden vaak geassocieerd met leeftijd, kanker, hart-en vaatziekten, diabetes, intensief gebruik van antibiotica, en invasieve procedures zoals hemodialyse, mechanische ventilatie katheter, tracheostomie, en anderen.4
de toenemende incidentie van multiresistente P. aeruginosa als oorzaak van nosocomiale infectie is een wereldwijd probleem, een gevolg van het vermogen van dit micro-organisme om resistentie te ontwikkelen tegen bijna alle andere antimicrobiële middelen tijdens antimicrobiële chemotherapie, hetzij door selectie van mutaties in chromosomale genen of door horizontale genoverdracht.5,6 in Brazilië is dit probleem nog groter, omdat er een zeer hoge dichtheid van antibioticagebruik is, met name β-lactamen, carbapenems en fluorochinolonen.7,8 de weerstand in P. aeruginosa aan carbapenems is tot 60% in sommige Braziliaanse ziekenhuizen9,10 en komt voornamelijk voor door de productie van metallo-β-lactamasen (MBL).
tien subklassen van de MBL-enzymen zijn bekend: IMP (Imipenemase), VIM (Verona Imipenemase), SPM-1 (São Paulo MBL), GIM (Duits Imipenemase), SIM-1 (Seul Imipenemase),11 AIM-1 (Australisch Imipenemase),12 KHM (Kyorin University Hospital),13 NDM-1 (New Delhi MBL),14 DIM-1 (Nederlands Imipenemase)), 15 en TMB (Tripoli MBL).16 in Brazilië zijn de meest voorkomende subklassen IMP-1 en SPM-1.11
verscheidene andere virulentiegenen en biofilmvorming kunnen bijdragen tot de pathogeniteit van ernstige infecties, in het bijzonder met inbegrip van infecties geassocieerd met invasieve procedures.Onder de belangrijkste virulentiefactoren die in de literatuur worden beschreven, benadrukken we die met betrekking tot de hechting van micro-organismen aan gastheercellen via de flagella, fimbriae en alginaat18 en die de verstoring van de epitheliale integriteit vergemakkelijken en interfereren met het immuunsysteem, zoals elastase, fosfolipase C en protease alkaline, verder exotoxine A, pyocyanine en pyoverdine.19 de productie van biofilms wordt in het bijzonder geassocieerd met de moeilijkheid van antibiotica om de cellen te penetreren, aangezien zij een polymere matrix afscheiden die uit polysachariden, proteã NEN, EN DNA wordt samengesteld.20,21
het doel van deze studie was het identificeren van de risicofactoren geassocieerd met bacteriëmie veroorzaakt door carbapenem-resistente P. aeruginosa en de productie van MBL. Daarnaast onderzochten we de frequentie van virulentiegenen en hun vermogen om biofilm te vormen.
materialen en methodepatiënten En Ziekenhuis
de P. aeruginosa stammen werden teruggevonden van patiënten opgenomen in de Uberlandia University Hospital (Brazilië), Federale Universiteit van Uberlândia (HC-UFU), en verkregen van de Microbiologie Laboratorium van de HC-UFU, tijdens de periode van mei 2009 tot December 2012, rekening houdend met alleen de eerste episode van infectie.
onderzoeksopzet
we hebben een case (patiënten met bacteriëmie veroorzaakt door P. aeruginosa resistent tegen carbapenems) versus control (patiënten met bacteriëmie veroorzaakt door P. aeruginosa gevoelig voor carbapenems) studie uitgevoerd om risicofactoren te identificeren bij patiënten geïnfecteerd met P. aeruginosa resistent tegen carbapenems. Daarnaast evalueerden we secundaire uitkomsten, waaronder perioden van hospitalisatie, opname op de intensive care unit (IC) en het gebruik van invasieve ingrepen. Demografische, klinische en epidemiologische kenmerken van elke in de studie opgenomen patiënt werden teruggevonden in de klinische gegevens.
definities
zorginfecties (HAIs) worden gedefinieerd als elke infectie die ontstaat na opname van een patiënt in het ziekenhuis. HAIs kan manifesteren tijdens de hospitalisatie of na ontslag, omdat ze verband houden met hospitalisatie of procedures uitgevoerd tijdens de hospitalisatie.Bacteriëmie,volgens de Centers for Disease Control and Prevention, 23 kan worden gedefinieerd als de aanwezigheid van levensvatbare bacteriën in het bloed gedocumenteerd door een positieve bloedkweek resultaat. Bacteriëmie werd geclassificeerd als primair wanneer het niet verwant aan een andere nadruk van besmetting was of wanneer het met een intraveneuze katheter, en secundair toen het klinisch met besmetting in een andere anatomische plaats werd gerelateerd.Multidrugresistentie wordt gedefinieerd als verworven niet-gevoeligheid voor ten minste één middel in drie of meer antimicrobiële categorieën.De antimicrobiële therapie werd ongeschikt geacht wanneer een geïsoleerd micro-organisme in vitro resistentie vertoonde tegen antimicrobiële middelen die worden gebruikt voor de behandeling van de patiënt en/of een gebrek aan behandeling gedurende 24 uur na de diagnose van microbiële infecties.25
klinische microbiologische en moleculaire testen
culturen werden verzameld volgens het protocol dat wordt gebruikt door het microbiologisch laboratorium van het HC-UFU en werden verwerkt met behulp van het geautomatiseerde systeem BACT/Alert® (BioMérieux, Durham, USA). De identificatie-en antimicrobiële gevoeligheidstesten werden uitgevoerd door automatisering met behulp van het VITEK II-systeem en de stammen die een middelmatige gevoeligheid vertoonden werden als resistent beschouwd. Kwaliteitscontroleprotocollen werden gebruikt volgens de normen van het klinische en laboratorium standaard Instituut.26-28 de carbapenem-resistente P. aeruginosa-isolaten werden fenotypisch gescreend op MBL-productie met behulp van dubbelschijfsynergietests, zoals eerder beschreven.29,30 bovendien werd, om de aanwezigheid van MBL-genen in P. aeruginosa-stammen te beoordelen, een multiplex PCR uitgevoerd, zoals eerder beschreven.31 de cyclische omstandigheden waren: 94°C gedurende 5min, gevolgd door 30 denaturatiecycli bij 94°C gedurende 30s, gloeien bij 53 ° C gedurende 45s en verlenging bij 72 ° C gedurende 30s, gevolgd door definitieve verlenging bij 72 ° C bij 10min, alles in een MasterCycler personal (Eppendorf). Detectie van virulentiegenen die alkalische protease (aprA), elastase A (lasA), elastase (lasB),32 hemolytische fosfolipase C (plcH), niet-hemolytische fosfolipase C (plcN), exotoxine A (toxA) en alginaat (algD)codificeren 33 werden bepaald door uniplex PCR, met behulp van het volgende protocol: 94°C gedurende 3min, 30 cycli bij 94°C gedurende 30s, 55°C gedurende 1min en 72 voor 1min en 30s en 72°C voor 5min.
initiële adhesie-assay34
om de initiële adhesie te evalueren, werd 200µL van een celsuspensie met 1×107cells/mL, bereid in TSB, toegevoegd aan 96-wells polystyreenplaten. Initiële hechting werd toegestaan voor 2 uur bij 37°C met rotatie bij 120rpm. Bacteriën gehecht in 96-put polystyreen platen werden tweemaal gewassen met een 0,9% NaCl-oplossing en geoogst door schrapen van de putten voor
biofilmvorming assay35
200µL van een celsuspensie met 1 × 107cells/mL, bereid in TSB, werd toegevoegd aan 96-wells polystyreenplaten. De vorming van Biofilm werd toegestaan om 24h bij 37°C met omwenteling bij 120rpm voor te komen. Bacteriën die in 96-wells polystyreenplaten werden gekweekt, werden tweemaal gewassen met een 0,9% NaCl-oplossing en in omgekeerde positie laten drogen. De totale biomassa werd gemeten door middel van methanol (Merck) – fixatie, kristalviolet (Merck) – kleuring en zuurazijn (Merck) – elutie zoals eerder beschreven. De geëlueerde kleurstof werd uit elke put verwijderd en in een nieuwe 96-wells microtiterplaat geplaatst, en de absorptie ervan werd afgelezen op een ELISA-plaatlezer (BioTek Instruments Inc., Vermont, USA) op 570nm. De experimenten werden gedaan met acht replicaten voor elke stam in drie onafhankelijke experimenten. TSB zonder bacteriën werd gebruikt als een negatieve controle. De Optical density cut-off value (ODc) werd vastgesteld als drie standaardafwijkingen (SD) boven het gemiddelde van de optische dichtheid (OD) van de negatieve controle: ODc=gemiddelde OD van de negatieve controle+3x SD van de negatieve controle. Voor een gemakkelijkere interpretatie van de resultaten werden stammen ingedeeld in de volgende categorieën volgens optische dichtheid: (ODi): ODI≤ODc of ODc
ODi2x ODc=niet-biofilm producent/zwakke biofilm producent; 2x ODcODi4x ODc=matige biofilm producent; 4x ODcODi=sterke biofilm producent.Biofilmcelconcentratie36
de biofilmcelconcentratie werd bepaald door CFU-telling. Na de vorming van biofilm werden de biofilms tweemaal gewassen met een 0,9% NaCl-oplossing en geoogst na het schrapen van de putten voor 90s. the celsuspensie verkregen werd geplateerd op TSA platen. Alle experimenten werden in drievoud uitgevoerd, bij drie onafhankelijke gelegenheden.
statistische analyse
statistische analyse werd uitgevoerd met behulp van GraphPad Prism v. 5 (GraphPad Software, San Diego, CA). Kwantitatieve analyses werden vergeleken met de Kruskal-Wallis, waarbij de meervoudige vergelijkingstest van Dunn werd toegepast. Alle testen werden uitgevoerd met een betrouwbaarheidsniveau van 95% en statistische significantie werd gedefinieerd als p
0,05.Ethische goedkeuring
de Onderzoeksethiekcommissie van de Federale Universiteit Uberlandia heeft ons studieontwerp geëvalueerd en goedgekeurd.
resultaten
van 1 mei 2009 tot 31 December 2012 werd een ziekenhuisbewaking van de incidentie van P. aeruginosa bacteriëmie uitgevoerd in het laboratorium voor Microbiologie van het Universitair Ziekenhuis. In deze periode werden 157 niet-repetitieve patiënten met P. aeruginosa bacteriëmie in het onderzoek opgenomen. De gedetailleerde informatie over factoren in verband met de ontwikkeling van bacteriëmie en de klinische en demografische kenmerken, evenals de verdeling van patiënten naar afdelingen worden weergegeven in tabellen 1 en 2. De primaire bacteriëmie kwam voor bij 75,8% en die met onbekende focus waren goed voor 62.4% van de gevallen. Secundaire bacteriëmie was goed voor 24,2% van de patiënten, waarbij de luchtwegen de belangrijkste focus van infectie waren (17,2%). Verder had 43,9% van de patiënten bacteriëmie met carbapenem-resistente P. aeruginosa, en de meeste van deze patiënten werden opgenomen op de IC. De meeste patiënten waren mannelijk (66,8%), met een gemiddeld verblijf in het ziekenhuis van 63,2±80,17 dagen en een gemiddelde leeftijd van 52,01±20,24 jaar.
verspreiding van patiënten geïnfecteerd met Pseudomonas aeruginosa in verschillende eenheden van het Klinisch Ziekenhuis van de Federale Universiteit van Uberlândia van mei/2009 tot December/2012.
| Klinieken | Totaal | Carbapenem-resistente Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Operatie | 35 (22.3) | 16 (23.2) |
| Medische kliniek | 24 (15.3) | 10 (14.5) |
| Oncologie | 14 (8.9) | 2 (2.9) |
| Emergency room | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| Neonatale INTENSIVE care | 2 (1.3) | 0 |
| Pediatrische INTENSIVE care | 2 (1.3) | 1 (1.5) |
| Transplantatie | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
Intensive care unit.
Burneds, thoracale pijneenheid.
risicofactoren geassocieerd met carbapenemresistentie bij patiënten met bacteriëmie veroorzaakt door Pseudomonas aeruginosa.
| risicofactoren | Totaal | Carbapenem resistente | Multisensitivea | Univariate | Multivariate | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | OF (CI 95%) | p | |
| Leeftijd-gemiddelde (jaar) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Man/vrouw | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| Moment van ziekenhuisopname, gemiddelde (dagen) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| Intensive care unit | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Operatie | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| Invasieve procedures (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| veneuze centrale katheter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| chirurgische drain | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Probes enterale / maagvoeding | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hemodialyse | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Parenterale voeding | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Comorbiditeit voorwaarden | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| hartfalen | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Kanker | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| Chronische nierinsufficiëntie | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| Humaan immunodeficiëntie virus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| Primaire bacteriëmie | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| Central line catheter gerelateerde | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Onbekend | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Secundaire bacteriëmie | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| de Luchtwegen | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| Urinewegen | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| ongepaste therapie | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| eerder gebruik van antibiotica | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| mortaliteit | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive stammen werden beschouwd als degenen die de vatbaarheid voor alle stoffen getest.
Odds ratio.
betrouwbaarheidsinterval.
p-waarde.
gemiddelde score voor de ernst van de ziekte.
statistisch significant (p≤0,05).
eerder gebruik van antibiotica (78,3%), invasieve ingrepen (88,5%), comorbiditeiten (77,7%) en voorafgaande chirurgie (43,9%) kwamen vaak voor. Er werd vastgesteld dat 31,2% van de patiënten inadequate behandeling kregen, en het sterftecijfer was 58,6%. Verschillende intrinsieke en extrinsieke factoren voor de ontwikkeling van bacteriëmie door stammen van P. aeruginosa resistent tegen carbapenems werd gedetecteerd door univariate analyse. Echter, alleen mechanische ventilatie, enterale/nasogastrische buizen, primaire bacteriëmie met onbekende focus en ongepaste therapie waren risicofactoren die onafhankelijk geassocieerd werden met de ontwikkeling van carbapenem-resistente P. aeruginosa bacteriëmie.
MBL-productie werd geanalyseerd voor 56 carbapenem-resistente P. aeruginosa-isolaten. Negen (25,0%) isolaten waren fenotypisch positief en een totaal van 16,1% (n= 9/56) was consistent met de amplicons MBL-genen, zijnde 10,71% blaSPM-1 en 5.3% blaVIM genen in het algemeen vertoonden de stammen een multidrug resistentieprofiel. Voor andere geëvalueerde virulentiegenen (aprA, plcH, plcN, lasA, lasB, toxA en algD) vertoonden alle stammen een hoge frequentie (88%).
van de 88 carbapenem-gevoelige P. aeruginosa stammen waren er 21 (23,9%) resistent tegen andere β-lactamen. Voor 69 stammen die resistent waren tegen carbapenems was het resistentieprofiel hoog: β-lactam 50/69 (72,5%), fluorochinolonen 48/69 (69,6%) en aminoglycosiden 50/69 (72,5%) (Tabel 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
naast MBL-onderzoek werden vijf stammen geselecteerd (twee die SPM-1 bevatten, één die VIM bevat, en twee fenotypisch positief voor MBL) voor de evaluatie van de biofilmvorming gebruikend kwantitatieve analyses van totale biomassa door met kristalviolet te bevlekken. Gezien de aanwezigheid van MBL genen, werden alle stammen geïdentificeerd als sterk biofilm producenten met een gemiddelde van 0,90±0,61 van biomassa. Verschillen in initiële hechting van individuele stammen werden niet waargenomen. Er was echter een lagere OD voor de stam die het blavim-gen bevat (Fig. 1).
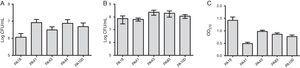
(A) aantal cellen dat na 2 uur aan een oppervlak van polystyreen wordt gehecht, uitgedrukt als log CFU/mL voor 5 uit bloed geïsoleerde monsters van Pseudomonas aeruginosa. B) aantal levensvatbare cellen in de biofilm (log CFU/mL). C) biomassa van biofilm, uitgedrukt als optische dichtheid van kristalviolet (OD570nm).
discussie
bacteriëmie in ziekenhuizen veroorzaakt door multiresistente micro-organismen, hetzij grampositief of gramnegatief, is vaak beschreven als een significant gezondheidsprobleem dat de ziekenhuiskosten verhoogt en het moeilijk maakt om een geschikte antimicrobiële therapie vast te stellen, wat resulteert in een slechtere prognose.Het hoge percentage ziekenhuisbacteriëmie veroorzaakt door P. aeruginosa resistent tegen carbapenems wijst op het belang van dit organisme als een belangrijke oorzaak van deze infectie in ons ziekenhuis. Het hoge percentage ziekenhuisbacteriëmie veroorzaakt door P. aeruginosa resistent tegen carbapenems wijst op het belang van dit organisme als een belangrijke oorzaak van deze infectie in ons ziekenhuis. De resultaten van verschillende studies hebben gesuggereerd dat intrinsieke risicofactoren zoals mechanische ventilatie, gebruik van een nasogastrische buis, en voorafgaand gebruik van antibiotica verhogen het risico van bacteriëmie ontwikkeling veroorzaakt door P. aeruginosa resistent tegen carbapenems, evenals het risico van morbiditeit en mortaliteit.38
in deze studie werd volgens univariate analyse meer dan 50% van de risicofactoren geassocieerd met infectie met dit micro-organisme. Echter, alleen mechanische beademing, enterale/maagvoedingsbuizen, primaire bacteriëmie van onbekende oorsprong en ongepaste behandeling werden door multivariate analyse beschouwd als onafhankelijke risicofactoren.
een centraal veneuze katheter is een van de belangrijkste risicofactoren voor verworven bacteriëmie in het ziekenhuis, aangezien het in verband werd gebracht met meer dan 90% van deze infecties.Hoewel het geen significante risicofactor was in dit onderzoek, onderging 85,5% van de patiënten met bacteriëmie met carbapenem-resistente P. aeruginosa deze invasieve procedure.
vaak heeft bacteriëmie veroorzaakt door P. aeruginosa resistent tegen antibiotica een hoger sterftecijfer, met name als gevolg van de toediening van ongeschikte antibioticumtherapie.40 in deze studie onderzochten we een cohort van 157 patiënten met bacteriëmie veroorzaakt door P. aeruginosa stammen, waarvan 69 geïnfecteerd zijn door carbapenem-resistente P. aeruginosa isolaten. De totale mortaliteit was hoger in de carbapenem-resistente groep; nochtans, werd de aanwezigheid van resistente stammen beduidend geassocieerd met ongepaste antimicrobial therapie, die bewijst dat deze groep gewoonlijk een slechtere prognose heeft. Vergelijkbaar met onze bevindingen toonden eerdere studies aan dat P. aeruginosa geïsoleerd uit patiënten die ongepaste therapie kregen een slechtere prognose had, met percentages van 46,1% 41 en 53,8%.42
naast ernstige infecties leidt resistentie tegen carbapenems bij P. aeruginosa vaak tot de productie van MBL.43 Uit Onze resultaten bleek dat de carbapenem-resistente P. aeruginosa was overwegend in het hele ziekenhuis met genen die deze enzymen coderen in 16,1% van de stammen, zijnde 10,7% van genotype blaSPM-1 en 5,4% van genotype blaVIM. Aangezien de frequentie van multidrug-resistente stammen hoog was, suggereren deze resultaten dat andere resistentiemechanismen in deze stammen naast elkaar bestaan, zoals effluxpompen en ondoordringbaarheid van het membraan.44
de prevalentie van MBL als resistentiemechanisme is toegenomen, vooral in Latijns-Amerika.45 in Brazilië is de prevalentie van MBL-producerende P. aeruginosa varieert tussen verschillende regio ‘ s en tussen ziekenhuizen, met tarieven variërend van 7,5% tot 44%.11
SPM-1-enzym wordt beschouwd als het meest voorkomende in Brazilië, gevolgd door IMP-1,11,46 maar er is ook een toename in de frequentie van P. aeruginosa-isolaten die vim-enzym bevatten.45,47 in onze studie, werd het enzym SPM-1 ontdekt in 16,7% fenotypically producerend steekproeven van MBL, gevolgd door vim enzym, dat in 8,3% van gevallen werd ontdekt. Deze resultaten wijzen op een significante verspreiding van MBL-coderende genen in onze regio.Gezien de aanwezigheid van MBL-en biofilmproductie werd 100% van de stammen geclassificeerd als sterke producenten. Een andere studie in Brazilië vond dat 40% van P. aeruginosa geclassificeerd als sterke biofilm-producerende ook MBL-producenten waren.35 wij geloven dat deze resultaten belangrijk zijn zodra deze kenmerken (biofilm productie en MBL) overlappen en infecties veroorzaakt door deze bacteriën moeilijk te behandelen zijn. Dit is deels gerechtvaardigd omdat de groei van bacteriën in de biofilm ongeveer 64 keer beter bestand is tegen antimicrobiële stoffen.48
P. aeruginosa heeft een groot aantal extracellulaire virulentiefactoren die ook bijdragen aan de pathogeniteit en ernst van deze infecties, zoals die gecodeerd door APRA -, plcH -, plcN -, lasA -, lasB -, toxA-en algD-genen.32,33 onze gegevens toonden aan dat de aanwezigheid van een multiresistent profiel in de meeste stammen (88%) positief was voor de virulentiegenen aprA, plcH, plcN, lasA, lasB, toxA en algD, behalve in één stam die de toxA-en plcH-genen niet vertoonde, wat verder kan bijdragen aan een slechtere prognose geassocieerd met ernstige infecties.
onze resultaten bevestigen eerdere bevindingen met betrekking tot risicofactoren voor de ontwikkeling van P. aeruginosa carbapenem-resistente bacteriëmie, evenals de verspreiding van MBL-producerende stammen van het SPM-1-type. Nochtans, draagt deze studie voor verder bewijs van de verspreiding van MBL-producerende stammen, in het bijzonder het type VIM, in hoogst virulente stammen en sterk biofilm producenten bij.
belangenconflicten
de auteurs verklaren geen belangenconflicten.