Apesar da queda drástica do vírus da imunodeficiência humana tipo 1 (HIV-1)-morbidade e mortalidade após a descoberta dos inibidores da protease e o advento da combinação altamente ativa terapia antiretroviral (ARV) em meados da década de 1990, muitos pacientes ainda estavam falhando terapia, devido a resistência e/ou intolerability (1). Era claro que mais ARVs atuando em diferentes etapas no ciclo de vida do vírus, ativo contra vírus resistentes, e melhor tolerado eram necessários. A demonstração do papel chave dos receptores de quimiocina CCR5 e CXCR4 na entrada do HIV-1 despertou o interesse neste processo como um novo alvo ARV (2, 3). O CCR5 é o co-receptor para a maioria das estirpes do VIH-1, e estes vírus são denominados com tropismo para o CCR5 (R5). As estirpes virais que utilizam o CXCR4 são chamadas de tropismo CXCR4 (X4), enquanto as estirpes que podem usar ambos os receptores são de tropismo duplo (4). Vírus de um paciente muitas vezes podem conter misturas de estirpes R5, X4, e dual-tropic, coletivamente chamadas de uso CXCR4.
O papel-chave do CCR5 em HIV-1 entrada, juntamente com a demonstração de que os indivíduos que foram homozigotos para uma versão de 32 pares de base deleção no gene CCR5 (CCR5Δ32), e, posteriormente, não expressam funcional CCR5, foram altamente protegido da infecção com R5 HIV-1, concentraram a atenção no CCR5 como um alvo atraente (5). Embora alguns estudos têm demonstrado efeitos sutis do CCR5Δ32 de mutação sobre a função imunológica, tais como diminuição inflamatória pontuações na hepatite C em indivíduos infectados e a recuperação da hepatite B em heterozigotos; enquanto homozygotes são mais suscetíveis a encefalite transmitida por carrapatos e grave o vírus do Nilo Ocidental doença, estes indivíduos sofrem pouco aparentes efeitos adversos na sua saúde (5, 6). Isso, junto com o fato de que membros da superfamília de receptores acoplados à proteína G são muitas vezes tratáveis ao desenvolvimento de medicamentos potentes, seletivos e orais biodisponíveis (7), levou ao início de programas de descoberta de ligando CCR5 por vários grupos, incluindo uma equipe da Pfizer Global Research and Development baseada nos laboratórios Sandwich no Reino Unido.
Maraviroc (UK-427 857, MVC) foi descoberto através da análise de alto rendimento da biblioteca composta da Pfizer, usando um teste de ligação radioliganda de chemokine. O composto mais promissor do processo de triagem foi otimizado para a potência contra o receptor, atividade antiviral, características farmacocinéticas e seletividade contra alvos celulares humanos através de um grande esforço de química medicinal em que quase 1000 moléculas foram caracterizadas (7). MVC liga-se no bolso transmembranar de CCR5 e é um antagonista funcional de deslocamento lento que impede a internalização (7, 8). Tem uma actividade antiviral potente contra uma vasta gama de isolados de VIH-1 (7). Juntamente com o seu excelente perfil de segurança pré-clínica e farmacocinética aceitável, este facto resultou na sua nomeação como candidato clínico em dezembro de 2000 (7).
ficou sempre claro que o desenvolvimento clínico dos antagonistas CCR5 seria um desafio, uma vez que estes seriam os primeiros medicamentos ARV alvo do hospedeiro e que, portanto, estávamos nos aventurando em território desconhecido. A fim de antecipar questões-chave, uma equipe de desenvolvimento clínico foi estabelecida logo após o início do Programa discovery e eu fui recrutado para liderar a equipe de desenvolvimento inicial, juntando-se à Pfizer em fevereiro de 1999. Identificamos vários desafios fundamentais a serem enfrentados no projeto do programa clínico, além de demonstrar segurança e eficácia. O primeiro destes testes foi que não existia nenhum ensaio disponível no mercado, clinicamente validado para identificar doentes infectados com o VIH-1 R5. Isto foi crítico, uma vez que o MVC é ativo apenas contra estirpes R5 de HIV-1 (7). Em segundo lugar, apesar de aparentemente saudáveis fenótipo dos indivíduos com CCR5Δ32 (5, 6), persistem as preocupações sobre a segurança de longo prazo de exposição para os antagonistas do CCR5, como o bloqueio de CCR5 pode ser diferente da ausência congênita do receptor CCR5, onde o sistema imunológico amadureceu na ausência de CCR5 e mecanismos de compensação, podem ter desenvolvido. Por último, em indivíduos infectados pelo VIH-1, a incidência de estirpes de VIH-1 que utilizam o CXCR4 aumenta com a progressão da doença e diminui as contagens das células CD4 (9), embora não tenha sido demonstrada qualquer relação causal entre a depleção das células CD4 que utilizam o CXCR4 e a depleção das células CD4. Isso levou a preocupações de que a pressão seletiva de um antagonista CCR5 pode levar a população do vírus a usar CXCR4 e resultar no declínio das células CD4.
Fase 1 único e vários estudos de dose em voluntários saudáveis, realizado em 2001 e o primeiro semestre de 2002, demonstrou que o MVC foi seguro e bem tolerado em doses múltiplas de até 300 mg duas vezes ao dia (BID), tinha um perfil farmacocinético compatível com o de uma vez por dia (QD) ou LANCE de dosagem oral, que pode ser combinado com outros ARVs, e que doses ≥100 mg LANCE resultou na exposição acima da média geométrica antiviral IC90 in vitro (7, 10). Para demonstrar a farmacologia, a saturação do receptor CCR5 foi medida utilizando um teste de internalização ex vivo do MIP-1β por medida. Foi demonstrada saturação dependente da Dose, com doses ≥25 mg QD resultando em níveis de saturação quase máximos, aumentando a interessante possibilidade de que a MVC possa ser eficaz em doses tão baixas como 25 mg QD. A saturação do Receptor manteve-se elevada durante vários dias após a descontinuação da administração, reflectindo um deslocamento lento do receptor in vivo (11).Estávamos entusiasmados e encorajados pelos dados da fase 1 e rapidamente passámos para um programa de demonstração do conceito da fase 2a. Os doentes infectados pelo VIH-1 foram rastreados apenas para detecção da presença do vírus R5, utilizando um novo teste de tropismo fenotípico (Trofile®, Monogram Biosciences, South San Francisco, CA, EUA), e receberam MVC em monoterapia durante 10 dias (12). A saturação do receptor CCR5 foi medida neste estudo para avaliar a possibilidade de usar isto como biomarcador para eficácia e monitorização terapêutica. Os dados tão aguardados corresponderam às nossas expectativas e demonstraram que doses ≥100 mg duas vezes por dia resultaram em reduções médias máximas de ARN VIH-1 de >1.5log10 (figura 1A), com todos os doentes, excluindo um doente com vírus X4 que foi erradamente incluído, alcançando uma redução de ARN VIH-1 de pelo menos 1log10 (12). Isto deu-nos confiança de que o ensaio identificou correctamente os doentes susceptíveis de responder ao acidente de viação. O nadir do ARN VIH-1 ocorreu 1-5 dias após a última dose de MVC, consistente com a saturação prolongada dos receptores, como demonstrado nos estudos de Fase 1 (12). Para todas as doses, excepto 25 mg QD, observou-se uma saturação do receptor >80% ao longo do período de administração. No entanto, não houve correlação entre a redução da carga viral e o grau de saturação dos receptores. A explicação mais provável para este facto é que são necessários níveis muito elevados de saturação dos receptores para a eficácia antiviral e a variabilidade inerente do ensaio não permite diferenciação nesse grau (11, 12).
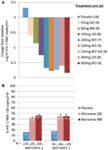
Figura 1. Maraviroc prova do conceito e resultados de eficácia de Fase 3. A) alteração máxima média do ARN VIH-1 em doentes a receber MVC em monoterapia em relação aos valores basais. Com base nos dados de Fase 1 e na modelagem e simulação, foram seleccionadas doses que variaram entre 25 mg QD e 300 mg BID (incluindo 150 mg bid, alimentados e em jejum). Avaliaram-se ARN VIH-1, Segurança e farmacocinética da MVC (12). B) MOTIVATE 1 e 2 – proporção de doentes que atingiram ARN VIH-1 <50 cópias/mL na semana 48. Os doentes infectados pelo VIH-1 com experiência e/ou resistência de classe tripla em R5 em VIH-1 foram aleatorizados para receber QD ou BID de MVC, ou placebo, em associação com um regime anti-retroviral de base optimizado (TSO). P < 0.001 (13, 14).
os dados da fase 2a geraram agitação em toda a empresa e estávamos interessados em progredir o programa de desenvolvimento clínico o mais rapidamente possível, uma vez que havia uma grande necessidade médica de novos ARVs para tratar pacientes com opções de tratamento sem ou limitado. O extenso programa de Fase 1 (incluindo múltiplos estudos de interação droga-Droga) e ampla gama de doses avaliadas na fase 2a prova de estudos conceituais, juntamente com modelagem e simulação, nos deu uma compreensão muito boa da dose provavelmente eficaz de MVC em combinação com outros ARVs. Por conseguinte, fomos capazes de passar directamente para estudos de eficácia de Fase 3 Avaliando MVC a 300 mg (ou equivalente, dependendo dos medicamentos co-administrados) QD e BID, sem a necessidade de realizar estudos de dose individuais 2b, reduzindo significativamente a linha do tempo de desenvolvimento. No final de 2004, iniciámos quatro grandes estudos; MOTIVAR 1 e 2 no tratamento de pacientes experientes com R5 HIV-1 (13, 14), o MÉRITO (a fase 3 do estudo, com uma fase 2b roll-in) no tratamento de ingênuo pacientes com R5 HIV-1 (15), e o estudo A4001029, uma fase 2b estudo de segurança no tratamento de pacientes experientes com os não-CCR5 trópico (vírus CXCR4-utilizando ou não phenotypable vírus) (16).Este foi um empreendimento massivo, com 4794 pacientes rastreados em mais de 200 locais nos EUA, Canadá, Europa, Austrália, África do Sul, México e Argentina. Dois outros antagonistas da molécula pequena CCR5 (aplaviroc e vicriviroc) foram também avaliados em estudos de Fase 2b nesta altura (17, 18). Além dos desafios habituais de gestão de grandes estudos clínicos, foram lançados dois curveballs, o primeiro dos quais foi a descontinuação de aplaviroc devido à hepatotoxicidade idiossincrática. Houve especulações de que este poderia ser um efeito de classe dos antagonistas CCR5, uma vez que os ratinhos nocaute CCR5 são mais susceptíveis à concanavalina-uma hepatotoxicidade mediada (17). Adicionalmente, um doente no estudo MERIT desenvolveu hepatotoxicidade grave. Os dados implicavam que era provável que estivesse relacionado com isoniazida ou cotrimoxazol, mas não se podia excluir um papel contributivo para a MVC (15). Uma análise aprofundada de todos os dados relativos à evidência de hepatotoxicidade para a CVM e um elevado nível de vigilância para quaisquer sinais, não encontrou qualquer evidência de aumento sistemático das enzimas hepáticas ou de outros marcadores de hepatotoxicidade. Pouco tempo depois, foram levantadas preocupações relativamente a um potencial aumento do risco de certas doenças malignas, após a ocorrência de linfoma em quatro doentes a receber vicriviroc no estudo ACTG5211 (18). Inicialmente, havia preocupações de que este poderia ser um efeito de classe baseado no potencial imunomodulatório dos antagonistas CCR5, mas a revisão de dados de outros estudos de vicriviroc, bem como os estudos em curso de MVC não apoiaram esta teoria (18).
os dados do MOTIVATE 1 e 2 e do A4001029 estavam disponíveis antes do Mérito, uma vez que a duração do estudo é normalmente mais Curta nos estudos em doentes previamente tratados. Foi com grande emoção que nós esperou a semana de 24 de análises intermediárias para o MOTIVAR estudos, em outubro de 2006 e ficámos radiantes ao ver que, significativamente mais pacientes recebendo MVC tinha HIV-1 RNA de <50 cópias/mL (o indicador-chave para a eficácia) em comparação com aqueles que receberam placebo OBT. Isto foi confirmado pelos dados da semana 48, demonstrando durabilidade da resposta (figura 1B) (13, 14). Em contraste, os doentes com VIH-1 com tropismo para o VIH-1 não-CCR5 a receberem MVC no a4001029 não parecem obter um benefício virológico significativo em comparação com o placebo (16). A análise dos dados de segurança não suscitou preocupações significativas. Especificamente, não houve evidência de um efeito adverso sobre a função imunitária, sem aumento de episódios de infecção ou neoplasias em doentes tratados com MVC. A avaliação do tropismo viral no insucesso demonstrou que >50% dos doentes com insucesso da terapêutica com MVC apresentavam vírus que utilizavam o CXCR4 no insucesso, mas não houve evidência de um efeito deletério no número de células CD4 (14). A avaliação virológica demonstrou que o vírus que utiliza o CXCR4, emergido sob pressão selectiva da MVC, era de uma população minoritária pré-existente e não surgiu de novo (19). No total, estes resultados demonstraram claramente o benefício do MVC no tratamento de doentes com VIH-1 sujeitos a tratamento prévio. Um esforço supremo da equipa resultou na apresentação de dossiês para registo tanto nos EUA como na Europa apenas dois meses após a disponibilização dos dados provisórios. A MVC (300 mg BID) recebeu aprovação para utilização (em combinação com outros ARVs) nos EUA em agosto de 2007, apenas 6.5 anos após ter sido nomeado como candidato ao desenvolvimento clínico. Um mês depois, também foi aprovado para uso nesta população na UE.
A semana de 48 análise do MÉRITO estudo foi decepcionante, como MVC plus zidovudina/lamivudina (HIV-1 RNA <50 cópias/mL, 65.3%) não atender o pré-definir critérios para a não-inferioridade (limite inferior de 1-face 97.5 intervalo de confiança abaixo de -10%) efavirenz além de zidovudina/lamivudina (HIV-1 RNA <50 cópias/mL, 69.3%) (15). No entanto, os doentes para este estudo foram avaliados relativamente ao vírus R5 utilizando o ensaio original do Trofile. Este teste foi melhorado entretanto para ser mais sensível para a detecção de populações minoritárias de vírus que utilizam o CXCR4. Todas as amostras de rastreio dos doentes em mérito foram subsequentemente reanalisadas utilizando o ensaio melhorado e uma análise pós-hoc realizada, incluindo apenas doentes que tinham vírus R5 apenas através do ensaio mais sensível. Nesta análise, as taxas de resposta para a CVM e o efavirenz foram de 68, 3 e 68, 5%, respectivamente, com o limite inferior do intervalo de confiança de 97, 5% acima de-10% (15). Com base nestes dados, MVC também foi aprovado para uso em pacientes sem tratamento prévio em novembro de 2009 pela Food and Drug Administration dos Estados Unidos.
MVC não só provou ser uma adição valiosa para o crescente armamentário de medicamentos ARV, mas os dados destes estudos melhoraram a nossa compreensão do tropismo do HIV e a relação entre tropismo e progressão da doença. Para mim, pessoalmente, isso representou um período de grande excitação e satisfação, tanto como médico e cientista.
Autor Contributions
er drafted this manuscript based on her personal experience as a member of the MVC development team. Todos os dados foram publicados na íntegra noutro local. Todos os estudos foram realizados em conformidade com os princípios da Declaração de Helsínquia e com todas as orientações da Conferência Internacional sobre a harmonização das Boas Práticas Clínicas e os requisitos regulamentares e jurídicos locais. Todos os estudos foram aprovados por comités de ética independentes e todos os pacientes deram consentimento informado por escrito.Elna Van Der Ryst foi um empregado da Pfizer Global Research and development na época em que a MVC foi desenvolvida. Actualmente, presta serviços de consultoria à Pfizer.
agradecimentos
gostaria de agradecer aos colegas da Pfizer que contribuíram para o programa de descoberta e desenvolvimento da MVC, bem como aos investigadores e doentes que participaram nos estudos clínicos.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF, et al. A prevalência de Resistência a medicamentos anti-retrovirais nos Estados Unidos. AIDS (2004) 18:1393-401. doi: 10.1097 / 01.SIDA.0000131310.52526.C7
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. A entrada do VIH-1 nas células CD4+ é mediada pelo receptor da quimiocina CC-CKR-5. Nature (1996) 381:667-73. doi: 10.1038/381667a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Cofactor de entrada do VIH – 1: Clonagem funcional de um receptor acoplado a proteínas sete-transmembranas. Science (1996) 272:872-7. doi: 10.1126 / science.272.5263.872
CrossRef Full Text | Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Uma nova classificação para HIV-1. Nature (1998) 391:240. doi:10.1038/34571
CrossRef texto completo | pesquisador do Google
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Resistência à infecção por VIH-1 em indivíduos caucasianos com alelos mutantes do gene receptor da quimioquina CCR5. Nature (1996) 382:722-5. doi: 10.1038 / 382722a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Utilização clínica de inibidores CCR5 no VIH e para além dele. J Transl Med(2011) 9 (Suppl 1):S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M, et al. Maraviroc (UK-427,857), um potente, biodisponível oralmente e selectivo pequeno inibidor molecular do receptor da quimiocina CCR5, com actividade de largo espectro do vírus da imunodeficiência humana tipo 1. Antimicrob Agents Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Full Text | Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, et al. Interacções moleculares do CCR5 com as principais classes de antagonistas CCR5 da molécula pequena anti-VIH-1. Mol Pharmacol (2008) 73:789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
9. Berger EA, Murphy PM, Farber JM. Receptores de quimioquina como co-receptores de VIH-1: papéis na entrada viral, tropismo e doença. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146 / annurev.imunol.17.1.657
Pubmed Abstract / Pubmed Full Text | CrossRef Full Text | Google Scholar
10. Abel S, van der Ryst e, Rosario MC, James I, Ridgway C, Medhurst C, et al. Avaliação da farmacocinética, segurança e tolerância de maraviroc, um novo antagonista CCR5, em voluntários saudáveis. Br J Clin Pharmacol(2008) 65 (S1):5-18. doi: 10.1111 / J. 1365-2125. 2008. 03130.X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel S, et al. Análise farmacocinética-farmacodinâmica da ocupação do receptor CCR5 pelo maraviroc em indivíduos saudáveis e doentes VIH positivos. Br J Clin Pharmacol(2008) 65 (S1):86-94. doi: 10.1111 / J. 1365-2125. 2008. 03140.X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman aim, et al. Eficácia de monoterapia de curta duração com maraviroc, um novo antagonista CCR5 em doentes infectados pelo VIH-1. Nat Med (2005) 11:1170-2. doi: 10.1038/nm1319
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumbeck N, DeJesus E, Horban A, et al. Maraviroc para doentes previamente tratados com infecção pelo VIH-1 R5. N Engl J Med (2008) 359:1429-41. doi: 10.1056/NEJMoa0803152
CrossRef texto completo | pesquisador do Google
14. Fätkenheuer G, Nelson M, Lazzarin a, Konourina I, Hoepelman IM, Lampiris H, et al. Análises de subgrupos de maraviroc em infecções por VIH-1 previamente tratadas. N Engl J Med (2008) 359:1442-55. doi: 10.1056/NEJMoa0803154
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
15. Cooper da, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maraviroc versus efavirenz, ambos em associação com zidovudina / lamivudina, para o tratamento de indivíduos sem terapêutica anti-retroviral prévia com VIH-1 com tropismo para o CCR5. J Infect Dis (2010) 201:803-13. doi:10.1086/650697
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo | Google acadêmico
16. Saag m, Goodrich J, Fätkenheuer G, Clotet B, Clumbeck N, Sullivan J, et al. Um ensaio em dupla ocultação, controlado com placebo, de maraviroc em doentes previamente tratados infectados com VIH-1 não tropismo para o CCR5: Resultados de 24 semanas. J Infect Dis (2009) 11:1638-47. doi:10.1086/598965
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo | Google acadêmico
17. Nichols WG, Steel HM, Bonny T, Adkison K, Curtis l, Millard J, et al. Hepatotoxicidade observada em ensaios clínicos de aplaviroc (GW873140). Antimicrob Agents Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
18. Tsibris AM, Paredes R, Chadburn a, Su Z, Henrich TJ, Krambrink A, et al. Diagnóstico de linfoma e carga plasmática do vírus Epstein-Barr durante a terapêutica com vicriviroc: resultados dos ensaios clínicos da SIDA grupo A5211. Clin Infect Dis (2009) 48:642-9. doi:10.1086/597007
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo | Google acadêmico
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M, et al. O vírus que utiliza o CXCR4, detectado em doentes a receber maraviroc nos estudos de fase III, MOTIVATE 1 e 2, é originário de uma minoria pré-existente de vírus que utilizam o CXCR4. Antivir Ther (2007) 12:S65.
Google Scholar