- Introdução
- ChREBP Structure and Regulation Via the LID/Grace Domains
- activação do Sarrebp por metabolitos de Glucose
- Co-factores e Parceiros da Crebp
- Papel de ChREBP no Metabolismo dos Hidratos de carbono e Hepatokine Produção
- ChREBP como Regulador da função Hepática de Ácidos graxos Síntese e Secreção de VLDL
- Regulation of frutose Metabolism by ChREBP in Liver and Intestine
- Regulamento da BDK:PPM1K Eixo no Fígado
- ChREBP é necessário para a regulação mediada pela Glucose de FGF21
- Papel de ChREBP na Inter-Órgão de Rede Que Controla a Homeostase Energética
- Papel de Hepáticas ChREBP no Controle da Sensibilidade à Insulina Saldo
- Romance Interação Entre o Hormônio-Sensível Lipase e ChREBP no Tecido Adiposo
- Conclusion and Future Directions
- contribuições dos autores
- Financiamento
- Declaração de conflito de interesses
Introdução
Aumento do consumo de açúcares simples como a sacarose e alta frutose xarope de milho nos últimos anos tem levado a um aumento do risco de doenças metabólicas, como obesidade, dislipidemia, diabetes tipo 2 e/ou doença hepática gordurosa não alcoólica (NAFLD). O fígado é o principal órgão responsável pela conversão do excesso de hidratos de carbono dietéticos em gordura. Os triglicéridos resultantes (TG) podem ser embalados em lipoproteínas de muito baixa densidade (VLDL) e segregados para a circulação, armazenados como gotículas lipídicas, ou metabolizados através da via de beta-oxidação. A insulina secretada em resposta a níveis elevados de glucose no sangue, estimula a expressão dos genes da síntese de novo de ácidos gordos (lipogénese) através do factor de transcrição factor de ligação do elemento regulador dos esteróis proteína-1c (SREBP-1c) (Foretz et al., 1999). SREBP-1c atua em sinergia com outro fator de transcrição chamado proteína de ligação do elemento carboidrato (ChREBP), que Media a resposta aos carboidratos alimentares. A estrutura proteica de ChREBP contém um baixo domínio inibitório de glicose (DIL) e um elemento conservado de ativação de resposta glicose (GRACE) localizado em seu n-terminus (Li et al., 2006). A activação do domínio da Graça pelos metabolitos da glucose promove a actividade transcritiva de Brebp e a ligação a uma sequência altamente conservada chamada elemento de resposta aos hidratos de carbono (Tarefas). A core está presente nos promotores dos genes-alvo do Sarbp, que codificam as principais enzimas da lipogénese de novo, incluindo a L-piruvato cinase (L-pk), uma enzima limitante da taxa de glicólise, a ácido gordo sintase (Fas), a acetil-CoA carboxilase (Acc) e a estearoil-CoA desaturase (Scd1) (Kawaguchi et al., 2001). Um estudo recente relatou a interdependência entre o ChREBP (activado pela glucose) e o SREBP-1C (activado pela insulina) para a indução completa da expressão genética glicolítica e lipogénica no fígado (Linden et al., 2018). O restabelecimento Viral da forma activa nuclear de SREBP-1c no fígado de ratos deficientes em ChREBP (ChREBPKO) normalizou a expressão do gene lipogénico, não tendo qualquer efeito no resgate da expressão do gene glicolítico. O espelho da experiência, em que ChREBP expressão foi induzida no fígado de SREBP-1c knockout mice, resgatado glycolytic a expressão do gene, mas surpreendentemente não lipogênicos a expressão do gene, apesar da conhecida função de ChREBP no controle da síntese de ácidos graxos genes. No entanto, este estudo sugere a importância da dupla acção de Sarebp e SREBP-1c nos genes de controlo envolvidos na regulação da síntese de ácidos gordos (Linden et al., 2018).
ChREBP é altamente enriquecido no fígado e foi estudado como um regulador mestre do metabolismo lipídico (Iizuka et al., 2004; Osorio et al., 2016). A paródia também é significativamente expressa em ilhéus pancreáticos, intestino delgado, músculo esquelético e, em menor extensão, no rim e no cérebro (ver Richards et al., 2017 for review). Curiosamente, outra isoforma de ChREBP, ChREBPß, originária de um primeiro promotor alternativo de exon, foi identificada pela primeira vez em tecido adiposo (Herman et al., 2012) e mais tarde descrito em outros tipos de células (ver Abdul-Wahed et al., 2017 for review). Como vamos discutir, ChREBPß é descrito como uma isoforma constitucionalmente ativa. Espera-se que os futuros trabalhos abordem os papéis respectivos de ChREBP e ChREBPß na regulação da glucose e do metabolismo lipídico, bem como identifiquem os seus objectivos específicos e/ou sobrepostos.
ChREBP Structure and Regulation Via the LID/Grace Domains
ChREBP belongs to the Mondo family of bHLH / Zip transcription factors. O domínio de N-terminus (1-251 resíduos) contém dois sinais de exportação nuclear (NES) e um sinal de localização nuclear (NLS) regulando a localização subcelular interagindo com a manutenção da região cromossômica 1 (CRM1) também referido como exportina 1 e/ou 14-3-3 proteínas (Sakiyama et al., 2008). A região c-terminus contém um domínio polyproline, um domínio bHLH/LZ (660-737 resíduos) e um domínio semelhante a leucina zipper (Tipo Zip, 807-847 resíduos) que estão associados com co-fatores e ligação ao DNA (Yamashita et al., 2001; Fukasawa et al., 2010; Ge et al., 2012). A localização e a ativação transcritional de ChREBP são determinadas pela disponibilidade de nutrientes. A regulação mediada pela Glucose de Brebp ocorre principalmente ao nível do módulo de detecção de glucose (GSM) ou da região conservada mondo (MCR), que é composto pela tampa e pelos domínios de graça, como mencionado na introdução (figura 1A).; Li et al., 2006; Singh and Irwin, 2016). Em 2012, Herman et al. (2012) described another ChREBP isoorm, ChREBPß, that is transcribed from an alternative first exon promoter 1b to exon 2 (Figure 1B). Esta transcrição é traduzida de exon 4, gerando uma proteína mais curta de 687 aminoácidos (a isoforma de ChREBP de comprimento completo, renomeada α, contém 864 aminoácidos, chamada ChREBP no manuscrito) em que os dois NES, NLS e o domínio da tampa estão faltando. ChREBPß é altamente ativo em tecido adiposo branco de uma forma GLUT-4 dependente e sugere-se que seja diretamente regulado por ChREBPa, uma vez que uma sequência de Tarefas foi identificada no promotor exon 1β (Herman et al., 2012; figura 1B). A regulação de ChREBPß por ChREBPa sugere a existência de um laço feed-forward que pode exacerbar a resposta à glucose em condições hiperglicémicas. No entanto, o(s) mecanismo (s) de regulação da isoforma de ChREBPß, e mais importante ainda a sua função específica, precisam de ser elucidados.
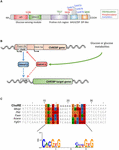
Figura 1. A) estrutura do elemento de resposta em hidratos de carbono: proteína α (ChREBPa). ChREBPa é composto por 864 aminoácidos e contém vários domínios regulatórios. No terminal N, A proteína contém um módulo sensível à glucose composto pelo domínio inibidor da glucose (Dil) baixo e pelo elemento conservado activado da glucose (GRACE). A proteína também contém um domínio rico em poliprolinas, um bHLH/LZ e um domínio semelhante a leucina-zipper (semelhante a Zip) localizado no C-terminus. As modificações pós-translacionais estão indicadas nos respectivos resíduos, fosforilação (vermelha), acetilação (azul) e nas O-Glcnacilações recentemente identificadas (verde). B) estrutura genética do gene de Brebp e geração das duas isoformas de Brebp α e β. O ChREBPß é transcrito a partir de um primeiro promotor alternativo de exon 1b. esta transcrição é traduzida a partir de exon 4 gerando uma proteína mais curta de 687 aminoácidos em que faltam os dois NES, o NLS e o domínio da tampa. Sugere-se que a isoforma de ChREBPß seja directamente regulada por ChREBPa, uma vez que foi identificada uma sequência de Tarefas no promotor 1b do exon. desconhece-se actualmente se ambas as isoformas de ChREBP α e β se ligam à tarefa. Figura adaptada de Herman et al. (2012). (C) multi-alinhamento de sequências de Consenso de Tarefas apresenta em vários promotores de genes alvo de Brebp. O alinhamento baseado em nucleótidos é apresentado no topo da figura juntamente com a sequência de consenso descrita em Poungvarin et al. (2015). O logótipo correspondente à sequência de consenso associada a este alinhamento particular também está representado.
activação do Sarrebp por metabolitos de Glucose
em jejum, activação dependente do glucagon da proteína cinase a (PKA) (Kawaguchi et al., 2002) phosphorylates ChREBP on residues Ser196 and Thr666, leading to ChREBP binding to the protein 14-3-3 and its retention in the cytosol (Kawaguchi et al., 2001, 2002; Davies et al., 2008). A proteína ativada AMPK (AMPK), um sensor de energia celular central, também fosforila ChREBP no resíduo Ser568, o que por sua vez diminui a ligação de ChREBP aos promotores de seus genes alvo (Kawaguchi et al., 2002; Sato et al., 2016). Foi demonstrado que os metabolitos gerados durante o jejum, tais como AMP e corpos cetónicos produzidos a partir da oxidação de ácidos gordos, desempenham um papel inibitório alostérico alterando o Sarbp e a afinidade proteica de 14-3-3-3, melhorando a estabilização complexa e favorecendo a retenção citosólica (Sakiyama et al., 2008; Nakagawa et al., 2013; Sato et al., 2016). Em resposta aos carboidratos, o ChREBP é regulado nos níveis transcritional, translacional e pós-translacional. O aumento das concentrações de glucose após uma refeição promove a síntese de metabolitos intermédios tais como a xilulose-5-fosfato (X5P), inicialmente proposto como activador da fosfatase 2A (PP2A) (Kawaguchi et al., 2001; Kabashima et al., 2003). O PP2A foi descrito anteriormente para desphosphorilato de Sarebp no resíduo de Ser196, permitindo a sua translocação para o núcleo, onde é ainda mais desphosphorilado de forma dependente de X5P e PP2A (em Thr666 e Ser568). No entanto, este modelo foi contestado ao longo dos anos e outros metabolitos, tais como a glucose-6-fosfato (G6P), foram propostos como potenciais activadores da translocação/actividade do Sarebp (Dentin et al., 2012). McFerrin et al. (2012) identified a putative motif for G6P binding (253-SDTLFT-258) on the GRACE domain, which is also conserved in MondoA, a ChREBP/MondoB ortholog (see Richards et al., 2017 for review). De acordo com esta hipótese, o G6P poderia promover uma mudança de conformação alostérica que induz uma conformação aberta para o Crebp, facilitando a interação com co-fatores e subsequente translocação para o núcleo (McFerrin et al., 2012).
no interior do núcleo, o Sarebp pode ser modificado através de O-Glcnacilação, uma modificação pós-translacional dependente do metabolismo da glucose, e identificado como importante para a actividade transcripcional do Sarebp (Guinez et al., 2010). A o-Glcnacila ocorre nos resíduos de serina e treonina através da actividade da O-GlcNAc transferase (OGT), uma enzima que adiciona resíduos de N-acetilglucosamina (GlcNAc) às proteínas alvo, modificando assim a sua actividade, estabilidade e/ou localização subcelular. Yang et al. (2017) recently revealed several ChREBP residues modified by O-Glcnacilation. Mutações destes resíduos nos domínios bHLH/ZIP e dimerização e domínio de localização citoplasmática (DCD) permitiram a identificação de Thr517 e Ser839 como locais essenciais para a activação dependente da glucose de ChREBP (figura 1A). ChREBP também pode ser modificado por acetilação através da atividade da acetiltransferase histona de p300 (Bricambert et al., 2010). O P300 ativado pela glicose, acetila Crebp sobre Lys672 e aumenta a sua atividade transcritional, aumentando o seu recrutamento para a sequência de acordes, que é a seqüência de ligação de consenso ideal é Caygycnnnnnnnncrtg (figura 1C). Poungvarin et al. (2015) analyzed ChREBP binding sites by ChIP-seq in liver and white adipose tissue of mice re-fed with a high-carboydrates, fat-free diet. Eles relataram que a ligação de ChREBP é enriquecida em vias envolvidas na sinalização de insulina, junções aderentes e câncer, sugerindo um novo envolvimento de ChREBP na tumorigênese e progressão do câncer. Além disso, um estudo recente relatou a importância do Sarrebp no carcinoma hepatocelular (HCC) (Ribback et al., 2017). Os autores descobriram que a eliminação genética de Crebp (em ratinhos de ChREBPKO) prejudicou a hepatocarcinogénese impulsionada pela sobre-expressão proteica cinase B/Akt em ratinhos. Além disso, a inibição da Sarrebp mediada pelo siRNA nas células HCC de ratinho e/ou humano resultou numa diminuição da proliferação e apoptose.
Co-factores e Parceiros da Crebp
vários Co-factores e / ou parceiros da Crebp foram identificados ao longo dos últimos anos (ver Richards et al., 2017 for review). Max like protein x( Mlx), um fator de transcrição bHLH/LZ, foi o primeiro identificado como um parceiro de ligação comum da família Mondo (Stoeckman et al., 2004). A dimerização de Crebp com Mlx é necessária tanto para translocação nuclear em resposta à glicose e ligação aos elementos de Tarefas. Receptores nucleares como o factor Nuclear hepatocitário 4α (HNF4a) e o receptor farnesóide X (FXR) também foram descritos como parceiros de ChREBP. O HNF4a interage fisicamente com o ChREBP ligando-se à região de repetição-1 directa (DR-1) ao promotor dos genes-alvo do ChREBP (Adamson et al., 2006; Meng et al., 2016). Além disso, as proteínas do co-ativador transcriptional p300/CBP foram mostradas para estabilizar o complexo de ChREBP/HNF4a (Burke et al., 2009). As proteínas do co-activador p300 / CBP transcriptional desempenham um papel central na coordenação e integração de múltiplos eventos dependentes do sinal com o aparelho de transcrição. Outra propriedade chave do P300 / CBP é a presença de atividade da acetiltransferase histona (HAT), que confere a p300/CBP a capacidade de influenciar a atividade da cromatina modulando histonas nucleossômicas. Em hepatócitos humanos, a ligação FXR ao complexo de ChREBP-HNF4a desencadeia a libertação de ChREBP do CBP/p300, levando ao Recrutamento do SMRT de histone deacetilase no promotor Lpk, agindo assim como um co-repressor da actividade transcripcional de ChREBP (Caron et al., 2013). Além disso, a atividade do chapéu CBP/p300 modifica o ChREBP no Lys 672, levando à sua ativação transcritional em resposta à glicose (Bricambert et al., 2010).Bricambert et al. (2018) recentemente identificou a planta de histona demetilase homeodomain finger 2 (Phf2), que pertence à família histone lysina demetilase (KDM7), como um novo co-fator de ChREBP. A interacção entre o Phf2 e o ChREBP aumenta a activação transcritional do ChREBP apagando as marcas de metilo H3K9 no promotor dos seus genes-alvo. Curiosamente, específicos co-recrutamento de Phf2 e ChREBP para o promotor do fator nuclear erythroid 2 como 2 (Nrf2) contribui para o efeito de proteção de Phf2 contra aumento de espécies reativas de oxigênio (ROS) e NAFLD progressão no contexto de hiperglicemia (Bricambert et al., 2018).
Papel de ChREBP no Metabolismo dos Hidratos de carbono e Hepatokine Produção
ChREBP como Regulador da função Hepática de Ácidos graxos Síntese e Secreção de VLDL
Não-alcoólica fígado gordo doença é uma característica da síndrome metabólica, e os estudos em seres humanos revelam que de novo lipogênese contribui para cerca de 25% do total de lipídios no fígado em pacientes com NAFLD (Donnelly et al., 2005). Em Estados resistentes à insulina, a hiperglicemia e hiperinsulinemia aumentam a lipogénese, em parte através da activação do Sarbp e do SREBP-1c. A inibição da crebp no fígado de ratinhos obesos e resistentes à insulina, através de RNAi ou ablação genética, conduz à reversão da esteatose hepática (Dentin et al., 2006; Iizuka et al., 2006). A secreção alterada de VLDL pelo fígado também contribui para a patogênese do NAFLD. Proteína de transferência de triglicéridos microssomais (MHTTP) é a proteína responsável pela montagem e secreção de lipoproteínas contendo apolipoproteína B. A deficiência de MHTTP em ratinhos e humanos causa hipolipidemia e fígado gordo. A regulação desta proteína tem sido associada a alguns elementos cis altamente conservados no seu promotor, incluindo domínios regulamentares críticos positivos e negativos (Cuchel et al., 2013; Hussain et al., 2011). Recentemente, o ChREBP foi apontado como um potencial regulador do MTTP, uma vez que a falta de Crrebp funcional no fígado suprime a expressão do Mttp e a montagem e secreção VLDL (Niwa et al., 2018). No entanto, uma vez que não foi possível identificar claramente qualquer tarefa no promotor do Mhttp, será necessária uma análise mais aprofundada para identificar o mecanismo com o qual o Crebp regula o Mhttp.
Regulation of frutose Metabolism by ChREBP in Liver and Intestine
The link between ChREBP and frutose metabolism was first evidenced by the phenotypic analysis of ChREBP knockout mice (ChREBPKO mice). Foi relatado que os ratos de ChREBPKO morreram em vários dias após a alimentação com alta frutose (HFrD) (Iizuka et al., 2004). Esta grande intolerância à frutose foi atribuída à redução da expressão da frutoquinase e da triose cinase, duas enzimas necessárias para o metabolismo da frutose (Iizuka et al., 2004). Kim et al. (2016) relataram a importância de ChREBP para a conversão eficiente de frutose em glicose no fígado e no corpo inteiro teor de frutose folga, mas também, sob a ingestão de frutose, ChREBP poderia contribuir para a hiperglicemia diretamente trans-ativação G6pc expressão, uma chave gene da gliconeogênese. Este efeito pode conduzir a um ciclo vicioso em que o consumo de frutose agrava a produção de glucose através da actividade de ChREBP (Kim et al., 2016). No ano seguinte, o estudo de Zhang et al. (2017) relatou que os ratinhos de ChREBPKO alimentados com HFrD desenvolvem lesões hepáticas graves devido à Sobre-activação do stress do retículo endoplasmático e da apoptose hepatocitária mediada pela proteína homóloga da proteína de ligação do ccaat-enhancer. A apoptose nos hepatócitos nestes ratinhos foi mais provavelmente associada ao aumento da biossíntese do colesterol, uma vez que a inibição desta via via via HMG-CoA redutase (HMGCR) ou inibição SREBP2 resgatou ratinhos de Brebpko de lesões hepáticas induzidas pelo HFrD. A falta de Sarrebp foi também recentemente associada a uma desregulação do metabolismo da sacarose e da frutose, que levou à intolerância ao açúcar e à malabsorção no ratinho (Kato et al., 2018). Estes efeitos foram associados à diminuição da expressão intestinal de sacarose-isomaltase (SI), que digere a sacarose em glucose e frutose, os transportadores de glucose 5 (Glut5) e 2 (Glut2) e a enzima cetohexocinase (Khk), que regula a fructólise (Figura 2). A desregulação destas enzimas pode levar à acumulação de sacarose e frutose não digeridas, com potenciais repercussões na composição do microbiota intestinal. A comparação entre ChREBPKO e fígado específicas ChREBP knockout (ChREBPLiverKO) ratos alimentados com HFrD tinha anteriormente, revelou que hepática ChREBP deficiência por si só, não levam a intolerância à frutose, mas que ChREBP deficiência no intestino delgado é provavelmente responsável por uma deficiência de frutose tolerância observado nesses ratos (Kim et al., 2017). No seu conjunto, estes estudos sublinham a importância do Sarebp na regulação do metabolismo da frutose e sublinham a necessidade de uma melhor compreensão do seu papel e regulação no intestino delgado.
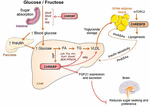
Figura 2. O ChREBP regula múltiplos sinalizadores / vias metabólicas em resposta à glucose e frutose. ChREBP é expresso em vários tecidos, incluindo intestino, fígado e tecido adiposo branco. Nestes tipos de células, em resposta à glucose e/ou frutose, o Sarebp é activado e induz um programa genico específico, tal como indicado na figura. No intestino, a estimulação da expressão SI, Glut5, Glut2 e Cetohexocinase (Khk) por ChREBP (directa ou indirectamente) foi descrita para melhorar a tolerância à sacarose e a absorção de frutose. No fígado, o ChREBP é um modulador chave da expressão genética glicolítica, lipogênica e microssómica da proteína de transferência de triglicéridos (Mhttp), controlando assim a acumulação de ácidos gordos e a exportação de VLDL a partir do fígado. ChREBP também regula a produção de hepatocinas, tais como fibroblast growth factor 21 (FGF21). Este eixo fígado-a-cérebro expande a função hepática de Crebp a partir de um regulador hepático para um modulador sistêmico que afeta não só o manuseio do substrato no fígado, mas também a preferência nutricional. A activação do sarrebp no tecido adiposo branco está ligada a uma homeostase metabólica melhorada através da produção de sinais protectores circulantes. Uma nova classe de lípidos de mamíferos caracterizada por uma ligação ramificada de éster entre um ácido gordo e um ácido hidroxi-gordo (ácido palmítico ácido hidroxilesteárico) foi relatada como exercendo efeitos benéficos sobre a homeostase da glucose através da modulação directa e mediada pela incretina da função das células β, do aumento da captação de glucose adiposa e da redução da inflamação. Curiosamente, o mtroc2 foi recentemente identificado como um novo regulador da isoforma de ChREBPß em células adiposas.
Regulamento da BDK:PPM1K Eixo no Fígado
O primeiro cometidos etapa da cadeia ramificada de aminoácidos (Bcaa), o catabolismo é regulada pela cadeia ramificada ketoacid desidrogenase (BCKDH) complexo que é controlado por duas enzimas, os aminoácidos de cadeia alfa-ceto ácido desidrogenase quinase (BDK) e a proteína fosfatase, Mg2+/Mn22+ dependentes de 1K (PPM1K). White et al. (2018) recentemente associou Crebp à regulação do BDK e à regulação do PPM1K no fígado e identificou um motivo de Retore conservado no promotor de ambos os genes. Observou-se uma correlação positiva entre a expressão de BDK e outros genes-alvo típicos de ChREBP (Fasn, Pklr, ChREBPß) em fígados de ratos alimentados com uma dieta rica em glicose ou frutose. A nível fisiológico, o aumento da razão BDK:PPM1K levou à fosforilação e activação da liase ATP-citrato (ACLY), estimulando assim a lipogénese de novo. Estes achados revelam que BDK e PPM1K podem ser novos genes ativadores da lipogênese regulados por ChREBPß. Dado o seu papel na regulação do metabolismo dos lípidos, da glucose e dos aminoácidos, o BDK e o PPM1K podem ser considerados como potenciais alvos terapêuticos no fígado num futuro próximo (White et al., 2018).
ChREBP é necessário para a regulação mediada pela Glucose de FGF21
ChREBP foi recentemente associado à produção e secreção de hepatocinas tais como o factor de crescimento dos fibroblastos 21 (FGF21) (Iizuka et al., 2009; Dushay et al., 2015, Iroz et al., 2017). FGF21 é uma hormona metabólica sintetizada pelo fígado com múltiplos efeitos benéficos nos tecidos periféricos (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Até recentemente, o FGF21 foi considerado como uma hormona em jejum que aumenta a oxidação dos ácidos gordos, a cetogénese e a lipólise sob o controlo transcritional do receptor activado pelo proliferador de peroxissomas α (Ppara) (Inagaki et al., 2007). Uma tarefa do promotor Fgf21 foi previamente identificada em ratos (-74 a -52 bp) e humanos (-380 a -366 bp) (Iizuka et al., 2009) mas os estudos funcionais têm faltado até recentemente. O consumo de glucose e frutose conduziu a um aumento rápido dos níveis de FGF21 em voluntários saudáveis e em doentes com síndrome metabólica (Dushay et al., 2015). Estudos adicionais também relataram uma ligação mecanicista entre FGF21 derivado de Crebp e preferência macronutriente através de um eixo fígado-cérebro (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Este eixo fígado-cérebro expande a função de Crebp a partir de um regulador metabólico hepático para um modulador sistêmico, afetando não só o manuseio de substrato hepático, mas também o comportamento alimentar global (Abdul-Wahed et al., 2017).
Papel de ChREBP na Inter-Órgão de Rede Que Controla a Homeostase Energética
Papel de Hepáticas ChREBP no Controle da Sensibilidade à Insulina Saldo
Nosso laboratório relatado anteriormente que ChREBP atua como uma chave modulador da função hepática composição de ácidos graxos e a sensibilidade à insulina no contexto da não-alcoólicas e alcoólicas, doenças do fígado (ver Abdul-Wahid et al., 2017 for review). Os ratos que expelem demasiado a Sarrebp desenvolveram uma esteatose hepática maior do que os controlos, mas, curiosamente, mantiveram-se livres de complicações metabólicas e não desenvolveram resistência à insulina. A análise lipidómica revelou que a esteatose mediada por Sarebp está associada a uma diminuição dos ácidos gordos saturados e a um aumento dos ácidos gordos monoinsaturados, estes últimos que têm demonstrado estar associados a efeitos benéficos mediados por Sarebp na sensibilidade à insulina (Benhamed et al., 2012). Estes resultados demonstram o papel de ChREBP em Particionamento lipídico e sugerem que espécies lipídicas específicas, quando presentes na localização e tempo adequados, podem desencadear sinais que modulam a adaptação ao estresse metabólico (Benhamed et al., 2012; Bricambert et al., 2018). Curiosamente, Jois et al. (2017) também sugeriu um papel protector para o Sarebp hepático no que diz respeito à homeostase da glucose no corpo inteiro e à sensibilidade à insulina. Os ratos de ChREBPLiverKO exibem um agravamento da tolerância à glucose, enquanto protegidos da esteatose hepática. A deleção hepática de Sarebp também resultou em alterações na expressão genética em tecidos adiposos brancos e marrons, sugerindo comunicação inter-tecidular. A contribuição de ChREBP para o equilíbrio energético do corpo inteiro pode, portanto, basear-se na sua regulação das espécies lipídicas e/ou da produção de hepatoquinas, contribuindo para a coordenação inter-tecidular da homeostase energética (Jois et al., 2017).A alteração da sinalização da insulina no tecido adiposo é uma característica crítica da resistência à insulina. Estudos têm relatado que a ativação do Sarrebp no tecido adiposo branco pode melhorar a homeostase metabólica através da produção de sinais circulantes Protetores (Yore et al., 2014; Tang et al., 2016). Foi relatada a existência de uma classe de lípidos de mamíferos caracterizada por uma ligação ramificada de éster entre um ácido gordo e um ácido hidroxi-gordo, ácido palmítico ácido hidroxilesteárico (PAHSA), que exerce efeitos benéficos sobre a homeostase da glucose através da modulação directa e mediada pela incretina da função das células β, da captação de glucose e da redução da inflamação (Yore et al., 2014). Da mesma forma, adiposo específicas ChREBP knockout (ChREBPadiposeKO), que apresentam baixa lipogênese taxas de tecido adiposo, são resistente à insulina com comprometimento da acção da insulina no fígado, músculo e tecido adiposo branco em ambos os chow e alto teor de gordura, dieta de condições. ChREBPadiposeKO ratos têm menores níveis séricos de PAHSAs, enquanto PAHSA suplementação, em particular a 9-PAHSA de isómeros, resgata ChREBPadiposeKO global de resistência à insulina e inflamação do tecido adiposo, confirmando que a perda de tecido adiposo-ChREBP é suficiente para causar resistência à insulina (Vijayakumar et al., 2017). Um estudo recente identificou o alvo mecanicista do complexo 2 de rapamicina (mtroc2) como um novo regulador de ChREBP (especialmente a isoforma β) em células adiposas. A ablação específica do companheiro insensível à rapamicina do mTOR (Rictor) em adipócitos maduros prejudicou a captação de glucose estimulada pela insulina nos tecidos adiposos, conduzindo à regulação descendente do ChREBPß e à expressão genética alvo envolvida no controlo da lipogénese (Tang et al., 2016). De acordo com uma importante adipose–crosstalk hepático mediada pelo Sarbp, estes efeitos estão associados à resistência à insulina hepática e à gluconeogénese aumentada. Ao todo, estes estudos apoiam um papel importante para a adipose ChREBP no desencadeamento de sinais sensíveis à insulina (Tang et al., 2016).
Romance Interação Entre o Hormônio-Sensível Lipase e ChREBP no Tecido Adiposo
ChREBP foi recentemente identificada como um parceiro da enzima lipolítica hormônio-sensível lipase (HSL) no tecido adiposo (Morigny et al., 2019). Demonstrou-se que a redução do HSL nos adipócitos humanos e no tecido adiposo do Ratinho aumenta a sensibilidade à insulina e induz o alongamento da enzima dos ácidos gordos de cadeia muito longa (Elovl6). Elov16 é uma enzima microssómica que regula o alongamento dos ácidos gordos saturados e monoinsaturados de forma dependente de Crebp (Morigny et al., 2019). No mecanicista nível, a interação física entre o HSL e ChREBP prejudicada a translocação nuclear de ChREBPa e a posterior indução de ChREBPß e genes alvo, em particular Elovl6 (Morigny et al., 2019). Este estudo revela um novo regulamento para a sarda em tecido adiposo. A inibição da interacção entre HSL e ChREBP pode levar a potenciais estratégias terapêuticas para melhorar a sensibilidade à insulina nas células adiposas.
Conclusion and Future Directions
ChREBP is now a well-established carboidratos sensor. Embora a maioria dos estudos tem sido dedicada à sua implicação no controle da glycolytic e lipogênicos caminhos, os dados mais recentes também revelaram novas contribuições de ChREBP nos hepatócitos e nas células de gordura, onde ele poderia ser fundamental na produção de hepatokines e/ou lipokines provocando inter-órgão de interferência. Como discutido, os co-fatores recentemente identificados (modificadores epigenéticos) e/ou parceiros (adipose HSL) nestes tecidos também podem representar potenciais estratégias terapêuticas para o NAFLD e/ou para melhorar a sensibilidade sistémica à insulina. Estudos recentes também apoiaram a importância do Sarrebp na regulação do metabolismo da frutose e sublinharam a necessidade de uma melhor compreensão do seu papel e regulação no intestino delgado. Por último, a identificação de objectivos específicos e/ou sobrepostos de ChREBPa e ChREBPß em tipos-chave de células, bem como a determinação do seu impacto específico na sensibilidade à insulina, serão particularmente importantes nos próximos anos.
contribuições dos autores
todos os autores listados fizeram uma contribuição substancial, direta e intelectual para a obra, e aprovaram-na para publicação.
Financiamento
O postic’s do laboratório (U1016-Institut Cochin) é suportado por doações da ChroME Rede (Marie Curie Skłodowska Ação H2020-MSCA-ITN-2015-675610), a Fundação para a Pesquisa Médica (FRM) (DEQ20150331744) e a ANR-15-CE14-0026-Hepatokind.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.