- Introdução
- as funções múltiplas da Quimase
- Quimase em mastócitos
- múltiplas funções enzimáticas da Quimase
- a função enzimática da Quimase em NASH
- envolvimento da Quimase em modelos animais de NASH
- Efeito de Chymase Inibidor de NASH Modelos Animais
- Efeito de Chymase Inibidor de NASH Modelos Animais
- mecanismo de inflamação hepática atenuado pelo inibidor da Timase
- Conclusão
- Autor Contributions
- Declaração de conflito de interesses
Introdução
Não-alcoólica fígado gordo doença (NAFLD) tem sido reconhecido como a forma mais comum de doença hepática (Angulo, 2002; Clark et al., 2002). A esteatohepatite não-alcoólica (NASH) imita a hepatite alcoólica apesar da ausência de uma história de bebida (Ludwig et al., 1980). NAFLD e NASH estão associados à síndrome metabólica resultante da obesidade, resistência à insulina, hiperlipidemia e hipertensão. O NAFLD é considerado a doença hepática mais comum e apresenta-se tipicamente como esteatose hepática simples (Tiniakos et al., 2010). Em contraste, NASH é caracterizado por esteatose grave, inflamação lobular e fibrose do fígado (Powell et al., 1990; Bertot and Adams, 2016). Embora o mecanismo responsável pelo desenvolvimento de NASH continua a não ser claro, NASH é proposto para ser causado por um ‘múltiplos hit’ do processo, com a esteatose hepática como o primeiro hit’ e acessos subseqüentes, tais como inflamação, estresse oxidativo, e endotoxinas (Tilg e Moschen, 2010). NASH está intimamente relacionado com a síndrome metabólica, e vários estudos clínicos investigaram o tratamento terapêutico de NASH, focando nos sintomas de diabetes, hiperlipidemia e hipertensão (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). No entanto, não foram estabelecidos agentes terapêuticos geralmente aceites.A Quimase pode estar envolvida na patogénese da fibrose hepática. A actividade da quimase aumentou significativamente nos fígados de doentes com fibrose ou cirrose e houve uma correlação significativa entre o nível de quimase e o grau de fibrose (Komeda et al., 2008). Embora o aumento da actividade da quimase não tenha sido notificado em doentes com NASH, foi observado em modelos animais de NASH (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Em contraste, a inibição da quimase utilizando inibidores da molécula baixa resultou numa redução significativa da inflamação, esteatose e fibrose em modelos de rato e hamster NASH (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Estes achados indicam que quimase pode estar envolvido em inflamação, esteatose e fibrose durante o desenvolvimento e progressão de NASH (Figura 1).
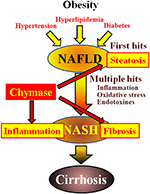
FIGURA 1. NAFLD e NASH estão ligados à síndrome metabólica por obesidade, resistência à insulina, hiperlipidemia e hipertensão. Acredita-se que NASH se desenvolve através de um processo de “acerto múltiplo”, com esteatose hepática como o “primeiro acerto” e sucessos subsequentes, como inflamação, estresse oxidativo e endotoxinas, e é caracterizada por esteatose grave, inflamação e fibrose. A quimase pode estar envolvida na progressão da esteatose, inflamação e fibrose no fígado.
as funções múltiplas da Quimase
Quimase em mastócitos
Quimase (EC 3.4.21.39) são expressas nos grânulos secretores de mastócitos. A quimase é produzida como uma procimase inactiva dentro de grânulos secretores e requer dipeptidil peptidase I (DPPI) para activação. DPPI é uma proteinase tiol e seu pH ótimo é 6,0. O pH ideal é consistente com a função proposta de DPPI para ativar a procimase, uma vez que o pH dentro dos grânulos secretórios é regulado em pH 5.5 (de Young et al., 1987) (Figura 2). No entanto, a quimase não tem atividade enzimática dentro de mastócitos a este pH, porque o pH ideal para a quimase é entre 7 e 9 (Takai et al., 1996, 1997). Após a ativação do mastro de grânulos celulares por estímulos tais como inflamação e lesão, a quimase é libertada e exibe a função enzimática no seu pH óptimo de 7.4 (Figura 2).
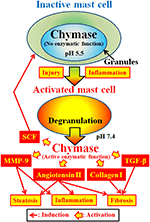
FIGURA 2. A quimase é armazenada nos grânulos secretores de mastócitos inactivos. O pH dentro dos grânulos é mantido em pH 5.5, uma condição na qual a quimase não tem atividade enzimática. A quimase exibe as suas funções enzimáticas, tais como a formação de angiotensina II, MMP-9, TGF-β, colagénio i e SCF, após libertação de mastócitos, após activação por inflamação e lesão.
múltiplas funções enzimáticas da Quimase
A Quimase é uma protease serina e clama o lado C-terminal das proteínas após aminoácidos aromáticos tais como Phe, Tyr e Trp em geral. A quimase pode clivar a ligação Phe8-His9 do peptídeo não Bioactivo angiotensina I e formar o seu peptídeo Bioactivo angiotensina II em tecidos de mamíferos, incluindo humanos (Urata et al., 1990; Takai et al., 1996, 1997). In addition, quimase enzymatically cleaves the precursors of matrix metalloproteinase (MMP)-9, transforming growth factor (TGF)-β and collagen I to their active forms (Kofford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Além disso, a função enzimática da quimase pode produzir factor das células estaminais (SCF) através da clivagem enzimática da forma inactiva ligada à membrana do SCF, que induz a formação de mastócitos maduros a partir de células mastigadoras imaturas através da estimulação do receptor C-kit (Longley et al., 1997). Assim, a quimase tem múltiplas funções enzimáticas, incluindo a ativação da angiotensina II, MMP-9, TGF-β, colagénio i e SCF (Figura 2).
a função enzimática da Quimase em NASH
a angiotensina II pode promover a esteatose hepática e a inflamação aumentando as espécies reactivas de oxigénio (ROS) após estimulação dos receptores da angiotensina II em modelos animais de NASH (Hirose et al., 2007; Nabeshima et al., 2009). A angiotensina II também induziu fibrose hepática por indução da actina muscular α-lisa (SMA) em células esteladas hepáticas (Hscs) (Yoshiji et al., 2001). Foi relatado que o MMP-9 induz a infiltração de neutrófilos e macrófagos através da degradação de matrixes intercelulares tais como vitronectina e fibronectina, resultando num aumento da inflamação (Medina et al., 2006). Em doentes com NASH, observou-se um aumento significativo da expressão do gene MMP-9 no fígado em comparação com os controlos normais (Ljumovic et al., 2004). A sobre-expressão hepática do TGF-β em ratinhos transgénicos produziu fibrose hepática grave através do aumento da expressão do gene procollagen I (Casini et al., 1993). Sabe-se que tanto a formação TGF-β como a acumulação de colagénio I induzem fibrose hepática. A activação do SCF induz um aumento do número de células mastigadas e a sua função enzimática pode resultar num aumento da actividade da quimase nos tecidos fibróticos (Maruichi et al., 2004). Estas funções enzimáticas da quimase podem estar envolvidas na esteatose, inflamação e fibrose, todas as quais são observadas nos fígados de pacientes NASH e modelos animais (Figura 2).
envolvimento da Quimase em modelos animais de NASH
a dieta com deficiência de metionina e Colina (MCD) tem sido amplamente utilizada para induzir um modelo típico de NASH. Nos hamsters alimentados com a dieta MCD, observaram-se aumentos significativos da bilirrubina total, triglicéridos e ácido hialurónico no plasma (Tashiro et al., 2010). Além disso, observou-se acumulação de células inflamatórias e aumento da área do depósito lipídico e da área fibrótica no fígado. Neste modelo de NASH induzido pela dieta MCD, a actividade hepática da quimase e factores relacionados, tais como a angiotensina II, MMP-9 e colagénio i, aumentaram significativamente (Tashiro et al., 2010; Masubuchi et al., 2013). Recentemente, foi desenvolvido um novo modelo NASH no qual ratos hipertensos, propensos a acidentes vasculares cerebrais espontaneamente, 5/Dmcr (SHRSP5/Dmcr) foram alimentados com uma dieta rica em gorduras e colesterol (HFC) (Kitamori et al., 2012). Este modelo mostrou sintomas de síndrome metabólica que se pensava serem clinicamente semelhantes aos de pacientes de NASH (Kitamori et al., 2012). No modelo NASH induzido pela dieta HFC, foi observada hipertensão e hiperlipidemia, e foram detectadas esteatose grave, fibrose e acumulação de células inflamatórias no fígado (Miyaoka et al., 2017). Além disso, foi observado um aumento significativo da actividade da quimase juntamente com MMP-9, TGF-β e colagénio i no fígado (Miyaoka et al., 2017). Assim, parece haver uma relação próxima entre quimase e NASH patogênese em modelos animais de NASH.
Efeito de Chymase Inibidor de NASH Modelos Animais
Efeito de Chymase Inibidor de NASH Modelos Animais
baixo molécula chymase inibidor significativamente atenuado chymase atividade e diminuição da angiotensina II, MMP-9 e o colágeno eu níveis no fígado em um MCD dieta alimentados NASH hamster modelo, quando a administração do inibidor foi iniciada, ao mesmo tempo, como o MCD dieta (Tashiro et al., 2010; Masubuchi et al., 2013). O inibidor da quimase preveniu significativamente a esteatose hepática, fibrose e acumulação de células inflamatórias neste modelo NASH (Tashiro et al., 2010; Masubuchi et al., 2013). Pensa-se que o estresse oxidativo desempenha um papel na teoria do “acerto múltiplo” do desenvolvimento de NASH, e o aumento do marcador oxidativo do malondialdeído foi significativamente atenuado no fígado pelo inibidor de quimase (Masubuchi et al., 2013). Em um modelo de NASH induzido pela dieta de hamster MCD, o inibidor de quimase mostrou um efeito benéfico quando administrado em NASH estabelecido (Masubuchi et al., 2013). Os graus de esteatose e fibrose no fígado foram reduzidos em comparação com antes da administração do inibidor da quimase (Masubuchi et al., 2013).
no fígado de um modelo NASH induzido pela dieta de ratos hipertensos, um inibidor da quimase molecular baixo atenuou os níveis de quimase, bem como MMP-9, TGF-β e colagénio i, que são todos factores associados à quimase (Miyaoka et al., 2017). O inibidor da quimase atenuou significativamente a esteatose hepática e a fibrose, e reduziu a mieloperoxidase como marcador de inflamação, particularmente de infiltração neutrofílica (Miyaoka et al., 2017). Neste modelo induzido pela dieta HFC, a sobrevivência do grupo tratado com placebo foi de 0% às 14 semanas após o início da dieta HFC, e resultou de insuficiência hepática grave (Miyaoka et al., 2017). No entanto, o grupo tratado com inibidores da timase, no qual os ratos foram tratados com o inibidor da timase imediatamente após o início da dieta HFC, demonstrou uma sobrevivência de 100% às 14 semanas. Além disso, foi notificada uma taxa de sobrevivência de 50% para ratos tratados com o inibidor da quimase, com início 8 semanas após o início da dieta HFC, altura em que NASH foi estabelecido (Miyaoka et al., 2017).Consequentemente, os inibidores da quimase podem ser agentes úteis para a prevenção e melhoria de NASH em modelos animais. Por outro lado, a angiotensina II também promove indirectamente a inflamação hepática, esteatose e fibrose através de aumentos da expressão do gene MMP-9 e TGF-β. Tanto o MMP-9 como o TGF-β estão estreitamente envolvidos na patogénese de NASH, mas estes factores não são necessariamente induzidos apenas pela angiotensina II (Takai et al., 2010). Factores que não a estimulação da angiotensina II contribuem para o aumento da expressão do gene MMP-9 e TGF-β (Takai et al., 2010). Nestes casos, o bloqueador dos receptores da angiotensina II (ARB) não é capaz de atenuar as acções MMP-9 e TGF-β; No entanto, um inibidor da timase pode ter efeitos atenuantes através da inibição da activação do MMP-9 e do TGF-β, indicando um curso de tratamento potencial para a prevenção da progressão de NASH.
mecanismo de inflamação hepática atenuado pelo inibidor da Timase
O inibidor da Timase foi capaz de reduzir a inflamação em modelos NASH induzidos pela dieta MCD de hamster e em modelos NASH induzidos pela dieta HFC de ratos (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). O tratamento com inibidor da quimase atenuou significativamente a actividade da quimase hepática, bem como a redução dos níveis de angiotensina II e MMP-9 (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Na HSC, a angiotensina II induz a geração ROS, como peróxido de hidrogénio e superóxido, através da activação da nicotinamida fosfato dinucleótido (NADPH) oxidase (de Minicis e Brenner, 2007). O inibidor da quimase resultou em reduções na expressão genética do componente da NADPH oxidase Rac – 1 e do marcador de stress oxidativo malondialdeído, além de uma redução dos níveis de angiotensina II em um modelo NASH induzido pelo mcd de hamster (Masubuchi et al., 2013). O aumento da angiotensina II induzido pela ROS promoveu a expressão do gene MMP-9 em neutrófilos e macrófagos (Yaghooti et al., 2011; Kurihara et al., 2012). Assim, o inibidor da quimase inibe directamente a activação do proMMP-9 para MMP-9 e reduz indirectamente a expressão do gene MMP-9 através da diminuição da angiotensina II. O MMP-9 clives constituintes da matriz extracelular, tais como a vitronectina e a fibronectina, leva à desintegração da integridade hepática e induz a infiltração de macrófagos e neutrófilos (Medina et al., 2006). Num modelo NASH induzido pela dieta da HFC, foi observado um aumento significativo da expressão da mieloperoxidase nos macrófagos e neutrófilos no fígado, e foi reduzido pelo inibidor da quimase (Miyaoka et al., 2017). Assim, o mecanismo de inflamação atenuado pelo inibidor da timase pode depender da redução dos níveis de angiotensina II e MMP-9 no fígado.Mecanismo de esteatose hepática atenuado pelo inibidor da Timase
a angiotensina II pode influenciar a esteatose hepática através da produção de ROS. Em murine HSC, um inibidor da NADPH oxidase diminuiu significativamente a produção de ROS e uma ARB retardou o desenvolvimento de esteatose hepática através da atenuação da produção de ROS (Hirose et al., 2007; Guimarães et al., 2010). Num modelo de rato NASH induzido pela dieta MCD, foi observada uma atenuação significativa da esteatose em ratinhos com deficiência em receptores da angiotensina II (Nabeshima et al., 2009). Tanto as experiências in vivo como in vitro demonstraram que a angiotensina II apresenta uma elevada regulação da proteína de ligação do elemento regulador dos esteróis (SREBP)-1c e da expressão do gene da ácido gordo sintase (FAS), ambos factores importantes na regulação da lipogénese, na sequência do aumento da ROS (Kim et al., 2001; Hongo et al., 2009). Em contraste, a ARB atenuou a esteatose hepática juntamente com a redução da expressão genética de SREBP-1c e FAS através da atenuação ROS em um modelo de NASH de rato (Kato et al., 2012). Num modelo NASH induzido pela dieta de hamster MCD, observou-se uma atenuação significativa da expressão do gene SREBP-1C e FAS após o tratamento com um inibidor da quimase molecular baixo (Masubuchi et al., 2013). Por conseguinte, o mecanismo benéfico da esteatose hepática através do inibidor da quimase pode depender da redução da produção de ROS através da redução da produção de angiotensina II no fígado.Mecanismo de fibrose hepática atenuado pelo inibidor da Quimase
A Quimase pode estar estreitamente associada à progressão da fibrose tecidular, uma vez que contribui para a formação de TGF-β a partir do precursor não Bioactivo TGF-β, e sabe-se que o TGF-β induz fortemente o crescimento de fibroblastos (Takai et al., 2003; Oyamada et al., 2011). Sabe-se que o TGF-β desempenha um papel central na progressão da fibrose em doentes NASH por meio de HSC activado (Williams et al., 2000). A inibição da função TGF-β através da expressão genética e da sinalização resultou numa melhoria da fibrose hepática em modelos experimentais (George et al., 1999; arias et al., 2003). Num modelo NASH induzido pela dieta do HFC, a atenuação da actividade da quimase pelo inibidor da quimase resultou em reduções nos níveis de TGF-β e na área fibrótica do fígado (Miyaoka et al., 2017). Assim, a redução do TGF-β pelo inibidor da quimase pode contribuir para a prevenção da fibrose hepática.
angiotensina II também pode estar envolvido na indução de fibrose hepática. A angiotensina II induz a contracção e proliferação de HSC, e também induz a expressão genética do TGF-β em fibroblastos in vitro (Kagami et al., 1994; Bataller et al., 2000). Tanto os níveis de TGF-β como o grau de acumulação de colagénio e as lesões fibróticas foram observados por ligação do ducto biliar em ratinhos de tipo selvagem, no entanto, estes foram atenuados em ratinhos com deficiência em receptores da angiotensina II (Yang et al., 2005). Num modelo Rat NASH, a ARB também atenuou a fibrose hepática através da redução da expressão do gene TGF-β (Hirose et al., 2007). Pode também existir uma relação entre a angiotensina II e a fibrose hepática, à excepção da expressão do gene TGF-β induzido pela angiotensina II. Em doentes com hepatite C crónica, a ARB reduziu a expressão do gene do colagénio através da expressão do gene Rac-1 (Colmenero et al., 2009). HSC são reconhecidas como as principais células produtoras de colagénio no fígado, e o aumento na expressão da actina muscular α-lisa (SMA) no HSC induz fortemente a deposição da matriz extracelular, incluindo o colagénio I (de Minicis e Brenner, 2007). A angiotensina II pode induzir a expressão do gene α-SMA no HSC do rato. Em contraste, o bloqueio da angiotensina II resulta na atenuação da fibrose hepática juntamente com a redução de α-SMA (Yoshiji et al., 2001). Embora não tenham sido avaliadas em doentes com NASH, tanto as actividades formadoras de quimase como de angiotensina II foram significativamente aumentadas em regiões fibróticas de fígados de doentes com cirrose, e foram observadas correlações significativas entre a quimase, a actividade formadora de angiotensina II e a fibrose hepática (Komeda et al., 2008). Num modelo de cirrose hepática induzida por tetracloreto de hamster, foram observados aumentos significativos na actividade da quimase e da formação de angiotensina II, que foram significativamente atenuados juntamente com cirrose hepática após tratamento com um inibidor da quimase molecular baixa (Komeda et al., 2010).
o tranilast estabilizador de células do mastro pode inibir a activação das células do mastro, bloqueando a libertação de quimase e impedindo assim o desenvolvimento de fibrose hepática num modelo NASH induzido pela dieta do rato e da HFC (Uno et al., 2008). A quimase promove a proliferação de mastócitos através da ativação SCF pela sua função enzimática (Longley et al., 1997). Em modelos animais de NASH, o inibidor da timase reduziu o aumento do número de mastócitos no fígado, resultando numa redução da actividade da timase após inibição directa pelo inibidor da timase e numa redução indirecta da expressão da timase nos mastócitos (Masubuchi et al., 2013; Miyaoka et al., 2017).
portanto, o inibidor da timase pode contribuir para a prevenção da fibrose hepática através da inibição da activação do TGF-β Por inibição da timase e/ou atenuação dos níveis de TGF-β através da redução da proliferação celular de angiotensina II e mast.
Conclusão
síndrome Metabólica, compreendendo a obesidade, resistência à insulina, dislipidemia e hipertensão arterial está intimamente relacionado com o desenvolvimento de NASH, e ensaios de anti-diabético, anti-hyperlipidemic, e anti-hipertensivos agentes têm sido realizados para o tratamento de NASH. O conceito por trás destes agentes é atenuar os sintomas da síndrome metabólica (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Relatórios anteriores demonstraram que o inibidor da quimase atenua a inflamação e a fibrose sem influenciar os níveis de glucose e lípidos no sangue e a pressão arterial em modelos animais de diabetes, hiperlipidemia e hipertensão, respectivamente (Inoue et al., 2009; Takai et al., 2014; Zhang et al., 2016). Portanto, o conceito por trás da inibição da quimase é atenuar a inflamação hepática e fibrose de NASH diretamente. Propomos que o inibidor de quimase que visa a síndrome metabólica é uma estratégia potencialmente poderosa para a atenuação da progressão de NASH.
Autor Contributions
ST And DJ: wrote the manuscript. Ambos os autores leram e aprovaram o manuscrito final.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.