- Introdução
- materiais e métodos
- colheita de oócitos e microinjecção de cRNA
- Isolamento de Frações de Membrana e Immunoblotting
- Imunohistoquímica
- Freeze Fracture Electron Microscopy
- Caprate de Incubação
- a análise estatística
- resultados
- expressão de Claudin-5 e integração em X. laevis membrana plasmática de oócitos
- Incubação Com Caprate
- Discussion
- Claudinas contribuem para propriedades de adesão mais fortes
- Conclusion
- contribuições dos autores
- conflito de interesses
- Material Suplementar
Introdução
apertado proteína de junção da família é crucial para a célula fisiologia como a falta ou deficiência está associada com doenças e disfunção de vários órgãos e tecidos, como mostrado por exemplo, no ouvido interno (Wilcox et al., 2001; Florian et al., 2003), kidney (Konrad et al., 2006; Günzel et al., 2009), gastrointestinal tract (Resnick et al., 2005; Amasheh et al., 2009), epiderme (Furuse et al., 2002; Tebbe et al., 2002), and brain capillaries (Nitta et al., 2003; Wolburg et al., 2003). As claudinas representam uma família de proteínas transmembranares constituída por, pelo menos, 27 membros (Mineta et al., 2011). Além de seus quatro domínios de helix transmembranar, eles contêm dois loops extracelulares (ECL1 e ECL2), um curto N-terminus e um C-terminus (Suzuki et al., 2014). Específicos claudin padrões de expressão determinar e refletir a permeabilidade seletiva de epithelia, e a capacidade de claudin proteínas para interagir em cis (dentro de uma mesma membrana) e trans (entre as membranas da célula vizinha) permite a formação de barreira de formação e poros formando apertado junção de fios (Van Itallie e Anderson, 2006).
Claudin-5 é fortemente expresso em endotélia capilar e domina a junção apertada (TJ) da barreira hemato-encefálica (BBB), uma vez que a expressão é >100 vezes mais elevada em comparação com qualquer outro claudin (Ohtsuki et al., 2007). Além disso, é expresso em uma variedade de tecidos epiteliais, incluindo pulmões (Soini, 2011), tecidos exócrinos (Comper et al., 2009), intestinal (Garcia-Hernandez et al., 2017), and urinary tract (Koda et al., 2011). No entanto, claudin-5 causa uma barreira mais forte nos capilares cerebrais do que em outros tecidos (Reinhold e Rittner, 2017) e sua função é prejudicada em distúrbios neurodegenerativos e neuroinflamatórios (Greene et al., 2019). Por isso, claudin-5 é crucial para manter o BBB. Mas o BBB não é apenas protetor, ele também limita as opções terapêuticas, uma vez que os medicamentos são impedidos de permear esta barreira.
Nitta et al. (2003) reported, that the BBB is more permeable to molecules of 800 Da in size in claudin-5 deficit rates compared to wild type mice (Nitta et al., 2003). Isto foi de acordo com experimentos de transfecção demonstrando um efeito selante de claudin-5 em monocelulares Caco-2 (Amasheh et al., 2005).Outra importante forma de formação de barreira é claudin-3, que foi relatado seletivamente selar a barreira contra a passagem de íons de qualquer carga e solutos não carregados (Milatz et al., 2010). É também expressa na junção endotelial apertada dos capilares cerebrais e a sua perda funcional é observada em fases de inflamação do microvessel, glioblastoma e plexo coróide de doentes com esclerose múltipla (Engelhardt et al., 2001; Wolburg et al., 2003).
as propriedades da barreira podem ser modificadas dinamicamente, como por exemplo: demonstrou-se que a incubação com caprato de sódio diminui rápida e reversivelmente a resistência eléctrica transepitelial na linha celular intestinal humana HT-29/B6 (Krug et al., 2013). Caprato de sódio abre transitoriamente claudin-5 contendo barreiras em junções apertadas de células epiteliais e endoteliais (Del Vecchio et al., 2012).
isto indica que claudin-5 é um alvo promissor para o aumento da oferta de drogas no BBB.
In this study, we objected to employ the heterologous expression system of Xenopus laevis oocytes (Vitzthum et al., 2019) for the analysis of claudin-5 and claudin-3 interaction and pertubation. Devido à falta de contactos endógenos célula-célula, este sistema de expressão celular única permite a análise de claudinas específicas sem interferência de outras proteínas de junção apertada.
materiais e métodos
colheita de oócitos e microinjecção de cRNA
oócitos foram colhidos de fêmeas adultas da garra Africana por laparotomia cirúrgica. Para anastesia, 0.2% MS222 (3-aminobenzoato de etilo metanossulfonato, Sigma-Aldrich, Taufkirchen, Alemanha) foi utilizado como solução de banho durante 5-10 minutos a 20°C. Uma vez atingida a anastesia cirúrgica, foram feitas incisões musculares cutâneas e abdominais e a massa ovárica foi exteriorizada e removido o tecido ovárico. O isolamento dos oócitos foi realizada por digestão enzimática em temperatura ambiente por 90 min 1,5 mg/ml de colagenase Fisher BioReagents BP2649-1 (Fisher Scientific, Schwerte, Alemanha) dissolvido em oócitos de Ringer, solução (ORi), conforme descrito por Vitzthum et al. (2019). As células foliculares foram removidas por incubação em ORi livre de Ca2+contendo (em mM): NaCl (90), KCl (1), EGTA (ácido tetraacético de trietilenoglicol) (1), 5 HEPES (5); pH 7, 4 durante 10 minutos num agitador mecânico com 50 rpm. Os oócitos dos estágios V E VI (>1000 µm) foram injetados (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Estados Unidos) com 1 ng cRNA codificando a água livre de claudin-5, claudin-3 ou RNase como controles. O volume de injecção foi de 50, 6 nl por oocyte. Após a injecção, os oócitos foram incubados a 16°C em ORi 3 dias para a expressão proteica.
Isolamento de Frações de Membrana e Immunoblotting
Dez injetado oócitos foram agrupados por western blot e suspensão em 500 µl de tampão de homogeneização contendo (em mM), MgCl2 (5), NaH2PO4 (5), EDTA (ethylenediaminetetraacetic acid) (1), sacarose (80), e Tris (Tris(hydroxymethyl aminomethane)tamponada) (20); pH 7.4. Os extractos de oócitos foram centrifugados duas vezes a 200 rpm durante 10 minutos a 4°C para eliminar os detritos celulares. O sobrenadante foi centrifugado a 13 000 rpm durante 30 minutos a 4 ° C, a fim de sedimentar a membrana celular, tal como descrito por Leduc-Nadeau et al. (2007). Os péletes foram ressuspendidos em tampão de homogeneização de 80 µl. A quantificação das proteínas foi feita colorimetricamente utilizando o Kit de ensaio de proteínas Pierce 600 nm (Thermo Fisher Scientific, Hennigsdorf, Alemanha) de acordo com as instruções do fabricante numa placa de sondagem de 96 nm. O leitor de placas (PerkinElmer Enspire Multimode Plate Reader, Waltham, MA, Estados Unidos) foi ajustado para 562 nm e padrão de albumina sérica bovina (Thermo Fisher Scientific, Hennigsdorf, Alemanha) variando de 125 a 2000 µg/ml foi empregado para avaliação. Antes da imunoblotting, as amostras foram misturadas com tampão de 4× Laemmli (Bio-Rad Laboratories, Munique, Alemanha), carregadas num gel de poliacrilamida de 10% SDS e electroforesadas. Para a transferência de proteínas, as membranas PVDF foram utilizadas e bloqueadas em 5% de leite seco não gordo em solução salina tratada com Tris durante 120 minutos. As proteínas foram detectadas por immunoblotting primários de anticorpos produzidos contra claudin-3 ou claudin-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Estados Unidos).
anticorpos anti-coelho e anti-rato conjugados com peroxidase (#7074, # 7076 Cell Signaling Technology, Danvers, MA, Estados Unidos) foram usados para se ligar aos anticorpos primários e, portanto, incubados durante um mínimo de 45 minutos à temperatura ambiente. Para detecção, o substrato de Blotting ECL Western Clarity (#1705061, Bio-Rad Laboratories GmbH, Munique, Alemanha) foi usado e os sinais foram visualizados por um sistema de ChemiDoc MP (Bio-Rad Laboratories).
Imunohistoquímica
Injetado oócitos foram fixados em 4% PFA (16% paraformaldeído, E15700, de Serviços de Ciência, Munique, Alemanha) por 4 h em temperatura ambiente, seguido de desidratação gradiente de etanol a 70% de xileno (Carl Roth, Karlsruhe, Alemanha), no prazo de 48 h. As amostras foram incluídos em parafina e inter-seccionados (5 µm) utilizando uma Leica RM 2245 micrótomo (Leica Microsystems, Heidelberg, Alemanha). Pouco antes do tratamento imunohistoquímico, a parafina foi removida via xilol para o gradiente de etanol. Os locais de ligação não específicos foram bloqueados utilizando 5% de soro cabra em tampão fosfato salino e incubados com os mesmos anticorpos primários que para a imunoblotting. As amostras foram incubadas com os anticorpos secundários Alexa Fluor-488 anti-coelho de cabra e Alexa Fluor-594 anti-rato de cabra (Life Technologies, Carlsbad, CA, Estados Unidos) e examinadas por microscopia de imunofluorescência a laser confocal (LSM 710, Zeiss, Oberkochen, Alemanha).
Freeze Fracture Electron Microscopy
Freeze fracture electron microscopy was performed as recently reported (Greene et al., 2019). Para a fixação, os oócitos injectados foram incubados em glutaraldeído (2,5% em tampão de cacodilato de 0, 1 M) durante a noite a 4°C. após lavagem com tampão de cacodilato, os oócitos foram preparados para fraturação em congelamento. As amostras foram crioproteccionadas em 30% de glicerol e congeladas em nitrogênio líquido. Após fraturação, e sombreamento com platina e carbono (BAF400D; Balzers, Liechtenstein), O material orgânico restante foi removido por uma lavagem de hipoclorito de sódio. Os oócitos foram analisados em um microscópio eletrônico de transmissão (em-10, Zeiss, Oberkochen, Alemanha) e fotografados com uma câmera digital (Tröndle GmbH). A análise morfométrica das cadeias de junção apertada foi realizada com uma ampliação de 20.000×.Foi implementado o ensaio de pares de oócitos e quantificação das áreas de contacto
manitol para diminuir os oócitos injectados e permitir a remoção mecânica da membrana vitelina utilizando fórceps sem danificar a membrana plasmática. 5-10 oócitos foram colocados em uma placa de petri (35 mm de diâmetro, termo Fisher, Henningsdorf, Alemanha, #153066) cheia de ORi. O manitol foi adicionado e dissolvido até à diminuição hipertónica das células (aproximadamente 400 mOsmol/l durante 10 minutos). Após a devitelinização manual, os oócitos foram imediatamente transferidos para uma placa de 24 alvéolos (1. 86 cm2 superfície, TPP Techno Plastic Products, Trasadingen, Suíça, # 92024) contendo 2 ml de ORi. Em cada poço, duas células foram cuidadosamente agrupadas empurrando-as juntamente com uma pipeta Pasteur (1 ml, termo Fisher, Henningsdorf, Alemanha, #PP88SB) e uma sonda bulbosa.
Oócito pares de claudin-5-expressar (cldn5 − cldn5), claudin-3-expressar (cldn3 − cldn3), claudin-3 e claudin-5 coexpressing (cldn3,5 − cldn3,5) e controle de oócitos (controle − controle) foram mantidos juntos por até 48 h ORi a 16°C.
Brilhante microscopia de campo foi utilizado para a quantificação da área de contato do cluster de oócitos após 1, 24 e 48 h. Imagens do ingênuo oócito pares em 24 de bem placas de cultura foram realizadas a estes pontos, usando uma Leica DMI6000 B Microscópio Leica (Leica Microsystems, Wetzlar, Alemanha). O diâmetro da área de contacto foi medido utilizando a escala de micron (LAS-AF 3.2.0). As áreas de contato são consideradas circulares e assim a área de contato foi calculada usando a equação circular a=π π r2.As membranas Vitelinas foram removidas mecanicamente, tal como descrito anteriormente, e os oócitos agrupados por analagose ao doseamento emparelhado de oócitos. Adicionalmente, foram testados pares de oócitos mistos (controlo–cldn5 e controlo–cldn3) no ensaio de impulso de pressão hidrostática (HPI). Após 24 h de estabilização, um impulso hidrostático definido foi criado usando uma única pipeta eletrônica de canal (EE-300R, Eppendorf Research Pro, software version 2.06.00, Hamburgo, Alemanha).Foram mantidos os oócitos
em 24 placas de sondagem contendo ORi de 2 ml e verificou-se a posição central antes da aplicação do volume de pipetagem 250 µl ORi. Além disso, o ângulo (45°) e a distância de Aplicação (∼1,3 cm) foram uniformemente aplicados. A pressão ambiente, a viscosidade dos ORi e o diâmetro da abertura da ponta da pipeta foram mantidos em condições constantes. Foi utilizada microscopia de campo brilhante para quantificação das áreas de contacto 30 minutos após a pressão hidrostática ter sido aplicada e comparada com as áreas de contacto antes da aplicação. A configuração experimental é descrita na Figura 1.Figura 1
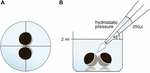
Figura 1. Configuração Experimental do ensaio de impulso de pressão hidrostática (a) vista esquemática de cima do poço: a posição central do par de oócitos foi verificada antes da aplicação da pressão hidrostática. B) vista lateral esquemática do poço: foram adicionados 250 µl ORi utilizando uma única pipeta electrónica de canal. A velocidade de distribuição foi uniformemente definida para a velocidade máxima. O ângulo (45°) e a distância de aplicação foram uniformemente aplicados. A pressão ambiente, a viscosidade dos ORi e o diâmetro da abertura da ponta da pipeta foram mantidos em condições constantes.
Caprate de Incubação
Para caprate de incubação, sódio caprate (#C4151, Sigma Aldrich, Taufkirchen, Alemanha) no final concentrações de 50, 100 e 500 µM, ou ORi como grupo de referência, que foi adicionado para os oócitos 24 h após o emparelhamento. Os oócitos foram mantidos em 24 placas com ORi de 2 ml e a solução de caprato foi dissolvida num volume de adição definido de 250 µl ORi por alvéolo. A largura da área de contacto foi quantificada em 30, 60 e 120 minutos após a adição.
a análise estatística
a análise estatística foi realizada com JMP Pro 14.0.0 (NC, Estados Unidos). Os dados são apresentados como medianos e apresentados como alteração percentual com base na combinação agrupada nos primeiros pontos de exame. As figuras 4, 5 são apresentadas como parcelas de caixa, representando o primeiro quartil (25%), a mediana (50%) e o segundo quartil (75%). Os bigodes são atraídos para o 10º percentil e até o 90º percentil. A distribuição Normal foi verificada utilizando o teste Shapiro-Wilk.O teste Kruskal-Wallis foi utilizado para comparação múltipla, seguido de uma correcção Dunn-Bonferroni. os valores p são dados como números continentais.
resultados
expressão de Claudin-5 e integração em X. laevis membrana plasmática de oócitos
para testar o sucesso da expressão e integração da proteína de junção apertada claudin-5 na membrana plasmática de oócitos, 3 dias após a injecção de cRNA de claudin-5, As fracções de membrana foram analisadas por imunoblotting. Todas as amostras de três animais (d1–d3) revelaram sinais específicos de claudin-5 a 23 kDa, enquanto que os oócitos injetados em água sem RNAse não mostraram sinais específicos para a expressão de claudin-5 (Figura 2A).Figura 2
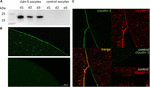
Figura 2. Detecção de claudinas heterologicamente expressas em Xenopus laevis oócitos. A) Imunoblot analysis of tight junction protein claudin-5 in X. laevis oócitos of three animals (d1–d3). Os lisatos das membranas celulares foram submetidos à SDS-PAGE seguida de imunoblot em membranas PVDF. As membranas foram incubadas com anticorpos primários e anticorpos secundários conjugados com peroxidase (n = 3). B) A coloração Imunofluorescente revelou sinais específicos de claudin-5 (verdes) nas membranas oocitárias de todos os oócitos injetados em cRNA, enquanto nos controlos injetados em água não foram detectados sinais específicos de claudin em microscopia confocal. Imagens representativas de oócitos derivados de três animais. Barras de escala: 50 µm. C) a coloração Imunofluorescente dos oócitos de claudin-5 e de claudin-3 que expressam os oócitos revelou sinais específicos de claudin-3 (verde) e de claudin-5 (vermelho) nas membranas oócitas dos oócitos injetados em cRNA, enquanto nos controlos injetados em água não foram detectados sinais específicos de claudin. A colocalização das proteínas claudinas expressas na membrana plasmática dos oócitos é revelada por coloração dupla imunofluorescente (amarela). Barra de escala: 10 µm.
para visualização das proteínas expressas na membrana plasmática, foram realizadas e analisadas manchas imunohistoquímicas por microscopia de varrimento a laser confocal (figura 2B). Sinais específicos foram detectados e distribuídos uniformemente pela membrana plasmática dos oócitos que expressam o claudin-5. De acordo com os imunoblots, não foram detectados sinais específicos nas membranas plasmáticas de controlo dos oócitos.Assim, após a injecção de cRNA, claudin-5 foi expressa e integrada com sucesso na membrana plasmática dos oócitos X. laevis.
Co-expressão de claudin-3 e claudin-5 no oócito pares revelou sinais específicos para claudin-5 (vermelho) e claudin-3 (verde) em ambas as células (Figura 2C). As membranas plasmáticas dos oócitos mostraram uma fusão das células vizinhas através da interacção directa cldn3,5–cldn3,5 (amarela).Foram analisadas manchas de cadeias de junção apertada nos oócitos de Claudin-5 Que expressam
as membranas plasmáticas dos oócitos e a visualização de cadeias de junção apertada foi bem sucedida (Figura 3). A microscopia eletrônica de fratura congelante mostrou manchas de morfologia da cadeia nas membranas plasmáticas dos oócitos injetados de claudin-5, e a organização da cadeia dos oócitos expressando claudin-5 foi altamente organizada e de forma angular (figura 3A). Cadeias de junção estreitas foram detectadas principalmente na face protoplasmática (P -) da membrana. Os oócitos injectados de Claudin-3 mostraram filamentos de junção apertados, arredondados e altamente organizados, tal como referido anteriormente (Vitzthum et al., 2019; figura 3B). Fractura por congelação microscopia electrónica de claudin-3 e de claudin-5, os oócitos Co-expressantes revelaram fibrilhas que ambos têm propriedades de claudin-3 e claudin-5. A arquitetura da cadeia Fibril de oócitos coexpressores aparecia arredondada e complexa como os oócitos de claudin-3 expressando, mas também descontínua e mais inclinada como mostrado para as células expressantes de claudin-5 (Figura 3C). Os oócitos de controlo tinham uma superfície lisa típica (figura 3D).Figura 3
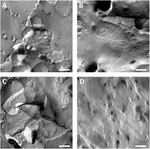
Figura 3. Microscopia electrónica de fractura por congelação. A) a microscopia electrónica por fratura Congelante revela uma proteína de junção apertada cldn-5 como uma malha de fibrilas descontínuas angulares em filas em oócitos de Xenopus laevis. B) a microscopia electrónica de fractura por congelação revela uma proteína de junção apertada cldn-3 como uma malha de fibrilhas arredondadas em X. laevis oócitos. C) a microscopia electrónica de fratura de congelação de claudin-3 e os oócitos de co-expressão de claudin-5 revelam fibrilhas que ambos têm propriedades de claudin-3 e claudin-5. D) os oócitos de controlo injectados com água têm uma superfície lisa. Imagens representativas de oócitos derivados de três animais. Barra de escala: 250 nm.
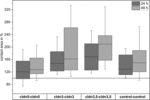
Figura 4. Áreas de contacto medianas de combinações de oócitos agrupados cldn5-cldn5, cldn3–cldn3,cldn3,5–cldn3, 5 e control–control 24 e 48 h após agrupamento em % das áreas de contacto inicial pouco depois de agrupamento (n = 8-38).

Figura 5. Áreas de contato de claudin-5, claudin-3, e coexpressing claudin-3 e claudin-5 ovócitos pressão hidrostática impulso (IPH), desafio após o período de estabilização e 30 min após o IPH (n = 16-70, *p < 0.05, **p < 0.01, Kruskal-Wallis seguido de uma correcção Dunn–Bonferroni).Todas as combinações agrupadas mostraram um aumento dependente do tempo na área de contacto durante o período de tempo medido (Figura 4 e Quadro 1).
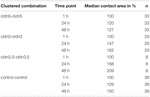
Quadro 1. Áreas de contacto dos oócitos dentro de 48 horas após agrupamento.A área de contacto dos oócitos de controlo injectados com água aumentou para 129% após 24 h E 150% após 48 h. Pares agrupados de oócitos expressando claudin-3 também mostraram um aumento das áreas de contato para 147% (24 h) e 162% (48 h). Pares agrupados de oócitos Co-expressando claudin-3 e claudin-5 mostraram áreas de contato de 168% (24 h) e 209% (48 h). Pares agrupados de oócitos que exprimem apenas o claudin-5 mostraram áreas de contacto de 120% (24 h) e 127% (48 h). Por conseguinte, as áreas de contacto em todas as combinações testadas eram comparáveis.O doseamento de impulsos à pressão hidrostática revela a junção específica de Claudin de pares de oócitos
numa abordagem separada, os oócitos que expressam claudin-3 ou claudin-5 ou co-expressando ambas as claudinas foram agrupados após a devitelinização mecânica. Os oócitos foram desafiados empregando um HPI e as áreas de contato foram medidas e calculadas 30 minutos após o desafio e comparadas com as áreas iniciais após o período de estabilização de 24 h (Figura 5 e Tabela 2). Após provocação da pressão hidrostática, a área de contacto dos oócitos de controlo injectados com água diminuiu para 89%. Cluster pares de oócitos expressar claudin-5, claudin-3 ou coexpressing claudin-3 e claudin-5 mantida maiores áreas de contato (97%, p = 0.0235; 96%, p = 0,003; 98%, p = 0.0253). As áreas de contacto dos oócitos de controlo misturados com água e dos oócitos de expressão de Claudina (controlo-cldn5 e controlo-cldn3) não diferiam significativamente dos oócitos de controlo (93%, p = 0, 2900; 83%, p = 0, 4455).
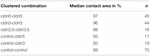
Quadro 2. Ensaio de impulso de pressão hidrostática.
Incubação Com Caprate
Em um piloto de incubação experimento, os oócitos foram injetados e emparelhados em combinações quer expressar claudin-5 (cldn5–cldn5) ou injetados com água livre de RNAse como controles (control–controle). Os pares foram incubados com concentrações finais de caprato de sódio de 50, 100 ou 500 µM. A incubação de pares de oócitos com ORi serviu como um grupo de referência. Os oócitos foram agrupados e, após 24 h de estabilização, a incubação começou e as larguras de contacto foram medidas 30, 60 e 120 minutos após a adição (figura suplementar S1).
a adição de ORi resultou numa diminuição inicial das áreas de contacto, tanto nos pares de oócitos que expressam os claudinos como nos pares de oócitos que injectam água, que se dispersam 60 ou 120 minutos após a adição. Isto é delineado pela forma parabólica da linha de ligação entre as áreas de contacto médias ao longo do tempo (curvas vermelhas na figura suplementar S1). No entanto, a incubação com caprato de sódio de 100 e 500 µM aumentou as áreas de contacto ligeiramente (100 µM) ou fortemente (500 µM) 30 minutos após a adição de caprato de 5.1 × 105 a 5.2 × 105 µm2 e 4.3 × 105 a 4.9 × 105 µm2.
Discussion
In the present study, we employed the classic model for transporters and human disease modeling (Tammaro et al., 2009; Nenni et al., 2019), The X. laevis oócitos, for an in-depth analysis of claudin-5 interaction and functional contribution to the junction seal. Para este fim, uma nova abordagem, introduzindo um HPI para interação desafiadora dentro da área de contato dos oócitos de Xenopus agrupados, foi estabelecida.
Claudinas contribuem para propriedades de adesão mais fortes
de acordo com resultados anteriores de Vitzthum et al. (2019), as claudinas únicas expressas em oócitos não levaram a um aumento das áreas de contato de interação em comparação com os oócitos de controle. No entanto, a visualização imunoblot e imuno-histoquímica provou a expressão e integração bem-sucedidas na membrana plasmática de plasma X. laevis oocyte. Além disso, o uso de microscopia de varredura a laser confocal permitiu uma localização precisa das claudinas expressas na membrana plasmática como o pinhole bloqueou a fluorescência fora de foco. Não foi efectuada uma quantificação dos sinais imunohistoquímicos, uma vez que a afinidade dos anticorpos para ligar os seus alvos difere.
Vedula et al. (2009) used a micropipette aspiration technique to investigate aspects of claudin-claudin interaction using L-fibroblasts transfected with GFP-tag ocludin, cldn-1, and cldn-2. A força de separação necessária para separar duas células umas das outras era maior nas células transfectadas cldn-1 e cldn-2 (nN 2.8 e 2.3 nN, respectivamente). Embora esta abordagem possa parecer também promissora para a análise de interação de claudin-claudin de expressar oócitos, testes preliminares revelaram que um desapego de oócitos agrupados não é possível sem interrupção das membranas plasmáticas de oócitos.
Portanto, como uma nova abordagem, a força das conexões foi medida por um HPI. Embora o HPI não forneça uma quantificação da força de separação em valores absolutos (por exemplo, em newton), ele permite uma análise rápida e econômica da interação de claudin sem perturbação de outras proteínas de junção apertadas (por exemplo, em newton)., ocludin, tricellulin, JAM-A). Claudinas contribuem para a junção de pares de oócitos, pois mostram uma maior área de contato em comparação com os oócitos injetados em água após HPI. Isto indica uma forte interacção homofílica entre as células que expressam o claudin.
a arquitectura fibril é específica para claudinas (Colegio et al., 2002). Em microscopia eletrônica de fratura congelada, claudin-3 foi relatado para montar uma malha de cadeia mais arredondada em formas de laço em Xenopus oócitos (Vitzthum et al., 2019; Figura 3B) enquanto em nosso estudo, claudin-5 formou uma malha mais angular e ordenada em linhas. As imagens revelaram que a proteína de junção apertada claudin-5 forma uma malha de fibrilhas em linhas descontínuas em forma angular em X. laevis oócitos. Isto está de acordo com os cordões claudin-5 conhecidos por ocorrer como cadeias de partículas associadas à fase-P (Piontek et al., 2011). Em nossos experimentos, a forma geométrica das fibrilhas parecia não ter nenhum efeito sobre as propriedades de adesão dos oócitos. De acordo com isso, a resistência paracelular foi relatada não estar relacionada com o número de fibril e as propriedades formadoras de fibril (Colegio et al., 2002). Além disso, claudin-3 e claudin-5 têm uma capacidade semelhante para a trans-interação homofílica em células HEK293 (Piontek et al., 2011).
este modelo de X. os oócitos de laevis, expressando proteínas unitárias de junção apertadas, permite observar o efeito de substâncias como o caprato de sódio na formação de áreas de contacto entre os oócitos agrupados. Pode, por conseguinte, constituir uma ferramenta útil para um rastreio atempado e económico das substâncias que afectam a barreira de junção apertada.
concentrações de caprato de sódio de 100 e 500 µM podem transmitir um efeito protector nos oócitos que expressam o claudin-5, resultando no aumento das áreas de contacto após 30 minutos de incubação.
Krug et al. (2013) demonstrou que a incubação com caprato de sódio levou a uma diminuição rápida e reversível da resistência transepitelial na linha celular intestinal humana HT-29/B6. Além disso, a microscopia de varrimento a laser confocal revelou uma redução acentuada de claudin-5 nas células HT-29/B6 tratadas com laurato de ácido gordo de cadeia média (Dittmann et al., 2014). O primeiro ciclo extracelular de claudinas (ECL1) é importante para as propriedades de barreira da junção apertada, enquanto o segundo ciclo extracelular (ECL2) está envolvido na formação de cadeia de trans-interação (Piontek et al., 2008; Rossa et al., 2014; Greene et al., 2019). Os aglutinantes Claudin-5 que visam o ECL1 ou o ECL2 do claudin-5 podem induzir a absorção intracelular da proteína de junção apertada, impedindo assim as trans-interacções claudin-5 no selo de junção apertada entre as células adjacentes e soltando o espaço paracelular (Hashimoto et al., 2017).Assim, hipotetizamos que a incubação com caprato de sódio levaria a uma diminuição na área de contato de cluster claudin-5 expressando X. laevis oócitos. Inesperadamente, o aumento das concentrações de caprato de sódio (100 e 500 µM) levou ao aumento das áreas de contacto dos oócitos agrupados expressando claudin-5 indicando um efeito protector de caprato de sódio no selo de junção apertado. Além disso, o caprato de sódio é descrito para induzir a contração do anel perijuncional da actomiosina, alargando o espaço paracelular (Lindmark et al., 1998; Maher et al., 2009). Este efeito baseia-se na fosforilação da cadeia luminosa regulamentar da miosina através de uma activação da fosfolipase C, que leva a uma clivagem de 4,5-bifosfato de fosfatidilinositol (PIP2) em trifosfato de inositol (IP3) e diacilglicerol (Tomita et al., 1995). O complexo de junção apertado ligado pela proteína de andaimes ZO-1 ao citoesqueleto de actina é então redistribuído da junção apertada para o citoplasma (Lindmark et al., 1998; Turner, 2000). A citoarquitetura do X. laevis oocyte é crucial para a regionalização citoplasmática durante a oogênese (Wylie et al., 1985). Embora, antes da fertilização, a expressão do gene tjp-1, a codificação do gene para ZO-1 é expressa apenas 1,9 TPM nos estágios V–VI dos oócitos (Session et al., 2016). Uma interação reduzida das claudinas com o andaime do citoesqueleto pode, portanto, explicar o resultado inesperado da incubação de caprato. É o escopo de estudos futuros para verificar a base mecanicista da descoberta.
no entanto, um efeito variante do caprato de sódio na permeabilidade paracelular foi descrito na literatura anterior. No tecido adesivo de Peyer retirado do intestino de suínos adultos, foi detectado um efeito de reforço semelhante. O Claudin-5 foi significativamente aumentado após incubação com caprato de 5 mM. Neste estudo, a caprato conduziu a uma resistência eléctrica transepitelial significativamente mais elevada (TEER) no epitélio associado ao folículo (Radloff et al., 2019).
Conclusion
In conclusion, heterologous expression of the tight junction protein claudin-5 in X. laevis oócitos permite novas percepções sobre a contribuição de claudinas únicas para a interação célula-célula e propriedades de adesão de células adjacentes. Assim, o uso do modelo X. laevis tight junction para claudin-5 permite a análise de componentes BBB em um modelo de célula única.Os conjuntos de dados gerados para este estudo estão disponíveis A pedido do autor correspondente.Os tratamentos com animais estavam em conformidade com as directrizes da legislação alemã, com a aprovação do responsável pelo bem-estar dos animais da Freie Universität Berlin e sob a administração da inspecção veterinária de saúde de Berlim (Landesamt für Gesundheit und Soziales Berlin, autorização G0025/16).
contribuições dos autores
todos os autores leram e aprovaram o manuscrito. NB and SA designed, planned, and supervised the experiments and wrote the manuscript. NB, LS, VC, RK e PF-B realizaram as experiências e a análise de dados.Este estudo foi financiado pela Deutsche Forschungsgemeinschaft, Grant No. Am141 / e a H. Wilhelm Schaumann Stiftung.
conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.Agradecemos a Martin Grunau, Gisela Manz, Katharina Söllig e Susanne Trappe pela excelente assistência técnica. Reconhecemos o apoio da iniciativa de publicação de Acesso Aberto da Freie Universität Berlin.
Material Suplementar
O Material Suplementar para este artigo podem ser encontradas online em: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
FIGURA S1 | áreas de Contato de claudin-5 expressar oócito pares em µm2 durante a incubação com o sódio caprate em diferentes concentrações (n = 6-8, respectivamente) e de injecção de água oócitos como controles (n = 5-7, respectivamente).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., e Kroesen, A. J. (2009). Mucosa inflamada possui entroncamentos apertados alterados indicando recorrência da doença inflamatória intestinal. T. J. Colorect. S. 24, 1149–1156. doi: 10.1007/s00384-009-0737-8
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Contribuição de claudin-5 para propriedades de barreira em junções apertadas de células epiteliais. Cell Tissue Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed Abstract | CrossRef texto completo | Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C., and Anderson, J. M. (2002). The role of claudin extracelular domains in tight junction fibril architecture and paracelular charge selectivity. Mol Biol Cell. 13:286.
Google acadêmico
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). O padrão de expressão de claudinas 5 e 7 distingue o pseudopapilar sólido do pancreatoblastoma, células acinares e tumores endócrinos do pâncreas. Manha. J. Surg. Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). Caprato de sódio abre transitoriamente barreiras contendo claudin-5 em junções apertadas de células epiteliais e endoteliais. Mol. Farmacêutico. 9, 2523–2533. doi: 10.1021 / mp30014
PubMed Abstract | CrossRef Full Text | Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., and Amasheh, S. (2014). A laurato permeia a via paracelular para moléculas pequenas no modelo de células epiteliais intestinais HT-29/B6 através da abertura das junções apertadas pela relocalização reversível de claudin-5. Farmacêutico. Res. Dordr. 31, 2539–2548. doi: 10.1007/s11095-014-1350-2
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Engelhardt, B., Wolburg-Buchholz, K., e Wolburg, H. (2001). Envolvimento do plexo coróide na inflamação do sistema nervoso central. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::auxílio-jemt13>3.0.co;2-5
CrossRef Texto Completo | Google acadêmico
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, R., et al. (2003). Claudins in the tight junctions of stria vascularis marginal cells. Bioquímica. Biophys. Res. Co. 304, 5–10. doi: 10.1016/s0006-291x(03)00498-4
CrossRef Texto Completo | Google acadêmico
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). As junções apertadas baseadas em Claudin são cruciais para a barreira epidérmica dos mamíferos: uma lição de ratos deficientes em claudin-1. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Abstract | CrossRef Full Text | Google Scholar
Garcia-Hernandez, V., Quiros, M., and Nusrat, A. (2017). Claudinas epiteliais intestinais: expressão e regulação na homeostase e inflamação. Anao. N. Y. Acad. Ciência. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed Abstract / CrossRef Full Text | Google Scholar
Greene, C., Hanley, N., and Campbell, M. (2019). Claudin-5: guardião da função neurológica. Fluidos Barr. CNS 16: 4321.
Google acadêmico
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudin-16 afeta a secreção Cl transcelular nas células MDCK. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
PubMed Abstract / CrossRef Full Text | Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Os ligantes Claudin-5 aumentam a permeação de solutos através da barreira hemato-encefálica num modelo mamífero. J. Pharmacol. Expo. Ther. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed Abstract | CrossRef Full Text | Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Nova expressão de claudin-5 em podócitos glomerulares. Cell Tissue 343, 637-648. doi: 10.1007/s00441-010-1117-y
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Konrad, M., Schaller, A., Seelow, D., Pandey, R. V., Waldegger, S., Lesslauer, A., et al. (2006). Mutações no gene de junção apertada claudin 19 (CLDN19) estão associadas ao desperdício de magnésio renal, falência renal e envolvimento ocular grave. Manha. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., and Amasheh, S. (2013). Caprato de sódio como potenciador da permeação macromolécula através de junções tricelulares apertadas das células intestinais. Biomateriais 34, 275-282. doi: 10.1016 / j. biomateriais.2012.09.051
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., e Bichet, D. G. (2007). Elaboration of a novel technique for purification of plasma membranes from Xenopus laevis oocytes. Manha. J. Physiol. Celula. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y., and Artursson, P. (1998). Aumento da absorção através da regulação intracelular da permeabilidade da junção apertada por ácidos gordos de cadeia média nas células Caco-2. J. Pharmacol. Expo. Ther. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., and Brayden, D. J. (2009). Segurança e eficácia do caprato de sódio na promoção da absorção oral do fármaco: desde In vitro até à clínica. Adv. Entrega De Drogas. Rev. 61, 1427-1449. doi: 10.1016 / j. addr.2009.09.006
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin-3 atua como um componente de vedação da junção apertada por íons de carga e solutos não carregados. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j. bbamem.2010.07.014
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Expansão prevista da família claudin multigene. FEBS Lett. 585, 606–612. doi: 10.1016 / j. febslet.2011.01.028
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: facilitar a utilização do Xenopus para modelar doenças humanas. Frente. Physiol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Abstract | CrossRef Full Text | Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Afrouxamento selectivo da barreira hemato-encefálica em ratos deficientes em claudin-5. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., asashima, T., and Terasaki, T. (2007). A expressão exógena do claudin-5 induz propriedades de barreira em células endoteliais capilares do cérebro de rato cultivadas. J. Cell Physiol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Abstract / CrossRef Full Text | Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Elucidating the principles of the molecular organization of heteropolymeric tight junction strands. Mol De Telemóvel. Life Sci. 68, 3903–3918. doi: 10.1007/s00018-011-0680-z
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Piontek, J. Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Formation of tight junction: determinants of homophilic interaction between classic claudins. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Abstract | CrossRef Full Text | Google Scholar
Radloff, J., Cornelius, V., Markov, A. G., and Amasheh, S. (2019). O caprato modula a função da barreira intestinal no epitélio associado ao folículo de Peyer suína. T. J. Mol. Ciência. 20:1418. doi: 10.3390/ijms20061418
PubMed Abstract | CrossRef Full Text | Google Scholar
Reinhold, A. K., and Rittner, H. L. (2017). Função de barreira no sistema nervoso periférico e central-uma revisão. Pflug. Arco. Euro. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). A dobragem e a montagem das proteínas Claudin-3 e Claudin-5 na junção apertada são controladas por resíduos não conservados nos segmentos transmembranar 3 (TM3) e ciclo extracelular 2 (ECL2). J. Biol. Chem. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Abstract | CrossRef Full Text | Google Scholar
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genoma evolution in the allotetraploid frog Xenopus laevis. Nature 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins em doenças pulmonares. Poupanca. Res. 12:70.
Google acadêmico
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). A estrutura cristalina de um claudin fornece uma visão da arquitetura de entroncamentos apertados. Science 344, 304-307. doi: 10.1126 / science.1248571
PubMed Abstract / CrossRef Full Text | Google Scholar
Tammaro, P., Shimomura, K., and Proks, P. (2009). “Xenopus oócitos as a heterologous expression system for studying ion channels with the patch-clamp technique,” in Potassium Channels: Methods and Protocols, ed. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google acadêmico
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Tight junction proteins: a novel class of integral membrane proteins-expression in human epidermis and in HaCaT keratinócitos. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomita, M., Hayashi, M., and Awazu, S. (1995). Mecanismo de aumento da absorção de caprato de sódio e decanoilcarnitina nas células Caco-2. J. Pharmacol. Expo. Ther. 272, 739–743.
Google Scholar
Turner, J. R. (2000). “Colocar o espremedor” na junção apertada, entendendo a regulação do citoesqueleto. Semen. Cell Dev. Biol. 11, 301–308. doi: 10.1006/scdb.2000.0180
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Itallie, C. M., and Anderson, J. M. (2006). Claudins e transporte paracelular epitelial. Annu. Rev. Physiol. 68, 403–429. doi: 10.1146 / annurev.physiol.68.040104.131404
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Forças de quantificação mediadas por proteínas de junção estanques integrais na aderência célula-célula. Exper. Mecanico. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutações no gene que codificam a junção apertada claudin-14 causam surdez recessiva autossómica DFNB29. Cela 104, 165-172. doi: 10.1016/s0092-8674(01)00200-8
CrossRef Texto Completo | Google acadêmico
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). A localização do claudin-3 nas junções estreitas da barreira hemato-encefálica é selectivamente perdida durante a encefalomielite auto-imune experimental e o Glioblastoma humano multiforme. Acta Neuropathol. 105, 586–592. doi: 10.1007/s00401-003-0688-z
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J., e Heasman, J. (1985). O citoesqueleto de oócitos Xenopus e seu papel no desenvolvimento. J. Embryol. Expo. Transformacao. 89, 1–15.
Google Scholar