com a ferida de tecido saudável, desenrola-se uma progressão previsível dos acontecimentos fisiológicos. Esta progressão pode ser dividida nas fases de inflamação, proliferação e maturação. Cada fase é caracterizada pela elaboração sequencial de citocinas distintivas por células específicas. Veja as imagens abaixo.
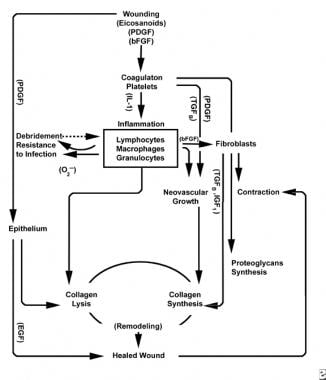 esquemas do processo de cicatrização da ferida.
esquemas do processo de cicatrização da ferida. 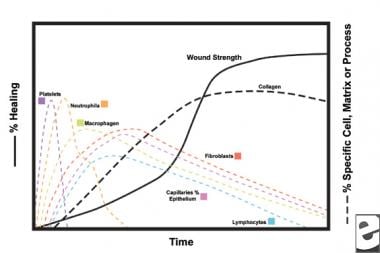 características celulares do processo de cicatrização da ferida.
características celulares do processo de cicatrização da ferida. A fase inflamatória
A fase inflamatória, simultaneamente, lança hemostático mecanismos e caminhos que criar clinicamente reconhecível sinais cardinais da inflamação: rubor (vermelhidão), calor (calor), tumor (edema), dolor (dor), e, fu laesa (perda de função).
a lesão no tecido vascular inicia a cascata de coagulação extrínseca libertando o factor cálcio e tecidular intracelular que activa o factor VII. o tampão fibrina resultante atinge a hemostase auxiliada pela vasoconstrição reflexa. Este plug atua como uma rede para a agregação de plaquetas, o tipo de célula mais comum e “assinatura” da fase inflamatória inicial.
as plaquetas elaboram uma série de substâncias pró-inflamatórias, tais como difosfato de adenosina, factor de crescimento dos tecidos beta (TGF-ß) e factores de crescimento derivados das plaquetas (PDGF). Estes factores de crescimento actuam nas células circundantes e estimulam a quimiotaxia dos neutrófilos, monócitos e fibroblastos na área de lesão.
tecidos feridos, através da fosfolipase a activada, catalisam simultaneamente ácidos araquidónicos para produzir prostaglandinas vasoativas e tromboxano, colectivamente conhecidos como eicosanóides. Os eicosanóides mediam a actividade que influencia a formação de plug plaquetários, a permeabilidade vascular e a quimiotaxia celular para influenciar a cicatrização das feridas. Por exemplo, o tromboxano A2 media a vasoconstrição e a agregação plaquetária.
após a vasoconstrição inicial, os sinais clássicos de inflamação manifestam-se devido ao aumento da permeabilidade vascular. Rubor resulta de vasodilatação, mediada pela prostaciclina (PGI2), prostaglandina A (PGA), prostaglandina D (PGD) e prostaglandina E (PGE). Tumor e calores desenvolvem – se à medida que as aberturas endoteliais vasculares aumentam, permitindo a saída de proteínas plasmáticas e fluidos para o espaço intersticial. Estas alterações são potenciadas pela PGE2 e pela prostaglandina F2a (PGF2a) e permitem a penetração de células inflamatórias na área de lesão, incluindo células que elaboram. Dolor é sentido como PGI2, PGE, e PGE2 agem em nociceptores periféricos.
na segunda fase da fase inflamatória, os leucócitos suplantam as plaquetas como o tipo celular dominante, atraídos pela quimiotaxia. Os glóbulos brancos (WBCs) são as células predominantes nos primeiros 3 dias após a lesão; o seu número atinge o pico em aproximadamente 48 horas. Os polimorfonucleócitos (PMNs) são os primeiros a iniciar actividades bactericidas utilizando mediadores inflamatórios e metabolitos radicais livres de oxigénio. No entanto, a cicatrização normal da ferida pode ocorrer sem SNM. Outro leucócito, a célula T auxiliar, elabora a interleucina-2 (IL–2). O IL-2 promove a proliferação de células T para aumentar a resposta imunogénica a lesões.
à medida que os leucócitos PMN começam a diminuir após 24-36 horas, os monócitos em circulação entram na ferida e amadurecem em macrófagos tecidulares. Estas células debridem a ferida no nível microscópico e produzem uma grande variedade de substâncias importantes, tais como IL-1 e fator básico de crescimento de fibroblastos (bFGF). O IL-1 estimula a proliferação de células inflamatórias e promove a angiogénese através da replicação das células endoteliais. bFGF é um fator quimiotático e mitogênico para fibroblastos e células endoteliais. Ao contrário das PMNs, a depleção de macrófagos prejudica gravemente a cicatrização de feridas, à medida que o desbridamento, a proliferação de fibroblastos e a angiogênese diminuem.
no final do ciclo inflamatório, o meio em evolução dos eicosanóides na ferida interagem com os tipos celulares presentes, resultando na síntese de fibroblastos de colagénio e substância moída (do aumento da razão de PGF2a para PGE2). Além disso, os fatores de crescimento derivados de macrófagos estão agora em níveis ótimos, influenciando fortemente o influxo de fibroblastos e, em seguida, queratinócitos e células endoteliais para a ferida. Como as células mononucleares continuam a substituir WBCs e macrófagos, a fase proliferativa começa.
A fase proliferativa
Dois a três dias após o ferimento, fibroblastos migram para dentro das margens da ferida sobre o fibrinosos matriz estabelecida durante a fase inflamatória. Durante a primeira semana, os fibroblastos começam a produzir glicosaminoglicanos e proteoglicanos, a substância moída para o tecido de granulação, bem como colagénio, em resposta a bFGF e TGF-ß sintetizados pelos macrófagos, bem como PDGF.
os fibroblastos logo se tornam o tipo de célula dominante, atingindo um máximo de 1-2 semanas. Geram não só moléculas de colagénio, mas também citocinas como PDGF , TGF-ß, bFGF, factor de crescimento queratinocitário e Factor de crescimento insulino-1. Os fibroblastos também montam moléculas de colagénio em fibras, que são interligadas e organizadas em feixes. O colagénio é o principal componente do tecido conjuntivo agudo da ferida, continuando a produção líquida nas próximas 6 semanas. O teor crescente de colagénio da ferida correlaciona-se com o aumento da resistência à tracção.
os queratinócitos e as células endoteliais também proliferam durante este tempo, eventualmente produzindo factores de crescimento autocrínicos que mantêm o seu crescimento. A expansão endotelial contribui para a angiogênese, já que os vasos intactos geram rebentos no tecido de granulação. A Neovascularização facilita o crescimento da linha avançada de fibroblastos na ferida, fornecendo-lhes nutrientes e citocinas necessários.
a degradação do coágulo de fibrina e da matriz provisória é acompanhada pela deposição de tecido de granulação (substância moída, colagénio, capilares), que continua até que a ferida seja coberta. Diminuição dos níveis de ácido hialurónico (na substância moída) e aumento dos níveis de sulfato de condroitina lentidão na migração e proliferação dos fibroblastos, induzindo a diferenciação dos fibroblastos, transitando para a fase de maturação da cicatrização da ferida.
a fase de maturação
durante as primeiras 6 semanas, a nova produção de colagénio domina o processo de cicatrização da ferida, depositada aleatoriamente no tecido de granulação aguda da ferida. À medida que a ferida amadurece, o colagénio é remodelado numa estrutura mais organizada, com maior resistência à tracção. Gradualmente, o colagénio tipo I substitui o tipo III até se atingir a razão normal da pele de 4:1. À medida que a remodelação continua, a colagenólise da metaloproteinase da matriz atinge um estado estacionário com a síntese do colagénio. Planaltos de resistência à tracção a 80% da resistência original, aproximadamente 1 ano após o júri.
Superficial a esta atividade, as células epiteliais continuam a migrar para dentro da borda da ferida até que o defeito seja coberto. Neste ponto, a inibição de contato induz a transformação de fibroblastos em miofibroblastos, que contêm fibras de actina contractil. Segue-se a contracção da ferida, substituindo o volume de tecido ferido por tecido novo, embora o papel exacto do miofibroblast não tenha sido completamente elucidado.
dissuadir a cicatrização de feridas
feridas agudas geralmente procede através de um processo reparativo ordenado e oportuno que resulta em uma restauração duradoura da integridade anatômica e funcional. No entanto, vários fatores fisiológicos e mecânicos podem prejudicar a resposta curativa, resultando em uma ferida crônica que não consegue prosseguir através da progressão gradual usual. Infecção Local, hipoxia, trauma, corpos estranhos, ou problemas sistêmicos como diabetes mellitus, desnutrição, imunodeficiência, ou medicamentos são os mais frequentemente responsáveis.
todas as feridas estão contaminadas, mas a maioria resistiu com sucesso à infecção invasiva. Quando a concentração excede 100.000 (105) organismos por grama de tecido ou o sistema imunológico fica comprometido, a infecção frequentemente se segue. A celulite prolonga a fase inflamatória, mantendo níveis elevados de citocinas pró-inflamatórias e proteases tecidulares, que degradam os fatores de granulação e crescimento tecidular, e atrasando a deposição de colagénio.
debridamento (cirúrgico, enzimático e/ou por mudança de curativo) e antibióticos são os principais esteios do tratamento com antibióticos. O desbridamento remove o tecido devitalizado, que pode ser uma fonte de endotoxinas que inibem a migração de fibroblastos e queratinócitos para a ferida. Corpos estranhos também podem requerer remoção, uma vez que a presença de uma sutura de seda reduz o número de bactérias necessárias para incitar a infecção 10 000 vezes. (Para uma descrição pormenorizada da técnica, ver o artigo de referência Medscape “ferida de remoção de corpo estranho”.)
a hipoxia celular retarda a cicatrização através de vários meios. O crosslinking do colagénio fibril requer oxigénio para hidroxilar a prolina e a lisina e falha quando a pressão dos tecidos é inferior a 40 mm Hg. A potência bactericida da fosforilação oxidativa leucocitária também sofre em ambiente hipóxico, reduzindo o limiar de infecção. As medidas para melhorar o fornecimento de oxigênio dependem da etiologia. O uso de tabaco, que causa vasoconstrição e aumenta a adesão plaquetária, deve ser interrompido. Angioplastia ou enxerto de bypass arterial podem ser necessários para a doença vascular periférica. Podem ser indicadas medidas adjuvantes para melhorar a perfusão sistémica em casos de insuficiência cardíaca. O valor hematócrito inferior a 15% deve ser tratado e euvolemia restaurada, conforme necessário. A estase venosa ou insuficiência linfática pode ser melhorada com vestuário compressor.
a doença sistémica pode prolongar ou interromper dramaticamente a cicatrização da ferida. A glicosilação na diabetes mellitus prejudica os neutrófilos e a fagocitose macrófaga das bactérias, prolongando a fase inflamatória. A fase proliferativa é também prolongada na mesma doença em que os eritrócitos se tornam menos maleáveis e menos capazes de fornecer oxigénio à ferida para o metabolismo dos tecidos e a síntese do colagénio.
a desnutrição resulta em diminuição da proliferação de fibroblastos, diminuição da neovascularização e diminuição da imunidade celular e humoral. As feridas exercem elevadas exigências metabólicas, particularmente no tecido de granulação. Aminoácidos como a metionina, a prolina, a glicina e a lisina são essenciais para a função celular normal e para a reparação de feridas cutâneas. Os ácidos gordos são constituintes críticos das membranas celulares e são o substrato para os eicosanóides que mediam o processo inflamatório. Os ácidos gordos essenciais linolénicos e o ácido linoleico devem ser fornecidos na dieta, uma vez que o corpo humano é incapaz de síntese de novo destas moléculas.
devem estar disponíveis vitaminas e minerais adequados para o metabolismo celular, actuando como sinais celulares e cofactores. A vitamina C (ácido ascórbico) e o ferro são necessários para a hidroxilação da lisina e prolina, que cruzam e estabilizam a estrutura tripla hélice do colágeno; o cobre também desempenha um papel na estabilização do colágeno. A vitamina A (ácido retinóico) desempenha um papel importante na modulação da produção e degradação do colagénio e é particularmente importante na epitelização. Um potente antioxidante, a vitamina E (alfa-tocoferol), parece acelerar a cicatrização dérmica e óssea nos animais, e a suplementação pode ter um papel nos seres humanos. Trace metal, particularmente zinco, deficiência também está associada com a cicatrização deficiente da ferida; este deve ser reabastecido, conforme apropriado.
Ovídio supostamente escreveu: “os medicamentos às vezes curam, às vezes matam.”Isto é certamente verdade em relação à cura da ferida. Os corticosteróides afugentam os processos de toda a fase inflamatória. A vitamina A (topicamente ou 25 000 UI/d oralmente) mitiga os efeitos curativos prejudiciais dos corticosteróides, mas a hepatotoxicidade pode resultar do uso prolongado (ou seja, >1 mo). Medicamentos anti-inflamatórios não esteróides (AINEs) também interferem com o metabolismo do ácido araquidónico e, portanto, com a cicatrização da ferida. Adicionalmente, os AINEs inibem a função plaquetária, um dos primeiros processos na fase inflamatória.
um estudo de Sutcliffe et al sugeriu que a regulação da ligação proteica entre gap é comum a feridas crônicas. Examinando connexin em três tipos de feridas venosas, pé diabético e úlceras de pressão—os pesquisadores descobriram que cada tipo de ferida, apresentado upregulation da epiderme connexin 43, connexin 26, e connexin 30, bem como dérmica connexin 43.