Holger J Schünemann, Julian PT Higgins, Gunn E Vist, Paulo Glasziou, Elie Uma Akl, Nicole Skoetz, Gordon H Guyatt; em nome da Cochrane GRADEing Métodos de Grupo (anteriormente Aplicabilidade e Recomendações Métodos de Grupo) e Cochrane Métodos Estatísticos de Grupo
- Pontos-Chave:
- 14.1 Resumo das constatações’ tabelas
- 14.1.1 Introdução para “Resumo das constatações’ tabelas
- 14.1.2 a selecção dos resultados para os quadros “Resumo das conclusões” quadros
- 14.1.3 Modelo geral para os quadros “Resumo das conclusões” quadros
- 14.1.4 elaboração dos quadros “Resumo das conclusões”
- 14.1.5 considerações Estatísticas nos quadros “resumo dos resultados”
- 14.1.5.1 resultados Dicotómicos
- 14.1.5.2 resultados de tempo para evento
- 14.1.6 conteúdo pormenorizado de um quadro “resumo das conclusões”
- 14.1.6.1 título e cabeçalho do quadro
- 14.1.6.2 resultados
- 14.1.6.3 a melhor estimativa do risco com a intervenção comparadora
- 14.1.6.4 risco com intervenção
- 14.1.6.5 diferença de risco
- 14.1.6.Efeito relativo (IC 95%)
- 14.1.6.7 Número de participantes (estudos)
- 14.1.6.8 certeza da evidência (grau)
- 14.1.6.9 comentários
- 14.1.6.10 As explicações
- 14.2 Avaliar a segurança ou qualidade de um corpo de evidência
- 14.2.1 O GRAU de abordagem
Pontos-Chave:
- um quadro de “resumo dos resultados” para uma dada comparação das intervenções fornece informações fundamentais sobre as grandezas dos efeitos relativos e absolutos das intervenções examinadas, a quantidade de dados disponíveis e a certeza (ou qualidade) dos dados disponíveis.
- os quadros “Resumo das conclusões” incluem uma linha para cada resultado importante (até um máximo de sete). Os formatos aceites das tabelas “Resumo das conclusões” e das tabelas “Resumo das conclusões” interactivas podem ser produzidos utilizando o software GRADEPRO GDT da GRADE.
- Cochrane has adopted the GRADE approach (Grading of Recommendations Assessment, Development and Evaluation) for assessing certainty (or quality) of a body of evidence.
- a abordagem de grau especifica quatro níveis de certeza para um corpo de evidência para um determinado resultado: alto, moderado, baixo e muito baixo.
- as avaliações de grau de certeza são determinadas através da consideração de cinco domínios: risco de viés, inconsistência, indireza, imprecisão e viés de publicação. Para evidências de estudos não aleatórios e estudos raramente aleatórios, avaliações podem ser atualizadas através da consideração de três outros domínios.
Cite este capítulo como: Schünemann HJ, Higgins JPT, Vist GE, Glasziou P, Akl EA, Skoetz N, Guyatt GH. Capítulo 14: preenchimento dos quadros “resumo dos resultados” e classificação da certeza dos elementos de prova. In: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions version 6.2 (updated February 2021). Cochrane, 2021. Disponível em www.formacao.cochrane.org/handbook.
14.1 Resumo das constatações’ tabelas
14.1.1 Introdução para “Resumo das constatações’ tabelas
‘Resumo das constatações’ tabelas de apresentar as principais conclusões de uma revisão transparente, estruturado e simples, de formato tabular. Em especial, fornecem informações essenciais sobre a certeza ou a qualidade das provas (ou seja, a confiança ou a certeza na gama de uma estimativa de efeitos ou de uma associação), a magnitude do efeito das intervenções examinadas e a soma dos dados disponíveis sobre os principais resultados. As Revisões Cochrane devem incorporar os quadros “Resumo das conclusões” durante o planeamento e a publicação, e devem ter pelo menos um quadro-chave “resumo das conclusões” que represente as comparações mais importantes. Algumas revisões podem incluir mais de uma tabela de “resumo dos achados”, por exemplo, se a revisão aborda mais de uma comparação importante, ou inclui populações substancialmente diferentes que exigem tabelas separadas (por exemplo, porque os efeitos diferem ou é importante mostrar os resultados separadamente). Na Base de Dados Cochrane de Revisões Sistemáticas (CDSR), o principal quadro “resumo das conclusões” de uma revisão aparece no início, antes da secção de fundo. Outros quadros de “resumo das conclusões” aparecem entre os resultados e as secções de discussão.
14.1.2 a selecção dos resultados para os quadros “Resumo das conclusões” quadros
o planeamento para o quadro “resumo das conclusões” começa no início da revisão sistemática, com a selecção dos resultados a incluir em: (i) a revisão; e (ii) o quadro “resumo das conclusões”. Este é um passo crucial, e um passo que os autores de revisão precisam abordar cuidadosamente.
para assegurar a produção de informação de utilidade óptima, As Revisões Cochrane começam por desenvolver uma questão de revisão e por listar todos os principais resultados que são importantes para os doentes e outros decisores (ver Capítulo 2 e Capítulo 3). A abordagem de grau para avaliar a certeza das provas (ver secção 14.2) define e operacionaliza um processo de notação que ajuda a separar os resultados daqueles que são críticos, importantes ou não importantes para a tomada de decisões. A consulta e o feedback sobre o protocolo de revisão, nomeadamente por parte dos consumidores e de outros decisores, podem melhorar este processo.
é provável que os resultados críticos incluam objectivos claramente importantes; exemplos típicos incluem mortalidade e morbilidade major (tais como acidentes vasculares cerebrais e enfarte do miocárdio). No entanto, podem também representar efeitos secundários frequentes menores e raros, sintomas, qualidade de vida, encargos associados ao tratamento e problemas de recursos (custos). Os encargos representam o impacto da carga de trabalho dos cuidados de saúde sobre a função e o bem-estar do paciente, e incluem as exigências de adesão a uma intervenção que os pacientes ou cuidadores (por exemplo, família) podem não gostar, tais como ter de passar por testes mais frequentes, ou as restrições ao estilo de vida que certas intervenções requerem (Spencer-Bonilla et al 2017).Com frequência, ao formular perguntas que incluem todos os resultados importantes para a tomada de decisão, os autores da revisão irão confrontar relatórios de estudos que não incluíram todos estes resultados. Isto é particularmente verdade para os resultados adversos. Por exemplo, ensaios aleatórios podem contribuir com evidências sobre os efeitos pretendidos e sobre efeitos secundários frequentes e relativamente menores, mas não relatam resultados adversos raros tais como tentativas de suicídio. O Capítulo 19 discute estratégias para lidar com efeitos adversos. Para obter dados para todos os resultados importantes pode ser necessário examinar os resultados de estudos não aleatorizados (ver Capítulo 24). Cochrane, em colaboração com outros, desenvolveu orientações para os autores de revisão para apoiar a sua decisão sobre quando procurar e incluir estudos não aleatórios (Schünemann et al 2013).
se uma revisão incluir apenas ensaios randomizados, estes ensaios podem não abordar todos os resultados importantes e, portanto, pode não ser possível abordar estes resultados dentro das restrições da revisão. Os autores de revisão devem reconhecer essas limitações e torná-las transparentes para os leitores. Os autores da revisão são encorajados a incluir estudos não aleatorizados para examinar efeitos adversos raros ou de longo prazo que podem não ser adequadamente estudados em ensaios randomizados. Isto levanta a possibilidade de que os resultados nocivos possam vir de estudos nos quais os participantes diferem dos estudos utilizados na análise do benefício. Os autores da revisão terão então de considerar até que ponto tais diferenças são susceptíveis de ter impacto nos resultados, o que influenciará a certeza da evidência devido a preocupações sobre a indireza relacionada com a população (ver secção 14.2.2).
estudos não aleatorizados podem fornecer informações importantes não só quando os ensaios randomizados não relatam um resultado ou ensaios randomizados sofrem de indireza, mas também quando a evidência de ensaios randomizados é classificada como estudos muito baixos e não-randomizados fornecem evidência de maior certeza. O Capítulo 24 apresenta igualmente uma análise mais aprofundada destas questões.
14.1.3 Modelo geral para os quadros “Resumo das conclusões” quadros
várias versões alternativas padrão dos quadros “Resumo das conclusões” foram desenvolvidas para assegurar a coerência e a facilidade de Utilização entre as revisões, a inclusão da informação mais importante necessária para os decisores e a apresentação óptima (ver exemplos nas figuras 14.1.a e 14.1.B). Estes formatos são apoiados por pesquisas que se concentram em uma melhor compreensão das informações que pretendem transmitir (Carrasco-Labra et al 2016, Langendam et al 2016, Santesso et al 2016). Eles estão disponíveis através do pacote de software oficial da GRADE desenvolvido para apoiar a abordagem de grau: GRADEpro GDT (www.gradepro.org).
os quadros “Resumo das conclusões” do Cochrane Standard incluem os seguintes elementos, utilizando um dos formatos aceites. Na secção 14.1.6 são fornecidas mais orientações sobre cada uma delas.
- uma breve descrição da população e indicação abordada pelas provas disponíveis (que podem ser ligeiramente diferentes ou mais estreitas do que as definidas na pergunta de revisão).
- uma breve descrição da comparação abordada no quadro “resumo dos Resultados”, incluindo as intervenções experimentais e comparativas.
- uma lista dos resultados de saúde mais críticos e/ou importantes, desejáveis e indesejáveis, limitados a sete ou menos resultados.
- uma medida da carga típica de cada resultado (por exemplo, risco ilustrativo, ou média ilustrativa, na intervenção comparadora).
- a magnitude absoluta e relativa do efeito medida para cada um (se ambos forem adequados).
- o número de participantes e estudos que contribuem para a análise de cada resultado.
- uma avaliação de grau da certeza global do conjunto de provas para cada resultado (que pode variar em função do resultado).
- espaço para Comentários.
- explicações (anteriormente conhecidas como notas de rodapé).
idealmente, os quadros “Resumo das conclusões” são apoiados por quadros mais pormenorizados (conhecidos como “perfis de prova”) aos quais a revisão pode estar ligada, que fornecem explicações mais pormenorizadas. Os perfis de evidência incluem os mesmos resultados importantes para a saúde, e fornecem mais detalhes do que os quadros de “resumo dos achados” de ambas as considerações individuais que alimentam a classificação da certeza e dos resultados dos estudos (Guyatt et al 2011a). Asseguram que seja utilizada uma abordagem estruturada para avaliar a certeza dos elementos de prova. Embora raramente sejam publicadas em Revisões Cochrane, os perfis de evidência são frequentemente usados, por exemplo, por desenvolvedores de diretriz em considerar a certeza das evidências para apoiar recomendações de diretriz. Os autores da revisão acharão mais fácil desenvolver a tabela “Resumo dos achados” completando a classificação da certeza da evidência no perfil de evidência primeiro em GRADEpro GDT. Eles podem então converter automaticamente este para um dos formatos de “resumo das descobertas” em GRADEpro GDT, incluindo um “resumo das descobertas” interativo para publicação.
como medida da magnitude do efeito para os resultados dicotómicos, a tabela “Resumo dos resultados” deve fornecer uma medida relativa do efeito (por exemplo, relação de risco, razão de probabilidade, perigo) e medidas de risco absoluto. Para outros tipos de dados, uma medida absoluta por si só (como uma diferença de meios para dados contínuos) pode ser suficiente. É importante que a magnitude do efeito seja apresentada de forma significativa, o que pode exigir alguma transformação do resultado de uma meta-análise (ver também Capítulo 15, secção 15.4 e secção 15.5). Os reexames com mais de uma comparação principal devem incluir um quadro separado “Resumo das conclusões” para cada comparação.
figura 14.1.a apresenta um exemplo de um quadro “resumo das conclusões”. Figura 15.1.b fornece um formato alternativo que pode facilitar ainda mais a compreensão e interpretação dos resultados da revisão por parte dos utilizadores. As provas que avaliam diferentes formatos sugerem que a tabela “Resumo das conclusões” deve incluir uma diferença de risco como medida do efeito absoluto e os autores devem, preferencialmente, utilizar um formato que inclua uma diferença de risco .
uma descrição pormenorizada do conteúdo de um quadro “resumo das conclusões” figura na secção 14.1.6.
figura 14.1.um Exemplo de um “Resumo das constatações’ tabela
Resumo das conclusões (para a versão interativa clique aqui)
|
as meias de Compressão em comparação com nenhum meias de compressão para as pessoas que tomam voos de longa duração |
||||||
|
Pacientes ou população: alguém a tomar um vôo longo (com duração superior a 6 horas) Definições: as viagens aéreas internacionais Intervenção: compressão stockingsa Comparação: sem meias |
||||||
|
Resultados |
Ilustrativo comparativa de riscos* (95% CI) |
efeito Relativo (CI de 95%) |
Número de participantes (estudos) |
a Certeza da evidência (GRAU) |
||
|
risco Assumido |
risco Correspondente |
|||||
|
Sem meias |
Com meias |
|||||
|
Sintomático de trombose venosa profunda (TVP) |
Ver comentário |
comentário |
Não estimável |
(9 estudos) |
comentário |
0 os participantes desenvolveram sintomático TVP nestes estudos |
|
Symptomless TVP |
Baixo risco populationb |
RR 0.10 (0.04 para 0.26) |
(9 estudos) |
⊕⊕⊕⊕ Alta |
||
|
10 por 1000 |
1 por 1000 (0 a 3) |
|||||
|
Alto risco populationb |
||||||
|
20 por 1000 |
2 por 1000 (de 1 a 8) |
|||||
|
Superficial, trombose venosa |
13 por 1000 |
6 por 1000 (2 a 15) |
RR 0.45 (0.18 a 1.13) |
(8 estudos) |
⊕⊕⊕◯ Moderatec |
|
|
Edema Pós-vôo valores medidos em uma escala de 0, sem edema, 10, máximo de edema |
A média de edema pontuação variou entre os grupos de controle, a partir de 6 9 |
A média de edema de pontuação nos grupos de intervenção foi, em média, 4.7 inferior (95% CI -4.9 a -4.5) |
(6 estudos) |
⊕⊕◯◯ Lowd |
||
|
embolia Pulmonar |
comentário |
Comentário |
Não estimável |
(9 estudos) |
comentário |
0 os participantes desenvolveram embolia pulmonar nestes studiese |
|
a Morte |
comentário |
comentário |
Não estimável |
(9 estudos) |
comentário |
0 os participantes morreram nestes estudos |
|
efeitos Adversos |
comentário |
comentário |
Não estimável |
(4 estudos) |
comentário |
A tolerabilidade dos meias foi descrito como muito bom, sem queixas de efeitos colaterais em 4 studiesf |
|
*A base para o risco assumido é fornecido em Rodape. O risco correspondente (e o seu intervalo de confiança de 95%) baseia-se no risco assumido no grupo de intervenção e no efeito relativo da intervenção (e no seu IC de 95%). IC: intervalo de confiança; RR: rácio de risco; grau: grau: grupo de trabalho graus de evidência (ver explicações). |
||||||
a todas as meias dos nove estudos incluídos nesta revisão foram meias de compressão abaixo do joelho. Em quatro estudos, a força de compressão foi de 20 mmHg a 30 mmHg no tornozelo. Foi de 10 mmHg a 20 mmHg nos outros quatro estudos. As meias têm tamanhos diferentes. Se uma meia é muito apertado em torno do joelho, pode evitar o retorno venoso essencial, fazendo com que o sangue para poça em torno do joelho. As meias de compressão devem ser correctamente montadas. Uma meia demasiado apertada pode cortar a pele durante um longo voo e causar ulceração e aumento do risco de TVP. Algumas meias podem ser ligeiramente mais espessa do que a cobertura normal da perna e podem ser potencialmente restritivas com o desgaste apertado do pé. É uma boa idéia usar meias em torno da casa antes de viajar para garantir um bom, confortável ajuste. Os participantes colocam suas meias de duas a três horas antes do voo na maioria dos estudos. A disponibilidade e o custo das meias podem variar.
B dois estudos recrutaram participantes de alto risco definidos como aqueles com episódios anteriores de TVP, perturbações da coagulação, obesidade grave, mobilidade limitada devido a problemas ósseos ou articulares, doença neoplásica nos dois anos anteriores, grandes veias varicosas ou, num dos estudos, participantes com mais de 190 cm e mais pesados que 90 kg. A incidência para os sete estudos que excluíram participantes de alto risco foi 1.45% e a incidência para os dois estudos que recrutaram participantes de alto risco (com pelo menos um factor de risco) foi de 2,43%. Usámos 10 e 30 por 1000 para expressar diferentes estratos de risco, respectivamente.
C o intervalo de confiança não atravessa nenhuma diferença e não exclui um pequeno aumento.
D A Medição do edema não foi validada (indirectness of the outcome) ou cega à intervenção (risco de viés).Se houver muito poucos ou nenhuns eventos e o número de participantes for grande, o julgamento sobre a certeza da evidência (particularmente juízos sobre a imprecisão) pode basear-se no efeito absoluto. Neste caso, a notação de certeza pode ser considerada “elevada” se o resultado tiver sido adequadamente avaliado e o evento, de facto, não tiver ocorrido em 2821 participantes estudados.
f nenhum dos outros estudos relatou efeitos adversos, à excepção de quatro casos de trombose venosa superficial nas veias varicosas na região do joelho que foram comprimidos pela extremidade superior da meia num estudo.
figura 14.1.b Exemplo de alternativa “Resumo das constatações’ tabela
|
Resumo das conclusões (para a versão interativa clique aqui): |
||||||
|
Probióticos comparado a nenhum probióticos como um auxiliar de antibióticos em crianças |
||||||
|
Paciente ou população: crianças que recebem antibióticos Definições: pacientes internados e de ambulatório Intervenção: probióticos Comparação: não probióticos |
||||||
|
Resultados Nº de participantes (estudos) |
em relação efeitos |
Previsto absoluta efeitos* (95% IC) |
a Certeza da evidência |
|||
|
Sem probióticos |
Com probióticos |
Diferença |
||||
|
Incidência de diarréia: Probiótico dose de 5 bilhões de UFC/dia acompanhamento: 10 dias a 3 meses Crianças < 5 anos |
Crianças < 5 anos |
⊕⊕⊕⊝ moderateb Devido ao risco de viés |
Provavelmente diminui a incidência de diarréia. |
|||
|
1474 (7 estudos) |
RR 0,41 (0,29 para 0.55) |
22.3%um |
8.9% (6.5 para 12.2) |
13.4% menos childrena (de 10,1 a 15.8 menos) |
||
|
Crianças > 5 anos |
Crianças > 5 anos |
⊕⊕⊝⊝ lowb, c Devido ao risco de viés e imprecisão |
Pode diminuir a incidência de diarréia. |
|||
|
624 (4 estudos) |
RR de 0,81 (de 0,53 para 1.21) |
11.2%um |
9% (5.9 para 13.6) |
2.2% menos childrena (5.3 menos 2.4 mais) |
||
|
Adversos eventsd acompanhamento: 10 a 44 dias 1575 (11 estudos) |
1.8%um |
2.3% (0.8 para 3.8) |
0.5% mais adversos eventse (1 a menos de 2 mais) |
⊕⊕⊝⊝ lowf, g Devido ao risco de viés e inconsistência |
pode haver pouca ou nenhuma diferença em eventos adversos. |
|
|
Duração da diarreia acompanhamento: 897 (5 estudos) |
a duração média da diarreia sem probióticos foi de 4 dias. |
0.6 menos dias (de 1,18 0,02 menos dias) |
⊕⊕⊝⊝ lowh, i Devido à imprecisão e inconsistência |
Pode diminuir a duração da diarréia. |
||
|
fezes por dia Follow-up: 425 (4 estudos) |
as fezes médias por dia sem probióticos eram de 2, 5 fezes por dia. |
0.3 menos fezes por dia (0,6 a 0 menos) |
⊕⊕⊝⊝ lowj, k Devido à imprecisão e inconsistência |
pode haver pouca ou nenhuma diferença nas fezes por dia. |
||
|
*a base para o risco no grupo de controlo (por exemplo, o risco mediano do grupo de controlo em todos os estudos) é apresentada em notas de rodapé. O risco no grupo de intervenção (e o seu intervalo de confiança de 95%) baseia-se no risco assumido no grupo de comparação e no efeito relativo da intervenção (e no seu IC de 95%). IC: intervalo de confiança; RR: rácio de risco. |
||||||
|
explicações as estimativas de risco de grupo de controlo provêm de estimativas agrupadas de grupos de controlo. Efeito relativo baseado na análise de casos disponível B risco elevado de viés devido a perdas elevadas no seguimento.A imprecisão devido a poucos acontecimentos e intervalos de confiança inclui benefícios ou danos apreciáveis.Efeitos secundários d: erupção cutânea, náuseas, flatulência, vómitos, fleuma aumentada, dor no peito, obstipação, alterações do paladar e baixo apetite.Os riscos foram calculados a partir de diferenças de risco agrupadas. f risco elevado de viés. Apenas 11 dos 16 ensaios notificados sobre acontecimentos adversos, sugerindo uma notificação selectiva de viés.D incoerência grave. Numerosos agentes probióticos e doses foram avaliados entre um número relativamente pequeno de ensaios, limitando nossa capacidade de tirar conclusões sobre a segurança dos muitos agentes probióticos e doses administradas. h inconsistência inexplicável grave (grande heterogeneidade I2 = 79%, valor P , estimativas pontuais e intervalos de confiança variam consideravelmente).* * * * * * * * * * * O limite superior de 0, 02 menos dias de diarreia não é considerado importante para o doente. J inconsistência inexplicável grave (grande heterogeneidade I2 = 78%, valor P , estimativas pontuais e intervalos de confiança variam consideravelmente). k imprecisão grave. O intervalo de confiança de 95% não inclui efeito e a ligação inferior de 0, 60 fezes por dia é de importância duvidosa para o doente. |
||||||
14.1.4 elaboração dos quadros “Resumo das conclusões”
software do grupo de trabalho de qualidade, GRADEpro GDT (www.gradepro.org), incluindo o manual interactivo da GRADE, está disponível para ajudar os autores da revisão na preparação dos quadros “Resumo das conclusões”. GRADEpro pode usar dados sobre o risco de grupo comparador e a estimativa do efeito (introduzidos pelos autores da revisão ou importados de arquivos gerados em RevMan) para produzir os efeitos relativos e os riscos absolutos associados às intervenções experimentais. Além disso, ele conduz o utilizador através do processo de um tipo de avaliação, e produz uma tabela que pode ser usado como um autônomo tabela em uma revisão (inclusive por importação direta em software como RevMan ou integração com RevMan Web), ou uma interativo “Resumo das constatações’ tabela (consulte os recursos de ajuda no GRADEpro).
14.1.5 considerações Estatísticas nos quadros “resumo dos resultados”
14.1.5.1 resultados Dicotómicos
os quadros “resumo dos resultados” devem incluir medidas absolutas e relativas de efeito para os resultados dicotómicos. Os rácios de risco, os rácios de Probabilidades e as diferenças de risco são formas diferentes de comparar dois grupos com dados de resultados dicotómicos (ver Capítulo 6, secção 6.4.1). Além disso, existem dois rácios de risco distintos, dependendo do evento (por exemplo, ” Sim ” ou “não”) que é o foco da análise (ver Capítulo 6, secção 6.4.1.5). Na presença de um efeito de intervenção não-zero, qualquer variação entre os estudos no grupo comparador de riscos (i.e. a variação do risco de ocorrência do evento sem intervenção de interesse, por exemplo em populações diferentes) torna impossível que mais de uma dessas medidas seja realmente a mesma em cada estudo.Há muito que se presume, na epidemiologia, que as medidas relativas de efeito são mais consistentes do que as medidas absolutas de efeito de um cenário para outro. Há evidências empíricas que sustentam esta suposição (Engels et al 2000, Deeks e Altman 2001, Furukawa et al 2002). Por esta razão, as meta-análises devem geralmente utilizar uma relação de risco ou uma relação de probabilidades como medida de efeito (Ver capítulo 10, secção 10.4.3). Do mesmo modo, é provável que uma única estimativa do efeito relativo seja um resumo mais adequado do que uma única estimativa do efeito absoluto. Se um efeito relativo for de facto consistente entre os estudos, os diferentes riscos do grupo comparador terão implicações diferentes para o benefício absoluto. Por exemplo, se o rácio de risco for consistentemente 0.Em seguida, a intervenção experimental reduziria um risco de grupo comparador de 80% a 60% no grupo de intervenção (uma redução absoluta do risco de 20 pontos percentuais), mas também reduziria um risco de grupo comparador de 20% a 15% no grupo de intervenção (uma redução absoluta do risco de 5 pontos percentuais).
os quadros “resumo dos resultados” baseiam-se na hipótese de um efeito relativo consistente. Por conseguinte, é importante considerar as implicações deste efeito para os diferentes riscos do grupo comparador (estes podem ser derivados ou estimados a partir de várias fontes, ver secção 14.1.6.3), que pode exigir uma avaliação da certeza dos elementos de prova prognósticos (Spencer et al 2012, Iorio et al 2015). Para qualquer risco de grupo comparador, é possível estimar um risco de grupo de intervenção correspondente (ou seja, o risco absoluto com a intervenção) a partir da relação de risco meta-analítica ou de probabilidade. Note-se que os números indicados na coluna “risco correspondente” são específicos dos “riscos” da coluna adjacente.
para a relação de risco meta-analítica (RR) e risco comparador assumido (ACR), o risco de intervenção correspondente é obtido como:
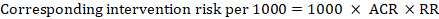 .
.
como exemplo, na figura 14.1.a, a relação de risco meta-analítica para trombose venosa profunda (TVP) sintomática é RR = 0, 10 (IC 95% 0, 04 a 0, 26). Assumindo um risco comparador de ACR = 10 por 1000 = 0,01, obtém-se:
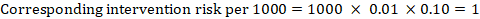 .
.
para o rácio de probabilidades meta-analíticas (ou) e risco comparador assumido, ACR, o risco de intervenção correspondente é obtido como:
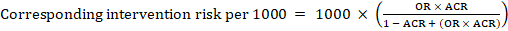 .
.
os limites de confiança superiores e inferiores para o risco de intervenção correspondente são obtidos através da substituição da RR ou dos seus limites de confiança superiores e inferiores, respectivamente (por exemplo, substituição de 0.10 com 0, 04, depois com 0, 26, no exemplo). Esses intervalos de confiança não incorporam incerteza nos riscos de comparação assumidos.
quando se trata de rácios de risco, é fundamental que seja utilizada a mesma definição de “evento” que foi utilizada para a meta-análise. Por exemplo, se a meta-análise incidiu na “morte” (em oposição à sobrevivência) como acontecimento, então os riscos correspondentes no quadro “resumo dos resultados” devem também referir-se à “morte”.
em circunstâncias (raras) em que existe uma razão clara para assumir uma diferença de risco consistente na meta-análise, em princípio, é possível apresentá-la para os “riscos assumidos” relevantes e seus riscos correspondentes, e apresentar os correspondentes (diferentes) efeitos relativos para cada risco assumido.
a diferença de risco expressa a diferença entre a ACR e o risco de intervenção correspondente (ou a diferença entre a intervenção experimental e a intervenção comparadora).
para o rácio de risco meta-analítico (RR) e o risco comparador assumido (ACR), a diferença de risco correspondente é obtida como (note-se que os riscos também podem ser expressos utilizando pontos percentuais ou percentuais)):
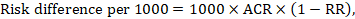
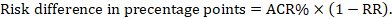
como exemplo, na figura 14.1.b a relação de risco meta-analítica é de 0, 41 (IC 95% 0, 29 a 0, 55) para a diarreia em crianças com menos de 5 anos de idade. Assumindo um risco de grupo comparador de 22,3% obtemos:
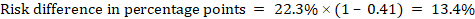 .
.
Para a meta-análise de odds ratio (or) e assumiu o comparador de risco (ACR) o risco absoluto diferença é obtida como (p.p.):
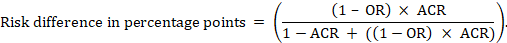
Superior e inferior limites de confiança para o risco absoluto diferença são obtidos por re-executar o cálculo acima, enquanto substituição de RR ou por seu superior e inferior limites de confiança, respectivamente (por exemplo, substituição de 0,41 com 0.28, em seguida, com a 0,55, no exemplo). Esses intervalos de confiança não incorporam incerteza nos riscos de comparação assumidos.
14.1.5.2 resultados de tempo para evento
resultados de tempo para evento medem se e quando um determinado evento (por exemplo, morte) ocorre (van Dalen et al 2007). O impacto da intervenção experimental em relação ao grupo de comparação nos resultados Tempo-A-evento é normalmente medido utilizando uma taxa de risco (RH) (ver Capítulo 6, secção 6.8.1).
uma taxa de perigo expressa uma estimativa do efeito relativo. Pode ser utilizado de várias formas para obter riscos absolutos e outras quantidades interpretáveis para uma população específica. Aqui nós descrevemos como re-expressar as razões de perigo em termos de: (i) risco absoluto de sobrevivência livre de acontecimentos num determinado período de tempo; (II) risco absoluto de um acontecimento num determinado período de tempo; e (iii) tempo mediano para o acontecimento. Todos os métodos são baseados na hipótese de efeitos relativos consistentes (ou seja, que a razão de perigo não varia ao longo do tempo).O risco absoluto de sobrevivência livre de acontecimentos num determinado período de tempo de sobrevivência livre de acontecimentos (por exemplo, sobrevivência global) é frequentemente notificado pelos estudos individuais. Para obter efeitos absolutos para os resultados de tempo para evento medidos como sobrevivência livre de evento, o RH resumo pode ser utilizado em conjunto com uma proporção presumida de doentes que estão livres de eventos no grupo comparador (Tierney et al 2007). Esta proporção de doentes será específica a um período de observação. No entanto, não é estritamente necessário especificar esse período de tempo. Por exemplo, uma proporção de 50% dos doentes sem acontecimentos pode aplicar-se a doentes com uma elevada taxa de acontecimentos observada ao longo de 1 ano, ou a doentes com uma baixa taxa de acontecimentos observada ao longo de 2 anos.

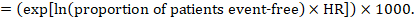
como exemplo, suponha-se que a taxa de risco meta-analítica é 0, 42 (95% IC 0, 25 a 0, 72). Supondo que um grupo de comparação risco de sobrevida livre de eventos (e.g. para a sobrevivência de pessoas vivas) em 2 anos de ACR = 900 por 1000 = 0.9 obtemos:

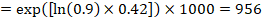
de modo que a 956 por 1000 pessoas vai estar vivo, com a intervenção experimental em 2 anos. A determinação do risco deve ser explicada numa observação ou nota de rodapé.
(ii) risco Absoluto de um evento dentro de um determinado período de tempo Para obter este absoluta efeito, novamente o resumo de RH pode ser usado (Tierney et al. 2007):

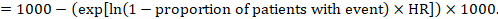
No exemplo, vamos supor que, suponha que um grupo de comparação do risco de eventos (e.g. para a mortalidade, as pessoas sendo mortas) em 2 anos de ACR = 100 por 1000 = 0.1. Nós obtemos:

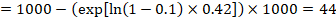
para que 44 por 1000 pessoas morram com a intervenção experimental aos 2 anos.
(iii) tempo mediano para o evento em vez de números absolutos, o tempo para o evento nos grupos de intervenção e comparação pode ser expresso como tempo mediano de sobrevivência em meses ou anos. Para obter o tempo de sobrevivência mediano, o HR combinado pode ser aplicado a um tempo de sobrevivência mediano presumido no grupo comparador (Tierney et al. 2007):
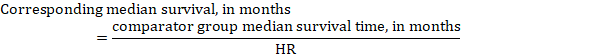
no exemplo, assumindo um tempo mediano de sobrevivência do grupo comparador de 80 meses, obtemos:
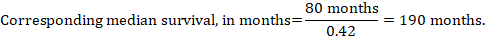
Para todos esses três opções para a re-expressão de resultados de tempo-para-evento análises, superior e inferior limites de confiança para a correspondente intervenção de risco são obtidos através da substituição de RH pelo seu superior e inferior limites de confiança, respectivamente (e.g. substituindo 0.42 com 0,25, em seguida, com 0.72, no exemplo). Mais uma vez, quanto aos resultados dicotómicos, esses intervalos de confiança não incorporam incerteza nos riscos do grupo comparador assumido. Trata-se de uma preocupação especial para a sobrevivência a longo prazo com uma taxa de mortalidade baixa ou moderada e um número correspondente elevado de doentes censurados (ou seja, um número reduzido de doentes em risco e uma taxa elevada de censura).
14.1.6 conteúdo pormenorizado de um quadro “resumo das conclusões”
14.1.6.1 título e cabeçalho do quadro
o título de cada quadro “resumo das conclusões” deve especificar a questão dos cuidados de saúde, enquadrada em termos de população e deixando claro exactamente que comparação das intervenções é feita. Na Figura 14.1.a, a população é pessoas que fazem longos voos de avião, a intervenção é Meias de compressão, e o controle não é Meias de compressão.
as primeiras linhas de cada tabela de “resumo das conclusões” devem fornecer as seguintes informações de “cabeçalho”:
doentes ou População, o que clarifica ainda mais a população (e possivelmente as subpopulações) de interesse e, idealmente, a magnitude do risco do resultado adverso mais crucial para o qual se dirige uma intervenção. Por exemplo, as pessoas em um voo de longo curso podem estar em diferentes riscos para DVT; os doentes que utilizam inibidores selectivos da recaptação da serotonina (ISRSs) podem ter um risco diferente para efeitos secundários; enquanto os doentes com fibrilhação auricular podem ter um risco baixo (< 1%), moderado (1% a 4%) ou elevado (> 4%) de acidente vascular cerebral.Definição
isto deve indicar quaisquer características específicas das definições da questão dos cuidados de saúde que possam limitar a aplicabilidade do resumo dos resultados a outras definições (por exemplo, cuidados primários na Europa e na América do Norte).
intervenção a intervenção experimental.Compare a intervenção comparadora (sem intervenção específica).
14.1.6.2 resultados
as linhas de uma tabela “Resumo das conclusões” devem incluir todos os resultados desejáveis e indesejáveis para a saúde (listados por ordem de importância) que são essenciais para a tomada de decisões, até um máximo de sete resultados. Se houver mais resultados na revisão, os autores da revisão terão que omitir os resultados menos importantes da tabela, e a decisão de selecionar quais resultados são críticos ou importantes para a revisão deve ser feita durante o desenvolvimento do protocolo (ver Capítulo 3). Os autores da revisão devem fornecer prazos para a medição dos resultados (por exemplo, 90 dias ou 12 meses) e do tipo de pontuações do instrumento (por exemplo, variando de 0 a 100).
Note que os autores da revisão devem incluir os resultados críticos e importantes pré-especificados na tabela se os dados estão disponíveis ou não. No entanto, devem estar atentos à possibilidade de a importância de um resultado (por exemplo, um efeito adverso grave) Só poder ser conhecida após a redacção do protocolo ou a análise ter sido realizada, e devem tomar as medidas adequadas para as incluir no quadro “resumo das conclusões”.
o quadro “resumo dos resultados” pode incluir os efeitos em subgrupos da população para diferentes riscos comparadores e tamanhos de efeito separadamente. Por exemplo, na figura 14.1.os efeitos b são apresentados separadamente para crianças com menos de 5 anos e mais de 5 anos. Os autores de revisão também podem optar por produzir tabelas separadas de “resumo dos achados” para diferentes populações.
Revisão de autores deve incluir eventos adversos graves, mas pode ser possível combinar efeitos colaterais menores, como um único resultado, e descrever em nota de rodapé explicativa (nota que não é apropriado para adicionar eventos em conjunto, a menos que eles são independentes, isto é, um participante que tenha experimentado um evento adverso tem afetado chance de experimentar a outros eventos adversos).Os resultados medidos em vários pontos temporais representam um problema particular. Em geral, para manter a tabela simples, os autores de revisão devem apresentar vários pontos de tempo apenas para resultados críticos para a tomada de decisões, onde o resultado ou a decisão tomada são susceptíveis de variar ao longo do tempo. O restante deve ser apresentado num ponto de tempo comum, sempre que possível.
os autores da Revisão podem apresentar medidas contínuas de resultados na tabela “Resumo das conclusões” e devem esforçar-se por as tornar interpretáveis para o público-alvo. Para tal, é necessário que as unidades sejam claras e facilmente interpretáveis, por exemplo, dias de dor ou frequência de cefaleias, e indicar o nome e a escala de quaisquer ferramentas de medição utilizadas (por exemplo, uma escala analógica Visual, que varia entre 0 e 100). No entanto, muitos instrumentos de medição não são facilmente interpretáveis por médicos ou pacientes não especializados, por exemplo, pontos em um inventário de depressão Beck ou pontuação de qualidade de vida. Para estes, uma apresentação mais interpretável pode envolver a conversão de um resultado contínuo a um resultado dicotómico, como a melhoria > 50% (ver Capítulo 15, Secção 15).5).
14.1.6.3 a melhor estimativa do risco com a intervenção comparadora
os autores da revisão devem fornecer até três riscos típicos para os participantes que recebem a intervenção comparadora. Para resultados dicotômicos, recomendamos que estes sejam apresentados na forma do número de pessoas que experimentam o evento por 100 ou 1000 pessoas (frequência natural) dependendo da frequência do resultado. Para os resultados contínuos, este seria declarado como um valor médio ou mediano do resultado medido.
Estimado ou presumido comparador de intervenção riscos poderia ser com base em avaliações de riscos típicos em diferentes grupos de pacientes, decorrentes da análise em si, representante individual de estudos na revisão, ou riscos derivados a partir de uma revisão sistemática de estudos de prognóstico ou de outras fontes de evidência que podem por sua vez requerem uma avaliação da certeza para o prognóstico de provas (Spencer et al 2012, Iorio et al 2015). Idealmente, os riscos reflectiriam grupos que os médicos podem identificar facilmente com base nas suas características de apresentação.
uma nota explicativa deve especificar a fonte ou justificação de cada risco de grupo comparador, incluindo o período A que corresponde, se for caso disso. Na Figura 14.1.a, os médicos podem facilmente diferenciar indivíduos com fatores de risco de trombose venosa profunda daqueles que não têm. Se se souber que existe uma pequena variação no risco inicial, os autores de revisão poderão utilizar o risco mediano do grupo comparador em todos os estudos. Se os riscos típicos não forem conhecidos, uma opção é escolher o risco dos estudos incluídos, proporcionando o segundo mais alto para uma população de alto e o segundo mais baixo para uma população de baixo risco.
14.1.6.4 risco com intervenção
para resultados dicotómicos, os autores da revisão devem fornecer um risco absoluto correspondente para cada risco comparador de grupo, juntamente com um intervalo de confiança. Este risco absoluto com a intervenção (experimental) será normalmente derivado do resultado da meta-análise apresentado na coluna de efeito relativo (ver secção 14.1.6.6). As fórmulas são apresentadas na secção 14.1.5. Os autores da revisão devem apresentar o efeito absoluto no mesmo formato que os riscos com a intervenção comparadora (ver secção 14.1.6.3), por exemplo como o número de pessoas que experimentam o evento por 1000 pessoas.
para resultados contínuos, uma diferença de meios ou diferença padronizada de meios deve ser apresentada com o seu intervalo de confiança. Estes normalmente serão obtidos diretamente de uma meta-análise. O texto explicativo deve ser utilizado para clarificar o significado, como Na Figura 14.1.a e 14.1.B.
14.1.6.5 diferença de risco
para os resultados dicotómicos, a diferença de risco pode ser fornecida utilizando um dos formatos da tabela “Resumo das conclusões” como opção adicional (ver Figura 14.1.B). Esta diferença de risco expressa a diferença entre a intervenção experimental e a intervenção comparadora e será normalmente derivada do resultado da meta-análise apresentado na coluna de efeito relativo (ver secção 14.1.6.6). As fórmulas são apresentadas no ponto 14.1.5. Revisão, os autores devem apresentar o risco de diferença no mesmo formato assumido e riscos correspondentes, com o comparador de intervenção (ver Secção 14.1.6.3); por exemplo, como o número de pessoas com o evento por 1000 pessoas ou como pontos percentuais se o assumido e riscos correspondentes são expressos em porcentagem.
para resultados contínuos, se o quadro “resumo dos resultados” incluir esta opção, a diferença média pode ser apresentada aqui e a coluna “risco correspondente” deixada em Branco (ver Figura 14.1.B).
14.1.6.Efeito relativo (IC 95%)
o efeito relativo será tipicamente uma razão de risco ou de probabilidade (ou ocasionalmente uma razão de perigo) com o respectivo intervalo de confiança de 95%, obtido a partir de uma meta-análise realizada com base na mesma medida de efeito. Os rácios de risco e de probabilidade são semelhantes quando os riscos de intervenção comparadores são baixos e os efeitos são pequenos, mas podem diferir consideravelmente quando os riscos do grupo comparador aumentam. A meta-análise pode envolver uma suposição de efeitos fixos ou aleatórios, dependendo do que os autores da revisão consideram apropriado, e implicando que o efeito relativo é uma estimativa do efeito da intervenção, ou uma estimativa do efeito médio da intervenção entre os estudos, respectivamente.
14.1.6.7 Número de participantes (estudos)
Essa coluna deve incluir o número de participantes avaliados em estudos incluídos para cada resultado e o correspondente número de estudos que contribuíram estes participantes.
14.1.6.8 certeza da evidência (grau)
os autores da revisão devem comentar sobre a certeza da evidência (também conhecida como qualidade do corpo da evidência ou confiança nas estimativas do efeito). Os autores da revisão devem utilizar o sistema específico de classificação de provas desenvolvido pelo grupo de trabalho GRADE (Atkins et al 2004, Guyatt et al 2008, Guyatt et al 2011a), que é descrito em pormenor na secção 14.2. A abordagem de grau classifica a certeza num conjunto de provas como “elevada”, “moderada”, “baixa” ou “muito baixa” por resultado. Isto é resultado de julgamento, mas o processo de julgamento opera dentro de uma estrutura transparente. Como um exemplo, a certeza seria “alta” se o resumo foram de vários ensaios randomizados com baixo risco de viés, mas a classificação de certeza torna-se menor, se há preocupações sobre o risco de viés, inconsistência, indirectness, imprecisão ou viés de publicação. Os juízos que não tenham uma certeza “elevada” devem ser tornados transparentes utilizando notas de rodapé explicativas ou a coluna “comentários” no quadro “resumo das conclusões” (ver secção 14.1.6.10).
14.1.6.9 comentários
o objectivo do campo “Comentários” é ajudar a interpretar as informações ou dados identificados na linha. Por exemplo, isto pode ser sobre a validade da medida de resultado ou a presença de variáveis que estão associadas com a magnitude do efeito. Importantes advertências sobre os resultados devem ser sinalizadas aqui. Nem todas as linhas necessitarão de comentários, e é melhor deixar um branco se não houver nada que justifique um comentário.
14.1.6.10 As explicações
devem ser incluídas como notas de rodapé para apoiar os juízos constantes do quadro “resumo das conclusões”, como a avaliação global do grau. As explicações devem descrever as razões subjacentes a aspectos importantes do conteúdo. Quadro 14.1.a lists guidance for useful explanations. As explicações devem ser concisas, informativas, relevantes, fáceis de entender e precisas. Se as explicações não puderem ser suficientemente descritas em notas de rodapé, os autores da revisão devem fornecer mais detalhes sobre as questões nas secções de resultados e discussão da revisão.
quadro 14.1.uma orientação para fornecer explicações úteis nos quadros “Resumo das conclusões” (SoF). Adaptado de Santesso et al (2016)
orientação geral
- introduza a informação dos leitores directamente no quadro, se possível (por exemplo, informação sobre a duração do seguimento ou a escala utilizada).
- geralmente, não cite referências na secção explicações, a menos que existam razões específicas, por exemplo, para fornecer informações sobre fontes de riscos de base (ver ponto 3).
- fornecer a fonte de informação sobre os riscos de base utilizados para calcular os efeitos absolutos.
- após a conclusão da tabela, Reveja todas as explicações para determinar se algumas poderiam ser referenciadas várias vezes se reformuladas ou combinadas.
- fornecer razões para a actualização e desclassificação das provas (ver orientação específica do domínio abaixo) e utilizar software de GRADEpro GDT para aderir à orientação de grau.
- o corpo de evidência para um determinado resultado pode ser determinado a ter problemas graves ou muito graves para o domínio afetado (ou criticamente grave para o risco de viés quando ROBINS-I é usado). Assim, pode ser útil indicar o número de níveis para desclassificação (por exemplo, desclassificado por um nível para o risco de viés), mas evitar a repetição do que está na tabela (e a impressão de relatórios formulaicos ou algorítmicos). Em perfis de evidência, esta informação já está nas células da tabela.
- embora as explicações sobre a certeza das provas sejam principalmente necessárias quando alteram a certeza, considere adicionar uma explicação quando a certeza das provas não foi alterada, mas quando esta decisão pode ser questionada por outros. Isto ajudará a compreender as razões de desacordo.
- assegurar que o quadro não é utilizado como descrição dos métodos de análise (por exemplo, não descrever os motivos da análise estatística).
- introduzir resultados que não puderam ser combinados estatisticamente numa meta-análise (i.e. resultados narrativos) diretamente na tabela SoF nas colunas de resultados. Pode não ser necessária uma explicação para comunicar esses resultados. Se considerado benéfico para o público a que se destina, adicione estimativas complementares dos efeitos de intervenção (por exemplo, o número necessário para tratar os benefícios e os danos, a diferença de risco expressa em percentagem, o resultado contínuo expresso em unidades de diferença mínimas importantes) na coluna de comentários.
- utilize a informação apresentada nas explicações sobre o processo de classificação para informar outras partes-chave da revisão, incluindo as versões resumidas e a discussão.
Domínio-específico de orientação para a escrita de explicações úteis
Risco de viés
- Descrever o número de estudos, ou a quantidade de informações que eles fornecem, na meta-análise, que estavam em alto risco de viés e para o qual critério.
- usar termos como maioria, minoria, todos, alguns ou nenhum; ou o número de estudos como estudos X/X.
- para ensaios aleatorizados, mencionar os critérios específicos incluindo ocultação de sequências de alocação, relatórios de resultados seletivos, etc. Para estudos não aleatórios, descreva o critério na ferramenta utilizada (por exemplo, usando a ferramenta ROBINS-I).
- indicar se o efeito do risco de viés foi examinado numa análise de sensibilidade. Se for caso disso, mencionar a contribuição dos estudos com elevado risco de viés para as estimativas.
- podem ser incluídas informações sobre a concepção do estudo nas explicações, em especial na SoF, quando forem incluídos diferentes projectos de estudo.
inconsistência
- indica a medida usada para julgar a inconsistência, tais como o teste estatístico ou medida (I2, Chi2, Tau), ou a sobreposição de intervalos de confiança, ou semelhança de estimativas pontuais.
- se a inconsistência é baseada em I2, descreva-a como considerável, substancial, moderada ou não importante.Se aplicável, mencionar se a heterogeneidade foi explorada em análises de subgrupos por PICO (doentes, intervenção, comparação, resultado) e se existem outras razões potenciais para a heterogeneidade.
- no caso de um único estudo para um resultado, dizer que não há “nenhum” em vez de “Não aplicável”.
Imprecisão
- Indicar onde o tamanho da amostra ou o número de eventos não cumprir o ideal informações tamanho calculado, ou as ‘regras de ouro’ (e.g. 400 eventos). Evitar a referência ao número de estudos como motivo de imprecisão.
- indicar se os intervalos de confiança incluem a possibilidade de um efeito pequeno ou nulo e benefícios ou danos importantes. Se for conhecido, indicar o valor numérico do limiar de benefícios importantes.
- evitar comunicar o resultado como estatisticamente ou não estatisticamente significativo.
actualização
- mencionar a razão para a actualização: devido a um grande efeito; um gradiente dose-resposta; ou uma oposição residual plausível aumenta a certeza das provas.
- para efeitos graves, indicar se o efeito relativo é >2 ou >5. Para os gradientes de dose-resposta, indicar o nível de intervenção e o efeito no resultado. Para o domínio “oposição residual plausível à confusão”, descrever o efeito do factor de confusão na estimativa.
14.2 Avaliar a segurança ou qualidade de um corpo de evidência
14.2.1 O GRAU de abordagem
Os Graus de Recomendação, Avaliação, Desenvolvimento e Avaliação do Grupo de Trabalho (GRAU de Grupo de Trabalho) desenvolveu um sistema de classificação a certeza de provas (Schünemann et al 2003, Atkins et al 2004, Schünemann et al 2006, Guyatt et al 2008, Guyatt et al., 2011a). Mais de 100 organizações, incluindo a Organização Mundial de Saúde (OMS), o Colégio Americano de Médicos, da Sociedade Americana de Hematologia (ASH), a Agência Canadense de Medicamentos e Tecnologia em Saúde (CADTH) e o instituto Nacional de Saúde e Excelência Clínica (NICE) do reino UNIDO adotaram o sistema de CLASSE (www.gradeworkinggroup.org).
Cochrane tem também formalmente adotado esta abordagem, e todas as Cochrane de Revisões deve utilizar para avaliar o GRAU de certeza de provas de importantes resultados (ver MECIR Caixa 14.2.a).
MECIR Box 14.2.um Relevantes expectativas para a conduta de intervenção comentários
|
C74: Avaliar o grau de certeza o corpo de prova (Obrigatória) |
|
|
Use as cinco GRAU considerações (risco de viés, consistência de efeito, imprecisão, indirectness e viés de publicação) para avaliar a certeza de corpos-de-prova para cada resultado, e para tirar conclusões sobre a certeza de provas dentro do texto da revisão. |
o grau é a abordagem mais utilizada para resumir a confiança nos efeitos das intervenções através dos resultados de estudos. É preferível usar a Ferramenta de GRADEpro online, e usá-la como descrito no sistema de ajuda do software. Isto deverá ajudar a garantir que as equipas de autores estejam a aceder à mesma informação para informar os seus juízos. Idealmente, duas pessoas que trabalham de forma independente devem avaliar a certeza do corpo de provas e chegar a uma opinião consensual sobre quaisquer decisões de desclassificação. As considerações de cinco graus devem ser abordadas independentemente de o reexame incluir um quadro “resumo das conclusões”. É útil tirar partido desta informação na discussão, nas conclusões dos autores e transmitir a certeza na evidência no resumo de linguagem abstrata e simples. |
|
C75: Justificando avaliações da certeza de que o corpo de prova (Obrigatória) |
|
|
Justificar e documentar todas as avaliações da certeza de que o corpo de prova (e.g. fazer o downgrade ou upgrade de usar a CLASSE). |
a adoção de uma abordagem estruturada garante transparência na formulação de uma interpretação das provas, e o resultado é mais informativo para o usuário. |
para revisões sistemáticas, a abordagem de grau define a certeza de um conjunto de provas como a medida em que se pode estar confiante de que uma estimativa de efeito ou associação está próxima da quantidade de interesse específico. Avaliando a certeza de um corpo de evidências que envolve a consideração de dentro e através de estudo de risco de viés (limitações no estudo, concepção e execução ou qualidade metodológica), inconsistência (ou heterogeneidade), indirectness das provas, a imprecisão das estimativas de efeito e risco de viés de publicação (ver Secção 14.2.2), bem como domínios que podem aumentar a nossa confiança no efeito de estimativa (como descrito na Seção 14.2.3). O sistema de classificação implica uma avaliação da certeza de um conjunto de provas para cada resultado individual. Os juízos sobre os domínios que determinam a certeza das provas devem ser descritos na secção de resultados ou discussão e como parte do quadro “resumo das conclusões”.
a abordagem por grau especifica quatro níveis de certeza (figura 14.2.a). Para as intervenções, incluindo diagnóstico e outros testes que são avaliados como intervenções (Schünemann et al 2008b, Schünemann et al., 2008a, Balshem et al 2011, Schünemann et al 2012), o ponto de partida para a classificação a certeza de prova é classificada em dois tipos:
- ensaios clínicos randomizados; and
- non-randomized studies of interventions( NRSI), including observational studies (including but not limited to cohort studies, and case-control studies, cross-sectional studies, case series and case reports, although not all of these designs are usually included in Cochrane Reviews).
existem muitos casos em que os autores de revisão dependem da Informação do NRSI, em particular para avaliar potenciais danos (ver Capítulo 24). Além disso, os autores de revisão podem obter dados relevantes de ensaios aleatorizados e NRSI, com cada tipo de evidência complementando a outra (Schünemann et al 2013).
de grau, Um conjunto de evidências de ensaios aleatorizados começa com uma classificação de alta certeza, enquanto um conjunto de evidências de NRSI começa com uma classificação de baixa certeza. A menor classificação com NRSI é o resultado do viés potencial induzido pela falta de aleatorização (ou seja, confusão e viés de seleção).
no Entanto, quando as novas Risco De Viés Em Estudos Não randomizados de Intervenções (ROBINS-I) ferramenta (Sterne et al 2016), uma ferramenta de avaliação que cobre o risco de viés devido à falta de randomização, todos os estudos podem começar como a certeza absoluta de provas (Schünemann et al 2018). A abordagem de iniciar todos os projetos de estudo (incluindo NRSI) com uma elevada certeza não entra em conflito com a abordagem de grau inicial de iniciar a classificação de NRSI como prova de pouca certeza. Isto ocorre porque um corpo de evidências de NRSI deve geralmente ser rebaixado por dois níveis devido ao risco inerente de viés associado com a falta de aleatorização, ou seja, o desvio confundindo e seleção. Não rebaixar o NRSI de alta para baixa certeza precisa de uma justificação transparente e detalhada para o que mitiga as preocupações sobre a confusão e viés de seleção (Schünemann et al 2018). Existem actualmente muito poucos exemplos de casos em que não se justifica uma redução de dois níveis.
a classificação de certeza mais elevada é um conjunto de provas quando não há preocupações em nenhum dos factores de grau enumerados na figura 14.2.A. autores de revisão frequentemente desclassificam evidências para evidências moderadas, baixas ou mesmo muito baixas, dependendo da presença dos cinco fatores na figura 14.2.A. geralmente, a classificação de certeza cairá por um nível para cada fator, até um máximo de três níveis para todos os fatores. Se houver problemas muito graves para qualquer domínio (ex. ao avaliar o risco de viés, todos os estudos não foram combinados, não vinculados e perderam mais de 50% de seus pacientes para acompanhamento), a evidência pode cair em dois níveis devido a esse fator sozinho. Não é possível fixar uma taxa inferior aos dados de “certeza muito baixa”.
os autores da revisão avaliam geralmente as evidências de estudos não-aleatórios sonoros como sendo de baixa certeza, mesmo que ROBINS-I seja usado. Se, no entanto, tais estudos produzirem grandes efeitos e não houver nenhum viés óbvio explicando esses efeitos, os autores de revisão podem classificar a evidência como moderada ou – se o efeito for grande o suficiente – mesmo como alta certeza (figura 14.2.a). O nível de certeza muito baixo é apropriado para, mas não se limita a, estudos com problemas críticos e observações clínicas não sistemáticas (por exemplo, séries de casos ou relatórios de casos).