nome genérico: cloridrato de clonidina
Forma farmacêutica: comprimido
Drugs.com. atualizado pela última vez em 1 de julho de 2020.
- Visão
- Efeitos Colaterais
- Dosagem
- Profissional
- Dicas
- Medicamentosas
- Mais
- Clonidina Cloridrato de Tablets, USP
- Clonidine Descrição
- clonidina – Farmacologia Clínica
- farmacocinética
- indicações e Utilização dos comprimidos de cloridrato de clonidina
- advertências
- retirada
- precauções
- geral
- Utilização perioperatória
- informação para os doentes
- Interacções medicamentosas
- Toxicologia
- Carcinogênese, mutagénese, problemas de Fertilidade
- Gravidez
- mães a amamentar
- reacções adversas
- sobredosagem
- como é fornecida clonidina
- PRINCIPAL PAINEL de VISUALIZAÇÃO
- PRINCIPAL PAINEL de VISUALIZAÇÃO
- PRINCIPAL DISPLAY PANEL
- Mais sobre clonidine
- recursos de Consumo
- recursos de Profissionais de
- Relacionados guias de tratamento de
Clonidina Cloridrato de Tablets, USP
Oral anti-hipertensivo
Comprimidos de 0,1 mg, 0,2 mg e 0.3 mg
Somente Rx
Informação de Prescrição
Clonidine Descrição
Clonidina cloridrato, a USP é uma central atuando alfa-agonista de hipotensão agente disponível na forma de comprimidos para administração oral em três dosagens: 0,1 mg, 0,2 mg e 0,3 mg. O comprimido de 0, 1 mg é equivalente a 0, 087 mg da base Livre.Os componentes inactivos são dióxido de silício coloidal, amido de Milho, Fosfato de cálcio dibásico, hidroxipropilcelulose, celulose microcristalina, lactose mono-hidratada e estearato de magnésio. Além disso, o 0.Os comprimidos de 1 mg contêm Fd&C Vermelho n. o 40, e os comprimidos de 0, 2 mg e 0, 3 mg contêm Fd&C Amarelo n. o 6 como aditivos de cor, respectivamente.
o cloridrato de clonidina é um derivado da imidazolina e existe como um composto mesomérico. A Denominação química é cloridrato de 2-(2,6-diclorofenilamino)-2-imidazolina. Segue-se a fórmula estrutural::
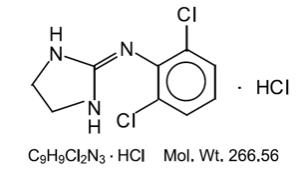
o cloridrato de clonidina é uma substância cristalina inodora, amarga, branca e solúvel em água e álcool.
clonidina – Farmacologia Clínica
clonidina estimula os alfa-adrenoreceptores no tronco cerebral. Esta acção resulta numa redução do fluxo simpático do sistema nervoso central e na diminuição da resistência periférica, da resistência vascular renal, da frequência cardíaca e da pressão arterial. Os comprimidos de cloridrato de clonidina actuam relativamente rapidamente. A pressão arterial do doente diminui 30 a 60 minutos após uma dose oral, ocorrendo a diminuição máxima em 2 a 4 horas. O fluxo sanguíneo Renal e a taxa de filtração glomerular permanecem essencialmente inalterados. Os reflexos posturais normais estão intactos; portanto, os sintomas ortostáticos são leves e pouco frequentes.
Aguda estudos com cloridrato de Clonidina em humanos têm demonstrado uma redução moderada (de 15% a 20%) de saída cardíaca na posição supina, sem alterar a resistência periférica: em um 45′ tilt há uma menor redução do débito cardíaco e diminuição da resistência periférica. Durante a terapêutica a longo prazo, o débito cardíaco tende a voltar aos valores de Controlo, enquanto a resistência periférica permanece diminuída. Observou-se diminuição da frequência cardíaca na maioria dos doentes aos quais foi administrada clonidina, mas o fármaco não altera a resposta hemodinâmica normal ao exercício.Em alguns doentes pode desenvolver-se tolerância ao efeito antihipertensor, necessitando de uma reavaliação da terapêutica.Outros estudos em doentes apresentaram evidência de redução da actividade da renina plasmática e da excreção de aldosterona e catecolaminas. A relação exacta destas acções farmacológicas com o efeito antihipertensor da clonidina não foi completamente esclarecida.
clonidina estimula acentuadamente a libertação da hormona do crescimento tanto em crianças como em adultos, mas não produz uma elevação crónica da hormona do crescimento com o uso a longo prazo.
farmacocinética
a farmacocinética da clonidina é proporcional à dose no intervalo de 100 a 600 mcg. A biodisponibilidade absoluta da clonidina na administração oral é de 70% a 80%. Os níveis plasmáticos máximos de clonidina são atingidos em aproximadamente 1 a 3 horas.
após administração intravenosa, a clonidina apresenta uma disposição bifásica com uma semi-vida de distribuição de cerca de 20 minutos e uma semi-vida de eliminação de 12 a 16 horas. A semi-vida aumenta até 41 horas em doentes com compromisso grave da função renal. A clonidina atravessa a barreira placentária. Foi demonstrado que atravessa a barreira hemato-encefálica em ratos.Após administração oral, cerca de 40% a 60% da dose absorvida é recuperada na urina sob a forma de fármaco inalterado em 24 horas. Cerca de 50% da dose absorvida é metabolizada no fígado. Nem os alimentos nem a raça do doente influenciam a farmacocinética da clonidina.O efeito antihipertensor é atingido em concentrações plasmáticas entre 0, 2 e 2, 0 ng/mL em doentes com função excretora normal. Um aumento adicional dos níveis plasmáticos não irá aumentar o efeito anti-hipertensor.
indicações e Utilização dos comprimidos de cloridrato de clonidina
, USP estão indicados no tratamento da hipertensão. Comprimidos de cloridrato de clonidina, USP pode ser utilizado isoladamente ou concomitantemente com outros fármacos anti-hipertensores.Os comprimidos de cloridrato de clonidina não devem ser utilizados em doentes com hipersensibilidade conhecida à clonidina (ver precauções).
advertências
retirada
os doentes devem ser instruídos a não interromper a terapêutica sem consultar o seu médico. A interrupção súbita do tratamento com clonidina resultou, em alguns casos, em sintomas como nervosismo, agitação, cefaleias e tremor acompanhados ou seguidos por um rápido aumento da pressão arterial e concentrações elevadas de catecolaminas no plasma. A probabilidade de tais reacções à interrupção da terapêutica com clonidina parece ser maior após a administração de doses mais elevadas ou continuação do tratamento concomitante com beta-bloqueador, pelo que se recomenda precaução especial nestas situações. Foram notificados casos raros de encefalopatia hipertensiva, acidentes cerebrovasculares e morte após retirada da clonidina. Quando se Descontinua o tratamento com clonidina, o médico deve reduzir a dose gradualmente durante 2 a 4 dias para evitar sintomatologia de privação.
um aumento excessivo da pressão arterial após a interrupção da terapêutica com clonidina pode ser revertido pela administração de cloridrato de clonidina oral ou por fentolamina intravenosa. Se a terapêutica for interrompida em doentes que estejam a receber um bloqueador beta e clonidina concomitantemente, o bloqueador beta deve ser interrompido vários dias antes da descontinuação gradual da clonidina.
uma vez que as crianças têm frequentemente doenças gastrointestinais que provocam vómitos, podem ser particularmente susceptíveis a episódios hipertensos resultantes de incapacidade abrupta de tomar medicação.
precauções
geral
em doentes que desenvolveram sensibilização de contacto localizada à clonidina transdérmica, a continuação da clonidina transdérmica ou a substituição da terapêutica com cloridrato de clonidina oral pode estar associada ao desenvolvimento de uma erupção cutânea generalizada.
em doentes que desenvolvam uma reacção alérgica à clonidina transdérmica, a substituição do cloridrato de clonidina oral pode também provocar uma reacção alérgica (incluindo erupção cutânea generalizada, urticária ou angioedema).)
a acção simpaticolítica da clonidina pode piorar a disfunção do nódulo sinusal e o bloqueio auriculoventricular (AV), especialmente em doentes a tomar outros fármacos simpaticolíticos. Existem notificações pós-comercialização de doentes com anomalias da condução e/ou a tomar outros fármacos simpaticolíticos que desenvolveram bradicardia grave que requereram atropina, isoproterenol IV e ritmo cardíaco temporário enquanto tomam clonidina.
na hipertensão causada por feocromocitoma, não se pode esperar efeito terapêutico dos comprimidos de cloridrato de clonidina.
Utilização perioperatória
a administração de comprimidos de cloridrato de clonidina deve ser continuada até quatro horas após a cirurgia e retomada logo que possível a partir daí. A pressão arterial deve ser cuidadosamente monitorizada durante a cirurgia e devem estar disponíveis medidas adicionais para controlar a pressão arterial, se necessário.
informação para os doentes
os doentes devem ser advertidos contra a interrupção da terapêutica com comprimidos de cloridrato de clonidina sem o conselho do seu médico.Uma vez que os doentes podem ter um possível efeito sedativo, tonturas ou perturbações do alojamento com a utilização de clonidina, recomenda-se precaução aos doentes em actividades como conduzir veículos ou utilizar aparelhos ou máquinas. Informe também os doentes que este efeito sedativo pode ser aumentado pelo uso concomitante de álcool, barbitúricos ou outros fármacos sedativos.
os doentes que usam lentes de contacto devem ser advertidos de que o tratamento com comprimidos de cloridrato de clonidina pode causar secura ocular.
Interacções medicamentosas
clonidina pode potenciar os efeitos depressivos do SNC do álcool, barbitúricos ou outras drogas sedantes. Se um doente a tomar cloridrato de clonidina também estiver a tomar antidepressivos tricíclicos, o efeito hipotensor da clonidina pode ser reduzido, necessitando de um aumento na dose de clonidina. Se um doente a tomar clonidina também estiver a tomar neurolépticos, podem ser induzidas ou exacerbadas perturbações da regulação ortostática (p.ex. hipotensão ortostática, tonturas, fadiga).
monitorize a frequência cardíaca em doentes a tomar clonidina concomitantemente com fármacos que afectam a função do nódulo sinusal ou condução AV nodal, por exemplo, digitálicos, bloqueadores dos canais de cálcio e beta-bloqueadores. Foi notificada bradicardia sinusal que resultou em hospitalização e inserção de pacemaker em associação com a utilização de clonidina concomitantemente com diltiazem ou verapamilo.
amitriptilina em associação com clonidina aumenta a manifestação de lesões da córnea em ratos (ver Toxicologia).Com base em observações em doentes em estado de delírio alcoólico, foi sugerido que doses intravenosas elevadas de clonidina podem aumentar o potencial arritmogénico (prolongamento QT, fibrilhação ventricular) de doses intravenosas elevadas de haloperidol. Não foi estabelecida uma relação Causal e relevância para os comprimidos orais de clonidina.
Toxicologia
em vários estudos com cloridrato de clonidina oral, foi observado um aumento dependente da dose na incidência e gravidade da degeneração espontânea da retina em ratos albinos tratados durante seis meses ou mais. Os estudos de distribuição tecidular em cães e macacos revelaram uma concentração de clonidina no coróide.Devido à degeneração da retina observada em ratos, foram efectuados exames oculares durante os ensaios clínicos em 908 doentes antes e periodicamente após o início da terapêutica com clonidina. Em 353 destes 908 doentes, os exames oftalmológicos foram efectuados por períodos iguais ou superiores a 24 meses. Com exceção de alguma secura dos olhos, não foram registrados achados oftalmológicos anormais relacionados com drogas e, de acordo com testes especializados, tais como eletrorretinografia e deslumbramento macular, a função retinal permaneceu inalterada.
em associação com amitriptilina, a administração de cloridrato de clonidina levou ao desenvolvimento de lesões da córnea em ratos num período de 5 dias.
Carcinogênese, mutagénese, problemas de Fertilidade
Crônica de dieta administração de Clonidina não foi carcinogênica para ratos (132 semanas) ou camundongos (78 semanas) doses, respectivamente, em até 46 ou 70 vezes o valor máximo diário recomendado humanos dose mg/kg (9 ou 6 vezes o MRDHD em mg/m2 de base). Não houve evidência de genotoxicidade no teste de Ames para Mutagenicidade ou teste de micronúcleo em ratinhos para clastogenicidade.
a fertilidade de ratos machos ou fêmeas não foi afectada por doses de clonidina tão elevadas como 150 mcg/kg (aproximadamente 3 vezes MRDHD). Numa experiência separada, a fertilidade de ratos fêmeas pareceu ser afectada em níveis de dose de 500 a 2000 mcg/kg (10 a 40 vezes o MRDHD oral numa base de mg/kg; 2 a 8 vezes o MRDHD numa base de mg / m’.)
Gravidez
Efeitos Teratogênicos: Gravidez Categoria C. estudos de Reprodução realizados em coelhos em doses até aproximadamente 3 vezes o oral diária máxima recomendada dose humana (MRDHD) de Clonidina cloridrato de tablets produzidos nenhuma evidência de efeitos teratogénicos ou embryotoxic potencial em coelhos. No entanto, nos ratos, doses tão baixas como 1/3 da MRDHD oral (1 / 15 da MRDHD numa base mg / m2) de clonidina foram associadas a aumentos de reabsorções num estudo em que as progenitoras foram tratadas continuamente a partir de 2 meses antes do acasalamento. O aumento das reabsorções não foi associado ao tratamento ao mesmo tempo ou a níveis de dose mais elevados (até 3 vezes o MRDHD oral) quando as progenitoras foram tratadas nos dias 6 a 15 de gestação. Observaram-se aumentos na reabsorção com doses muito mais elevadas (40 vezes o MRDHD oral numa base de mg / kg; 4 a 8 vezes o MRDHD numa base de mg / m2) em ratinhos e ratos tratados nos dias 1 a 14 de gestação (a dose mais baixa utilizada no estudo foi de 500 mcg/kg).Não foram realizados estudos adequados e bem controlados em mulheres grávidas. A clonidina atravessa a barreira placentária (ver farmacologia clínica, farmacocinética). Uma vez que os estudos de reprodução em animais nem sempre prevêem a resposta humana, este medicamento só deve ser utilizado durante a gravidez se for claramente necessário.
mães a amamentar
como o cloridrato de clonidina é excretado no leite humano, deve ter-se precaução quando os comprimidos de cloridrato de clonidina são administrados a uma mulher a amamentar.A segurança e eficácia em doentes pediátricos não foram estabelecidas em ensaios adequados e bem controlados (ver advertências, interrupção).
reacções adversas
a maioria dos efeitos adversos são ligeiros e tendem a diminuir com a continuação da terapêutica. Os mais frequentes (que parecem estar relacionados com a dose) São boca seca, ocorrendo em cerca de 40 de 100 doentes.; sonolência, cerca de 33 em 100; tonturas, cerca de 16 em 100; prisão de ventre e sedação, cada uma cerca de 10 em 100.
foram também notificados os seguintes efeitos adversos menos frequentes em doentes a tomar comprimidos de cloridrato de clonidina, mas em muitos casos os doentes estavam a tomar medicação concomitante e não foi estabelecida uma relação causal.
corpo no seu todo: fadiga, febre, cefaleias, palidez, fraqueza e síndrome de abstinência. Foram também notificados resultados fracamente positivos no teste de Coombs e aumento da sensibilidade ao álcool.
Cardiovascular: Bradicardia, insuficiência cardíaca congestiva, anomalias electrocardiográficas (isto é, paragem dos nódulos sinusais, bradicardia juncional, bloqueio AV de alto grau e arritmias), sintomas ortostáticos, palpitações, fenómeno de Raynaud, síncope e taquicardia.Foram notificados casos de bradicardia sinusal e bloqueio auriculoventricular, tanto com como sem a utilização concomitante de digitálicos.Sistema Nervoso Central: Agitação, ansiedade, delírio, percepção delirante, alucinações (incluindo visuais e auditivas), insónia, depressão mental, nervosismo, outras alterações comportamentais, parestesia, inquietação, perturbação do sono e sonhos ou pesadelos vívidos.Dermatológico: Alopécia, edema angioneurótico, urticária, prurido, erupção cutânea e urticária.
Gastrointestinal: dor Abdominal, anorexia, obstipação, hepatite, mal-estar, alterações transitórias ligeiras nos testes da função hepática, náuseas, parotite, pseudo-obstrução (incluindo pseudo-obstrução colónica), dor na glândula salivar e vómitos.Genitourinary: diminuição da actividade sexual, dificuldade no parto, disfunção eréctil, perda de libido, nocturia e retenção urinária.
Hematológica: Trombocitopenia.
metabólico: ginecomastia, elevação transitória da glucose sanguínea ou da creatinina fosfoquinase sérica e aumento de peso.Afecções musculosqueléticas e dos tecidos conjuntivos: cãibras nas pernas e dores musculares ou nas articulações.
Oro-otolaríngeo: secura da mucosa nasal.Oftalmológico: alterações da Acomodação, visão turva, queimadura dos olhos, lacrimação diminuída e secura dos olhos.
sobredosagem
a hipertensão pode desenvolver-se precocemente e pode ser seguida de hipotensão, bradicardia, depressão respiratória, hipotermia, sonolência, reflexos diminuídos ou ausentes, fraqueza, irritabilidade e miose. A frequência da depressão do SNC pode ser mais elevada nas crianças do que nos adultos. Uma sobredosagem grave pode resultar em defeitos de condução cardíaca reversíveis ou disritmias, apneia, coma e convulsões. Os sinais e sintomas de sobredosagem ocorrem geralmente dentro de 30 minutos a duas horas após a exposição. Tão pouco como 0, 1 mg de clonidina tem produzido sinais de toxicidade em crianças.Não existe antídoto específico para a sobredosagem com clonidina. A sobredosagem com clonidina pode resultar no rápido desenvolvimento de depressão do SNC; assim, não se recomenda a indução do vómito com xarope ipecacu. A lavagem gástrica pode ser indicada após ingestões recentes e / ou grandes. A administração de carvão activado e/ou de uma catártica pode ser benéfica. Os cuidados de suporte podem incluir sulfato de atropina para bradicardia, fluidos intravenosos e/ou vasopressores para hipotensão e vasodilatadores para hipertensão. A naloxona pode ser um adjuvante útil para o tratamento da depressão respiratória, hipotensão e/ou coma induzidas pela clonidina; a pressão arterial deve ser monitorizada uma vez que a administração de naloxona resultou ocasionalmente em hipertensão paradoxal. A administração de tolazolina produziu resultados inconsistentes e não é recomendada como terapêutica de primeira linha. Não é provável que a diálise aumente significativamente a eliminação da clonidina.
a maior sobredosagem notificada até à data envolveu um homem de 28 anos que ingeriu 100 mg de pó de cloridrato de clonidina. Este doente desenvolveu hipertensão seguida de hipotensão, bradicardia, apneia, alucinações, semicoma e contracções ventriculares prematuras. O doente recuperou completamente após um tratamento intensivo. Os níveis plasmáticos de clonidina foram de 60 ng/mL após 1 hora, 190 ng/mL após 1, 5 horas, 370 ng/mL após 2 horas e 120 ng/mL após 5, 5 e 6, 5 horas. Em ratinhos e ratos, a DL50 oral da clonidina é de 206 e 465 mg/kg, respectivamente.Dose e Administração de clonidina
adultos
a dose de comprimidos de cloridrato de clonidina deve ser ajustada de acordo com a resposta individual da pressão arterial do doente. Segue-se um guia geral da sua administração.
Dose inicial
0, 1 mg comprimido duas vezes por dia (de manhã e ao deitar). Os doentes idosos podem beneficiar de uma dose inicial mais baixa.Se necessário, até ser atingida a resposta desejada, podem ser efectuados incrementos adicionais de 0, 1 mg por dia. Tomar a maior parte da dose oral diária ao deitar pode minimizar os efeitos transitórios de ajuste da boca seca e sonolência. As doses terapêuticas mais frequentemente utilizadas variaram entre 0, 2 mg e 0, 6 mg por dia, administradas em doses divididas.
estudos indicaram que 2, 4 mg é a dose diária máxima eficaz, mas doses tão elevadas como estas raramente foram utilizadas.
compromisso Renal
doentes com compromisso renal podem beneficiar de uma dose inicial mais baixa. Os doentes devem ser cuidadosamente monitorizados. Uma vez que apenas uma quantidade mínima de clonidina é removida durante a hemodiálise de rotina, não há necessidade de administrar clonidina suplementar após diálise.
como é fornecida clonidina
comprimidos de cloridrato de clonidina, USP são fornecidos da seguinte forma:
0, 1 mg: um comprimido cor-de-rosa, em forma de “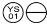 “.
“.
NDC 58657-647-01 (Frasco de 100)
NDC 58657-647-50 (Garrafa de 500)
NDC 58657-647-10 (Frasco de 1000)
0,2 mg: Uma laranja tablet, em forma de ” 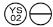 “.
“.
NDC 58657-648-01 (Frasco de 100)
NDC 58657-648-50 (Garrafa de 500)
NDC 58657-648-10 (Frasco de 1000)
0,3 mg: Uma luz laranja tablet, em forma de ” 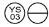 “.
“.
NDC 58657-649-01 (Frasco de 100)
NDC 58657-649-50 (Garrafa de 500)
NDC 58657-649-10 (Frasco de 1000)
Armazenamento a 25°C (77°F); excursões permitida a 15°C-30°C (59°F-86°F) . Dispense num recipiente apertado e resistente à luz.
fabricado por:
Yung Shin Pharmaceutical Ind. Emissao., Ltd.
Tachia, Taichung 43769
TAIWAN
distribuido por::
Method Pharmaceuticals, LLC
7333 Jack Newell Blvd. Norte, Suite 300
Fort Worth, Texas 76118
Para relatório de EXPERIÊNCIA ADVERSA, por favor, chamar o Método de produtos Farmacêuticos no 1-877-250-3427
Revista: 06/20
PRINCIPAL PAINEL de VISUALIZAÇÃO
NDC 58657-647-10
Clonidine
CLORIDRATO
TABLETS, USP
0,1 mg
Somente Rx
1000 Comprimidos

PRINCIPAL PAINEL de VISUALIZAÇÃO
NDC 58657-648-10
Clonidine
CLORIDRATO
TABLETS, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| a Clonidina CLORIDRATO Clonidina cloridrato de comprimido |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| a Clonidina CLORIDRATO Clonidina cloridrato de comprimido |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Método Pharmaceuticals, LLC (060216698)
Mais sobre clonidine
- Efeitos Colaterais
- Durante a Gravidez ou a Amamentação
- Informação sobre a Dosagem
- Paciente Dicas
- Droga Imagens
- Interações Medicamentosas
- Comparar Alternativas
- Grupo de Apoio
- Preço & Cupons
- 619 Avaliações
- classe da Droga: antiadrenergic agentes, agindo centralmente
- Alertas do FDA (1)
recursos de Consumo
- Informações do Paciente
- … +Mais 5
recursos de Profissionais de
- Informação de Prescrição
- CloNIDine (Profissional Paciente e Aconselhamento)
- Clonidine Comprimidos de Libertação Prolongada (FDA)
- Injeção de Clonidina (FDA)
- Clonidine Patch (FDA)
- Clonidine Comprimidos (FDA)
Outras marcas Catapres, Kapvay, Catapres-TTS, Duraclon, Nexiclon XR
Relacionados guias de tratamento de
- Ansiedade
- TDAH
- Abstinência de Álcool
- Fibrilação Atrial
- … + 19 mais
Declaração de exoneração de responsabilidade médica