Introdução
Saúde-infecções associadas (Iacs), como bacteremia causada por tuberculose multi-resistente a Pseudomonas aeruginosa cepas resultar em um aumento da morbidade e da mortalidade, prolongando o tempo de internação e custos mais altos em comparação com aqueles infecções causadas por cepas suscetíveis.1-3 infecções causadas por estes microrganismos resistentes são muitas vezes associados com a idade, Câncer, doença cardíaca, diabetes, uso intensivo de antibióticos, e procedimentos invasivos, tais como hemodiálise, cateter de ventilação mecânica, traqueostomia, e outros.4
a incidência crescente de P. multirresistente. aeruginosa como causa de infecção hospitalar é um problema global, uma consequência da capacidade deste microrganismo para desenvolver resistência a quase todos os outros agentes antimicrobianos durante a quimioterapia antimicrobiana, quer pela selecção de mutações em genes cromossômicos ou horizontal transferência de genes.5,6 no Brasil, este problema é ainda mais significativo, já que há uma densidade muito alta de uso de antibióticos, especialmente β-lactamas, carbapenemas e fluoroquinolonas.7,8 a resistência em P. aeruginosa para carbapenems é de até 60% em alguns hospitais brasileiros 9,10 e ocorre principalmente pela produção de metallo-β-lactamases (MBL).
Dez subclasses da MBL enzimas são conhecidas: IMP (Imipenemase), o VIM (Verona Imipenemase), SPM-1 (São Paulo MBL), GIM (alemão Imipenemase), SIM-1 (Seul Imipenemase),11 AIM-1 (Austrália Imipenemase),12 KHM (Kyorin Hospital Universitário),13 NDM-1 (New Delhi MBL),14 DIM-1 (holandês Imipenemase),15 e TMB (Trípoli MBL).16 no Brasil, as subclasses mais prevalentes são IMP – 1 e SPM-1.11
vários outros genes de virulência, bem como a formação de biofilmes, podem contribuir para a patogenicidade de infecções graves, particularmente incluindo as associadas a procedimentos invasivos.17 Entre os principais fatores de virulência descritos na literatura, destacam-se aqueles relacionados com a adesão de micro-organismos para células hospedeiras através de flagelados, fimbriae, e alginate18 e aqueles que facilitam o rompimento da integridade epitelial e interferir com o sistema imune, como a elastase, a fosfolipase C e protease alcalina, mais exotoxin Um, pyocyanin, e pyoverdine.A produção de biofilmes está particularmente associada à dificuldade de os antibióticos penetrarem nas células, uma vez que segregam uma matriz polimérica composta por polissacáridos, proteínas e ADN.20, 21
o objectivo deste estudo foi identificar os factores de risco associados à bacteremia causada por P. aeruginosa resistente ao carbapenem, bem como a produção de MBL. Além disso, investigamos a frequência dos genes de virulência e sua capacidade de formar biofilme.
materiais e métodos e hospital
The P. as estirpes de aeruginosa foram recuperadas de pacientes admitidos no Hospital Universitário de Uberlandia (Brasil), Universidade Federal de Uberlândia (HC-UFU), e obtidas do Laboratório de Microbiologia do HC-UFU, durante o período de Maio de 2009 a dezembro de 2012, considerando apenas o primeiro episódio de infecção.
concepção do estudo
conduzimos um estudo de caso (doentes com bacteremia devida a P. aeruginosa resistente aos carbapenemes) versus estudo de controlo (doentes com bacteremia causada por P. aeruginosa sensível aos carbapenemes) para identificar os factores de risco entre os doentes infectados por P. aeruginosa resistente aos carbapenems. Além disso, avaliamos resultados secundários, incluindo períodos de hospitalização, admissão na unidade de cuidados intensivos (UCI), e uso de procedimentos invasivos. As características demográficas, clínicas e epidemiológicas de cada paciente incluído no estudo foram recuperadas dos registros clínicos.
definições
infecções associadas aos cuidados de saúde (HAIs) são definidas como qualquer infecção adquirida após a admissão de um doente no hospital. As HAIs podem manifestar-se durante a hospitalização ou após a alta, uma vez que estão relacionadas com a hospitalização ou procedimentos realizados durante a hospitalização.22 Bacteremia,de acordo com os Centros de controle e prevenção de doenças, 23 pode ser definida como a presença de bactérias viáveis no sangue documentada por um resultado positivo da cultura de sangue. A Bacteremia foi classificada como primária quando não estava relacionada a outro foco de infecção ou quando estava relacionada a um cateter intravenoso, e secundária quando estava clinicamente relacionada a infecção em outro local anatômico.A resistência Multidrogénica é definida como a não susceptibilidade adquirida a pelo menos um agente em três ou mais categorias antimicrobianas.A terapêutica antimicrobiana foi considerada inadequada quando um microrganismo isolado apresentou resistência in vitro aos antimicrobianos utilizados no tratamento do doente e/ou uma ausência de tratamento durante 24 horas após o diagnóstico de infecções microbianas.25
Testes microbiológicos e moleculares clínicos
as culturas foram recolhidas de acordo com o protocolo utilizado pelo Laboratório de Microbiologia do HC-UFU e foram processadas utilizando o sistema automatizado BACT/Alert® (BioMérieux, Durham, EUA). Os testes de identificação e susceptibilidade antimicrobiana foram realizados por automação utilizando o sistema VITEK II e as estirpes que mostraram susceptibilidade intermédia foram consideradas resistentes. Protocolos de controle de qualidade foram utilizados de acordo com os padrões do Instituto padrão clínico e laboratorial.26-28 The carbapenem-resistant P. os isolados de aeruginosa foram rastreados fenotipicamente para a produção de MBL utilizando testes de sinergia de discos duplos, como descrito anteriormente.Além disso, para avaliar a presença de genes MBL em estirpes de P. aeruginosa, foi realizado um PCR multiplex, como descrito anteriormente.As condições de ciclismo foram: 94 ° C para 5min, seguido por 30 ciclos de desnaturação a 94 ° C para 30s, recozendo a 53°C para 45s e extensão a 72°C para 30s, seguido por uma extensão final a 72°C a 10min, tudo em um MasterCycler personal (Eppendorf). Detecção de genes de virulência a codificação de uma protease alcalina (aprA), elastase Um (lasA), elastase (lasB),32 hemolítica fosfolipase C (plcH), não-hemolítica fosfolipase C (plcN), exotoxin Um (toxA) e alginato (algD)33 foram determinados por uniplex PCR, utilizando o seguinte protocolo: 94°C por 3 min, 30 ciclos de 94°C por 30s, 55°C por 1min e 72 para 1min e 30s e 72°C por 5min.
aderência inicial assay34
para avaliar a aderência inicial, foram adicionadas às placas de poliestireno de 96 alvéolos 200 µl de uma suspensão celular contendo 1×107 células/mL preparada em TSB. A aderência inicial foi permitida durante 2h a 37 ° C com rotação a 120rpm. As bactérias aderidas em placas de poliestireno de 96 alvéolos foram lavadas duas vezes com uma solução de NaCl a 0,9% e colhidas por sucateamento dos poços durante os anos 90. a suspensão celular obtida foi banhada em TSA para contagem de unidades formadoras de colónias (UFC). Todas as experiências foram feitas em triplicado em três experiências independentes. A estirpe ATCC15692 (PAO1) foi utilizada como controlo positivo e a TSB sem bactérias foi utilizada como controlo negativo.A formação de biofilmes assay35
200 µl de uma suspensão celular contendo 1×107 células/mL preparada em TSB foi adicionada a placas de poliestireno de 96 alvéolos. A formação de biofilmes foi permitida durante 24h a 37 ° C com rotação a 120rpm. As bactérias cultivadas em placas de poliestireno com 96 alvéolos foram lavadas duas vezes com uma solução de NaCl a 0, 9% e deixadas a secar numa posição invertida. A biomassa total foi medida por fixação de metanol (Merck), coloração de violeta de cristal (Merck) e eluição ácido acético (Merck), como descrito anteriormente. O corante eluído foi removido de cada poço e colocado em uma nova placa microtitora de 96 poços, e sua absorvância foi lida em um leitor de placas ELISA (BioTek Instruments Inc., Vermont, USA) at 570nm. Os experimentos foram feitos com oito replicados para cada estirpe em três experimentos independentes. TSB sem bactérias foi usado como um controle negativo. O valor-limite de densidade óptica (ODc) foi estabelecido como três desvios-padrão (SD) acima da média da densidade óptica (OD) do controlo negativo: ODc=média de OD do controlo negativo+3x SD do controlo negativo. Para facilitar a interpretação dos resultados, as estirpes foram divididos nas seguintes categorias, de acordo com a densidade óptica: (ODi): ODi≤ODc ou ODc
ODi2x ODc=não-biofilme produtor/fraco biofilme produtor; 2x ODcODi4x ODc=moderada biofilme produtor; 4x ODcODi=forte biofilme produtor.Concentração de células de biofilm36
a concentração de células de biofilm foi determinada pela enumeração da UFC. Após a formação do biofilme, os biofilmes foram lavados duas vezes com uma solução NaCl de 0,9% e colhidos após raspagem dos poços durante os anos 90. a suspensão celular obtida foi banhada em placas TSA. Todas as experiências foram feitas em triplicado, em três ocasiões independentes.
análise estatística
análise estatística foi realizada usando GraphPad Prism v. 5 (Software GraphPad, San Diego, CA). Ensaios quantitativos foram comparados usando o Kruskal-Wallis, aplicando o teste de comparação múltipla de Dunn. Todos os testes foram realizados com um nível de confiança de 95% e a significância estatística foi definida como p
0, 05.Aprovação ética
o Comitê de Ética em pesquisa da Universidade Federal Uberlandia avaliou e aprovou o nosso projeto de estudo.
resultados
de 1 de Maio de 2009 a 31 de dezembro de 2012, foi realizada uma vigilância hospitalar da incidência de bacteremia de P. aeruginosa no laboratório de Microbiologia do Hospital Universitário. Neste período, foram incluídos 157 doentes não repetitivos com bacteremia P. aeruginosa no estudo. As informações detalhadas sobre os factores associados ao desenvolvimento de bacteremia e as características clínicas e demográficas, bem como a distribuição dos doentes pelas enfermarias, são apresentadas nas Tabelas 1 e 2. A bacteremia primária ocorreu em 75,8% e aqueles com foco desconhecido em 62.4% dos casos. A bacteremia secundária foi responsável por 24,2% dos pacientes, onde o trato respiratório foi o foco principal da infecção (17,2%). Além disso, 43, 9% dos doentes tinham bacteremia com P. aeruginosa resistente ao carbapenem, tendo a maioria destes doentes sido admitidos na UCI. A maioria dos pacientes eram do sexo masculino (66,8%), com uma estadia média no hospital de 63,2±80,17 dias e uma idade média de 52,01±20,24 anos.
distribuição de pacientes infectados com Pseudomonas aeruginosa em diferentes unidades do Hospital Clínico da Universidade Federal de Uberlândia de Maio/2009 a dezembro/2012.
| Clínicas | > Total | Carbapenem-Pseudomonas aeruginosa resistente |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Cirurgia | 35 (22.3) | 16 (23.2) |
| clínica Médica | 24 (15.3) | 10 (14.5) |
| Oncologia | 14 (8.9) | 2 (2.9) |
| sala de Emergência | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| UTI Neonatal | 2 (1.3) | 0 |
| UTI Pediátrica | 2 (1.3) | 1 (1.5) |
| Transplante | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
unidade de cuidados Intensivos.
Burneds, unidade de dor torácica.
factores de risco associados à resistência ao carbapenem em doentes com bacteremia causada por Pseudomonas aeruginosa.
| fatores de Risco | > Total | resistente a Carbapenem | Multisensitivea | Univariada | Multivariada | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | OU (IC 95%) | p | |
| Idade média (anos) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Masculino/feminino | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| Tempo de internação, média (dias) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| unidade de cuidados Intensivos | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Cirurgia | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| procedimentos Invasivos (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Venosa cateter central | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| Cirúrgico de drenagem | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Sondas enteral/gástrico nutrição | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hemodialysis | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Parenteral nutrition | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| condições de Comorbidade | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| a insuficiência Cardíaca | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Câncer | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| insuficiência renal Crônica | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| vírus da imunodeficiência Humana | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| bacteremia Primária | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| linha Central do cateter relacionados | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Desconhecido | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Bacteremia secundária | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| aparelho Respiratório | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| do trato Urinário | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| terapia Imprópria | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| uso prévio de antibióticos | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| Mortalidade | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive cepas foram considerados como aqueles que apresentaram susceptibilidade a todos os antimicrobianos testados.
Odds ratio.
intervalo de Confiança.
valor p.
Pontuação da gravidade média da doença.
Estatisticamente significativa (P≤0,05).
O uso prévio de antibióticos (78.3%), procedimentos invasivos (88.5%), comorbidades (77.7%), e antes da cirurgia (43.9%) eram comuns. Verificou-se que 31,2% dos pacientes receberam tratamento inadequado, e a taxa de mortalidade foi de 58,6%. Vários fatores intrínsecos e extrínsecos para o desenvolvimento de bacteremia por estirpes de P. a aeruginosa resistente aos carbapenems foi detectada por análise univariada. No entanto, apenas a ventilação mecânica, tubos enterais / nasogástricos, bacteremia primária com foco desconhecido e terapêutica inadequada foram factores de risco independentemente associados ao desenvolvimento de bacteremia P. aeruginosa resistente ao carbapenem.A produção de 56 isolados de P. aeruginosa resistentes ao carbapenem foi analisada . Nove (25,0%) isolados foram fenotipicamente positivos e um total de 16,1% (n= 9/56) foram consistentes com os genes amplicons MBL, sendo 10,71% blaSPM-1 e 5.3% dos genes de blaVIM em geral, as estirpes mostraram um perfil de Resistência a várias drogas. Para outros genes de virulência avaliados (aprA, plcH, plcN, lasA, lasB, toxA e algD), todas as estirpes apresentaram uma frequência elevada (88%).Entre as 88 estirpes de P. aeruginosa susceptíveis ao carbapenem, 21 (23, 9%) eram resistentes a outras β-lactamas. 69 cepas resistentes a carbapenems, o perfil de resistência foi alta: β-lactam 50/69 (72.5%), fluoroquinolonas 48/69 (69.6%), e os aminoglicosídeos 50/69 (72.5%) (Tabela 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
além de MBL pesquisa, cinco cepas foram selecionados (dois contendo SPM-1, uma contendo o VIM, e dois fenotipicamente positivo para MBL) para a avaliação da formação de biofilme usando ensaios quantitativos de biomassa total por coloração com cristal violeta. Considerando a presença de genes MBL, todas as estirpes foram identificadas como fortemente produtores de biofilmes, com uma média de 0,90±0,61 da biomassa. Não foram observadas diferenças na aderência inicial de cada estirpe. No entanto, houve uma overdose mais baixa para a estirpe que contém o gene blaVIM(Fig. 1).
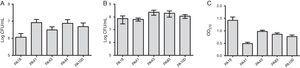
(a) número de células aderidas a uma superfície de poliestireno após 2h, expresso em log UFC/mL para 5 amostras de Pseudomonas aeruginosa isoladas a partir de sangue. B) Número de células viáveis no biofilme (log UFC/mL). C) Biomassa de biofilme expressa em densidade óptica de violeta cristal (OD570nm).
Discussão
Hospital bacteremia causada por multiresistant microorganismos, se Gram-positivos ou Gram-negativos, tem sido muitas vezes descrito como um importante problema de saúde, o que aumenta os custos hospitalares e o torna difícil estabelecer uma terapêutica antimicrobiana adequada, o que resulta em um pior prognóstico.37 a elevada proporção de bacteremia hospitalar causada por P. aeruginosa resistente aos carbapenems indica a importância deste organismo como uma causa significativa desta infecção no nosso hospital. A alta proporção de bacteremia hospitalar causada por P. aeruginosa resistente aos carbapenems indica a importância deste organismo como uma causa significativa desta infecção em nosso hospital. Os resultados de diferentes estudos têm sugerido que a intrínseca fatores de risco, tais como ventilação mecânica, uso de uma sonda nasogástrica, e uso prévio de antibióticos aumenta o risco de desenvolvimento de bacteremia causada por P. aeruginosa resistente a carbapenems, bem como o risco de morbidade e mortalidade.38
neste estudo, mais de 50% dos factores de risco foram associados à infecção por este microrganismo de acordo com a análise univariada. No entanto, apenas a ventilação mecânica, os tubos entéricos/gástricos, a bacteremia primária de origem desconhecida e o tratamento inadequado foram considerados factores de risco independentes pela análise multivariada.
um cateter venoso central é um dos factores de risco mais significativos para a bacteremia adquirida no hospital, uma vez que foi associado a mais de 90% destas infecções.Embora não tenha sido um factor de risco significativo neste estudo, 85, 5% dos doentes com bacteremia com carbapenem resistente a P. aeruginosa tiveram este procedimento invasivo.Frequentemente, a bacteremia causada por P. aeruginosa resistente aos antibióticos apresenta uma taxa de mortalidade mais elevada devido, em particular, à administração inadequada de terapia antibiótica.Neste estudo, investigámos um grupo de 157 doentes com bacteremia causada por estirpes de P. aeruginosa, dos quais 69 infectados por isolados de P. aeruginosa resistentes ao carbapenem. A mortalidade Total foi mais elevada no grupo resistente ao carbapenem; no entanto, a presença de estirpes resistentes foi significativamente associada a terapia antimicrobiana inadequada, provando que este grupo geralmente tem um prognóstico mais pobre. Tal como os nossos achados, estudos anteriores mostraram que P. aeruginosa isolada de pacientes que receberam tratamento inadequado teve um prognóstico pior, com taxas de 46, 1% 41 e 53, 8%.42
para além de estar associada a infecções graves, a resistência aos carbapenems em P. aeruginosa resulta frequentemente na produção de MBL.Os nossos resultados mostraram que o P. resistente ao carbapenem aeruginosa foi prevalente em todo o hospital com genes que codificam estas enzimas em 16, 1% das estirpes, sendo 10, 7% do genótipo blaSPM-1 e 5, 4% do genótipo blaVIM. Uma vez que a frequência das estirpes multirresistentes foi elevada, estes resultados sugerem que existem outros mecanismos de resistência nestas estirpes, tais como bombas de efluxo e Impermeabilidade da membrana.44
a prevalência de MBL como mecanismo de resistência aumentou, particularmente na América Latina.45 no Brasil, a prevalência de P. aeruginosa varia entre diferentes regiões e entre hospitais, com taxas que variam de 7,5% a 44%.11
a enzima SPM-1 é considerada a mais comum no Brasil, seguida por IMP-1,11,46 no entanto, também houve um aumento na frequência de isolados P. aeruginosa contendo enzima VIM.45,47 em nosso estudo, a enzima SPM-1 foi detectada em 16,7% das amostras fenotipicamente produtoras de MBL, seguidas pela enzima VIM, que foi detectada em 8,3% dos casos. Estes resultados indicam uma disseminação significativa de genes de codificação MBL na nossa região.
considerando a presença de produção de MBL e biofilme, 100% das estirpes foram classificadas como produtores fortes. Outro estudo no Brasil descobriu que 40% da P. aeruginosa classificada como forte produtora de biofilmes também eram produtores de MBL.Acreditamos que estes resultados são importantes uma vez que estas características (produção de biofilmes e MBL) se sobrepõem e infecções causadas por estas bactérias são difíceis de tratar. Isto é justificado, em parte, porque o crescimento de bactérias no biofilme é cerca de 64 vezes mais resistente ao antimicrobiano.48
P. aeruginosa tem um grande número de fatores de virulência extracelular que também contribuem para a patogenicidade e gravidade destas infecções, tais como a codificada por genes aprA, plcH, plcN, lasA, lasB, toxA e algD.32,33 Nossos dados mostraram que a presença de um multiresistant perfil, na maioria das cepas (88%) foram positivas para o aprA, plcH, plcN, lasA, lasB, toxA, e algD genes de virulência, exceto em uma tensão que não mostram a toxA e plcH genes, o que pode contribuir ainda mais para um pior prognóstico associado com infecções graves.
os nossos resultados confirmam resultados anteriores relativos a factores de risco para o desenvolvimento de bacteremia Resistente a P. aeruginosa carbapenem, bem como a disseminação de estirpes produtoras de MBL do tipo SPM-1. No entanto, este estudo contribui para a evidência adicional da propagação de estirpes produtoras de MBL, particularmente do tipo VIM, em estirpes altamente virulentas e em produtores fortemente de biofilmes.
conflitos de interesses
os autores não declaram conflitos de interesses.