introdução
tromboembolismo venoso (DTV), incluindo trombose venosa profunda (TVP), embolia pulmonar (EP) e trombose da veia esplâncnica, é uma complicação frequente do cancro.1 o desenvolvimento de DTV associada ao cancro está associado à redução da qualidade de vida e representa um encargo económico significativo para o doente e para o sistema de cuidados de saúde.A DTV é a segunda principal causa de morte em doentes oncológicos em ambulatório a receber quimioterapia e tem sido demonstrado ser um preditor independente da mortalidade na população de doentes com cancro.O tratamento de DTV associado ao cancro pode ser um desafio, uma vez que os riscos de DTV recorrente e de hemorragia relacionada com anticoagulantes são elevados apesar de um tratamento adequado.Além disso, as interacções medicamentosas e as co-morbilidades relacionadas com o cancro, tais como disfunção renal e/ou hepática, diminuição da ingestão oral, náuseas e vómitos induzidos pela quimioterapia, e trombocitopenia também aumentam a complexidade do tratamento, limitando a escolha do agente anticoagulante.
Ensaios Clínicos Avaliando a Heparina de Baixo Peso Molecular para o Tratamento de Câncer Associados TEV
A longo prazo da utilização de heparina de baixo peso molecular (LMWH) para o tratamento de TEV em pacientes com câncer ativo é recomendado como terapia de primeira linha, com base nos resultados de vários abrir-etiqueta de ensaios clínicos randomizados (RCTs).Os dois maiores estudos publicados até à data, os ensaios CLOT (comparação da heparina de baixo peso molecular versus a terapêutica anticoagulante Oral para a prevenção de tromboembolismo venoso recorrente em doentes com cancro) e CATCH (comparação dos tratamentos agudos na Hemostase do cancro), compararam uma terapêutica LMWH com a terapêutica antagonista da vitamina K em doentes com cancro activo e TVP proximal aguda sintomática ou EP. Ver Tabela 1 para as características basais e Tabela 2 para os resultados do estudo.8,9 ambos os ensaios utilizaram um desenho de estudo aberto, o mesmo rácio normalizado internacional alvo (INR) no braço de controlo dos antagonistas da vitamina K, a mesma definição de cancro activo e a mesma duração do tratamento e tinham critérios de elegibilidade comparáveis para os doentes.
Tabela 1: concepção do estudo e características de base dos ensaios de captura e coágulos
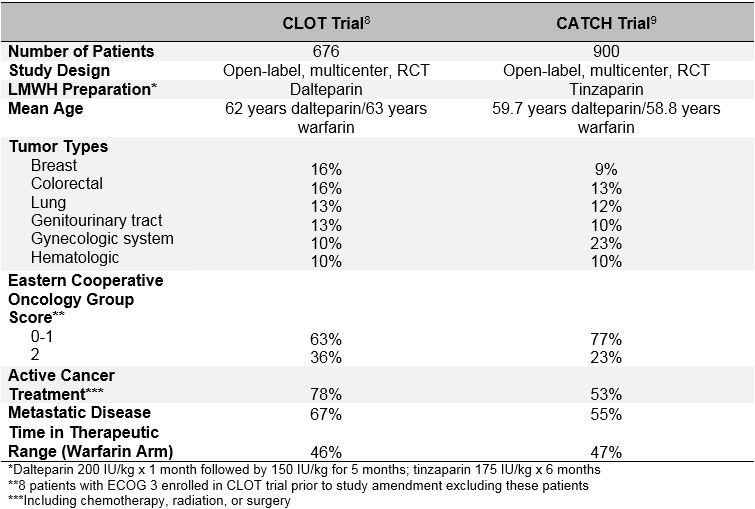
Quadro 2: Resultados do COÁGULO e PEGAR Ensaios

O COÁGULO de avaliação, publicado em 2003, randomizado 676 pacientes para receber dalteparina (200 UI/kg por dia durante 1 mês seguido por 150 UI/kg ao dia, durante 5 meses) ou antagonista da vitamina K (varfarina ou acenocoumarol com INR alvo de 2,5 para um total de 6 meses, com uma primeira 5-7 dias sobreposição com dalteparina 200 UI/kg).Foi observada TVP sintomática recorrente ou EP, incluindo morte relacionada com EP, em 27 doentes (7, 0%) aleatorizados para dalteparina e em 53 doentes (15%) antagonistas da vitamina K (taxa de risco 0, 48; Intervalo de confiança de 95%, 0, 30-0, 77; p = 0, 002). Não foram observadas diferenças nas taxas de hemorragia major (6 vs. 4%; p = 0, 27), qualquer hemorragia (15 vs. 19%; p = 0, 09) ou morte (39 vs. 41%; p = 0, 53) entre os 2 grupos.
no ensaio CATCH, publicado mais de 10 anos mais tarde em 2015, 900 doentes foram aleatorizados para tinzaparina (175 UI/kg por dia sem redução da dose) ou varfarina (INR alvo 2, 0-3, 0 com sobreposição inicial de tinzaparina 175 UI/kg durante 5-10 dias) durante um total de 6 meses.9 O principal composto de ponto de extremidade de TEV recorrente, incluindo incidentais TVP proximal e PE ocorreu em 31 pacientes (6.9%) no tinzaparin braço e 45 pacientes (10%) no varfarina braço de RH (DE 0,65; IC 95%, de 0,41-de 1,03; p = 0,07). Ocorreu TVP sintomática em significativamente menos doentes tratados com tinzaparina (2, 7 vs. 5, 3%; HR 0, 48; IC 95%, 0, 24-0, 96; p = 0, 04). Apesar de sangramento importante taxas foram semelhantes em ambos os braços, uma redução significativa clinicamente relevantes, não-sangramento importante foi observado com tinzaparin (10.9 vs. 15.3%; HR 0.58; 95% CI, 0.40-0.84; p = 0,004). A mortalidade foi semelhante em ambos os grupos, com aproximadamente um terço dos pacientes que morrem durante o período de estudo (33.4 vs. 30.6%; p = 0,54). Embora tinzaparin não reduzir significativamente o principal composto de ponto de extremidade de TEV recorrente, a PEGAR os resultados do estudo dão suporte a uso de longo prazo LMWH como o tratamento preferencial para o câncer de TEV associada devido a um menor risco de clinicamente relevantes, principais sangramento e uma redução significativa na TVP recorrente.
a incapacidade do ensaio de captura para cumprir a significância estatística para o objectivo primário pode ser devida à taxa recorrente de TEV mais baixa do que o esperado observada no braço da varfarina. Uma possível explicação para esta observação pode ser uma melhoria no tratamento da varfarina no ensaio de captura. No entanto, níveis semelhantes de controlo INR em ambos os estudos argumentam contra este facto (o tempo no intervalo terapêutico foi de 46% no coágulo vs. 47% nas capturas; o tempo acima do intervalo terapêutico foi de 24% no coágulo vs. 27% nas capturas). Uma explicação mais provável é um viés na seleção de pacientes “menos doentes” para a inscrição no teste CATCH. Embora os estudos sobre capturas e coágulos tenham utilizado critérios de inclusão e exclusão semelhantes, existem diferenças fundamentais nas características basais entre as duas populações de doentes, particularmente no que diz respeito a factores de risco trombóticos e prognósticos. Uma proporção mais elevada de doentes no ensaio CLOT estavam a receber tratamento do cancro activo (72% CLOT vs. 53% CATCH), tinham antecedentes de DTV anterior (11% CLOT vs. 6% CATCH), tinham evidência de doença metastática (67% CLOT vs. 55%), e teve um estado de desempenho inferior (pontuação do grupo de oncologia da Cooperativa Oriental de 2 em 36% de coágulos Versus 23% de capturas). Além disso, a mortalidade durante o período de tratamento de 6 meses foi também mais elevada na população de coágulos (39% de coágulos vs. 32% de capturas). Assim, é provável que a população de doentes tratados com CATCH tenha tido um risco inerente menor de DTV recorrente em comparação com os doentes tratados com CLOT. É altamente provável que os investigadores não matricularam pacientes em CATCH se eles sentiram LMWH seria mais benéfico do que varfarina, resultando no registro seletivo de pacientes que eram menos propensos a desenvolver VTE recorrente.
os ensaios que avaliaram os anticoagulantes orais directos em DTV associados ao cancro
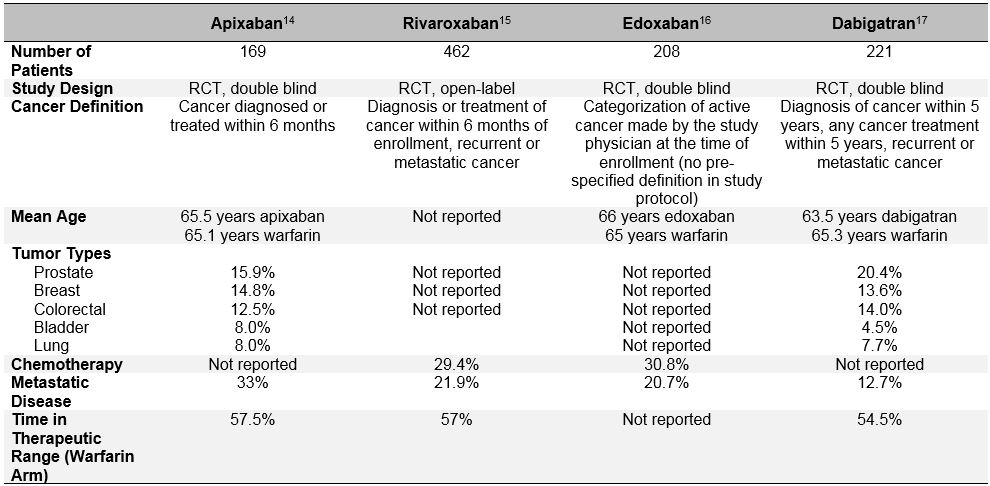
a viés de Selecção do doente é ainda mais evidente nos ensaios aleatorizados recentes que avaliaram a eficácia e a segurança dos anticoagulantes orais directos (DOACs) para o tratamento de DTV aguda.Estes anticoagulantes orais foram extensivamente estudados ao longo da última década em fibrilhação auricular, tratamento com TEV e prevenção de TEV. Nos ensaios clínicos de fase III de referência para o tratamento agudo da DTV, foi demonstrado consistentemente que os DOACs não são inferiores à varfarina (risco relativo agregado 0, 90; IC 95%, 0, 77-1.06) na prevenção da DTV recorrente, e apresentam um risco semelhante ou reduzido de hemorragia major (RR comum 0, 40; IC de 95%, 0, 45-0, 83).Entre os pacientes que foram classificados como tendo “câncer” ou “câncer ativo” nestes estudos, o DOACs também parece ter um desempenho semelhante à varfarina.12 mas um exame mais aprofundado destes dados post-hoc revela um importante viés de seleção de pacientes e questiona a generalização dos resultados do estudo DOAC para pacientes “da vida real” com câncer com TEV. Para além das definições heterogéneas de “cancro activo” utilizadas nestes ensaios que diferiam dos ensaios de coágulos e de captura, os determinantes importantes da DTV recorrente e da hemorragia foram também muito diferentes nos doentes com cancro da DOAC dos ensaios específicos do cancro da LMWH (Tabela 3). Estes incluem a presença de doença metastática e o uso concomitante de terapêutica anticancerosa. As grandes diferenças na mortalidade durante o período de estudo também argumentam que grupos muito diferentes de pacientes com “câncer” foram incluídos nos ensaios DOAC versus LMWH. Além disso, ao contrário da LMWH, que está associada a uma redução significativa do risco de DTV recorrente em comparação com antagonistas da vitamina K (RR 0, 52; IC 95%, 0, 36-0.74), DOACs não reduzir significativamente este risco em uma meta-análise de 1,132 pacientes com câncer matriculados no EINSTEIN clínico do programa de avaliação, HOKUSAI VTE (o edoxaban Versus Varfarina para o Tratamento Sintomático de Tromboembolismo Venoso), RECUPERAR (Eficácia e a Segurança da Dabigatrana Comparado à Varfarina para 6 Meses de Tratamento Agudo Sintomático Tromboembolismo Venoso), e AMPLIFICAR (Apixaban para o tratamento Inicial da Embolia Pulmonar e Profunda, Trombose de Veia como Terapia de Primeira Linha) RCTs (RR DE 0,66; IC 95%, 0.39-1.11).Todas estas considerações devem ter precaução na utilização não seleccionada de DOACs em doentes com cancro activo e DTV aguda e sintomática.13
Tabela 3: Desenho do Estudo de linha de Base e as Características dos Subgrupos de Pacientes Com Câncer De Fase III DOAC Ensaios
Conclusões
Todos os principais evidências baseadas em consensos e diretrizes recomendam LMWH para o inicial e o tratamento de longo prazo associada a câncer TEV.6,7,13 Esta recomendação é baseada na observação de que LMWH não só é mais eficaz do que a varfarina na prevenção de TEV recorrente, mas também oferece vantagens adicionais em relação oral agentes, incluindo estável anticoagulação em pacientes com baixa ingestão oral, a falta de interações medicamentosas, a experiência clínica e na gestão de anticoagulação torno de procedimentos invasivos e trombocitopenia. Embora os DOACs não sejam actualmente recomendados para o tratamento da DTV em doentes com cancro, os RCTs que comparam o rivaroxabano e o edoxabano com LMWH estão actualmente em curso e irão ajudar a clarificar o seu papel na DTV associada ao cancro.6,13
- Khorana AA, Dalal M, Lin J, Connolly GC. Incidência e preditores de tromboembolismo venoso (TEV) entre doentes oncológicos de alto risco ambulatório submetidos a quimioterapia nos Estados Unidos. Cancer 2013; 119: 648-55.
- Kourlaba G, Relakis J, Mylonas C, et al. Carga humanística e económica do tromboembolismo venoso em doentes oncológicos: uma revisão sistemática. Blood Coagulul Fibrinolysis 2015; 26: 13-31.
- Kuderer NM, Ortel TL, Francis CW. Impacto do tromboembolismo venoso e anticoagulação na sobrevivência do cancro e do cancro. J Clin Oncol 2009; 27: 4902-11.
- Khorana AA, Francis CW, Culakova e, Kuderer NM, Lyman GH. O tromboembolismo é uma das principais causas de morte em doentes oncológicos submetidos a quimioterapia ambulatorial. J Thromb Haemost 2007; 5: 632-4.
- Prandoni P, Lensing AW, Piccioli A, et al. Tromboembolismo venoso recorrente e complicações hemorrágicas durante o tratamento anticoagulante em doentes com cancro e trombose venosa. Blood 2002; 100: 3484-8.
- Lyman GH, Bohlke K, Khorana AA, et al. Profilaxia e tratamento de tromboembolismo venoso em doentes com cancro: american society of clinical oncology clinical practice guideline update 2014. J Clin Oncol 2015; 33: 654-6.
- Streiff MB, Holmstrom B, Ashrani A, et al. Doença Tromboembólica Venosa Associada Ao Cancro, Versão 1.2015. J Natl Compr Canc Netw 2015; 13: 1079-95.
- Lee AY, Levine MN, Baker RI, et al. Heparina de baixo peso molecular versus cumarina na prevenção de tromboembolismo venoso recorrente em doentes com cancro. N Engl J Med 2003; 349: 146-53.
- Lee AY, Kamphuisen PW, Meyer G, et al. Tinzaparina vs varfarina para Tratamento de tromboembolismo venoso agudo em doentes com cancro activo: um ensaio clínico aleatorizado. JAMA 2015; 314:677-86. Carrier m, Cameron C, Delluc A, Castellucci L, Khorana AA, Lee AY. Eficácia e segurança da terapêutica anticoagulante para o tratamento de trombose aguda associada ao cancro: uma revisão sistemática e meta-análise. Thromb Res 2014; 134: 1214-9.
- van Es N, Coppens M, Schulman S, Middeldorp s, Büller H. anticoagulantes orais directos em comparação com antagonistas da vitamina K para tromboembolismo venoso agudo: evidência de ensaios de Fase 3. Blood 2014; 124:1968-75.
- Vedovati MC, Germini F, Agnelli G, Becattini C. anticoagulantes orais directos em doentes com TEV e cancro: uma revisão sistemática e meta-análise. Chest 2015; 147: 475-83.
- Kearon C, Akl EA, Ornelas J, et al. Terapêutica antitrombótica para a doença DTV: Orientação torácica e relatório do Painel de peritos. Chest 2016; 149:315-52.
- Agnelli G, Büller HR, Cohen a, et al. Apixabano Oral para o tratamento de tromboembolismo venoso em doentes oncológicos: resultados do ensaio amplificado. J Thromb Haemost 2015; 13:2187-91.
- Prins MH, Lensing AW, Brighton TA, et al. Rivaroxabano Oral versus enoxaparina com antagonista da vitamina K para o tratamento de tromboembolismo venoso sintomático em doentes com cancro (EINSTEIN-TVP e EINSTEIN-PE): uma análise agrupada de dois ensaios controlados aleatorizados. Lancet Haematol 2014; 1: e37-46.
- Raskob GE, van Es N, Segers A, et al. Edoxabano para tromboembolismo venoso em doentes com cancro: resultados de uma análise de subgrupo de não inferioridade do ensaio aleatorizado, em dupla ocultação, duplo-simulado Hokusai-VTE. Lancet Haematol 2016; 3:e379-87. Schulman S, Goldhaber SZ, Kearon C, et al. Tratamento com dabigatrano ou varfarina em doentes com tromboembolismo venoso e cancro. Thromb Haemost 2015; 114: 150-7.
tópicos clínicos: Anticoagulation Management, Arrhythmias and Clinical EP, Cardio-Oncology, Pulmonary Hypertension and Venous Thromboembolism, Anticoagulation Management and Atrial Fibrillation, Anticoagulation Management and Venothromboembolism, Atrial Fibrillation/Supraventricular Arrhythmias
Keywords: Cardiotoxins, Cardiotoxicity, Heparina de Baixo Peso Molecular, Varfarina, Anticoagulantes, Razão Normalizada Internacional, Acenocoumarol, Dalteparina, Antithrombins, Tromboembolismo Venoso, Fatores de Risco, Fibrilação Atrial, em Ambulatório, Investigação Pessoal, Qualidade de Vida, Pyridones, Pirazóis, Pyridines, Thiazoles, Trombose Venosa, Embolia Pulmonar, Trombose, Trombocitopenia, Comorbidade, Hemostasia, Neoplasias
< de Volta para Listagens