- Introduction
- 結果
- DBH-CreドライバマークとCNO投与によって阻害される脳幹のTH発現ノルアドレナリン作動性領域に限定されている
- 成体マウスにおけるノルアドレナリン作動性ニューロンのCNO-hm4d媒介摂動
- CNO-hm4d DBH-Creニューロンの摂動は、Dbh-Cre;RCの三つの条件の下でHypercapnic欠損をもたらす
- 10mg/kg CNOを注入した兄弟対照は、両方のDBH-Cre;RCでHypercapnic Ventilatory欠損
- 生理食塩水を注入した常習野生型動物と未生存野生型動物は、プレサリンとポストサリンの変化を示さなかった
- クロザピンとCNOの濃度比は、血清中よりも脳内で高い
- ディスカッション
- 材料および方法
- 倫理的承認
- マウスの繁殖、遺伝的背景、および維持
- 組織学
- Plethysmography
- 液体クロマトグラフィー-質量分析
- データ収集と分析
- プレチスモグラフィー
- 統計
- プレチスモグラフィー
- 液体クロマトグラフィー-質量分析
- 倫理声明
- 著者の貢献
- 資金調達
- 利益相反声明
- 謝辞
Introduction
呼吸器化学感覚反射の根底にあるニューラルネットワークは、いくつかの行動および生理学的障害の病因を理解するための主要なターゲットである。 摂動化学感覚反射は、乳幼児突然死症候群(SIDS)、先天性中枢性低換気症候群(CCHS)、中枢性睡眠無呼吸症、Rett症候群における異常呼吸、および肥満低換気症候群(obonai e t a l. ら,1 9 9 8;Ozaza e t a l. ら、2 0 0 3;Amiel e t a l. ら、2 0 0 9;Ramanantsoa e t a l. ら、2 0 1 1;Lavezzi e t a l., 2013). 偽窒息警報仮説の下では、不適切な化学感覚活性化または過敏症は、パニック障害に罹患している患者のサブセットにおいて役割を果たすと考えら 化学感覚機能障害はまた、進行の加速に関連する睡眠呼吸障害を介した神経変性疾患においても役割を果たし得る(Hakim e t a l. ることができると考えられている。, 2017). したがって、脳幹化学感覚ネットワークのより良い理解は、行動や生理学的病理の数に重要な手がかりを提供します。
デザイナードラッグ(DREADDs)によって排他的に活性化された薬理遺伝学的デザイナー受容体(Armbruster et al. ら、2007)は、呼吸器化学反射(上昇した血液CO2レベルに対する呼吸応答)における神経集団をマッピングするために多くの研究に採用されている。 交差遺伝的展開と組み合わせたDREADD技術は、以前の回路マッピングアプローチからの多くの混乱を回避し、私たちの研究室や他の人によって意識し、無制限のマウスで呼吸機能を観察しながら、高度に標的化された神経集団を沈黙させるために利用されている(Ray et al. ら,2 0 1 1,2 0 1 3;Brust e t a l. ら、2 0 1 4;Hennessy e t a l. ら,2 0 1 7;Sun and Ray,2 0 1 7;Sun e t a l., 2017). これらおよび他のほとんどの研究は、ほとんど常にCNOが使用された高用量、10mg/kgにもかかわらず、意識と無制限のマウスで呼吸にオフターゲット効果をもたなかったと主張し、化学感覚または他の呼吸効果を示さなかった非DREADD発現兄弟コントロールのみを含んでいた。 それにもかかわらず、いくつかの他の研究において、CNOおよびその背部代謝産物は、種々のアッセイにおいて行動および歩行に対して標的外の効果を有 ら,2 0 0 9;Joober,2 0 1 0;Maclaren e t a l. ら,2 0 1 6;Gomezら,2 0 1 6;Gomezら, ら、2 0 1 7;Ilg e t a l. ら、2 0 1 8;MahlerおよびAston−Jones、2 0 1 8;Manvichら、2 0 1 8;Manvichら、2 0 1 9。 ることができます。 また、CNOおよびその代謝産物は、循環系と脳との間に同等に分布していないことが示された(Gomez e t a l., 2017).
第二に、対処されていない懸念は、全身気圧plethysmographyチャンバー内の動物を保持し、ハンドリング、腹膜内注射、および直腸温度測定を含む実験パラダイムによっ 以前のDREADD呼吸試験では、ナイーブマウスを小さなチャンバ(1 4 0〜4 0 0mls)に導入し、データ取得の2 0〜4 0分前に順応させた(Ray e t a l. ら,2 0 1 1,2 0 1 3;Brust e t a l. ら、2 0 1 4;Hennessy e t a l. ら,2 0 1 7;Sun and Ray,2 0 1 7;Sun e t a l., 2017). しかし、この時間が、クロザピンの効果と相互作用する因子として作用する可能性のあるストレス誘発呼吸変化を最小限に抑えるのに十分であるかどうかは明らかではない。
私たちの研究では、呼吸制御におけるノルアドレナリン作動性(NA)システムの役割を調べるために、我々は十分に確立されたRCを採用しようとしました::P_hm4d DREADD対立遺伝子(Ray e t a l.,2011)全身プレチスモグラフィーを用いて、無制限の成体動物におけるベースラインおよびhypercapnic呼吸におけるNAニューロンの役割をテストします。 ノルアドレナリンおよびN aニューロンは、ストレス応答において中心的な役割を果たすことも知られているので(Valentino and Van Bockstaele,2 0 0 8;Chen e t a l.、2018)、我々は、広範な慣れ(動物が経験が非脅威または生存可能であることを学習する実験パラダイムへの多重曝露)と高対を比較するための一連の研究を行 以前に公開されたDREADDプロトコルを用いた低(1mg/kg)CNO用量(Ray e t a l. ら,2 0 1 1,2 0 1 3;Brust e t a l. ら、2 0 1 4;Hennessy e t a l. ら,2 0 1 7;Sun and Ray,2 0 1 7;Sun e t a l., 2017). ここでは、CNOの高全身用量が意識マウスの自律呼吸機能にオフターゲット効果を引き出すことができることを初めて示しています。 我々はまた、化学感覚呼吸出力に対するCNOのオフターゲット効果が効果的に広範な慣れによってマスクされていないため、データ収集の前に短い順化期間 一緒に、これらの結果は、以前にマップされた神経集団が間接的にストレス応答の調節における潜在的な役割を介して呼吸制御に影響を与える 特に、これらのデータは、CNOがクロザピンへの代謝変換を介して高用量で生物学的に不活性ではないことを示唆する最近の報告と一致する(Maclaren e t a l. ら,2 0 1 6;Gomezら,2 0 1 6;Gomezら, そして、オフターゲットの行動効果は、行動回路の摂動だけでなく、根底にある自律神経回路および恒常性への混乱からも現れる可能性がある。
結果
DBH-CreドライバマークとCNO投与によって阻害される脳幹のTH発現ノルアドレナリン作動性領域に限定されている
DBH-Creラインの発現と特異性を調べるために、我々はAi9ラインにドライバを交差させた単一のリコンビナーゼ育種スキーム(図1A)を使用した(Madisen et al.,2010),これは、floxed tdTomatoを表現します. チロシンヒドロキシラーゼ(TH)抗体を用いた染色により、脳幹におけるtdTomatoの発現は、予想通り、コエルレウス座、a5、A1、A2、A7、SubCV、およびSubCD核を含むTH発現領域に限定されることが明らかになった(図1B)。 Hm4d受容体を発現するNAニューロンがCNOに応答していたことを確認するために、我々はCNO浴アプリケーション(n=3、図1C)にニューロンの発射の阻害を観察
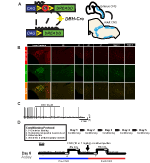
図1. 繁殖形態は胎生。 RCは::P_hm4d対立遺伝子は、ドーパミン-β-ヒドロキシラーゼ(DBH)-Creラインと組み合わせて、ノルアドレナリン作動性(NA)ニューロン(A)におけるhm4d受容体の細胞特異的 DBH-CreにおけるtdTomatoの蛍光発現;Ai9冠状脳切片は、脳幹NA核(B)におけるチロシンヒドロキシラーゼ(TH)と共発現する。 CNOアプリケーションの前と後のNA遺伝子座coeruleusのスライス記録では、ターゲットニューロン(C)におけるDREADD受容体機能を実証しています。 呼吸プロトコル。 馴化マウスは、取り扱い、直腸プローブ温度測定、生理食塩水注入、およびplethysmographyチャンバへの暴露からなる5日間の馴化プロトコルに供されます。 第六日目に、動物が呼吸室に置かれ、ベースライン部屋の空気条件の下で順化することを許可されるhypercapnic試金の下の習慣化された、そしてunhabituatedマウス両方。 次いで、動物を2 0分間の5%CO2に曝露し、続いて2 0分間の室内空気に曝露する。 次いで、動物にCNOまたは生理食塩水を腹腔内に注入し、続いてさらに2 0分間の注射後室内空気、2 0分間の5%CO2、および2 0分間の室内空気を注入する。 開いているボックスは、データ収集時間(D)を示します。
成体マウスにおけるノルアドレナリン作動性ニューロンのCNO-hm4d媒介摂動
ベースラインとhypercapnic呼吸の下でNAニューロンの役割を調べるために、我々はRCを採用した:P_Hm4D阻害DREADDシステムは、DBH-Creドライバと交差した。 全身プレチスモグラフィーを用いた(Ray e t a l. CNO投与前後の室内空気(2 1%O2/7 9%N2)および高炭酸ガス(5%CO2/2 1%O2/7 4%N2)条件下での無制限成体動物の換気反応を測定した(図1D)。 我々の実験設計によって誘発されるCNO投与および潜在的ストレスに対処するために、動物は4つの条件の1つに供された:(1)未生存および10mg/kgのCNOを注入、(2)10mg/kgのCNOを習慣化および注入、(3)未生存および1mg/kgのCNOを注入、または(4)1mg/kgのCNOを習慣化および注入した。 慣れは、取り扱い、直腸温度プローブ、生理食塩水注入、およびplethysmographyチャンバーへの毎日の30分間の暴露を伴う5日間のプロセスから成っていたが、ナイーブ動物は、以前の研究で行われたように、データ収集の直前に20-45分のチャンバー順化期間にのみ暴露された(Ray et al. ら,2 0 1 1,2 0 1 3;Brust e t a l. ら、2 0 1 4;Hennessy e t a l. ら,2 0 1 7;Sun and Ray,2 0 1 7;Sun e t a l., 2017). 測定された呼吸パラメータは、呼吸速度RR、一回換気量(VT)、分換気(VE)、酸素消費量(VO2)、酸素消費量(VE/VO2)、無呼吸周波数、ため息周波数、およびbreath間間隔と振幅(周期的およ 追加の対照として、本発明者らはまた、生理食塩水を注射した常習化野生型動物および未生息化野生型動物を比較した。
CNO-hm4d DBH-Creニューロンの摂動は、Dbh-Cre;RCの三つの条件の下でHypercapnic欠損をもたらす
::P_hm4d動物は、CNO投与後のVEおよびVE/VO2の減少を示したが、兄弟対照は、cno前および後の値に差を示さなかった。 10mg/kgのCNOを注射した未生存動物は、RR(-12.17%、p=0.034)およびVT(-30.87%、p=0.0016)が有意に減少し、VE(-38.64%、p=0.0031)が減少し、VO2(-14.25%、p=0.042)がわずかに減少した(図2)。 VEの減少は、VE/VO2の全体的な減少(-26.89%、p=0.0095)で、その結果、VO2の減少よりも大きかった。 1mg/kgのCNOを注射した未生存動物は、rrが減少し(-12.88%、p=0.066)、VTが有意に減少し(-16.52%、p=0.00085)、VEが有意に減少し(-28.08%、p=0.0070)、VE/VO2が全体的に減少した(-22.23%、p=0.016)(図3)。 最後に、1mg/kgのCNOを注入した常習動物は、RRの減少(-10.77%、p=0.074)、VEの減少傾向(-25.07%、p=0.074)、および全体的なVE/VO2の減少(-23.70%、p=0.024)を示した(図4)。 無呼吸頻度,ため息頻度,周期的または体積不安定性,または温度の有意な変化はいずれのコホートでも見られなかった。
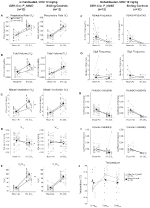
図2. 10mg/kgのCNOを投与したRC::P_Hm4d動物は、高capnic欠損を示し、一方、兄弟対照は変化を示さない。 CNO投与後、DBH-Cre;RC::P_hm4d動物は無呼吸の頻度(F)、ため息の頻度(G)、周期的な(H)または容積の不安定性(I)、および温度(J)の変更無しのhypercapnic条件の下で部屋の空気換気およびrr(A)、VT(B)、VE(C)、VO2(D)、およ 兄弟対照は、すべての前および後のCNO値に差を示さなかった。
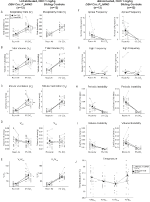
図3. 生存していないDBH-Cre;RC::P_Hm4d1mg/kgのCNOを投与した動物は、高capnic欠損を示し、一方、兄弟対照は変化を示さない。 CNO投与後、DBH-Cre;RC::P_hm4d動物は、室内空気換気またはRR(A)の有意な変化を示さず、VT(B)、VE(C)、およびVE/VO2(E)vo2(D)、無呼吸頻度(F)、ため息周波数(G)、周期的(H)または体積不安定性(I)、およ 兄弟対照は、すべての前および後のCNO値に差を示さなかった。
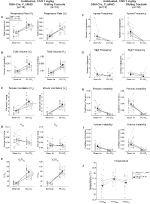
図4. 習慣化されたDBH-Cre;RC::P_Hm4d1mg/kgのCNOを投与された動物は、hypercapnic欠損を示し、兄弟対照は変化を示さない。 CNO投与後、DBH-Cre; RC::P_Hm4d動物は、部屋の空気換気の変化とRR(A)とVE/VO2(E)vt(B)、VE(C)、VO2(D)、無呼吸周波数(F)、ため息周波数(G)、周期的(H)またはボリューム不安定性(I)、および温度(J) 兄弟対照は、すべての前および後のCNO値に差を示さなかった。
10mg/kg CNOを注入した兄弟対照は、両方のDBH-Cre;RCでHypercapnic Ventilatory欠損
を示した。::P_HM4Dおよび10mg/kgのCNOを注射した兄弟対照常習動物では、RR(p=0.00036)およびVE(p=0.037)の減少によって媒介されるVE/VO2(p=0.0235)の有意な減少を認めた(図5)。 しかし、他のコホートとは異なり、DBH-Cre;RC::P_Hm4Dと兄弟対照動物の間に差はなかった:RR(-12.72対-10.22%、p=0.6268)、VE(-24.88対-23.94%、p=0.4150)、またはVE/VO2(-15.4対-22.55%、p=0.4643)。
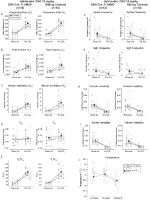
図5. 両方の習慣化されたDBH-Cre;RC::10mg/kgのCNOを投与したp_HM4D動物および兄弟対照は、高capnic欠損を示す。 CNO投与後、DBH-Cre;RC::P_Hm4D動物および兄弟コントロールは、vt(B)、VO2(D)、無呼吸頻度(F)、ため息周波数(G)、周期的(H)または体積不安定性(I)、および温度(J)の有意な変化
生理食塩水を注入した常習野生型動物と未生存野生型動物は、プレサリンとポストサリンの変化を示さなかった
1mg/kgのCNOを注入した対照では表現型は観察されなかったが、生理食塩水を注入した常習野生型動物と未生存野生型動物を試験することにより、10mg/kgのCNOを注入した対照では、注射自体が表現型を引き起こした可能性に対処した(図6)。 習慣化コホートと未生存コホートの両方で、動物はプレサリン投与とポストサリン投与の呼吸パラメータに差を示さなかった。 無呼吸頻度,ため息頻度,周期的または体積不安定性,または温度に有意な変化は見られなかった。
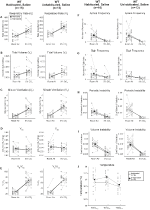
図6. 生理食塩水を投与した未生存および常習野生型動物の両方は、注射前および注射後の値の間に差を示さない。 生理食塩水投与後、未生息および常習野生型動物の両方は、RR(A)、VT(B)、VE(C)、VO2(D)、VE/VO2(E)、無呼吸頻度(F)、ため息周波数(G)、周期的(H)または体積不安定性(I)、およ
クロザピンとCNOの濃度比は、血清中よりも脳内で高い
CNOとクロザピンの生物学的利用能を決定するために、我々は質量分析を介して血清と脳 0.1mg/kg(血清p=0.0054、脳p=0.0001)(図7A)、1mg/kg(血清P>0.05、脳p=0.0197)(図7B)、および10mg/kg(血清p=0.0054、脳p=0.0001)(図7B)において、CNOは、血清および脳中の後代謝物クロザピンと比較して相対的存在量が低いことが見出される。0.0036、脳p=0。0005)(図7C)。 全体的なクロザピン対CNO比を分析したとき、それらは常にゼロを上回り、血清よりも脳で高かった(ビヒクルp>0.5、0.1mg/kg p>0.5、1mg/kg p=0.0018、10mg/kg p=0.0160)(図7D)。
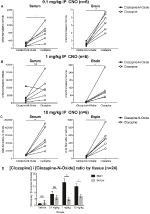
図7. CNO濃度比に対するクロザピンは血清中よりも脳内で高い。 血清および脳試料を、CNO投与の30分後に野生型マウスから、3つの異なる用量0.1mg/kg(A)、1mg/kg(B)、10mg/kg(C)で収集した。 個々のデータポイントは、LC−MSによって得られたクロザピン−N−酸化物またはクロザピンの相対的存在量を表す。
ディスカッション
この研究の最初の目標は、無制限で意識的な成体動物における急性摂動後の呼吸生理学におけるDBH-Creニューロンの役割を調 ノルアドレナリンおよびN aニューロンは、ストレス行動において十分に文書化された役割を果たすので(Valentino and Van Bockstaele,2 0 0 8;Chen e t a l.、2018)、我々はまた、ストレスの多い生理学的プロトコルへの慣れが以前に観察された呼吸表現型に影響を与えるかどうかを検討しようとした。 私達の実験室および他で使用される全身のplethysmography DREADDの議定書では動物は扱われ、直腸に温度のために調査され、新しい環境(plethysmographyの部屋)に露出され、そして腹腔内 以前の研究は、注射および他の「日常的な」手順への取り扱いおよび慣れが、呼吸を含む行動および生理学的パラメータを変更できることを示している(Misslin et al., 1982; AndrewsおよびFile,1 9 9 3;Lapin,1 9 9 5;Ryabinin e t a l., 1999). 他の適用されたストレッサーはまた、ベースラインおよびhypercapnic換気条件下の両方で呼吸を改変する(IsomおよびElshowihy、1982;Kinkead et al., 2001).
高用量のCNOを利用した研究では、DBH-Creで定義されたNAニューロンのhm4dを介した阻害は、RR、VT、およびVEを減少させた四つの定義された実験コホートでVE/VO2のhypercapnic反射を減少させ、以前の研究を支持することを見出した(Biancardi et al. ら,2 0 0 8;Viemari,2 0 0 8;Gargaglioni e t a l., 2010). しかし、以前の呼吸研究で使用されたCNOの10mg/kg用量を与えられた習慣化された兄弟対照は、DBH-Cre;RC::P_Hm4d動物で見られるのと同じ大きさのhypercapnic条件下 他の兄弟対照群はこの表現型を示さず、(1mg/kg CNO)または生理食塩水のみを受けた習慣化コホートを含む。 これらの結果は、より高いCNO用量(10mg/kg)は、おそらく動物のストレスレベルを減少させながら、広範な慣れの後にマスクされていないhypercapnic応答に影響を与え、低CNO用量は、馴化動物の呼吸制御に影響を与えないことを示唆している。 これらの成果はまた、Korsak et al.の研究と一致しています。 whoは、低用量CNO(2mg/kg)が、以前の訓練を含む運動アッセイにおいて、作業能力においてオフターゲット効果を生じないことを実証した(Korsak e t a l. ら、2 0 1 8)およびFleury Curado e t a l. whoは、呼吸出力に対する低用量CNO(1mg/kg)特異的効果を示さなかった(Fleury Curado e t a l., 2018).
血清中および脳内のクロザピンとCNOレベルの比率の増加(図7)は、CNOがクロザピンに容易に代謝され、マウスおよび他の場所でCNOと比較して脳透過性が高いことを示唆している最近の研究と一致している(Jann et al. ら、1 9 9 4;Chang e t a l. ら、1 9 9 8;Guettier e t a l. ら、2 0 0 9;Gomez e t a l. ら、2 0 1 7;Raper e t a l., 2017). しかし、観察されたオフターゲット効果がCNOまたはクロザピンによるものであるかどうかは明らかではない。 我々のhypercapnic測定は、CNOアプリケーションの後に<30分発生したように、オフターゲット呼吸効果はクロザピンによって媒介される可能性があります。 我々の結果(図7)は、CNOが完全に存在しないわけではないが、脳内のクロザピンの高い相対レベルを示している。 しかし、hucksteppらは、麻酔ラットの腹側髄質への直接CNO適用を用いて、高炭酸血症または低酸素負荷下ではなく、室内空気中でのみCNO適用がわずかな効果、頻度の増加、呼気持続時間の減少を示すが、VTは変化せず、高炭酸血症の間には明らかな効果は観察されないことを実証した(Huckstepp et al., 2015). 麻酔ラットおよび実験の時間枠での直接適用を考えると、見られる小さなオフターゲット効果は、クロザピンによってではなく、CNOによって媒介された
バック代謝産物クロザピンは、d1、D2、およびD4ドーパミン作動性受容体、5-HT2A、5-HT2C、5-HT3、5-HT6、および5-HT7セロトニン作動性受容体、H1ヒスタミン受容体、およびα1およびα2アドレナリン作動性受容体における低高親和性拮抗作用を含む、多くの内因性標的を有する統合失調症において一般的に使用される鎮静剤および抗精神病薬である(フィトンおよびヒール、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体、ヒスタミン受容体およびWang,1 9 9 6)。 ここで見られるオフターゲット効果は、別個のまたは組み合わせたメカニズムとターゲットに起因する可能性があります。 クロザピンは鎮静剤として呼吸に影響を与える可能性があります。 以前の研究では、マウスの静かな覚醒状態と比較して、遅波睡眠および急速眼球運動睡眠状態の両方の間に、5および10%のCO2下でRRおよびVTが減少した(Nakamura et al., 2007). また、標的DREADD発現ニューロンの阻害は、CNO/クロザピンを介した化学感覚オフターゲット効果を明らかにするために私たちの慣れプロトコルと同様の抗anxiogenicまたは抗不安効果をもたらす可能性があります。 両方の説明は、co2が生得的および学習された恐怖反応および不安関連行動において役割を果たすことを示したいくつかの研究によって支持され ら、2 0 0 9;Feinstein e t a l. ら、2 0 1 3;Taugher e t a l. ら、2 0 1 4;Dlouhy e t a l. 2015年、Winter et al., 2017). したがって、これらの研究のいくつかで標的とされるニューロンは、カテコールアミン作動性およびセロトニン作動性システムの両方が恐怖/不安行動およ ら、2 0 1 4;Hennessy e t a l., 2017).
対照群はCNO効果を示さなかったが、我々は、cno用量でNAを介したhypercapnic欠損を再現することができたように、高いCNOレベルで観察された化学感覚表現型は、本物であ しかし、報告されたVO2、VT、RR、およびVE/VO2データがない場合があるため、以前の研究を完全に比較することは困難である。 例えば、体温や代謝率の変化は、呼吸器や化学感覚の出力にいくつかの方法で影響を与える可能性があり、プレチスモグラフチャンバーの温度は、いくつかのケースでは大きく異なっていたこと(私たちの研究では34対30℃)、波形の気圧成分のダイナミックレンジ、したがって一回換気量に影響を与えます。 特に、我々は、我々の以前の高用量の全rhombomere研究で観察された、我々の状態のいずれかにおける呼吸波形特性のかなりの変化も、急性心臓呼吸停止も見られなかった(Sun et al., 2017).
私たちの結果は、CNOが広範な慣れによってマスクされていないhypercapnic化学感覚反射に予期しない効果を有することを初めて示しています。 重要なことは、高レベルにもかかわらず、CNOオフターゲット効果は、以前の兄弟コントロールにおける表現型の欠如のために除外されていたが、我々は慣れ親しんだ時に明らかになる示しています。 我々は、ラットおよび非ヒト霊長類の研究を補完するために、マウスモデルシステムにおけるCNOのオフターゲット特性評価を提供しています。 ここでの結果は、研究中の回路または自律神経または恒常性回路に対する追加のCNO媒介、オフターゲット効果が存在する可能性がありますが、他の制御 重要なことは、これらのデータは、研究者が慣れの高レベルと組み合わせて可能な活性化リガンドの最小限の用量を使用するように努力すべきであ
材料および方法
倫理的承認
研究は、プロトコルAN-6171の下でBaylor College Of Medicine Institutional Animal Care and Use Committeeによって承認されました。
マウスの繁殖、遺伝的背景、および維持
私たちは、c57BL/6Jマウスと兄弟交配によるホモ接合株にバッククロスすることにより、すべてのヘテロ 組織学的実験のために、DB H−Cremiceをホモ接合型A I9マウスと交配させた(Madisen e t a l.,2010)(JAX007909). プレチスモグラフィー実験のために、DB H−Creマウスをホモ接合体RC::P_Hm4Dと交配させた(Ray e t a l. ら、2 0 1 1)マウスを動物由来にし、全てのマウスがRC::P_H M4d対立遺伝子を担持した。 Cre対立遺伝子を継承しなかった兄弟動物を、Cre陽性の子孫に対する対照動物として使用した。 A I9、RC::P_H M4D、およびRC::EPEマウスのためのrosa2 6特異的プライマーは、5’−GCACTTGCTCCCAAAGTC、5’−GGGCGTACTTGGCATATGAT、および5’−CTTTAAGCCTGCCCAGAAGAであり、4 9 5bpバンド(標的化)および3 3 0bpバンド(w T)を得た。 すべてのrhombomere CreドライバのCre特異的プライマーは、5′-A T C G C C A T CTTCCAGCAGGCGCACCATTGCCCおよび5′-GCATTTCTGGGGATTGCTTAであり、陽性であれば550bpバンドが得られた。 LC−MS実験のために、C5 7BL/6Jマウスを、Center o f Comparative Medicine(CCM)、Baylor College o f Medicineから入手した。
組織学
四から八週齢のDBH-Cre;Ai9成体マウスは、0.1Mリン酸緩衝生理食塩水(PBS)で経心的に灌流した後、PBSで4%パラホルムアルデヒド(PFA)としました。 脳を解剖し、PBSすすぎおよびPBS中の20%スクロース中で平衡化する前に、4%PFA中で2時間固定した。 次いで、脳を30μ m切片に切片化し、スライド上に取り付け、免疫蛍光抗体で標識した。 我々は、カテコールアミン作動性ニューロン(1:1,000、ミリポアAB152)を識別するために抗チロシンヒドロキシラーゼ抗体で一晩染色2hロバ抗ウサギCy3二次(1:500、ジャクソン711-165-152)0.1%トリトン-X PBS(PBST)5%ロバ血清 画像はZeiss直立脱蛍光顕微鏡で収集した。<2605><9874>電気生理学<4409><1916>コエルレウス座(300μ m)を含む水平脳スライスを、成体DBH-Cre;RR2P;RC::ePeマウス(〜1ヶ月)からのビブラトーム(Leica VT1000S、Leica Microsystems、Buffalo Grove、IL)で4℃の人工脳脊髄液(ACSF)中で切断した。 切片を、mM:124NaCl、2.0KCl、1.3Mgso4、2.5Cacl2、1.2KH2PO4、25Nahco3、および10グルコース(2〜3ml/分)を含む酸素化ACSF(95%O2および5%CO2)で灌流したチャンバ中に浸漬した。 全細胞記録を、従来のパッチ−クランプ技術およびMulticlamp7 0 0B amplifier(Molecular Devices,Union City,C A)を使用して3 0℃で行った。 コエルレウス座由来のGFP陽性ニューロンを視覚的に同定し、続いて、直立顕微鏡(Axioskope FS2,Carl Zeiss,Oberkochen,Germany)のステージ上の赤外線差動干渉コントラストビデオによ パッチピペット(抵抗性4〜6Μ)を(m M):1 1 0K−グルコン酸塩、1 0KCI、1 0HEPES、1 0Na2−ホスホクレアチン、2Mg3−ATP、および0. 保持電位は−7 0mVであった。 CNOは浴を適用した。
Plethysmography
意識のないマウスのPlethysmographyは、6-12週齢の成体動物に記載されているように実施した(Ray et al., 2011). 馴化マウスは、処理の数分、直腸プローブ、腹腔内生理食塩水注入、およびプレチスモグラフィー室で30分によって撮影された温度からなる毎日と5日間の馴化プロトコールに供された。 その後、慣れの最後の日の1週間以内にマウスを試験した。 未生息マウスは、ハンドリングまたはplethysmographチャンバーにさらされていませんでした。 すべてのマウスはCNOにナイーブであり、一度だけ使用されました。
実験当日、マウスを自宅のケージから取り出し、体重を測定し、直腸温を測定した。 次いで、動物を、フロースルー、温度制御された(3 0℃で被覆された水)プレチスモグラフィー室に入れ、室内空気(2 1%O2/7 9%N2)条件で少なくとも2 0分間順応させた。 順化および室内空気下での測定の後、チャンバガスを、5%CO2/2 1%O2/7 4%N2の超炭酸混合物に2 0分間切り替えた。 その後、室内ガスを2 0分間室内空気に戻した。 マウスを、直腸温度測定および生理食塩水(1または0.1mg/ml)に溶解したCNO(National Institute of Mental Health Chemical Synthesis and Drug Supply Program)の腹膜内注射のために、それぞれ10または1mg/kgの有効濃度 動物を室内空気の別の2 0分、高炭酸ガス症の2 0分、および室内空気の2 0分のために室内に戻した。 次いで、動物をチャンバから除去し、実験の終了直後に直腸温を採取した。
液体クロマトグラフィー-質量分析
二十から四野生型マウス、性別によって均等に分割し、秤量し、10mg/kg CNO、1mg/kg CNO、0.1mg/kg CNO、またはビヒクルで処理した。 注射の3 0分後に、血液試料を心臓穿刺によって収集し、B Dマイクロ容器に入れた。 試料をベンチトップ遠心分離機中で4℃で1 3,5 0 0rpmで遠心分離し、上清を回収した。 血清および脳は、抽出まで-20℃に保たれた。<2 6 0 5><1 9 1 6>HPLCグレードの溶媒水、アセトニトリルクロロホルム、メタノールおよび質量分析グレードのギ酸は、Sigma−Aldrich(St. Agilent Technologies(Santa Cruz,C A)から購入した。 Louis、MO)から、N−アセチルアスパラギン酸−D3、トリプトファン−1 5N2、グルタミン酸−D5、チミン−d4、ジベレリン酸、trans−zeatin、ジャスモン酸、1 5Nアントラニル酸、およ Microtainer R SST TMは、Becton Dickinson(Franklin Lakes,NJ)から入手した。
抽出は、750μ lの氷冷メタノール:水(4:1)から成り、20μ lのスパイクされた内部標準を各脳サンプル(50mg)および品質管理に加え、それぞれ1分間ホモジナイズした。 次いで、20μ lのスパイクされた内部標準を含む750μ lの100%アセトニトリルを洗浄サンプル(100μ l)および品質管理に加え、次いで5分間超音波処理した。 全ての試料を5,0 0 0rpmで4℃で1 0分間遠心分離した。 <2 6 0 5><1 9 1 6>全ての試料を、6,4 9 0三重四重極質量分析計(Agilent Technologies,Santa Clara,C A)をHPLCシステム(Agilent Technologies,Santa Clara,C A)に結合させたmrm(multiple reaction monitoring)により分析した。<2 6 0 5><1 9 1 6>全ての試料を、HPLC 検出された代謝物ごとに約8-11のデータポイントが取得されました。 検出された代謝産物はクロザピン,CNO,ノルクロザピン(N-デスメチルクロザピン)であった。 方法にはESI陽性モードを用いた。 HPLCカラムは、ACQUITYUPLC C18カラム(100Å、1.8μ m、および2.1mm×100mm)であった。 Milford,M A,USA)の流速を0.
データ収集と分析
プレチスモグラフィー
プレチスモグラフィー圧力変化は、Validyne DP45差動圧力変換器と参照チャンバとCD15キャリア復調器を用いて測定し、LabChartProでリアルタイムで記録した。 波形を、labchartproおよびカスタム記述されたMATLABコードを使用してオフラインで分析して、呼吸速度(RR)、一回換気量(V T)を決定した(Ray e t a l.、2011)、分換気(VE)、およびパターン分析。 呼吸波形は、動物が休息していた期間中にオフラインで収集され、測定値は運動アーティファクトから自由であった。 与えられた実験条件の最後の10分から少なくとも10秒の長さのトレースからコンパイルされた最小1分間の累積データを分析した。 O2消費量は、AEI酸素センサーとアナライザを使用して空室内の校正とライブ呼吸との間のガス組成を比較することによって決定されました。 チャンバ温度は常にThermoWorks MicroThermo2とプローブを使用して監視され、リアルタイムでLabChartProで記録されました。
ポアンカレの測定値とため息と無呼吸の頻度は、各呼吸状態からの1分間の動きのない痕跡を用いて決定した。 ため息は、平均呼吸の少なくとも2倍の大きさの振幅を有する呼吸として定義された。 Apneaは、平均IBIの少なくとも二倍の大きさのinterbreath間隔(IBI)として定義されました。 IBIおよび振幅の変動係数(CV)も、各呼吸状態(標準誤差IBIまたは振幅/平均IBIまたは振幅)の同じ1分間のトレースコンパイルから計算した。
統計
プレチスモグラフィー
部屋の空気とhypercapnicデータの結果(RR、VT、VE、VO2、VE/VO2、apneasとため息の数、およびIBIと振幅のCv)は、DBH-Cre;RC::P_Hm4Dコホートと動物型の線形混合効果回帰モデルを用いた兄弟対照との間で比較された(実験対対照定効果としてCNO投与(注射前対注射後)およびランダム効果として動物Idを投与することができる。 温度データを、固定効果として動物型(実験対対照)を有する線形混合効果回帰モデルを用いて比較した。 統計的有意性を示すためにp<0.05を使用し、平均の個々のデータポイント、平均、および標準誤差がすべてのチャートに示されています。
液体クロマトグラフィー-質量分析
各サンプルのピーク下で得られた領域を内部制御により正規化し、統計分析を行う前にビヒクルに正規化した。 不対t試験を用いて,各組織におけるクロザピンおよびCNOの相対的存在量を濃度群によって比較した。
倫理声明
すべての実験は、Baylor College of MedicineのInstitutional Animal Care and Use Committeeによって承認されました。 実験は、実験動物ケアの評価と認定のための協会によって設定された実験動物のケアと使用のための国家基準に準拠していました。
著者の貢献
JS、FS-M、MC-M、RRは実験を考案し、設計しました。 JS、FS-M、PZは実験を行い、データの分析に貢献しました。 JS、FS-M、VM、MC-M、RRが論文を書いた。
資金調達
この研究は、国立心臓、肺、血液研究所からの助成金R01HL130249およびR01HL130249-S1、March of Dimes Basil O’Connor Award、およびMcNair Medical Instituteによって支援されました。
利益相反声明
著者らは、利益相反の可能性があると解釈される可能性のある商業的または財政的関係がない場合に研究が行われたと宣言し
謝辞
私たちは、Shaila K.Mani博士とBenjamin Arenkiel博士に有益な議論をしてくれたことに感謝します。 我々はまた、液体クロマトグラフィー-質量分析の実行のための医学プロテオミクスコア施設のベイラー大学に感謝します。
Amiel,J.,Dubreuil,V.,Ramanantsoa,N.,Fortin,G.,Gallego,J.,Brunet,J.-F.,et al. (2009). 呼吸制御におけるPHOX2B:先天性中枢性低換気症候群とそのマウスモデルからの教訓。 レスピール フィジオール ニューロビオール 168, 125–132. doi:10.1016/j.resp.2009.03.005
クロスリファレンス全文/Google Scholar
Andrews,N.,And File,S.E.(1993). ラットの歴史を扱うことは心配の高められたプラス当惑テストの薬剤の行動の効果を変更します。 ユーロ J.Pharmacol. 235, 109–112. 土井: 10.1016/0014-2999(93)90827-5
PubMed Abstract|CrossRef全文|Google Scholar
とができるようになることを期待しています。 強力に不活性リガンドによって活性化されたGタンパク質共役受容体のファミリーを作成するためのキーに合わせてロックを進化させます。 プロク… ナトル アカド サイ… 米国104、5163-5168。 ドイ:10.1073/pnas.0700293104
PubMed要約/CrossRef全文/Google Scholar
およびWang,R. 非定型抗精神病薬クロザピンの薬理学的作用:レビュー。 シナプス24、349-394。 土井:10.1002/(SICI)1098-2396(199612)24:4<349::エイド-シン5>3.0.CO;2-D
PubMed Abstract/CrossRef Full Text|Google Scholar
Bahia,C.M.C.d.S.,And Pereira,J.S.(2015). 閉塞性睡眠時無呼吸と神経変性疾患:双方向の関係。 デメント ニューロサイチョル… 9, 9–15. 土井:10.1590/S1980-57642015DN91000003
PubMed要約/CrossRef全文|Google Scholar
ビアンカルディ、V.、Bícego、K.C.、Almeida、M.C.、およびGargaglioni、L.H.(2008)。 Locus coeruleusノルアドレナリン作動性ニューロンとCO2は呼吸に駆動します。 Pflugersアーチ。 -ユーロ J.フィジオール。 455, 1119–1128. ドイ:10.1007/s00424-007-0338-8
PubMed Abstract|CrossRef全文|Google Scholar
ることができると考えています。 呼吸の原動力を調整するために専門にされる頭脳のセロトニン作動性ニューロンの分子サブタイプの機能および発達の同一証明。 細胞Rep.9、2152-2165。 ドイ:10.1016/j.celrep.2014.11.027
PubMed要約/CrossRef全文/Google Scholar
Chang,W.H.,Lin,S.K.,Lane,H.Y.,Wei,F.C.,Hu,W.H.,Lam,Y.W.,et al. (1998). 統合失調症患者におけるクロザピンおよびクロザピンN-オキシドの可逆的代謝。 プログ ニューロサイコファーマコール バイオル 精神医学22、723-739。 土井:10.1016/0278-5846(98)00035-9
PubMed Abstract|CrossRef全文|Google Scholar
Chen,Y.-W.,Das,M.,Oyarzabal,E.A.,Cheng,Q.,Plummer,N.W.,Smith,K.G.,et al. (2018). ノルアドレナリン作動性ニューロンの集団の遺伝的同定は、ストレス関連応答の減衰に関与しています。 モル 1月16日にdfaとなった。 土井:10.1038/s41380-018-0245-8
PubMed Abstract|CrossRef全文|Google Scholar
Dlouhy,B.J.,Gehlbach,B.K.,Kreple,C.J.,Kawasaki,H.,Oya,H.,Buzza,C.,et al. (2015). 発作が扁桃体に広がり、扁桃体刺激時に呼吸が阻害された。 J.Neurosci. 35, 10281–10289. 土井:10.1523/JNEUROSCI.0888-15.2015
PubMed要約/CrossRef全文/Google Scholar
Feinstein,J.S.,Buzza,C.,Hurlemann,R.,Follmer,R.L.,Dahdaleh,N.S.,Coryell,W.H.,et al. (2013). 両側扁桃体損傷を有するヒトにおける恐怖およびパニック。 ナット ニューロシ… 16, 270–272. ドイ:10.1038/nn.3323
PubMed要約/CrossRef全文/Google Scholar
Fitton,A.,And Heel,R.C.(1990). クロザピン その薬理学的特性のレビュー、および統合失調症における治療的使用。 40,722-747 土井: 10.2165/00003495-199040050-00007
PubMed Abstract|CrossRef全文|Google Scholar
Fleury Curado,T.A.,Pho,H.,Dergacheva,O.,Berger,S.,Lee,R.,Freire,C.,et al. (2018). 舌下運動ニューロンのサイレンシングは、無駄のないマウスで睡眠呼吸障害につながります。 フロント ニューロール 9:962. ドイ:10.3389/fneur.2018.00962
CrossRef全文|Google Scholar
Gargaglioni,L.H.,Hartzler,L.K. およびPutnam,R.W.(2010)。 遺伝子座のcoeruleusおよび中央化学感受性。 レスピール フィジオール ニューロビオール 173, 264–273. doi:10.1016/j.resp.2010.04.024
Pubmed要約/CrossRef全文/Google Scholar
Gomez,J.L.,Bonaventura,J.,Lesniak,W.,Mathews,W.B.,Sysa-Shah,P.,Rodriguez,L.A.,et al. (2017). 化学遺伝学的には、クロザピンを介したDREADDの活性化と活性化が明らかになった。 科学357,503-507. 土井:10.1126/科学。aan2475
PubMed要約/CrossRef全文/Google Scholar
ゲッティエ,J.M.,Gautam,D.,Scarselli,M.,Ruiz de Azua,I.,Li,J.H.,Rosemond,E.,et al. (2009). In vivoでのβ細胞機能のGタンパク質調節を研究するための化学遺伝的アプローチ。 プロク… ナトル アカド サイ… 米国106、19197-19202。 ドイ:10.1073/pnas.0906593106
CrossRef全文/Google Scholar
Hakim,F.,Gozal,D.,Kheirandish-Gozal,L.(2012). 子供に特に重点を置いて睡眠時無呼吸における交感神経とカテコールアミン作動性の変化。 フロント ニューロール 3:7. ドイ:10.3389/fneur.2012.00007
PubMed Abstract/CrossRef Full Text|Google Scholar
ることができると考えています。 タキキニン1を発現するPet1rapheニューロンの活性は、呼吸器化学反射を調節する。 J.Neurosci. 37, 1807–1819. 土井:10.1523/JNEUROSCI.2316-16.2016
PubMed要約|CrossRef全文|Google Scholar
Huckstepp,R.T.R.,Cardoza,K.P.,Henderson,L.E.,And Feldman,J.L.(2015). 成体ラットの呼吸制御における傍顔面核の役割。 J.Neurosci. 35, 1052–1067. 土井:10.1523/JNEUROSCI.2953-14.2015
PubMed要約/CrossRef全文/Google Scholar
とができるようになりました。 野生型ラットにおける急性全身低用量クロザピンの行動効果:行動神経科学におけるDREADDsの使用への影響。 フロント 行動する。 ニューロシ… 12:173. ドイ:10.3389/fnbeh.2018.00173
CrossRef全文|Google Scholar
およびElshowihy,R. 急性および慢性ストレスと呼吸との相互作用: ナロキソンによる修正。 ファーマコール… バイオケム 行動する。 16, 599–603. 土井: 10.1016/0091-3057(82)90422-1
PubMed Abstract|CrossRef全文|Google Scholar
Jann,M.W.,Lam,Y.W.,およびChang,W.H.(1994). モルモットおよびクロザピンN酸化物の管理に続く人のクロザピンの急速な形成。 アーチ Int. ファーマコジン Ther。 328, 243–250.
PubMed Abstract/Google Scholar
Joober,R.(2010). クロザピン:明確で、理解が不十分で、使用されていない分子。 J.精神科神経科. 35, 147–149. ドイ:10.1503/jpn.100055
PubMed要約/CrossRef全文/Google Scholar
Kinkead,R.,Dupenloup,L.,Valois,N.,And Gulemetova,R.(2001). 覚醒ラットにおけるhypercapnic換気応答のストレス誘発減衰。 J.Appl. フィジオール 90, 1729–1735. 土井:10.1152/jappl.2001.90.5.1729
Pubmed抄録|CrossRef全文/Google Scholar
Klein,D.F.(1993). 偽の窒息警報、自発のパニックおよび関連の条件。 統合的な仮説。 アーチ 精神医学50,306-317. 土井:10.1001/archpsyc.1993.01820160076009
PubMed要約/CrossRef全文/Google Scholar
ることができると考えています。 運動中の呼吸の制御における傍顔ニューロンの役割。 サイ… 8:400 土井:10.1038/s41598-017-17412-z
CrossRef全文|Google Scholar
Lapin,I.P.(1995). コントロールのみ:上昇したプラス迷路におけるマウスの行動に対する生理食塩水の取り扱い、偽の注射、および腹腔内注射の影響。 J.Pharmacol. トキシコール 方法34、73-77。 doi:10.1016/1056-8719(95)00025-D
PubMed Abstract/CrossRef Full Text|Google Scholar
Lavezzi,A.M.,Alfonsi,G.,And Matturri,L.(2013). 胎児/新生児の突然の原因不明の死におけるヒト座コエルレウス複合体の病態生理。 ニューロール 第35号、44-53号 doi:10.1179/1743132812Y.0000000108
PubMed要約/CrossRef全文/Google Scholar
MacLaren,D.A.A.,Browne,R.W.,Shaw,J.K.,Krishnan Radhakrishnan,S.,Khare,P.,España,R.A.,et al. (2016). クロザピンのn酸化物の管理は長いevansのラットの行動の効果を作り出す:DREADDの実験の設計のための含意。 3件中1-14件を表示しています。 土井:10.1523/ENEURO.0219-16.2016
PubMed要約/CrossRef全文/Google Scholar
Madisen,L.,Zwingman,T.A.,Sunkin,S.M.,Oh,S.W.,Zariwala,H.A.,Gu,H.,et al. (2010). 全マウスの頭脳のための強く、高効率Creの報告および性格描写システム。 ナット ニューロシ… 13, 133–140. ドイ:10.1038/nn.2467
PubMed Abstract/CrossRef Full Text|Google Scholar
とができるようになりました。 CNO悪? 行動神経科学における恐怖の使用のための考慮事項。 神経精神薬理学43,934-936. doi:10.1038/npp。2017.299
PubMed Abstract/CrossRef Full Text/Google Scholar
Manvich,D.F.,Webster,K.A.,Foster,S.L.,Farrell,M.S.,Ritchie,J.C.,Porter,J.H.,et al. (2018). DREADDアゴニストのクロザピンN酸化物(CNO)はクロザピンに逆新陳代謝し、ラットおよびマウスのクロザピンそっくりのinteroceptive刺激の効果を作り出します。 サイ… 8,3840円 土井:10.1038/s41598-018-22116-z
CrossRef全文|Google Scholar
ることができると考えられている。 マウスにおける下垂体-副腎応答に対する単離、取り扱いおよび新規性の影響。 精神神経内分泌学7、217-221。 土井:10.1016/0306-4530(82)90015-4
PubMed Abstract|CrossRef全文|Google Scholar
ることを明らかにしました。 オレキシンノックアウトマウスにおけるhypercapnic chemoreflexと誇張された睡眠時無呼吸の警戒状態依存減衰。 J.Appl. フィジオール 102, 241–248. 土井:10.1152/00679.2006
PubMed要約/CrossRef全文/Google Scholar
大保内,T.,安原,M.,中村,T.,高島,S.(1998). 突然の幼児死症候群の犠牲者の脳幹のカテコールアミンのニューロンの変化。 小児科101,285-288. ドイ:10.1542/peds.101.2.285
PubMed要約/CrossRef全文/Google Scholar
ることを明らかにした。 乳幼児突然死症候群における脳幹におけるα2-アドレナリン作動性受容体サブタイプの変化。 初期のハム。 デヴ 75位(サプラ…)、S129-S138。 土井:10.1016/j.pathophys.2004.01.015
クロスリファレンス全文/Google Scholar
とができるようになりました。 コカインの自己管理の歴史のラットのclozapine N酸化物によるコカイン誘発の移動の線量依存した減少。 ニューロシ… レット 674, 132–135. ドイ:10.1016/j.neulet.2018.03.045
PubMed要約/CrossRef全文/Google Scholar
Ramanantsoa,N.,Hirsch,M.-R.,Thoby-Brisson,M.,Dubreuil,V.,Bouvier,J.,Ruffault,P.-L.,et al. (2011). 条件付きPhox2B変異体におけるCO(2)化学感受性なしで呼吸。 J.Neurosci. 31, 12880–12888. 土井:10.1523/JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Egr2ニューロンはhypercapniaへの大人の呼吸の応答を制御します。 脳Res.1511,115-125. 土井:10.1016/j.brainres.2012.12.017
Pubmed抄録/CrossRef全文/Google Scholar
Ray,R.S.,Corcoran,A.E.,Brust,R.D.,Kim,J.C.,Richerson,G.B.,Nattie,E.,et al. (2011). 急性セロトニン作動性ニューロン阻害時の呼吸器および体温制御の障害。 科学333,637-642. 土井:10.1126/科学。1205295
PubMed要約/CrossRef全文/Google Scholar
Ryabinin,A.E.,Wang,Y.M. およびFinn,D. マウスの二つの近交系株における繰り返し処理および注射ストレス後のFos免疫反応性の異なるレベル。 ファーマコール… バイオケム 行動する。 63, 143–151. ドイ:10.1016/S0091-3057(98)00239-1
PubMed Abstract|CrossRef全文|Google Scholar
とができるようになりました。 慢性間欠性低酸素症は、初期段階の神経変性に関連する脳領域における酸化ストレスおよび炎症を誘導する。 フィジオール 5件中1-13件を表示しています。 ドイ:10.14814/phy2.13258
PubMed要約/CrossRef全文/Google Scholar
ることができます。 胚の後脳のパターン形成の遺伝子は大人の明瞭な心臓呼吸および新陳代謝の恒常性の人口を描写します。 サイ… 7:9117 土井:10.1038/s41598-017-08810-4
CrossRef全文|Google Scholar
とができます。 Tg(Th-Cre)Fi172Gsat(Th-Cre)は、完全なhypercapnicおよび低酸素反射に必要なニューロンを定義します。 バイオル オープン6、1200-1208。 土井:10.1242/bio.026823
PubMed要約/CrossRef全文/Google Scholar
Taugher,R.J.,Lu,Y.,Wang,Y.,Kreple,C.J.,Ghobbeh,A.,Fan,R.,et al. (2014). 終末線のベッド核は、CO2およびアシドーシスによって誘発される不安関連行動にとって重要である。 J.Neurosci. 34, 10247–10255. 土井:10.1523/JNEUROSCI.1680-14.2014
PubMed Abstract|CrossRef Full Text|Google Scholar
ることができます。 ストレスに対する適応応答としての座コエルレウス活性の収束的調節。 ユーロ J. ファーマコール… 583, 194–203. 土井:10.1016/j.ejphar.2007.11.062
クロスリファレンス全文/Google Scholar
とができるようになりました。 重複シンドロームおよび肥満のhypoventilationの呼吸の機械工そしてventilatory制御。 レスピール 14:132 土井: 10.1186/1465-9921-14-132
PubMed Abstract|CrossRef全文|Google Scholar
Viemari,J.-C.(2008). 呼吸ニューラルネットワークのノルアドレナリン作動性変調。 レスピール フィジオール ニューロビオール 164, 123–130. doi:10.1016/j.resp.2008.06.016
PubMed Abstract/CrossRef Full Text|Google Scholar
とができるようになりました。 ラットにおける二酸化炭素(CO2)吸入に対する行動感受性の差。 神経科学346,423-433. 土井:10.1016/j.神経科学.2017.01.003
PubMed要約/CrossRef全文/Google Scholar
Ziemann,A.E.,Allen,J.E.,Dahdaleh,N.S.,Drebot,I.I.,Coryell,M.W.,Wunsch,A.M.,et al. (2009). 扁桃体は、二酸化炭素とアシドーシスを検出して恐怖行動を誘発する化学センサーです。 Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar