- はじめに
- 材料と方法
- 卵母細胞の収穫とcRNA微小注入
- 膜画分の単離と免疫ブロッティング
- 凍結破壊電子顕微鏡
- 対卵母細胞アッセイと接触領域の定量
- 静水圧インパルスアッセイ
- 統計分析
- 結果
- Claudin-5の発現とXへの統合。 laevis卵母細胞原形質膜
- Claudin-5発現卵母細胞にタイトジャンクション鎖のパッチが見える
- Claudin Trans-Interactionの分析のためのペア卵母細胞アッセイ
- 静水圧インパルスアッセイは、卵母細胞のペアのクローディン特異的な接合部を明らかに
- Caprateとのインキュベーション
- ディスカッション
- クローディンは、Vitzthumらの以前の結果によると、より強い接着特性に寄与する
- 結論
- データ利用可能性に関する声明
- 倫理声明
- 著者の貢献
- 資金調達
- 利益相反
- 謝辞
- 補足資料
はじめに
タイトジャンクションタンパク質ファミリーは、例えば内耳に示されているように、多くの器官および組織の疾患および機能不全に関連しているため、細胞生理学にとって重要である(Wilcox et al. 2001年;Florian et al. ら、2 0 0 3)、腎臓(Konrad e t a l. ら,2 0 0 6;Gunzelら,2 0 0 6;Gunzelら, ら、2 0 0 9)、消化管(Resnick e t a l. ら、2 0 0 5;Amasheh e t a l. ら、2 0 0 9)、表皮(Furuse e t a l., 2002; Tebbe et al. ら、2 0 0 2)、および脳毛細血管(Nitta e t a l. ら、2 0 0 3;Wolburg e t a l., 2003). Claudinsは、少なくとも27のメンバーを含む膜貫通タンパク質ファミリーを表す(Mineta et al., 2011). それらの4つの膜貫通ヘリックスドメインに加えて、それらは、2つの細胞外ループ(ECL1およびECL2)、短いN末端およびC末端を含む(Suzuki e t a l., 2014). 特定のクローディンの発現パターンを決定し、上皮の選択的透過性を反映し、claudinタンパク質のcis(同じ膜内)とtrans(隣接する細胞の膜間)で相互作用する能力は、バリア形成と細孔形成タイトな接合ストランドの形成を可能にする(Van Itallie and Anderson、2006)。
クローディン-5は血管内皮で強く発現し、他のクローディンと比較して発現が>100倍高いため、血液脳関門(BBB)のタイトジャンクション(TJ)を支配している(Ohtsuki et al., 2007). さらに、それは、肺(Soini,2 0 1 1)、外分泌組織(Comper e t a l.,2 0 1 1)を含む種々の上皮組織で発現される。 ら、2 0 0 9)、腸(Garcia−Hernandez e t a l. ら、2 0 1 7)、および尿路(Koda e t a l., 2011). しかしながら、claudin-5は、他の組織よりも脳毛細血管において強い障壁を引き起こし(ReinholdおよびRittner、2017)、その機能は神経変性および神経炎症性障害において損, 2019). したがって、claudin-5はBBBを維持するために重要です。 しかし、BBBは保護的であるだけでなく、薬物がこの障壁に浸透するのを妨げるため、治療選択肢も制限します。
新田ら (2 0 0 3)は、BBBが、野生型マウスと比較して、クローディン−5欠損マウスにおいて、サイズが8 0 0Daの分子に対してより透過性であることを報告している(Nitta e t a l., 2003). これは、Caco−2細胞単分子層におけるclaudin−5の封止効果を実証するトランスフェクション実験に従った(Amasheh e t a l., 2005).
もう一つの主要な障壁を形成するclaudinはclaudin-3であり、電荷と非荷電溶質のいずれかのイオンの通過に対して障壁を選択的にシールすることが報告されている(Milatz et al., 2010). それはまた、脳毛細血管の内皮タイト接合部で発現され、その機能的損失は、多発性硬化症を有する患者の微小血管炎症、神経膠芽腫および脈絡叢の相 ら、2 0 0 1;Wolburg e t a l., 2003).
バリアプロパティは、次のように動的に変更できます。 ヒト腸細胞株H T−2 9/B6における経上皮電気抵抗を迅速かつ可逆的に減少させることが実証された(Krug e t a l., 2013). カプレートナトリウムは、上皮細胞および内皮細胞のタイトな接合部で一過性にクローディン-5含有障壁を開放する(Del Vecchio et al., 2012).
これは、claudin-5がBBBにおける薬物送達増強の有望な標的であることを示している。
本研究では、アフリカツメガエルlaevis卵母細胞の異種発現系を採用することを目的とした(Vitzthum et al. ら、2 0 1 9)claudin−5およびclaudin−3相互作用および過チュービングの分析のためのものである。 内因性細胞-細胞-接触の欠如のために、この単一細胞発現システムは、他のタイトな接合タンパク質の干渉なしに特定のクローディンの分析を可能に
材料と方法
卵母細胞の収穫とcRNA微小注入
卵母細胞は、外科的開腹術によって成体の雌アフリカクローガエルから収集されました。 アナステシアの場合、0。2%MS2 2 2(ethyl3−aminobenzoate methanesulfonate,Sigma−Aldrich,Taufkirchen,Germany)を浴溶液として2 0℃で5〜1 0分間使用した。 5mg/mlのコラゲナーゼFisher Bioreagents BP2 6 4 9−1(Fisher Scientific,Schwerte,Germany)中で、室温で9 0分間酵素消化により卵母細胞の単離を行った。 (2019). 濾胞細胞を、(m Mで):Nacl(9 0)、Kcl(1)、EGTA(トリエチレングリコールジアミン四酢酸)(1)、5HEPES(5);5 0rpmの機械的シェーカー上で1 0分間、Ca2+を含まないOri中でインキュベーション 第V期および第VI期(<4 0 4>1 0 0 0μ M)の卵母細胞に、対照としてヒトクロージン−5、クロージン−3またはRnaseをコードする1ngのcRNAを注入した(Nanoliter2 0 1 0,World Precession Instruments,Sarasota,FL,United States)。 注入量は卵母細胞あたり50.6nlであった。 注射後、卵母細胞を16℃でORiで3日間インキュベートし、タンパク質発現させた。
膜画分の単離と免疫ブロッティング
十注入卵母細胞は、ウェスタンブロット分析のためにプールされ、(mMで)Mgcl2(5)、Nah2Po4(5)、EDTA(エチレンジアミンテトラ酢酸)(1)、スクロース(80)、およびトリス(トリス(ヒドロキシメチル)アミノメタン)(20)を含む500μ lの均質化緩衝液に再懸濁させた。7.4. 卵母細胞抽出物を2 0 0rpmで4℃で1 0分間2回遠心分離して、細胞残屑を廃棄した。 上清を1 3,0 0 0rpmで4℃で3 0分間遠心分離して、Leduc−Nadeauら(1 9 9 8)によって記載されたように細胞膜をペレット化した。 (2007). ペレットを8 0μ lの均質化緩衝液中に再懸濁した。 タンパク質定量は、Pierce6 0 0nm Protein Assay Kit(Thermo Fisher Scientific,Hennigsdorf,Germany)を使用して、9 6ウェルプレート中の製造業者の説明書に従って、比色測定的に行った。 プレートリーダー(Perkinelmer Enspire Multimode Plate Reader,Waltham,M A,United States)を5 6 2nmに調整し、1 2 5〜2 0 0 0μ g/mlの範囲のウシ血清アルブミン標準(Thermo Fisher Scientific,Hennigsdorf,Germany)を評価のために用いた。 免疫ブロッティングの前に、試料を4×LAEMMLI緩衝液(Bio−Rad Laboratories,Munich,Germany)と混合し、1 0%SDSポリアクリルアミドゲル上に負荷し、電気泳動した。 タンパク質移動のために、PVDF膜を使用し、1 2 0分間、トリス緩衝生理食塩水中の5%非脂肪乾燥乳中で遮断した。 タンパク質は、claudin−3またはclaudin−5に対して産生させた一次抗体(invitrogen#3 5−2 5 0 0、#3 4−1 7 0 0、#3 4−1 6 0 0、Life Technologies、Carlsbad、C A、United States)を用いた免疫ブロッティングによって検出した。<1 1 3><3 5 1 6>ペルオキシダーゼ結合ヤギ抗ウサギおよび抗マウス抗体(#7 0 7 4、#7 0 7 6Cell Signaling Technology、Danvers、M A、United States)を使用して一次抗体に結合し、したがって室温で最低4 5分間 検出のために、Clarity Western ECL Blotting Substrate(#1 7 0 5 0 6 1,Bio−Rad Laboratories Gmbh,Munich,Germany)を使用し、シグナルをChemidoc MPシステム(Bio−Rad Laboratories)によって可視化した。<1 1 3><2 0 7 5>免疫組織化学<9 1 0 5><3 5 1 6>注入された卵母細胞を4%PFA(1 6%paraformaldehyde,E1 5 7 0 0,Science Service,Munich,Germany)に室温で4時間固定し、続いて7 0%エタノールからキシロル(Carl Roth,Karlsruhe,Germany)へミクロトーム(leica microsystems heidelberg,Germany)。 免疫組織化学的処理の直前に,パラフィンをキシロールを介してエタノール勾配に除去した。 非特異的結合部位は、リン酸緩衝生理食塩水中の5%ヤギ血清を使用してブロックされ、免疫ブロッティングと同じ一次抗体とインキュベートされた。 試料を、二次抗体Alexa Fluor−4 8 8ヤギ抗ウサギおよびAlexa Fluor−5 9 4ヤギ抗マウス(Life Technologies,Carlsbad,C A,United States)とインキュベートし、共焦点レーザー走査免疫蛍光顕微鏡(LSM7 1 0,Zeiss,Oberkochen,Germany)によって調
凍結破壊電子顕微鏡
凍結破壊電子顕微鏡は最近報告されたように行われた(Greene et al., 2019). 固定のために、注入された卵母細胞をグルタルアルデヒド(2.5%in0.1M cacodylate buffer)中で4℃で一晩インキュベートした。cacodylate bufferで洗浄した後、卵母細胞を凍結破砕のために調製した。 試料を30%グリセロール中で凍結保護し、液体窒素中で凍結した。 破砕し、白金および炭素(BAF4 0 0D;Balzers,Liechtenstein)でシャドーイングした後、残留する有機材料を次亜塩素酸ナトリウム洗浄によって除去した。 卵母細胞を透過型電子顕微鏡(EM−1 0,Zeiss,Oberkochen,Germany)で分析し、デジタルカメラ(Trondle Gmbh)で撮影した。 タイトな接合ストランドの形態計測分析は、20,000×の倍率で行われました。
対卵母細胞アッセイと接触領域の定量
マンニトールは、注入された卵母細胞を縮小し、原形質膜を損傷することなく鉗子を使用してビテリン膜の機械的除去を可能にするために実施された。 5〜1 0個の卵母細胞を、Oriを充填したペトリ皿(直径3 5mm、Thermo Fisher,Henningsdorf,Germany,#1 5 3 0 6 6)に入れた。 マンニトールを添加し、細胞の高張収縮が達成されるまで溶解した(約4 0 0mOsmol/l、1 0分間)。 手動脱vitellinisation後、卵母細胞はすぐに24ウェルプレートに転送されました(1. 8 6cm2表面積、TPP Techno Plastic Products,Trasadingen,Switzerland,#9 2 0 2 4)2mlのOriを含有する。 各ウェルにおいて、2つの細胞を、Pasteurピペット(1ml、Thermo Fisher,Henningsdorf,Germany,#PP8 8SB)および球根状プローブと共に押し出すことによって、穏やかにクラスター化した。<1 1 3><3 5 1 6>クローディン−5発現(cldn5−cldn5)、クローディン−3発現(cldn3−cldn3)、クローディン−3およびクローディン−5共発現(cldn3,5−cldn3,5)および対照卵母細胞(control−control)の卵母細胞対を、1 6℃でOriで最大4 8時間一緒に保った。<1 1 3><3 5 1 6>明視野顕微鏡法を用いた。2 4ウェル培養皿中のナイーブ卵母細胞対の画像を、これらの時点で、leica dmi6 0 0 0B顕微鏡(leica Microsystems,wetzlar,Germany)を使用して撮影した。 接触面積の直径は、ミクロンスケール(LAS-AF3.2.0)を用いて測定した。 接触面積は円形であるとみなされ、したがって、接触面積は円方程式A=√r2を使用して計算された。
静水圧インパルスアッセイ
ビテリン膜は、前に説明したように機械的に除去され、卵母細胞は対の卵母細胞アッセイに類似してクラスター化された。 さらに、混合卵母細胞対(対照−cldn5および対照−cldn3)を静水圧インパルス(HP I)アッセイで試験した。 2 4時間の安定化の後、単一チャネル電子ピペット(EE−3 0 0R,Eppendorf Research Pro,software version2.
卵母細胞を2mlのORiを含む24の井戸プレートに保持し、ピペッティング容量250μ lのORiを適用する前に中央の位置決めをチェックしました。 分配の速度は0.9s.の分配の速度を同等にする最高速度にuniformely置かれた。 周囲圧力,Oriの粘度およびピペット先端開口部の直径を一定条件下に保った。 明視野顕微鏡は、静水圧が適用され、適用前に接触領域と比較された30分後に接触領域の定量のために採用された。 実験のセットアップについては、図1を参照してください。
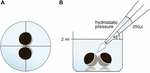
図1. 静水圧インパルスアッセイの実験セットアップ(A)ウェルの模式的な上面図:静水圧を適用する前に卵母細胞対の中央位置決めをチェックした。 (B)ウェルの概略側面図:単一チャネル電子ピペットを使用して2 5 0μ l Oriを添加した。 分配の速度は最高速度にuniformely置かれました。 適用の角度(45°)そして間隔はuniformely適用されました。 周囲圧力,Oriの粘度およびピペット先端開口部の直径を一定条件下に保った。<1 1 3><7 9 3 9><2 0 7 5>カプラートインキュベーション<9 1 0 5><3 5 1 6>カプラートインキュベーションのために、5 0、1 0 0、および5 0 0μ Mの最終濃度、または参照群としてのOriのカプラートナトリウム(#C4 1 5 1、Sigma Aldrich、Taufkirchen、Germany)を、対合の2 4時間後に卵母細胞に添加した。 卵母細胞を2mlのOriを含有する2 4個のウェルプレートに保持し、カプレート溶液を、ウェル当たり2 5 0μ lのoriの規定された添加量に溶解した。 接触面積の幅を、添加後3 0分、6 0分、および1 2 0分で定量した。
統計分析
統計分析は、JMP Pro14.0.0(NC,United States)を用いて行いました。 データは中央値として表示され、最初の検査ポイントでクラスタ化された組み合わせに基づいてパーセント変化として表示されます。 図4、5は箱ひげ図として示されており、最初の四分位数(25パーセント)、中央値(50パーセント)、および第二の四分位数(75パーセント)を示しています。 ウィスカーは、10パーセンタイルまで、90パーセンタイルまで描画されます。 Shapiro–Wilk-testを用いて正規分布をチェックした。
Kruskal–Wallis検定を多重比較に使用し、続いてDunn-Bonferroni補正を行った。 p値は連続数として与えられます。
結果
Claudin-5の発現とXへの統合。 laevis卵母細胞原形質膜
claudin-5cRNAの注入の3日後、卵母細胞原形質膜へのタイトジャンクション蛋白質claudin-5の成功した発現と統合をテストするために、膜画 三つの個々の動物(d1–d3)からのすべてのサンプルは、23kDaでクローディン-5特異的なシグナルを明らかにしたが、RNAseフリー水注入卵母細胞はクローディン-5発現
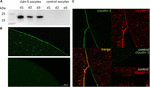
図2. アフリカツメガエルlaevis卵母細胞における異種発現クローディンの検出。 (A)3匹の動物(d1〜d3)のx.laevis卵母細胞におけるタイトジャンクション蛋白質claudin−5の免疫ブロット分析。 細胞膜溶解物をSDS−PAGEに供し、続いてimmunoblotをPVDF膜上に供した。 膜は、一次抗体および二次ペルオキシダーゼ共役抗体(n=3)とインキュベートした。 (B)免疫蛍光染色は、水注入コントロールでは、クローディン特異的な信号は共焦点顕微鏡で検出されなかったのに対し、すべてのcRNA注入卵母細胞の卵母細胞膜 三匹の動物由来の卵母細胞の代表的な画像。 スケールバー:50μ m。 (C)claudin-5およびclaudin-3発現卵母細胞の免疫蛍光染色は、crna注入卵母細胞の卵母細胞膜における特定のclaudin-3シグナル(緑)とclaudin-5シグナル(赤)を明らかにしたが、水注入 卵母細胞の原形質膜内の発現クロージン蛋白質の共局在は、二重免疫蛍光染色(黄色)によって明らかにされる。 スケールバー:10μ m。
形質膜内で発現したタンパク質を可視化するために、免疫組織化学染色を行い、共焦点レーザー走査顕微鏡によって分析した(図2B)。 特定の信号が検出され、均等に卵母細胞を発現するクローディン-5の原形質膜全体に分布していた。 Immunoblotsによれば,対照卵母細胞原形質膜では特異的シグナルは検出されなかった。
したがって、cRNAの注入後、claudin-5が正常に発現し、X.laevis卵母細胞の原形質膜に統合された。
卵母細胞対におけるクローディン-3とクローディン-5の同時発現は、両方の細胞におけるクローディン-5(赤)とクローディン-3(緑)の特異的なシグナルを明らかにした(図2C)。 卵母細胞の原形質膜は、直接cldn3,5−cldn3,5相互作用(黄色)によって提供される隣接細胞の融合を示した。
Claudin-5発現卵母細胞にタイトジャンクション鎖のパッチが見える
卵母細胞の原形質膜を分析し、タイトジャンクション鎖の可視化に成功しました(図3)。 凍結破壊電子顕微鏡では、クローディン-5注入卵母細胞の原形質膜における鎖形態のパッチを示し、クローディン-5発現卵母細胞の鎖組織は高度に組織化され、角状であった(図3A)。 タイトな接合ストランドは、主に膜の原形質(P-)面で検出された。 Claudin-3注入卵母細胞は、以前に報告されたように丸みを帯びた高度に組織化されたタイトな接合鎖を示した(Vitzthum et al.、2019年、図3B)。 クローディン-3とクローディン-5共発現卵母細胞の凍結骨折電子顕微鏡は、両方のクローディン-3とクローディン-5の特性を負担する原線維を明らかにした。 共発現卵母細胞のフィブリル鎖アーキテクチャは、クローディン-3発現卵母細胞として丸みを帯びた複雑な両方が、また、クローディン-5発現細胞のために示 対照卵母細胞は典型的な滑らかな表面を有していた(図3D)。
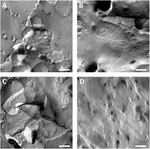
図3. 凍結破壊電子顕微鏡。 (A)凍結破壊電子顕微鏡は、アフリカツメガエルlaevis卵母細胞の行の角度不連続線維のメッシュワークとしてタイトな接合タンパク質cldn-5を明らかにする。 (B)凍結破壊電子顕微鏡は、x.laevis卵母細胞における丸みを帯びた線維のメッシュワークとしてタイトな接合タンパク質cldn-3を明らかにする。 (C)クローディン-3とクローディン-5共発現卵母細胞の凍結骨折電子顕微鏡は、両方のクローディン-3とクローディン-5の特性を負担する原線維を明らかに (D)水注入された対照卵母細胞は滑らかな表面を有する。 三匹の動物由来の卵母細胞の代表的な画像。 スケールバー:250nm。
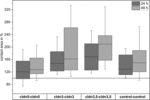
図4. クラスタ化された卵母細胞の組み合わせcldn5−cldn5、cldn3−cldn3、cldn3、5−cldn3、5および対照の接触面積の中央値は、クラスタ化直後の初期接触面積の%で、クラスタ化後2 4および4 8時間を制御する(n=8−3 8)。

図5. Claudin-5、claudin-3、およびclaudin-3およびclaudin-5卵母細胞の接触領域は、安定化期間後およびHPI後30分後に静水圧インパルス(HPI)チャレンジで同時発現する(n=16-70、*p<0.05、**p<0。01、Kruskal-Wallisに続いてDunn–Bonferroni補正が続く)。
Claudin Trans-Interactionの分析のためのペア卵母細胞アッセイ
すべてのクラスター化された組み合わせは、測定された期間にわたって接触面積の時間依存的な増加を示した(図4と表1)。<113><8021>表1
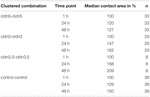
表1. クラスタリング後48時間以内に卵母細胞の接触領域。
水を注入した対照卵母細胞の接触面積は、24時間後に129%、48時間後に150%に増加した。 Claudin-3を発現する卵母細胞のクラスター化されたペアはまた、147%(24h)と162%(48h)に接触面積の増加を示した。 Claudin-3とclaudin-5を共発現する卵母細胞のクラスター化されたペアは、168%(24h)と209%(48h)の接触面積を示した。 Claudin-5単独で発現する卵母細胞のクラスタ化されたペアは、120%(24h)と127%(48h)の接触面積を示した。 従ってすべてのテストされた組合せの接触域は対等でした。
静水圧インパルスアッセイは、卵母細胞のペアのクローディン特異的な接合部を明らかに
別のアプローチでは、クローディン-3またはクローディン-5を発現するか、両方のクローディンを共発現する卵母細胞は、機械的デビテリン化後にクラスター化された。 卵母細胞を、HPIを用いることによって挑戦し、接触面積を測定し、挑戦の3 0分後に計算し、2 4時間の安定化期間後の初期面積と比較した(図5および表2)。 静水圧チャレンジ後、水注入コントロール卵母細胞の接触面積は89%に減少した。 クローディン-5、クローディン-3を発現する、またはクローディン-3とクローディン-5を共発現する卵母細胞のクラスター化された対は、より大きな接触領域を保持した(97%、p=0.0235;96%、p=0.003;98%、p=0.0253)。 混合水注入対照卵母細胞およびクローディン発現卵母細胞(対照-cldn5および対照-cldn3)の接触面積は、対照卵母細胞(93%、p=0.2900;83%、p=0.4455)と有意に異ならなかった。<113><8021>表2
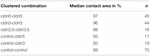
表2. 流体静力学圧力衝動の試金。
Caprateとのインキュベーション
パイロットインキュベーション実験では、卵母細胞を注入し、クローディン-5(cldn5–cldn5)を発現するか、RNAse遊離水を対照(対照–対照)として注入した。 対は50、100、または500μ mの最終的なナトリウムカプレート濃度でインキュベートした。 卵母細胞対のreferenceiとのインキュベーションは参照群として役立った。 卵母細胞をクラスター化し、24時間の安定化の後、インキュベーションを開始し、接触幅を添加後30、60、および120分測定した(補足図S1)。
ORiの添加は、添加後60または120分に分散しているクローディン発現および水注入卵母細胞対の両方における接触面積の初期減少をもたらした。 これは、時間の経過に伴う中央接触領域間の接続線の放物線形状によって概説される(補足図S1の赤い曲線)。 しかし、100および500μ mナトリウムカプレートとのインキュベーションは、わずかに(100μ m)または強く(500μ m)30分カプレート添加後5.1×105から5.2×105μ m2および4.3×105から4.9×105μ m2に接触面積を増加させた。
ディスカッション
本研究では、トランスポーターとヒト疾患モデリングのための古典的なモデルを採用しました(Tammaro et al. ら、2 0 0 9;Nenni e t a l. ら、2 0 1 9)、x.laevis卵母細胞、クローディン−5相互作用および接合部シールへの機能的寄与の詳細な分析のためのものである。 この目的のために、クラスター化アフリカツメガエル卵母細胞の接触領域内の挑戦的な相互作用のためのHPIを導入する新しいアプローチが確立され
クローディンは、Vitzthumらの以前の結果によると、より強い接着特性に寄与する
。 (2019)では、卵母細胞で発現された単一のクローディンは、対照卵母細胞と比較して相互作用接触面積の増加をもたらさなかった。 しかし,免疫ブロットと免疫組織化学的可視化は,x.laevis卵母細胞原形質膜への発現と統合に成功したことを証明した。 さらに、共焦点レーザー走査顕微鏡の使用は、ピンホールが焦点外蛍光をブロックするように原形質膜に発現クローディンの正確な局在化を可能にした。 標的との結合に対する抗体の親和性が異なるため、免疫組織化学的シグナルの定量化は追求されなかった。
Vedula et al. (2009)は、gfpタグ付きオクルジン、cldn-1、およびcldn-2をトランスフェクトしたL-線維芽細胞を使用してclaudin-claudin相互作用の側面を調査するためにマイクロピペット吸引 互いに二つの細胞をデタッチするために必要な分離力は、cldn-1とcldn-2トランスフェクト細胞(それぞれ≥2.8と2.3nN)で大きかった。 このアプローチは、卵母細胞を発現するクローディン-クローディン相互作用解析のためにも有望なように見えるかもしれないが、予備試験は、クラスタ化された卵母細胞の剥離は、卵母細胞の原形質膜の破壊なしには不可能であることを明らかにした。
したがって、新しいアプローチとして、接続の力をHPIによって測定しました。 HPIは絶対値の分離力の定量化を提供しないが(例えば、ニュートンの)、他の堅い接続点蛋白質の妨害なしでclaudinの相互作用の速く、費用効果が大きい分析をallowes、オクルジン、トリセルリン、ジャム-A)。 Claudinsはhpiの後で水注入された卵母細胞と比較されるより大きい接触域を示すので卵母細胞の対の接続点に貢献します。 これは、クローディン発現細胞間の強いホモ親和性トランス相互作用を示しています。
ストランドフィブリルアーキテクチャは単一クローディンに特異的である(Colegio et al., 2002). 凍結破壊電子顕微鏡では、クローディン-3は、アフリカツメガエル卵母細胞におけるループ形状で、より丸みを帯びたストランドメッシュワークを組み立てることが報告された(Vitzthum et al., 2019; 図3B)私たちの研究では、claudin-5はより角度のあるメッシュワークを形成し、行に並んでいました。 画像は、タイトな接合タンパク質claudin-5は、x.laevis卵母細胞の不連続、角度の形の行にフィブリルのメッシュワークを形成することを明らかにした。 これは、p相に関連する粒子の鎖として生じることが知られているクローディン−5鎖に従う(Piontek e t a l., 2011). 実験では,フィブリルの幾何学的形状は卵母細胞の接着特性に影響を及ぼさないと考えられた。 それによれば、傍細胞抵抗性は、原線維数および原線維形成特性とは無関係であることが報告された(Colegio et al., 2002). さらに、claudin−3およびclaudin−5は、HEK2 9 3細胞において同族性trans−相互作用について同様の能力を有することが示されている(Piontek e t a l., 2011).
単一のタイトジャンクション蛋白質を発現するX.laevis卵母細胞のこのモデルは、クラスター化された卵母細胞間の接触領域の形成に及ぼすカプレートナトリウムカプレートのような物質の影響を観察することを可能にする。 従ってそれは堅い接続点の障壁に影響を与える物質の時間そしてコスト効率が高いスクリーニングに有用な用具を提供するかもしれません。
100および500μ mのナトリウムカプレート濃度は、インキュベーションの30分後に接触面積を増加させる、その結果、卵母細胞を発現するクローディン-5に保護効
Krug et al. (2013)は、カプレートナトリウムとのインキュベーションは、ヒト腸細胞株HT-29/B6における経上皮抵抗の急速かつ可逆的な減少につながったことを実証した。 さらに、共焦点レーザー走査顕微鏡は、中鎖脂肪酸ラウリン酸で処理したH T−2 9/B6細胞におけるクローディン−5の顕著な減少を明らかにした(Dittmann e t a l., 2014). クローディンの第1の細胞外ループ(ECL1)は、タイトジャンクションの障壁特性にとって重要であり、第2の細胞外ループ(ECL2)は、トランス相互作用の鎖形成に関 ら、2 0 0 8;Rossa e t a l. ら、2 0 1 4;Greene e t a l., 2019). Ecl1またはECL2を標的とするclaudin−5結合剤は、タイトジャンクション蛋白質の細胞内取り込みを誘導し、それにより、隣接する細胞間のタイトジャンクションシ, 2017).
したがって、我々はナトリウムカプレートとのインキュベーションは、クラスター化されたclaudin-5発現X.laevis卵母細胞の接触面積の減少につながったと仮定した。 予想外に、ナトリウムカプレート(100と500μ m)の濃度の増加は、タイトな接合シールにナトリウムカプレートの保護効果を示すclaudin-5を発現するクラスタ化された卵母細胞の接触領域の増加につながった。 さらに、カプレートナトリウムは、アクトミオシン周囲機能環の収縮を誘導し、傍細胞空間を広げることが記載されている(Lindmark et al. ら、1 9 9 8;Maher e t a l., 2009). この効果は、ホスファチジルイノシトール4,5-ビスリン酸(PIP2)のイノシトール三リン酸(IP3)およびジアシルグリセロールへの切断につながるホスホリパーゼC, 1995). 足場タンパク質ZO-1によってアクチン細胞骨格に連結されたタイトジャンクション複合体は、タイトジャンクションから細胞質に再分配される(Lindmark et al. ら、1 9 9 8年;Turner,2 0 0 0年)。 X.laevis卵母細胞の細胞構築は、卵形成中の細胞質領域化のために極めて重要である(Wylie e t a l., 1985). しかし、受精の前に、TJP-1遺伝子発現は、ZO–1をコードする遺伝子は、卵母細胞の段階V-VIでのみ発現される(Session et al., 2016). したがって、細胞骨格足場とクローディンの減少した相互作用は、caprateインキュベーションの予期しない結果を説明するかもしれません。 この発見のメカニズム的基礎を検証するための将来の研究の範囲である。
しかし、傍細胞透過性に対するカプレートナトリウムの変異効果は、以前の文献に記載されていた。 成体ブタの腸から採取したPeyerパッチ組織においても同様の強化効果が検出された。 Claudin-5は5mM caprateとの孵化の後でかなり増加しました。 この研究では、caprateは、卵胞関連上皮において有意に高い経上皮電気抵抗(TEER)をもたらした(Radloff e t a l., 2019).
結論
結論として、xにおけるタイトジャンクションタンパク質claudin-5の異種発現。 laevis卵母細胞は、隣接する細胞の細胞間相互作用および癒着特性への単一クローディンの寄与に新しい洞察を可能にする。 したがって、claudin-5のx.laevisタイトジャンクションモデルを使用すると、単一セルモデル内のBBB成分の分析が可能になります。
データ利用可能性に関する声明
この研究のために生成されたデータセットは、対応する著者の要求に応じて利用可能です。
倫理声明
動物の治療は、ベルリン自由大学の動物福祉官の承認を得て、ベルリン獣医衛生検査官(landesamt für Gesundheit und Soziales Berlin,permit G0025/16)の統治下で、ドイツの法律のガイ
著者の貢献
すべての著者が原稿を読み、承認しました。 NBとSAは実験を設計、計画、監督し、原稿を書いた。 NB,LS,VC,RK,PF-Bは実験とデータ解析を行った。
資金調達
この研究は、Deutsche Forschungsgemeinschaft、Grant No.によって資金提供されました。 AM141/11-1とH.Wilhelm Schaumann Stiftung。
利益相反
著者らは、この研究は潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言しています。
謝辞
私たちは、優れた技術支援のためのMartin Grunau、Gisela Manz、Katharina Söllig、Susanne Trappeに感謝します。 我々は、ベルリン自由大学のオープンアクセス出版イニシアティブによる支持を認める。
補足資料
この記事の補足資料はオンラインで見つけることができます: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
図s1/クローディン-5の接触面積は、異なる濃度(n=6-8、それぞれ)と対照として水注入卵母細胞(n=5-7、それぞれ)のナトリウムカプレートとのインキュベーション中にμ m2で卵母細胞対を発現しています。
Amasheh,S.,Dullat,S.,Fromm,M.,Schulzke,J.D.,Buhr,H.J.,And Kroesen,A.J.(2009). 炎症を起こしたパウチ粘膜は、炎症性腸疾患の再発を示す変化したタイトジャンクションを有する。 Int. J.Colorect. Dis。 24, 1149–1156. ドイ:10.1007/s00384-009-0737-8
PubMed Abstract|CrossRef全文|Google Scholar
Amasheh,S.,Schmidt,T.,Mahn,M.,Florian,P.,Mankertz,J.,Tavalali,S.,et al. (2005). 上皮細胞のタイトジャンクションにおけるバリア特性へのクローディン-5の寄与。 細胞組織Res.321,89-96. 土井:10.1007/00441-005-1101-0
PubMed Abstract|CrossRef全文|Google Scholar
とができるようになることを期待しています。 タイトな接合フィブリルアーキテクチャと傍細胞電荷選択性におけるクローディン細胞外ドメインの役割。 モールバイオールセル… 13:286.
Comper,F.,Antonello,D.,Beghelli,S.,Gobbo,S.,Montagna,L.,Pederzoli,P.,et al. (2009). クローディン5および7の発現パターンは、膵臓の膵臓芽細胞腫、腺房細胞および内分泌腫瘍から固体偽乳頭を区別する。 アム… J.Surg.Pathol. 33, 768–774. ドイ:10.1097/pas.0b013e3181957bc4
PubMed要約/CrossRef全文/Google Scholar
Del Vecchio,G.,Tscheik,C.,Tenz,K.,Helms,H.C.,Winkler,L.,Blasig,R.,et al. (2012). カプレートナトリウムは、上皮および内皮細胞のタイトな接合部で一過性クローディン-5含有障壁を開きます。 モル ファーム 9, 2523–2533. 土井:10.1021/mp3001414
PubMed要約/CrossRef全文/Google Scholar
ることができるようになりました。 Laurateはclaudin-5のリバーシブルの再配置によって堅い接続点の開始によって腸の上皮細胞モデルHT-29/B6の小さい分子のためのparacellular細道に浸透する。 ファーム ドードルレセア-ドードルレセア- 31, 2539–2548. 土井:10.1007/s11095-014-1350-2
PubMed Abstract|CrossRef全文|Google Scholar
とができるようになることを期待しています。 中枢神経系の炎症における脈絡叢の関与。 マイクロスク… 技術士第一次試験の合格者は? 52, 112–129. 土井: 10.1002/1097-0029(20010101)52:1<112::aid-jemt13>3.0.co;2-5
CrossRef全文|Google Scholar
Florian,P.,Amasheh,S.,Lessidrensky,M.,Todt,I.,Bloedow,A.,Ernst,a.,et al. (2003). 血管条縁細胞のタイトな接合部のクローディン。 バイオケム バイオフィス・バイフィス・バイフィス (株)エス-エム-エス-エス 304, 5–10. doi:10.1016/s0006-291x(03)00498-4
CrossRef全文|Google Scholar
古瀬理,秦理,古瀬理,古瀬理,古瀬理,古瀬理,古瀬理,古瀬理,古瀬理 ら,吉田洋,原武A,杉谷洋,ら. (2002). クローディン-1欠損マウスからの教訓:クローディンベースのタイトジャンクションは、哺乳類の表皮障壁のために重要です。 J.Cell Biol. 156, 1099–1111. ドイ:10.1083/jcb.200110122
PubMed要約/CrossRef全文/Google Scholar
とができるようになりました。 腸上皮クローディン:恒常性および炎症における発現および調節。 アン N.Y.Acad. サイ… 1397, 66–79. 土井:10.1111/nyas.13360
Pubmed要約/CrossRef全文/Google Scholar
とができるようになりました。 Claudin-5:神経機能のゲートキーパー。 流体Barr。 16:4321
Günzel,D.,Amasheh,S.,Pfaffenbach,S.,Richter,J.F.,Kausalya,P.J.,Hunziker,w.,et al. (2009). Claudin-16はMDCKの細胞のtranscellular Cl分泌に影響を与えます。 J.フィジオール。 ロンド 587, 3777–3793. 土井:10.1113/jphysiol.2009.173401
PubMed要約/CrossRef全文/Google Scholar
橋本裕,白倉健,岡田裕,武田弘,遠藤健,田村雅人ら (2017). Claudin-5-bindersは、哺乳類モデルの血液脳関門を横切る溶質の浸透を強化する。 J.Pharmacol. 経験値 Ther。 363, 275–283. ドイ:10.1124/jpet.117.243014
Pubmed要約/CrossRef全文/Google Scholar
Koda,R.,Zhao,L.N.,Yaoita,E.,Yoshida,Y.,Tukita,S.,Tamura,a.,et al. (2011). 糸球体のpodocytesのclaudin-5の新しい表現。 細胞組織Res.343,637-648. ドイ:10.1007/s00441-010-1117-y
PubMed要約/CrossRef全文|Google Scholar
Konrad,M.,Schaller,A.,Seelow,D.,Pandey,A.V.,Waldegger,S.,Lesslauer,a.,et al. (2006). タイトジャンクション遺伝子クローディン19(CLDN19)の変異は、腎マグネシウム消耗、腎不全、および重度の眼の関与に関連付けられています。 アム… J.ハム ジュネット 79, 949–957. 土井: 10.1086/508617
PubMed Abstract|CrossRef全文|Google Scholar
クリュッグ,S.M.,Amasheh,M.,Dittmann,I.,Christoffel,I. とができるようになりました。 腸の細胞の三細胞堅い接続点を渡る高分子の浸透の増強物としてナトリウムのcaprate。 バイオマテリアル34,275-282. 土井:10.1016/j.生体材料.2012.09.051
Pubmed要約/CrossRef全文/Google Scholar
Leduc-Nadeau,A.,Lahjouji,K.,Bissonnette,P.,Lapointe,J.Y.,And Bichet,D.G.(2007). アフリカツメガエルlaevis卵母細胞からの原形質膜の精製のための新しい技術の精緻化。 アム… J.フィジオール。 セル 292、C1132-C1136。
ることができると考えられている。 Caco-2細胞における中鎖脂肪酸によるタイトな接合透過性の細胞内調節による吸収増強。 J.Pharmacol. 経験値 Ther。 284, 362–369.
とができるようになりました。 口頭薬剤の吸収の促進のナトリウムのcaprateの安全そして効力:in vitroから医院への。 Adv.ドラッグデリバリー. 61、1427年-1449年。 doi:10.1016/j.addr.2009.09.006
PubMed要約/CrossRef全文/Google Scholar
Milatz,S.,Krug,S.M.,Rosenthal,R.,Gunzel,D.,Muller,D.,Schulzke,J.D.,et al. (2010). Claudin-3は、電荷と非荷電溶質のいずれかのイオンのタイトジャンクションのシール成分として機能します。 バイオヒム バイオフィス・バイフィス・バイフィス アクタ1798,2048-2057. 土井:10.1016/j.bbamem.2010.07.014
Pubmed要約/CrossRef全文/Google Scholar
ミネタK.,山本Y.,山崎Y.,田中H.,多田Y.,斎藤K.,et al. (2011). クローディン-マルチジーン-ファミリーの拡大を予測した。 FEBS Lett. 585, 606–612. 土井:10.1016/j.febslet.2011.01.028
Pubmed要約/CrossRef全文/Google Scholar
Nenni,M.J.,Fisher,M.E.,James-Zorn,C.,Pells,T.J.,Ponferrada,V.,Chu,S.,et al. (2019). Xenbase:ヒトの疾患をモデル化するためのアフリカツメガエルの使用を促進する。 フロント フィジオール 10:154. ドイ:10.3389/fphys.2019.00154
PubMed要約|CrossRef全文|Google Scholar
ニッタ,T.,秦,M.,後藤,S.,瀬尾,Y.,佐々木,H.,橋本,N.,et al. (2003). Claudin-5欠損マウスにおける血液脳関門のサイズ選択的緩み。 J.Cell Biol. 161, 653–660. ドイ:10.1083/jcb.200302070
PubMed要約/CrossRef全文/Google Scholar
大槻,S.,佐藤,S.,山口,H.,鴨井,M.,浅島,T.,寺崎,T.(2007). クローディン-5の外因性発現は、培養ラット脳毛細血管内皮細胞におけるバリア特性を誘導する。 J.Cell Physiol. 210, 81–86. doi:10.1002/jcp。20823
PubMed要約/CrossRef全文/Google Scholar
Piontek,J.,Fritzsche,S. ら,cording,J.,Richter,S.,Hartwig,J.,Walter,M.,et a l. (2011). ヘテロポリマーのタイトジャンクション鎖の分子組織の原理を解明する。 セルモル… ライフサイエンス 68, 3903–3918. ドイ:10.1007/s00018-011-0680-z
PubMed要約/CrossRef全文|Google Scholar
Piontek,J.,Winkler,L.,Wolburg,H.,Muller,S.L.,Zuleger,N.,Piehl,C.,et al. (2008). タイトジャンクションの形成:古典的なクローディン間のホモフィリック相互作用の決定要因。 FASEB J.22,146-158. ドイ:10.1096/fj.07-8319com
PubMed要約/CrossRef全文/Google Scholar
とができるようになりました。 CaprateはブタのPeyerのパッチの小胞関連付けられた上皮の腸の障壁機能を調整します。 Int. J.モル。 サイ… 20:1418. doi:10.3390/ijms20061418
PubMed要約/CrossRef全文/Google Scholar
ることができます。 末梢および中枢神経系におけるバリア機能-レビュー。 Pflug。 アーチ ユーロ J.Phys. 469, 123–134. 土井:10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Claudin-3とclaudin-5タンパク質の折り畳みとタイトな接合部へのアセンブリは、膜貫通3(TM3)と細胞外ループ2(ECL2)セグメントの非保存残基によって制御され J.Biol. ケム 289, 7641–7653. ドイ:10.1074/jbc.m113.531012
PubMed要約/CrossRef全文/Google Scholar
Session,A.M.,Uno,Y.,Kwon,T.,Hapman,J.A.C.,Toyoda,A.,Takahashi,S.,et al. (2016). アロテトラプロイドカエルアフリカツメガエルlaevisにおけるゲノム進化。 自然538、336-343。
Soini,Y.(2011). 肺疾患のクローディン。 Resp. 12時70分現在、の最新リンクです。
鈴木浩、西澤拓、谷佳子、山崎洋、田村亜、石谷理、ら。 (2014). Claudinの結晶構造は、タイトジャンクションのアーキテクチャへの洞察を提供します。 科学344,304-307. 土井:10.1126/科学。1248571
PubMed要約/CrossRef全文/Google Scholar
Tammaro,P.,Shimomura,K.,およびProks,P.(2009). “アフリカツメガエル卵母細胞としての異種発現システムのための勉強のイオンチャネルにパッチクランプ法、カリウムチャネルのコントロールed. J.D.Lippiat(Totowa,NJ:Humana Press),127-139.
Tebbe,B.,Mankertz,J.,Schwarz,C.,Amasheh,S.,Fromm,M.,Assaf,C.,et al. (2002). タイトジャンクション蛋白質:インテグラル膜蛋白質の新規クラス-ヒト表皮およびHaCaTケラチノサイトにおける発現。 アーチスト-デルマトール… 294、14-18。 土井:10.1007/00403-001-0290-y
PubMed要約/CrossRef全文|Google Scholar
ることができる。 Caco-2細胞におけるカプレートナトリウムとデカノイルカルニチンの吸収増強機構。 J.Pharmacol. 経験値 Ther。 272, 739–743.
ターナー,J.R.(2000). タイトジャンクションに”スクイーズを置く”:細胞骨格調節を理解する。 セミン セル-デヴ… バイオル 11, 301–308. ドイ:10.1006/scdb。2000.0180
PubMed要約/CrossRef全文/Google Scholar
Van Itallie,C.M.,And Anderson,J.M.(2006). Claudinsおよび上皮のparacellular輸送。 アンヌ フィジオール牧師。 68, 403–429. ドイ:10.1146/annurev.フィジオール68.040104.131404
Pubmed要約/CrossRef全文/Google Scholar
Vedula,S.R.K.,Lim,T.S.,Kausalya,P.J.,Lane,E.B.,Rajagopal,G.,Hunziker,w.,et al. (2009). 細胞-細胞接着における一体型タイトジャンクション蛋白質によって媒介される力を定量化する。 エクパー メカ 49, 3–9. 土井:10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). タイトジャンクションclaudin-14をコードする遺伝子の変異は、常染色体劣性難聴DFNB29を引き起こします。 セル104、165-172。 ドイ:10.1016/s0092-8674(01)00200-8
CrossRef全文|Google Scholar
Wolburg,H.,Wolburg-Buchholz,K.,Kraus,J.,Rascher-Eggstein,G.,Liebner,S.,Hamm,S.,et al. (2003). 血液脳関門のタイトジャンクションにおけるクローディン-3の局在は、選択的に実験的自己免疫性脳脊髄炎とヒト神経膠芽腫多形の間に失われます。 アクタニューロパトール 105, 586–592. 土井:10.1007/00401-003-0688-z
PubMed要約/CrossRef全文|Google Scholar
Wylie,C.C.,Brown,D.,Godsave,S.F.,Quarmby,J.,And Heasman,J.(1985). アフリカツメガエル卵母細胞の細胞骨格とその発達における役割。 J.Embryol. 経験値 モーフ 89, 1–15.