Holger J Schünemann,Julian PT Higgins,Gunn E Vist,Paul Glasziou,Elie A Akl,Nicole Skoetz,Gordon H Guyatt;Cochrane GRADEing Methods Group(旧称Applicability and Recommendations Methods Group)およびCochrane Statistical Methods Group
- キーポイント:
- 14.1″調査結果の概要”表
- 14.1.1″調査結果の概要”表
- 14.1.2″所見の要約”表の結果の選択
- 14.1.3″調査結果の概要”テーブルの一般的なテンプレート
- 14.1.4 “調査結果の概要”表の作成
- 14.1.5″調査結果の概要”表における統計的考慮事項
- 14.1.5.1二分法の結果
- 14.1.5.2イベントまでの時間の結果
- 14.1.6″所見の要約”テーブルの詳細な内容
- 14.1.6.1テーブルのタイトルとヘッダー
- 14.1.6.2アウトカム
- 14.1.6.3比較器介入によるリスクの最良の推定
- 14.1.6.4介入によるリスク
- 14.1.6.5リスク差
- 14.1.6.6相対効果(95%CI)
- 14.1.6.7参加者数(研究)
- 14.1.6.8エビデンスの確実性(GRADE)
- 14.1.6.9Comments
- 14.1.6.10説明
- 14.2 エビデンスの確実性または質の評価
- 14.2.1グレードアプローチ
キーポイント:
- 介入の特定の比較のための”所見の要約”表は、検査された介入の相対的および絶対的影響の大きさ、利用可能な証拠の量、および利用可能な証拠の確
- ‘調査結果の概要’表には、各重要な結果の行が含まれています(最大7まで)。 “調査結果の要約”テーブルとインタラクティブな”調査結果の要約”テーブルの受け入れられた形式は、グレードのソフトウェアGRADEpro GDTを使用して生成するこ
- コクランは、一連のエビデンスの確実性(または質)を評価するために、グレードアプローチ(推奨評価、開発および評価のグレーディング)を採用している。
- グレードアプローチは、与えられた結果に対する一連のエビデンスの確実性の4つのレベルを指定します:高、中、低、および非常に低い。
- 確実性のグレード評価は、バイアスのリスク、不一致、間接性、不正確さ、出版バイアスの五つのドメインを考慮して決定されます。 無作為化されていない研究とまれに無作為化された研究からの証拠については、さらに3つのドメインを考慮して評価をアップグレードすることができます。
この章を次のように引用してください:Schünemann HJ、Higgins JPT、Vist GE、Glasziou P、Akl EA、Skoetz N、Guyatt GH。 第14章:”調査結果の要約”表を完成させ、証拠の確実性をグレーディングする。 In:Higgins JPT,Thomas J,Chandler J,Cumpston M,Li T,Page MJ,Welch VA(editors). Cochrane Handbook For Systematic Reviews of Interventionsバージョン6.2(2021年2月更新)。 コクラン、2021年。 Wwwから入手可能。訓練だcochrane.org/handbook.
14.1″調査結果の概要”表
14.1.1″調査結果の概要”表
“調査結果の概要”表は、レビューの主な調査結果を透明で構造化された単純な表形式で示しています。 特に、エビデンスの確実性または質(効果推定値または関連性の範囲における信頼性または確実性)、検査された介入の効果の大きさ、および主な結果に コクランレビューでは、計画および公表時に「調査結果の要約」表を組み込む必要があり、最も重要な比較を表す少なくとも1つの重要な「調査結果の要約」表を含める必要があります。 いくつかのレビューには、レビューが複数の主要な比較に対処している場合、または別々の表を必要とする実質的に異なる集団が含まれている場合など、複数の”所見の要約”表が含まれている場合があります(効果が異なる場合、または結果を別々に表示することが重要であるため)。 Cochrane Database of Systematic Reviews(CDSR)では、レビューの主要な”所見の要約”表が、バックグラウンドセクションの前の最初に表示されます。 他の”調査結果の要約”表は、結果と議論のセクションの間に表示されます。
14.1.2″所見の要約”表の結果の選択
“所見の要約”表の計画は、システマティックレビューの早期に開始され、(i)レビューおよび(ii)”所見の要約”表に含まれる結果の選 これは重要なステップであり、レビューの作成者は慎重に対処する必要があります。
最適に有用な情報を確実に生成するために、コクランレビューは、レビュー質問を作成し、患者や他の意思決定者にとって重要なすべての主要なアウトカムをリストすることから始まります(第2章および第3章を参照)。 エビデンスの確実性を評価するためのグレードアプローチ(セクション14.2参照)は、結果を意思決定にとって重要、重要、または重要でないものに分離するのに役立つ評価プロセスを定義し、運用化する。 消費者や他の意思決定者を含むレビュープロトコルに関する相談やフィードバックは、このプロセスを強化することができます。
重要なアウトカムには明らかに重要なエンドポイントが含まれる可能性が高く、典型的な例には死亡率および主要な罹患率(脳卒中や心筋梗塞など)が含まれる。 但し、それらはまた頻繁なマイナーで、まれな主要な副作用、徴候、生活環境基準、処置と関連付けられる重荷、および資源問題(費用)を表すかもしれません。 負担は、医療作業負荷が患者の機能と幸福に及ぼす影響を表し、より頻繁な検査を受けなければならないなど、患者や介護者(家族など)が嫌う介入を遵守する必要があること、または特定の介入が必要とするライフスタイルの制限が含まれる(Spencer-Bonilla et al2017)。
多くの場合、意思決定のためのすべての患者重要なアウトカムを含む質問を定式化するとき、レビュー著者はこれらのアウトカムをすべて含んでいな これは不利な結果のために特に本当です。 例えば、無作為化試験は、意図された効果、および頻繁で比較的軽微な副作用に関する証拠に寄与する可能性があるが、自殺未遂などのまれな有害な転帰については報告していない可能性がある。 第19章では、悪影響に対処するための戦略について説明します。 すべての重要な結果のデータを取得するには、非無作為化研究の結果を調べる必要があるかもしれません(第24章を参照)。 コクランは、他の人と共同で、レビュー著者がいつ非ランダム化研究を探して含めるかについての決定を支援するためのガイダンスを開発しました(Schünemann et al2013)。
レビューに無作為化試験のみが含まれている場合、これらの試験はすべての重要なアウトカムに対処できない可能性があるため、レビューの制約内でこれらのアウトカムに対処することはできない可能性がある。 レビューの作成者は、これらの制限を認識し、読者に透過的にする必要があります。 レビュー著者は、無作為化試験で十分に研究されない可能性のあるまれなまたは長期的な副作用を調べるために、非無作為化試験を含めることが奨励 これは、参加者が利益の分析に使用された研究のものとは異なる研究から害の結果が生じる可能性を高める。 レビューの著者は、そのような違いが調査結果にどのくらい影響する可能性があるかを検討する必要があり、これは人口に関連する間接性に関する懸念
非無作為化試験は、無作為化試験が結果を報告しない場合、または無作為化試験が間接性に苦しんでいる場合だけでなく、無作為化試験のエビデンスが非常に低く評価され、非無作為化試験がより高い確実性の証拠を提供する場合にも重要な情報を提供することができる。 これらの問題のさらなる議論は、第24章にも記載されています。
14.1.3″調査結果の概要”テーブルの一般的なテンプレート
“調査結果の概要”テーブルのいくつかの代替標準バージョンは、レビュー全体の一貫性と使いやすさ、意思決定者aおよび14.1.b)。 これらの形式は、伝達しようとする情報の理解の向上に焦点を当てた研究によってサポートされています(Carrasco-Labra et al2016、Langendam et al2016、Santesso et al2016)。 それらは等級のアプローチを支えるために開発される等級の公式のソフトウエアパッケージを通して利用できる:GRADEpro GDT(www.gradepro.org).
標準コクランの”所見の要約”表には、受け入れられている形式のいずれかを使用して以下の要素が含まれています。 これらのそれぞれのさらなるガイダンスは、セクション14.1.6に記載されています。
- 利用可能な証拠によって対処された人口と設定の簡単な説明(レビュー質問で定義されたものとはわずかに異なるか、狭い場合があります)。
- 実験介入と比較介入の両方を含む、”調査結果の要約”表に記載されている比較の簡単な説明。
- 最も重要かつ/または重要な健康転帰のリストであり、望ましいものと望ましくないものの両方で、7つ以下の転帰に限定されている。
- 各アウトカムの典型的な負担の尺度(例えば、比較器介入に対する例示的なリスク、または例示的な平均)。
- それぞれについて測定された効果の絶対的な大きさと相対的な大きさ(両方が適切な場合)。
- 各成果の分析に貢献する参加者と研究の数。
- 各結果(結果によって異なる場合がある)に対するエビデンス本体の全体的な確実性のグレード評価。
- コメントのためのスペース。
理想的には、”調査結果の要約”表は、レビューがリンクされる可能性のあるより詳細な表(”証拠プロファイル”として知られている)によってサポートされ、より詳細な説明を提供する。 エビデンスプロファイルには、同じ重要な健康アウトカムが含まれており、確実性のグレーディングに与える個々の考慮事項と研究の結果の両方の”所見の要約”表よりも詳細が記載されている(Guyatt et al2011a)。 彼らは、構造化されたアプローチが証拠の確実性を評価するために使用されることを保証する。 これらはコクランレビューではほとんど公表されていないが、エビデンスプロファイルは、例えば、ガイドラインの推奨を支持するためのエビデンスの確実性を考慮する際に、ガイドライン開発者によって頻繁に使用される。 レビューの著者は、GRADEpro GDTの最初の証拠プロファイルの証拠の確実性の評価を完了することによって、”調査結果の要約”表を開発することが容易になります。 その後、これをGRADEpro GDTの”調査結果の要約”形式のいずれかに自動的に変換し、公開用のインタラクティブな”調査結果の要約”を含むことができます。
二分法の結果に対する効果の大きさの尺度として、”所見の要約”表は、効果の相対的な尺度(リスク比、オッズ比、ハザードなど)と絶対リスクの尺度を提供すべきである。 他のタイプのデータでは、絶対測度のみ(連続データの平均の差など)で十分な場合があります。 効果の大きさは意味のある方法で提示されることが重要であり、メタ分析の結果のいくつかの変換を必要とする可能性がある(第15章、第15.4節および第15.5節も参照)。 複数の主要な比較を持つレビューには、それぞれの比較のための別々の”調査結果の要約”表が含まれている必要があります。
図14.1.aは、”調査結果の要約”テーブルの例を提供します。 図15.1.bは、レビューの調査結果のユーザーの理解と解釈をさらに容易にする代替形式を提供します。 異なる形式を評価するエビデンスは、”所見の要約”表に絶対的な効果の尺度としてリスク差を含めるべきであり、著者はリスク差を含む形式を使用すべきであることを示唆している。
“調査結果の概要”表の内容の詳細な説明は、セクション14.1.6に記載されています。
図14.1.”調査結果の要約”表の例
調査結果の要約(インタラクティブバージョンの場合はここをクリックしてください)
|
圧縮ストッキングは、長いフライトを取っている人々のための圧縮ストッキ |
||||||
|
<4031><1199><4031><1199><4031><1199><4031><1199><4031><1199><4031><1199><4031><1199><4031><1199><4031>: ストッキングなし |
||||||
|
結果 |
例示的な比較リスク*(95%CI) |
相対的な効果(95%CI) |
参加者数(研究) |
エビデンスの確実性(グレード) |
||
|
想定されるリスク |
対応するリスク |
|||||
|
ストッキングなし |
ストッキング付き |
|||||
|
症候性深部静脈血栓症(DVT) |
参照 コメント |
コメントを見る |
推定できない |
(9 研究) |
コメントを見る |
0 参加者は、これらの研究で症候性DVTを開発しました |
|
無症候性DVT |
低リスク人口b |
RR0.10 (0.04 を0にする。26) |
(9 研究) |
⊕⊕⊕⊕ 高い |
||
|
10 あたり1000 |
1 あたり1000 (0~3) |
|||||
|
ハイリスク人口b |
||||||
|
20 あたり1000 |
2 1000あたり (1-8) |
|||||
|
表在静脈血栓症 |
13 あたり1000 |
6 あたり1000 (2-15) |
RR0.45 (0.18へ1.13) |
(8 研究) |
⊕⊕⊕◯ モデラテック |
|
|
浮腫 飛行後の値は、0、浮腫なし、10、最大浮腫までのスケールで測定されました |
平均浮腫スコアは、 6から 6までの対照群にわたって範囲があった。9 |
介入群の平均浮腫スコアは、平均 4.7で、 が低かった(95%CI-4.9~-4。5) |
(6 研究) |
⊕⊕◯◯ Lowd |
||
|
肺塞栓症 |
コメントを見る |
コメントを見る |
推定できない |
(9 研究) |
コメントを見る |
0 参加者は、これらのstudieseで肺塞栓を開発しました |
|
死 |
コメントを見る |
コメントを見る |
ない エスティマブル |
(9 研究) |
コメントを見る |
0 参加者は、これらの研究で死亡しました |
|
副作用 |
コメントを見る |
コメントを見る |
推定できない |
(4 研究) |
コメントを見る |
ストッキングの忍容性は4つのstudiesfの副作用の不平無しで非常によいと記述されていました |
|
*想定されるリスクの基礎は、以下で提供されています 脚注。 対応するリスク(およびその95%信頼区間)は、介入群における想定されるリスクおよび介入の相対的効果(およびその95%CI)に基づいている。 CI:信頼区間;RR:リスク比;GRADE:grade Working Groupエビデンスのグレード(説明を参照)。 |
||||||
aこのレビューに含まれる九つの研究のすべてのストッキングは、膝下圧縮ストッキングでした。 四つの研究では、圧縮強度は足首で20mmHgから30mmHgであった。 それは他の四つの研究では10mmHgから20mmHgであった。 ストッキングは異なったサイズ入って来。 ストッキングが膝のまわりで余りに堅ければ膝のまわりでプールするために血を引き起こす必要な静脈のリターンを防ぐことができます。 圧縮のストッキングはきちんと合うべきである。 余りに堅いストッキングは長い飛行の皮に切れ、可能性としてはDVTの潰瘍そして高められた危険を引き起こすことができます。 いくつかのストッキングは、通常の脚のカバーよりもわずかに厚くすることができ、タイトな足の摩耗と潜在的に制限することができます。 それは良い、快適なフィット感を確保するために旅行する前に家の周りにストッキングを着用することをお勧めします。 参加者は、ほとんどの研究で飛行の2〜3時間前にストッキングを着用しました。 ストッキングの可用性とコストは異なる場合があります。
b二つの研究では、DVT、凝固障害、重度の肥満、骨または関節の問題による可動性の制限、過去二年間の腫瘍性疾患、大きな静脈瘤、またはいずれかの研究では、身長190cm以上90kg以上の参加者と定義された高リスク参加者を募集した。 リスクの高い参加者を除外した7つの研究の発生率は1でした。45%であり、高リスク参加者(少なくとも一つの危険因子を有する)を募集した二つの研究の発生率は2.43%であった。 私たちは、それぞれ異なるリスク層を表現するために10と30あたり1000を使用しています。
c信頼区間は差を超えず、わずかな増加を排除しません。
d浮腫の測定は検証されていない(結果の間接性)か、介入に盲目になっていない(バイアスのリスク)。
eイベントが非常に少なく、またはまったくなく、参加者の数が多い場合、証拠の確実性に関する判断(特に不正確さに関する判断)は、絶対的な効果に基づ ここでは、結果が適切に評価され、実際には2821研究された参加者でイベントが発生しなかった場合、確実性評価は”高い”とみなされる可能性があります。
f他の研究では、ある研究でストッキングの上端によって圧迫された膝領域の静脈瘤における表在静脈血栓症の四つの症例を除いて、副作用を報告し
図14.1.b代替”調査結果の要約”表の例
|
調査結果の概要(インタラクティブ版はこちらをクリック): |
||||||
|
子供の抗生物質に付加物としてprobiotics無しと比較されるProbiotics |
||||||
|
患者または人口:抗生物質を投与された子供 設定:入院患者および外来患者 介入:プロバイオティクス 比較: プロバイオティクスなし |
||||||
|
参加者数(研究数)) |
相対的影響 |
予想される絶対的な影響*(95%CI) |
エビデンスの確実性 |
|||
|
プロバイオティクスなし |
プロバイオティクスと |
違い |
||||
|
下痢の発生率:プロバイオティクス投与量5億CFU/日 フォローアップ: 10日から3ヶ月 子供<5歳 |
子供<5歳 |
⊕⊕⊕⊝ moderateb バイアスのリスクによる |
おそらく下痢の発生率を減少させます。 |
|||
|
1474 (7 研究) |
RR0.41 (0.29~0.55) |
22.3%a |
8.9% (6.5 に12.2) |
13.4% (10.1~15.8少ない) |
||
|
子供>5歳 |
子供>5歳 |
⊕⊕⊝⊝ lowb,c バイアスと不正確さのリスクによる |
下痢の発生を減らすかもしれません。 |
|||
|
624 (4 研究) |
RR0.81 (0.53~1.21) |
11.2%a |
9% (5.9 に13.6) |
2.2% 児童数 (5.3人から2人まで)あと4) |
||
|
有害事象の追跡:10~44日 1575件(11件の研究) |
1.8%a |
2.3% (0.8 に3.8) |
0.5% (1件~2件を表示)) |
⊕⊕⊝⊝ lowf,g バイアスと不一致のリスクによる |
有害事象にはほとんど、あるいは全く違いがあるかもしれません。 |
|
|
下痢の持続時間 フォローアップ: 10日~3ヶ月 897(5件)) |
プロバイオティクスを含まない下痢の平均持続時間は4日であった。 |
0.6 日数が少ない (1.18~0.02日が少ない) |
⊕⊕⊝⊝ lowh,i 不正確さと矛盾のため |
下痢の持続時間を減少させる可能性があります。 |
||
|
一日あたりの便 フォローアップ: 10日~3ヶ月 425(4件)) |
プロバイオティクスを含まない一日あたりの平均便は、一日あたり2.5便であった。 |
0.3 一日あたりの便の数 (0.6から0少ない) |
⊕⊕⊝⊝ lowj,k 不正確さと矛盾のため |
一日あたりの便にはほとんど、あるいはまったく違いがあるかもしれません。 |
||
|
*対照群におけるリスクの基礎(例えば、研究全体の対照群リスクの中央値)は、脚注に記載されている。 介入群におけるリスク(およびその95%信頼区間)は、比較群における想定されるリスクおよび介入の相対的効果(およびその95%CI)に基づいている。 CI:信頼区間;RR:リスク比。 |
||||||
|
説明 対照群のリスク推定値は、対照群のプールされた推定値から来ています。 利用可能なケース分析に基づく相対効果 bフォローアップの損失が高いため、バイアスのリスクが高い。 c事象が少ないことによる不正確さと信頼区間には、かなりの利益または害が含まれます。 d副作用:発疹、吐き気、鼓腸、嘔吐、痰の増加、胸痛、便秘、味覚障害および食欲不振。 eリスクはプールされたリスク差から計算した。 fバイアスのリスクが高い。 有害事象について報告された試験は16件中11件のみであり、選択的な報告バイアスが示唆されています。 多数のプロバイオティクス剤および投与量が比較的少数の試験の中で評価され、投与された多くのプロバイオティクス剤および投与量の安全性に結論を導き出す能力が制限された。 h深刻な原因不明の不一致(大きな異質性I2=79%、P値、点推定値および信頼区間はかなり異なる)。 私は深刻な不正確さ。 下痢の0.02少ない日の上限は、患者が重要であるとはみなされません。 j深刻な原因不明の不一致(大きな異質性I2=78%、P値、点推定値および信頼区間はかなり異なる)。 k深刻な不正確さ。 95%信頼区間には効果が含まれておらず、1日あたりの0.60便の下限は疑わしい患者の重要性を有する。 |
||||||
14.1.4 “調査結果の概要”表の作成
グレードワーキンググループのソフトウェア、GRADEpro GDT(www.gradepro.org GRADEのインタラクティブハンドブックを含む)は、”調査結果の要約”表の作成におけるレビュー著者を支援するために利用可能です。 GRADEproは、比較グループのリスクと効果推定値(レビュー作成者によって入力されたか、RevManで生成されたファイルからインポートされた)に関するデータを使用して、実験的介入に関連する相対的な効果と絶対的なリスクを生成することができます。 さらに、成績評価のプロセスを通じてユーザーを導き、レビューのスタンドアロンテーブルとして使用できるテーブルを作成します(RevManやRevMan Webとの統合などのソフ
14.1.5″調査結果の概要”表における統計的考慮事項
14.1.5.1二分法の結果
“調査結果の概要”表には、二分法の結果に対する絶対的および相対的な効 リスク比、オッズ比およびリスク差は、二つのグループを二分的なアウトカムデータと比較する異なる方法である(第6章、セクション6.4.1を参照)。 さらに、分析の焦点となる事象(例:「はい」または「いいえ」)に応じて、2つの異なるリスク比があります(第6章、セクション6.4.1.5を参照)。 非ゼロ介入効果の存在下では、比較群の研究間の任意の変動はリスク(すなわち 関心の介入なしに、例えば異なる集団で発生する事象のリスクの変動)は、これらの措置の複数がすべての研究で真に同じであることを不可能にする。
疫学では、効果の相対的尺度は、あるシナリオから別のシナリオへの効果の絶対的尺度よりも一貫していると長い間仮定されてきました。 この仮定を支持する経験的証拠がある(Engels et al2000、Deeks and Altman2001、Furukawa et al2002)。 このため、メタ分析では、一般的にリスク比またはオッズ比のいずれかを効果の尺度として使用する必要があります(第10章、第10.4.3節参照)。 これに対応して、相対効果の単一の推定値は、絶対効果の単一の推定値よりも適切な要約である可能性が高い。 相対的な効果が実際に研究間で一貫している場合、異なる比較グループのリスクは、絶対的な利益のために異なる意味を持つことになります。 たとえば、リスク比が一貫して0の場合。図75に示すように、実験的介入は、介入群で80%から60%の比較群リスクを低減する(絶対リスク低減20%ポイント)が、介入群で20%から15%の比較群リスクを低減する(絶対リスク低減5%ポイント)。
‘調査結果の概要’表は、一貫した相対的効果の仮定を中心に構築されています。 したがって、異なるコンパレータグループリスクに対するこの効果の影響を考慮することが重要です(これらは、多くのソースから導出または推定することができ、セクション14.1を参照してください。6.3),予後の証拠のための証拠の確実性の評価を必要とする可能性があります(Spencer et al2012,Iorio et al2015). 任意の比較群リスクについて、対応する介入群リスク(すなわち、介入を伴う絶対リスク)をメタ分析的リスク比またはオッズ比から推定することが “対応するリスク”列に記載されている数字は、隣接する列の”リスク”に固有のものであることに注意してください。
メタ分析リスク比(RR)および想定されるコンパレータリスク(ACR)について、対応する介入リスクは次のように求められます:
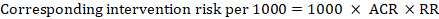 .例として
.例として
を図14.1に示します。a、無症候性深部静脈血栓症(DVT)のメタ分析リスク比はRR=0.10(95%CI0.04~0.26)である。 Acr=10/1000=0.01のコンパレータリスクを仮定すると、次のようになります:
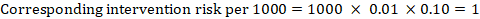 .
.
メタ分析オッズ比(OR)と仮定されたコンパレータリスクACRについて、対応する介入リスクは次のように得られます:
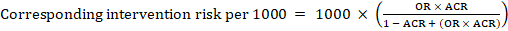 .
.
対応する介入リスクの上部信頼限界と下部信頼限界は、それぞれRRまたはまたはそれらの上部信頼限界と下部信頼限界によって(例えば、0を置10で0.04、次に0.26で、この例では)。 このような信頼区間には、想定される比較器リスクに不確実性は組み込まれていません。
リスク比を扱う場合、メタ分析に使用されたのと同じ「イベント」の定義を使用することが重要です。 たとえば、メタ分析がイベントとして(生存とは対照的に)「死」に焦点を当てた場合、「調査結果の要約」表の対応するリスクも「死」を参照する必要があります。
メタアナリシスにおいて一貫したリスク差を仮定する明確な根拠がある(まれな)状況では、原則として、関連する”想定されるリスク”とそれに対応するリスクについてこれを提示し、想定されるリスクごとに対応する(異なる)相対効果を提示することが可能である。
リスク差は、ACRと対応する介入リスクの差(または実験介入とコンパレータ介入の差)を表します。
メタ分析リスク比(RR)および想定コンパレータリスク(ACR)については、対応するリスク差が次のように求められます(リスクはパーセンテージまたはパーセンテージポイ):
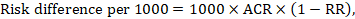
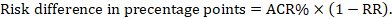
例として、図14.1に示します。b5歳未満の小児の下痢について、メタ分析リスク比は0.41(95%CI0.29~0.55)である。 コンパレータグループのリスクを22.3%と仮定すると、:
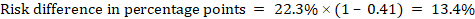 .
.
メタ分析オッズ比(OR)と仮定されたコンパレータリスク(ACR)については、絶対リスク差は(パーセンテージポイント)として得られます):
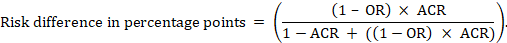
絶対リスク差の上限と下限の信頼限界は、RRまたはまたはをそれぞれ上限と下限の信頼限界で置き換えながら上記の計算を再実行することによ このような信頼区間には、想定される比較器リスクに不確実性は組み込まれていません。
14.1.5.2イベントまでの時間の結果
イベントまでの時間の結果は、特定のイベント(死など)が発生するかどうかといつ発生するかを測定する(van Dalen et al2007)。 比較グループに対する実験的介入の事象発生までの時間に対する影響は、通常、ハザード比(HR)を用いて測定される(第6章、第6.8.1節参照)。
ハザード比は、相対的な効果推定値を表しています。 これは、特定の集団の絶対的なリスクおよび他の解釈可能な量を得るために様々な方法で使用することができる。 ここでは、以下の観点からハザード比を再表現する方法について説明します: 特定の期間内の事象の絶対リスク;(i i)特定の期間内の事象の絶対リスク;および(iii)事象までの時間の中央値。(i i)特定の期間内の事象の絶対リスク;(i i)特定の期間内の事象の絶対リスク;および(i i)特定の期間内の事象の絶対リスク。 すべての方法は、一貫した相対的影響(すなわち、ハザード比が時間の経過とともに変化しないこと)を前提に構築されています。
(i)特定の期間内のイベントフリー生存の絶対リスクイベントフリー生存(全生存など)は、個々の研究によって一般的に報告されている。 事象のない生存として測定された事象までの時間の結果に対する絶対的な効果を得るために、要約HRは、比較群における事象のない患者の仮定された割合と組み合わせて使用することができる(Tierney et al2007)。 この割合の患者は、観察期間に固有のものである。 ただし、この期間を厳密に指定する必要はありません。 例えば、事象のない患者の50%の割合は、1年にわたって観察された事象率が高い患者、または2年にわたって観察された事象率が低い患者に適用され

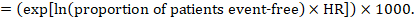
例として、メタ分析ハザード比が0.42(95%CI0.25~0.72)であるとします。 2年間のACR=900/1000=0.9で、イベントフリー生存率(例えば、生存している全生存者の場合)のコンパレータグループのリスクを仮定すると、次のようになります。:

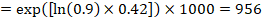
その956人あたり1000人が2年で実験的介入で生きているように。 リスクの導出は、コメントまたは脚注で説明する必要があります。
(ii)特定の期間内のイベントの絶対リスクこの絶対効果を得るために、再び要約HRを使用することができる(Tierney et al2007):

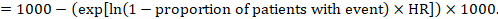
この例では、2年間のACR=100/1000=0.1での事象(例えば死亡率、死亡者)の比較群リスクを仮定するとします。 私達は得ます:

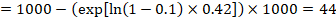
その44人あたり1000人が2年で実験的介入で死んでしまうようにします。
(iii)事象までの時間の中央値絶対数ではなく、介入群および比較群における事象までの時間は、月または年の生存時間の中央値として表すことがで 生存時間の中央値を得るために、プールされたH Rは、比較群における仮定された生存時間の中央値に適用することができる(Tierney e t a l.2007):
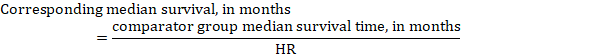
この例では、比較群の生存期間中央値が80ヶ月であると仮定すると、次のようになります:
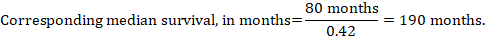
タイム-ツー-イベント分析の結果を再表現するためのこれらのオプションのすべてについて、対応する介入リスクの上限と下限の信頼限界は、HRをそれぞれ 繰り返しになりますが、二分的な結果については、このような信頼区間には、想定される比較グループリスクに不確実性が組み込まれていません。 これは、死亡率が低くまたは中程度であり、対応する多数の打ち切り患者(すなわち、リスクのある患者の数が少なく、打ち切り率が高い)を伴う長期生存に
14.1.6″所見の要約”テーブルの詳細な内容
14.1.6.1テーブルのタイトルとヘッダー
各”所見の要約”テーブルのタイトルは、人口の観点から囲まれ、介入の比較 図14.1に示します。a、人口は長い飛行機の飛行を取っている人々であり、介在は圧縮のストッキングであり、制御は圧縮のストッキングではない。
各”所見の要約”表の最初の行には、以下の”ヘッダー”情報を提供する必要があります。
患者または人口これは、関心のある人口(および場合によっては亜集団)、理想的には、介入が指示される最も重要な有害な結果のリスクの大きさをさらに明確にする。 例えば、長距離飛行の人々はDVTのための異なった危険にあるかもしれません; 選択的セロトニン再取り込み阻害剤(Ssri)を使用している人は、副作用のリスクが異なる可能性がありますが、心房細動を有する人は、脳卒中の年間リスクが低(<1%)、中程度(1%〜4%)、または高(>4%)である可能性があります。
設定これは、調査結果の要約の適用性を他の設定(ヨーロッパおよび北米のプライマリケアなど)に制限する可能性のある医療問題の設定の特定の特
介入実験的介入。
比較比較器の介入(特定の介入なしを含む)。
14.1.6.2アウトカム
“所見の要約”表の行には、意思決定に不可欠なすべての望ましくない健康アウトカム(重要度順に記載)を含める必要があります。 レビューにより多くの成果がある場合は、レビュー作成者はテーブルからあまり重要でない成果を省略する必要があり、プロトコル開発中にレビューに重要または重要な成果を選択する決定を行う必要があります(第3章を参照)。 レビューの著者は、結果の測定のための時間枠(例えば90日または12ヶ月)と機器のスコアの種類(例えば0から100までの範囲)を提供する必要があります。
レビュー作成者は、データが利用可能かどうかにかかわらず、事前に指定された重要かつ重要な結果を表に含める必要があることに注意してください。 しかし、彼らは、プロトコルが書かれたか、分析が行われた後にのみアウトカム(例えば、重篤な悪影響)の重要性が知られる可能性に注意する必要があり、”所見の要約”表にこれらを含めるために適切な措置を講じる必要があります。
“調査結果の要約”表には、異なる比較リスクおよび効果サイズに対する母集団のサブグループにおける効果を個別に含めることができます。 たとえば、図14.1です。b効果は、5歳未満の子供と5歳以上の子供に別々に提示されます。 レビューの著者はまた、異なる集団のために別々の”所見の要約”表を作成することを選択することがで
レビュー著者は重篤な有害事象を含めるべきであるが、軽度の有害事象を単一の結果として組み合わせて説明的な脚注に記述することは可能である(独立していない限り、すなわちある有害事象を経験した参加者が他の有害事象を経験する可能性がない限り、事象を一緒に追加することは適切ではないことに注意してください)。
複数の時点で測定された結果は、特定の問題を表します。 一般的に、表を単純に保つために、レビュー作成者は、意思決定に重要な結果に対してのみ複数の時点を提示する必要があります。 残りの部分は、可能な限り共通の時点で提示する必要があります。
レビューの著者は、”調査結果の要約”表に継続的なアウトカム測定値を提示することができ、これらを対象読者に解釈可能にするよう努力すべきである。 これは単位が明確、容易に解釈可能、例えば、苦痛の日、または頭痛の頻度であることを要求し、使用されるあらゆる測定用具の名前そしてスケールは示されるべきである(例えば0から100まで及ぶ視覚アナログのスケール)。 しかし、多くの測定機器は、非専門家の臨床医または患者、例えば、ベックうつ病在庫または生活の質スコアのポイントによって容易に解釈できません。 これらのために、より解釈可能な提示は、>50%の改善のような二分的な結果に連続を変換することを含むかもしれない(第15章、第15節を参照してください。5).
14.1.6.3比較器介入によるリスクの最良の推定
レビュー著者は、比較器介入を受けた参加者に最大三つの典型的なリスクを提供する必要があります。 二分法の結果については、結果の頻度に応じて、100人または1000人あたりのイベントを経験している人の数(固有振動数)の形で提示することをお勧めします。 連続的な結果の場合、これは測定された結果の平均値または中央値として記載されます。
推定または想定されるコンパレータ介入リスクは、レビュー自体から得られた異なる患者グループの典型的なリスク、レビューにおける個々の代表的な研究、または予後研究またはその他のエビデンスの系統的レビューから得られたリスクの評価に基づいている可能性がありますSpencer et al2012,Iorio et al2015。 理想的には、リスクは、臨床医が提示された特徴に基づいて容易に識別できるグループを反映するであろう。
説明的な脚注は、必要に応じて対応する期間を含め、各比較グループリスクのソースまたは理論的根拠を指定する必要があります。 図14.1に示します。aの臨床医は容易にそれらからの深い静脈の血栓症のための危険率の個人をなしで区別できます。 ベースラインリスクの変動がほとんどないことが知られている場合、レビュー著者は、研究全体で中央値比較群リスクを使用することができます。 典型的なリスクが知られていない場合、オプションは、含まれている研究からリスクを選択することです,高のための二番目に高いと低リスクの母集団のための二番目に低いを提供します.
14.1.6.4介入によるリスク
二分法の結果については、レビュー著者は、各比較群リスクに対応する絶対リスクと信頼区間を提供する必要があります。 (実験的)介入によるこの絶対リスクは、通常、相対効果列に提示されたメタ分析結果から導出される(セクション14.1.6.6を参照)。 式はセクション14.1に記載されています。5. レビューの作成者は、比較器の介入によるリスクと同じ形式で絶対的な効果を提示する必要があります(セクション14.1.6.3参照)、例えば1000人あたりのイベン
連続的な結果については、平均の差または平均の標準化された差をその信頼区間で提示する必要があります。 これらは通常、メタ分析から直接取得されます。 説明文は、図14.1のように、意味を明確にするために使用する必要があります。aおよび14.1.b.
14.1.6.5リスク差
二分法の結果については、”所見の要約”表形式のいずれかを追加オプションとして使用してリスク差を提供することができます図14.1を参b)。 このリスク差は、実験介入と比較介入の差を表し、通常は相対効果列に示されたメタ分析結果から導出される(セクション14.1.6.6を参照)。 式はセクション14.1.5に記載されています。 レビューの作成者は、比較器介入による想定および対応するリスクと同じ形式でリスク差を提示する必要があります(セクション14.1.6.3参照)。
継続的な結果については、”所見の要約”表にこのオプションが含まれている場合、平均差をここに表示し、”対応するリスク”列を空白のままにすることがでb)。
14.1.6.6相対効果(95%CI)
相対効果は、通常、同じ効果尺度に基づいて行われたメタ分析から得られた、それに付随する95%信頼区間を伴うリスク比またはオッズ比( 比較器介入リスクが低く、効果が小さい場合、リスク比とオッズ比は類似しているが、比較器グループリスクが増加する場合、かなり異なる可能性がある。 メタアナリシスは、レビュー著者が適切と考えるものに応じて、固定効果またはランダム効果のいずれかの仮定を含み、相対効果はそれぞれ介入の効果の推定値、または研究全体の介入の平均効果の推定値のいずれかであることを意味する。
14.1.6.7参加者数(研究)
この列には、各結果について含まれる研究で評価された参加者数と、これらの参加者に貢献した研究数を含める必要があります。
14.1.6.8エビデンスの確実性(GRADE)
レビューの著者は、エビデンスの確実性(エビデンス本体の品質または効果推定値の信頼性とも呼ばれる)についてコメントす レビューの著者は、グレードワーキンググループ(Atkins et al2004、Guyatt et al2008、Guyatt et al2011a)によって開発された特定の証拠グレーディングシステムを使用する必要があります。 グレードアプローチでは、エビデンスの本文の確実性を、結果によって「高い」、「中程度」、「低い」、または「非常に低い」と分類します。 これは判断の結果ですが、判断プロセスは透明な構造の中で動作します。 一例として、要約がバイアスのリスクが低いいくつかのランダム化試験であった場合、確実性は”高い”となりますが、バイアス、不一致、間接性、不正確さ、または出版バイアスのリスクについて懸念がある場合、確実性の評価は低くなります。 “高い”確実性以外の判断は、説明脚注または”調査結果の要約”表の”コメント”欄を使用して透明にする必要がありますセクション14.1.6.10参照。
14.1.6.9Comments
‘Comments’フィールドの目的は、行で識別された情報またはデータの解釈を支援することです。 たとえば、これは結果尺度の妥当性または効果の大きさに関連付けられている変数の存在にある可能性があります。 結果に関する重要な注意事項は、ここでフラグを立てる必要があります。 すべての行にコメントが必要なわけではなく、コメントを保証するものがない場合は空白のままにすることをお勧めします。
14.1.6.10説明
全体的な成績評価などの”所見の要約”表の判断を支持するために、詳細な説明を脚注として含める必要があります。 説明は、コンテンツの重要な側面の根拠を説明する必要があります。 表14.1.便利な説明のためのリストのガイダンス。 説明は簡潔で、有益で、関連性があり、理解しやすく、正確でなければなりません。 脚注に説明が十分に記述されていない場合は、レビューの作成者は、レビューの結果および議論のセクションで問題の詳細を提供する必要があります。
表14.1.”調査結果の要約”(SoF)表に有用な説明を提供するためのガイダンス。 Santesso et alから適応された(2016)
一般的なガイダンス
- 可能であれば、読者の情報をテーブルに直接入力します(フォローアップの期間や使用されるスケールに関する情報など)。
- 一般的に、ベースラインリスクの原因に関する情報を提供するなどの具体的な理由がない限り、説明のセクションに参考文献を引用しないでください(ポイ
- 絶対的な影響を計算するために使用されるベースラインリスクに関する情報源を提供します。
- 表が完成したら、すべての説明を見直して、書き直したり組み合わせたりした場合に複数回参照できるかどうかを判断します。
- エビデンスのアップグレードとダウングレードの理由を提供し(下記のドメイン固有のガイダンスを参照)、GRADEpro GDTソフトウェアを使用してグレードガイダンス
- 特定の結果についての証拠の本体は、影響を受けたドメインに深刻なまたは非常に深刻な問題があると判断される可能性があります(またはROBINS-Iを使 したがって、ダウングレードのレベルの数を示すことは有用かもしれません(例えば、バイアスのリスクのために一つのレベルによってダウングレード)が、表にあるものの繰り返しを避けること(および定型的またはアルゴリズム的な報告の印象)。 証拠プロファイルでは、この情報はすでにテーブルのセルにあります。
- エビデンスの確実性についての説明は、主に確実性を変更するときに必要とされるが、エビデンスの確実性が変更されていないが、この決定が他の人に疑問視される可能性がある場合には、説明を追加することを検討する。 これは、意見の相違の理由を理解するのに役立ちます。
- 表がレビューの方法の説明として使用されていないことを確認してください(例えば、統計分析の理由を説明しないでください)。
- メタアナリシスで統計的に組み合わせることができなかった結果の結果を入力します。 結果列のSoFテーブルに直接入力します。 これらの結果を伝えるために説明が必要ではないかもしれません。 意図された聴衆にとって有益であると考えられる場合は、コメント欄に介入効果の補完的な推定値(例えば、利益と害のために治療するために必要な数、リスク差をパーセンテージとして表現し、継続的な結果を最小重要な差単位で表現する)を追加する。
- 成績プロセスに関する説明に記載されている情報を使用して、要約バージョンや議論を含むレビューの他の重要な部分に通知します。
有用な説明を書くためのドメイン固有のガイダンス
バイアスのリスク
- バイアスのリスクが高い研究の数、またはメタ分析で提供する情報の量
- 多数派、少数派、すべて、一部またはなしなどの用語を使用する。
- 無作為化試験については、配分順序の隠蔽、選択的アウトカム報告などを含む特定の基準に言及する。 無作為化されていない研究の場合は、使用するツールに基準を記述します(例:ROBINS-Iツールの使用)。
- は、感度分析でバイアスのリスクの影響が検討されたかどうかを示します。 適切な場合は、推定値へのバイアスのリスクが高い研究の貢献に言及してください。
- 研究デザインに関する情報は、異なる研究デザインが含まれている場合、特に、SoFに説明に含まれることがあります。
不整合
- は、統計的検定や測定値(I2、Chi2、Tau)、信頼区間の重複、ポイント推定値の類似性など、不整合を判断するために使用される尺度を示します。
- 矛盾がI2に基づいている場合は、それをかなり、実質的、中程度、または重要ではないと記述してください。
- 該当する場合は、PICOによるサブグループ分析(患者、介入、比較、結果)で異質性が検討されたかどうか、および異質性の他の潜在的な理由があるかどうかを
- 結果のための単一の研究の場合、”該当しない”ではなく”なし”があると言います。
不正確さ
- は、サンプルサイズまたはイベント数が計算された最適な情報サイズ、または”経験則”(例:400イベント)を満たしていない場所を示します。 不正確な理由としての研究の数への参照を避けてください。
- は、信頼区間に効果が小さいか全くないか、および重要な利益または害の可能性が含まれているかどうかを示します。 既知の場合は、重要な利益のしきい値の数値を提供します。
- 結果を統計的または非統計的に有意であると報告することは避けてください。
アップグレード
- アップグレードの理由に言及:大きな効果のために、用量応答勾配、またはもっともらしい残留反対交絡が証拠の確実性を高めます。
- 大きな効果の場合は、相対効果が>2または>5のいずれかであるかどうかを報告します。 用量応答勾配については、介入のレベルと結果への影響を提供する。 ドメイン’もっともらしい残差反対交絡’については、推定値に対する交絡因子の効果を記述します。
14.2 エビデンスの確実性または質の評価
14.2.1グレードアプローチ
勧告、評価、開発および評価ワーキンググループ(グレードワーキンググループ)のグレードは、エビデンスの確実性をグレーディングするためのシステムを開発した(Schünemann et al2003、Atkins et al2004、Schünemann et al2006、Guyatt et al2008、Guyatt et al2011a)。 世界保健機関(WHO)、アメリカ医師大学、アメリカ血液学会(ASH)、カナダ医薬品衛生技術庁(CADTH)、英国国立衛生臨床卓越研究所(NICE)を含む100以上の組織がグレードシステム(GRADE system)を採用している。www.gradeworkinggroup.org
コクランもこのアプローチを正式に採用しており、すべてのコクランレビューではGRADEを使用して重要なアウトカムのエビデンスの確実性を評価すべきである(MECIRボックス14.2参照。a)。
メシルボックス14.2.介入レビューの実施のための関連する期待
|
C74:証拠の本体の確実性の評価(必須)) |
|
|
各結果の証拠のボディの確実性を査定し、検討のテキスト内の証拠の確実性についての結論を引き出すのに5つの等級の考察(バイアスの危険、効果の一貫性、不正確さ、間接性および出版のバイアス)を使用しなさい。 |
GRADEは、研究全体の結果による介入の効果に対する信頼性を要約するための最も広く使用されているアプローチです。 オンラインGRADEproツールを使用し、ソフトウェアのヘルプシステムに記載されているように使用することが望ましいです。 これは、著者チームが判断を通知するために同じ情報にアクセスしていることを確認するのに役立ちます。 理想的には、独立して働く二人の人々は、証拠の本体の確実性を評価し、任意の格下げの決定にコンセンサスビューに到達する必要があります。 レビューに「調査結果の要約」表が含まれているかどうかにかかわらず、5つのグレードの考慮事項に対処する必要があります。 議論や著者の結論でこの情報を引き出し、抽象的で平易な言葉の要約で証拠の確実性を伝えることは有益です。 |
|
C75:証拠の本体の確実性の評価を正当化する(必須) |
|
|
証拠の本体の確実性のすべての評価を正当化し、文書化する(グレードを使用したダウングレードまたはアップグレードなど)。 |
構造化されたアプローチを採用することで、証拠の解釈を策定する際の透明性が保証され、結果はユーザーにとってより有益です。 |
系統的レビューの場合、グレードアプローチは、効果または関連の推定値が特定の関心の量に近いことを確信できる程度として、一連の証拠の確実性を定 エビデンスの確実性を評価するには、研究内および横断的なバイアスのリスク研究の設計および実行または方法論的品質の制限、不一致または異質性、エビデンスの間接性、効果推定値の不正確さおよび出版バイアスのリスクセクション14.2.2を参照、ならびに効果推定値に対する信頼性を高める可能性のある領域セクション14.2.3に記載されている。 グレードシステムは、個々の結果のための証拠のボディの確実性の評価を伴います。 証拠の確実性を決定する領域についての判断は、結果または議論のセクションおよび”調査結果の要約”表の一部として記述する必要があります。
グレードアプローチは、確実性の四つのレベルを指定します図14.2。a)。 介入として評価される診断およびその他の検査(Schünemann et al2008b、Schünemann et al2008a、Balshem et al2011、Schünemann et al2012)を含む介入については、エビデンスの確実性を評価するための出発点:
- ランダム化試験; および
- 観察研究を含む介入の非ランダム化研究(NRSI)(コホート研究、ケースコントロール研究、断面研究、ケースシリーズおよびケースレポートを含むが、これらのデザイ
レビュー作成者がNRSIの情報、特に潜在的な害を評価するために依存している例がたくさんあります(第24章参照)。 さらに、レビュー著者は、無作為化試験とNRSIの両方から関連するデータを得ることができ、各タイプのエビデンスが他のエビデンスを補完する(Schünemann et al2013)。
グレードでは、無作為化試験からのエビデンスのボディは高確実性評価で始まり、NRSIからのエビデンスのボディは低確実性評価で始まります。 NRSIの低い評価は、ランダム化の欠如によって誘発される潜在的なバイアス(すなわち交絡バイアスと選択バイアス)の結果です。
しかし、ランダム化の欠如によるバイアスのリスクをカバーする評価ツールである介入の非ランダム化研究における新しいバイアスリスク(ROBINS-I)ツール(Sterne et al2016)を使用すると、すべての研究はエビデンスの高い確実性として始まる可能性がある(Schünemann et al2018)。 すべての研究計画(NRSIを含む)を高い確実性として開始するアプローチは、NRSIの評価を低い確実性の証拠として開始する初期グレードのアプローチと矛盾しない。 これは、ランダム化の欠如に伴うバイアスの固有のリスク、すなわち交絡バイアスと選択バイアスのために、NRSIからの一連の証拠は、一般的に二つのレベ NRSIを高確度から低確度に格下げしないには、交絡と選択バイアスに関する懸念を緩和するものについて、透明で詳細な正当化が必要です(Schünemann et al2018)。 現在、二つのレベルでダウン評価されていない場所の非常に少数の例が存在します。
最も高い確実性評価は、図14.2に記載されているグレード要因のいずれかに懸念がない場合の証拠です。A.レビュー著者は、図14.2の5つの要因の存在に応じて、しばしば証拠を中程度、低い、または非常に低い確実性の証拠に格下げする。a.通常、確実性評価は、各因子に対して1つのレベルで、すべての因子に対して最大3つのレベルまで低下します。 いずれかのドメインに非常に深刻な問題がある場合(例: バイアスのリスクを評価するとき、すべての研究は、フォローアップするために彼らの患者の50%以上が隠されていない、盲目であり、失われた)、証拠はその 「非常に低い確実性」の証拠よりも低く評価することはできません。
レビューの著者は、ROBINS-Iが使用されていても、一般的に健全な非ランダム化研究からの証拠を低い確実性として評価します。 しかし、そのような研究が大きな効果をもたらし、それらの効果を説明する明白なバイアスがない場合、レビュー著者はエビデンスを中程度、または効果が十分に大きければ確実性が高いと評価することができる(図14.2。a)。 非常に低い確実性レベルは、重大な問題および非体系的な臨床観察(例:症例シリーズまたは症例報告)を伴う研究に適しているが、これらに限定されない。