意義
それらのバイオマーカーの可能性に加えて、多くの生物学的プロセスおよび疾患におけるそれらの含 それらは主に、それらのバックスプライシング接合をマッピングする読み取りの存在によって検出される。 それにもかかわらず、circRNAは、環状Dnaが一般的であり、circRNAシグナルを模倣する転写産物を生じることができることが最近の研究で明らかにされているので、もはやそのような接合部を含む唯一の転写産物ではない。 したがって、この新しいタイプのキメラ転写物は、circRNA分析が行われている方法を変更し、すでに報告されている結果の一部に影響を与える可能性があ
環状Rnaは唯一のキメラ転写産物ですか?
環状RNA(circRNA)は、数年前にヒトを含む様々な生物に存在する非カノニックスプライシングRNA形態として再発見された(Salzman et al. ら、2 0 1 2;Jeck e t a l., 2013). これらは、RNAバックスプライシングイベントを介して形成された共有結合的に閉じた転写産物であり、下流エクソンのスプライス供与体が上流スプライス受容体に結合し、circrnaを線形の対応物と区別できるバックスプライシング接合が存在することを特徴とする共有結合的に閉じた転写産物につながる(図1A)(Zhang et al. ることを示した。
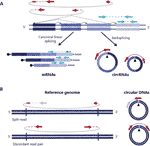
図1環状RNAとDnaの両方の検出は、接合部にまたがる読み取りに基づいています。 (A)エクソン結合と正準エクソン結合の間のバックスプライス結合は、それぞれcircrnaとmrnaを生じさせる非連続線と連続線で描かれています。 逆splicedジャンクションにまたがるペアエンド読み取りは赤で表示され、線形トランスクリプトと一致するペアエンド読み取りは青で表示されます。 (B)circRNAと同様に、環状Dna(eCCDNA)は、赤色で示される環状化事象と一致する構造読み取り変異体に基づいて検出される。
彼らの再発見以来、科学界はcircrnaに注意を喚起し、健康と病気におけるいくつかの細胞プロセスへの関与(Haque and Harries、2017)、バイオマーカーとしての潜在的な役割(Abu and Jamal、2016)、そ, 2016). 現在、circRNAは、細胞質ゾルおよび核において豊富で安定であることが知られている(Salzman e t a l. ら、2 0 1 2;Jeck e t a l. ら,2 0 1 3;Liら,2 0 1 4. ら、2 0 1 5)および生物流体中で遊離していることも見出されている(Bahn e t a l. ら,2 0 1 5;Memczakら,2 0 1 5;Memczakら, ら、2 0 1 5;Chen e t a l. ら、2 0 1 8)および細胞外小胞(Kyoung M I e t a l., 2017). Circrnaのバイオマーカーの可能性が激しく研究されている、実際には、異なる疾患のバイオマーカーである可能性が差動発現circrnaを求めて多くのケースコントロール研究 今日まで、circRNAは、癌を含むいくつかの疾患に関与している(Kristensen e t a l. ら、2 0 1 7;Arnaiz e t a l. ら、2 0 1 8)、神経障害(Akhter、2 0 1 8)、心血管疾患(Aufiero e t a l. ら、2 0 1 9)および免疫関連疾患(Iparraguirre e t a l. ら、2 0 1 7;Liu e t a l., 2019). 同時に、それらの生物発生、特性、機能、およびヒト生物学における意味を完全に理解することは、この分野の研究者にとって未解決の問題として残って
ほとんどのcircRNAの機能は不明であるが、一部のcircRNAはマイクロRNAスポンジとして作用し、マイクロRNAレベルとその活性を調節することが示されている(Hansen et al. ら、2 0 1 3;Memczakら、2 0 1 3;Memczakら、 ら、2 0 1 3;Zhengら、2 0 1 4;Chen e t a l., 2016). それらは、親遺伝子の転写を調節することによって遺伝子発現調節に関与し、線状スプライシングまたはスポンジタンパク質と競合する(Ashwal-Fluss et al. ら,2 0 1 4;Liら,2 0 1 4., 2018). 興味深いことに、リボソームプロファイリング研究は、最近、circRNAがin vitroおよびin vivoの両方で翻訳され得ることを示している(Legnini e t a l. ら、2 0 1 7;Yang e t a l., 2017).
circRNAの主な特徴であり、それらの特殊な特性の大部分を担うのは、それらの円形性である。 したがって、それらの特徴的なバックスプライス接合を検出するだけでなく、これらの分子の円形性をテストすることは、すべてのcircRNA研究の重要なポイ それにもかかわらず、多くの研究は、total RNA上のcircrnaの発見に基づいており、それによっていくつかの線形キメラ転写物をcircrnaとして解釈し、偽陽性circRNA検出を結 この問題を回避するために、ほとんどの研究は、Rnase R、Northern blotまたは電気泳動法を用いて、全RNA−seqによって見出される転写物の円形性を確認している(JeckおよびSharpless、2 0 1 4)。 しかし、これらの円形性検証はまた、全RNAから始まるcircRNAの検出がいくつかの偽陽性につながる可能性があることを確認する円形ではなく、線形であるように見える転写物を明らかにすることもある。 これらの偽陽性は、エクソンの複製や移植事象などの珍しい事象から得られた技術的な人工物または転写物に起因している(Jeck and Sharpless、2014;Szabo and Salzman、2016)。 とはいえ、バックスプライシング接合に相当する配列を含む真の生物学的に活性で機能的な線形転写物(今後はキメラ線形転写物と呼ばれる)を発見したという選択肢は、そのような線形RNAの供給源が健康な細胞について知られていないため、やや見落とされている。
キメラ線状転写物の供給源としての環状Dna
ヒトゲノムのほとんどは線状染色体で組織されているが、ミトコンドリアDNAなどのいくつかの例外や、発癌遺伝子を持つDNAサークルなどの染色体異常(例えば、二重分)が長い間受け入れられている(Benner et al. ら、1 9 9 1;Nathanson e t a l. ら、2 0 1 4;Turner e t a l. ら、2 0 1 7)および環染色体(Tumer e t a l., 2004). 最近まで、マイクロDNAのような異なる環状Dnaが存在しなかった(Shibata e t a l. ら、2 0 1 2)または染色体外環状Dna(eCCDNA)は、ヒトおよび酵母を含む異なる真核生物ゲノムの大部分からも生じることが見出された(Møller et al.,2012,2013,2014,2015,2016,2017,2018,2019,2019)。 ら、2 0 1 5;Kumar e t a l. ら、2 0 1 7;Møller et al., 2018).
環状Dnaは、線状DNAの両端が一緒に接合されているときに形成され、円化イベントと一致する構造読み取り変異体に基づいて検出される、一般的にブレークポ ら,2 0 1 0;Møllerら,2 0 1 0;Møllerら, ら,2 0 1 8;Prada−Luengo e t a l. 2019年(平成29年)1月1日現在の世帯数と人口は以下の通りである それらは通常、百塩基からメガベースサークルまでの範囲であり、完全なエクソンおよび遺伝子を含むことができる(Shibata et al. ら,2 0 1 2;Møllerら,2 0 1 2;Møllerら, ら、2 0 1 5;Kumar e t a l. ら、2 0 1 7;Turner e t a l. ら、2 0 1 7;Møller et al. ゲノムのいくつかの領域は環状DNA上でより一般的に見られるが(Sinclair and Guarente,1997;;Møller et al. ら、2 0 1 6;Turner e t a l. ら、2 0 1 7;Møller et al. ら、2 0 1 8)、ほとんどの環状DNAは無作為に発生するようである(Shibata e t a l. ら,2 0 1 2;Møllerら,2 0 1 2;Møllerら, ら、2 0 1 5;Kumar e t a l. ら、2 0 1 7;Møller et al., 2018).
興味深いことに、最近の論文でMøller et al. 健康な対照における白血球および筋肉細胞における何千ものeccdnaを同定した。 ECCDNAが転写され得るかどうかを調査するという考えで、mRNAライブラリーも筋肉組織から配列決定され、検出されたECCDNAのブレークポイント接合部を横切る転写イベン, 2018). この知見は、健康な組織中の環状DNAが転写され、circRNAのバックスプライシング配列と同等の配列を有する線状およびポリアデニル化転写物を生じさせることを示唆している(Møller et al. 2018年(平成20年)現在の世帯数と人口は以下の通りである。
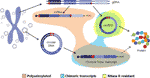
図2ゲノムDNAまたは環状DNAのいずれかから生じた異なる転写産物のグラフィカルな表現。 エクソンは紫色で着色され、バックスプライス接合またはキメラ接合は赤色で示されている。 ポリアデニル化、キメラ接合を含むとRNase R耐性転写産物は、それぞれオレンジ、青と黄色で強調表示されます。
環状Dnaの転写証拠は、一緒にその豊富さと、環状Dnaはキメラジャンクションを運ぶ線形Rnaのかなりの量の天然源である可能性があることを示唆する 多くの場合、これらのキメラジャンクションはcircrnaのバックスプライシングジャンクションと区別できないため、circRNA研究における交絡因子である可能性がある。 以下の段落では、この提案を支持するデータを説明します。
: 輝くのは金ではない
前に紹介したように、circrnaはbacksplicingと呼ばれる非標準的なスプライシングイベントで形成されます。 このバックスプライシング事象から生じる転写物は、5′-3’極性もポリアデニル化尾部もない共有結合閉ループ構造を有し、より重要なことに、それらは直鎖状転写物に対してスクランブルされたエクソン秩序の存在によって特徴付けられる(Zhang et al. ることを示した。 このスクランブルされたエクソン順序は、5’下流のシーケンスと上流の3’シーケンスを接続するバックスプライス接合で明らかになります。 したがって、すべてのcircRNA検出アルゴリズムは、circRNAの識別のための診断機能としてバックスプライス接合の存在を利用します(図1A)。
これらのバックスプライス接合の検出には、さまざまな方法が適応されています。 これらの逆spliced領域を標的とするプローブを含む市販のアレイは、バイオマーカースクリーニング研究において広く使用されている(Iparraguirre et al. ら、2 0 1 7;Liu e t a l. ら、2 0 1 7;Sui e t a l. ら,2 0 1 7;Liら,2 0 1 8., 2018). その後の検証は、多くの場合、発散プライマーを使用した逆splicing接合の増幅に基づいている(Panda and Gorospe、2018)。 他の多くの論文は、アノテーションされたcircrnaだけでなく、以前の研究でcircRNAがアノテーションされていないゲノム領域からのde novo RNA circularizationイベントを検出する いくつかのバイオインフォマティックパイプラインは、RNA-Seqデータセット中のcircrnaの検出のために開発されているが、それらのすべては、バックスプライシングジャンクションを横断する読み取りの存在に基づいており、最も信頼性の高いものを見つけることは、まだバイオインフォマティシャンのための挑戦である(Hansen et al. ら,2 0 1 6;Hansen,2 0 1 8;Prada−Luengo e t a l., 2019).
RNA-Seqデータ中のcircrnaの検出には、二つの主要なアプローチに従うことができます。 第一に、多くのcircRNA RNA-seq研究は、配列決定の前にすべての線状Rnaを枯渇させるために、RNase r処理試料に基づいている。 このアプローチはcircRNA検出のために特別に設計されているが、RNase r分解は可変であり、RNase R耐性の直鎖RnaおよびRNase R感受性circRNAのまれなケースがあること(Szabo and Salzman,2016)、およびこの処理はいくつかの組織に制限され得る高いRNA入力を必要とすることは注目に値する。 他のcircRNA研究は、線状および環状Rnaの両方を見出すことができる全rna、リボソーム枯渇(ribo−)RNA、または非ポリアデニル化(polyA−)RNAのいずれかを配列決定することを選 ら,2 0 1 2;Memczakら,2 0 1 2;Memczakら, ら、2 0 1 3;Broadbent e t a l. ら、2 0 1 5;Lu e t a l., 2015; Memczak et al., 2015). このアプローチは、配列決定に必要なRNA量を減少させ、同じデータセットから他のタイプのRnaの発現を研究することを可能にするRNase Rの使用を回避する。 良好な配列決定の深さおよび品質および慎重なデータ分析により、真のcircRNAが全RNA配列決定から検出され得ることが実証されている(Wang e t a l. しかし、この第二のアプローチでは、circrnaの後の円形性の確認が必要である。
環状Dnaから転写された線状キメラRnaの発見により、circrnaはもはやキメラ接合を有する唯一の転写産物ではない。 したがって、第一のアプローチは、検出されたキメラジャンクションのほとんどが真のcircrnaに対応するようにcircrnaのRNAサンプルを大幅に豊かにするのに対し、第二のアプローチは、circrnaと環状Dnaから転写された線形キメラ転写産物の両方から来るシグナルをcircrnaに帰することによって、circRNA転写産物の数を過大評価する可能性があることに注意することが最も重要である。 したがって、circrnaと線形キメラ転写産物の共存を考慮すると、circularityテストと機能性アッセイの必要性が重要になり、実験的だけでなく、バックスプライシングによって形成されたcircrnaと環状Dnaからのキメラ転写産物を間違えることを避けるために、計算方法にも特別な注意が払われるべきである。
ディスカッション
circRNAフィールドはまだ初期段階にありますが、circrnaはすでに驚くべき分子であり、多くのプロセスに関与しており、大きなバイオマーカーの可能性を秘めており、転写および翻訳プロセスの理解方法を変える可能性があります。 これらの理由から、彼らは注目を集めており、circRNA分野は現時点で最も活発なRNA研究分野の1つです。 しかし、議論されなければならない多くの紛争、論争、未解決の質問(Li、2019)がまだあります。
この報告では、環状DNA分野の最近の進歩に照らして、circRNAデータを妨害する可能性のあるバックスプライシングシグナルを有する線形転写物の主な天然の源の一つとして、染色体外環状DNAからの転写を指摘したい(Møller et al., 2018). 今後は、circRNA検出における偽陽性につながる可能性のある技術的な成果物、重複および移植事象から離れて、この新しいタイプのキメラ転写産物の存在も考慮に入れる必要があります。 従ってcircularizationテストおよび機能試金は重要です。
いずれにしても、これらのキメラ線状転写物は、circRNA研究の単なる交絡因子として考慮されるべきではない。 CircRNAの特性評価のための技術的な意味にもかかわらず、eccDNAから来るこれらのcircRNAのようなキメラ線状RNA分子の存在は、Rnaの増え続けるリストに分子の新 さらに、eccDNAから来るこれらの直鎖状RNA分子は、調節機能または翻訳される可能性を含む、circRNAと同様の機能を提示することもできる。 ECCDNA転写物からの遺伝子産物は、酵母で報告されているように、体細胞および組織の表現型に潜在的に寄与し得る(Gresham e t a l. ら、2 0 1 0;Demeke e t a l., 2015). しかし、この初期の分野では、氷山の表面を傷つけ始めるためには、より多くのデータと研究が必要です。
著者の貢献
LI、IP-L、BR、およびDOが論文を書いた。
資金調達
この研究は、プロジェクト”PI17/00189″(欧州地域開発基金/欧州社会基金の共同出資)”あなたの未来への投資”)を通じて、Instituto de Salud Carlos IIIによって資金 IP-LとBRはデンマーク独立研究評議会、6108-00171B、LIはバスク政府の教育省によってサポートされていました。
利益相反
著者らは、この研究は潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言しています。