健康な組織の創傷に伴い、生理学的事象の予測可能な進行が展開される。 この進行は、炎症、増殖、および成熟の段階に分けることができる。 各段階は、特定の細胞による特徴的なサイトカインの逐次的な精緻化によって特徴付けられる。 下の画像を参照してください。
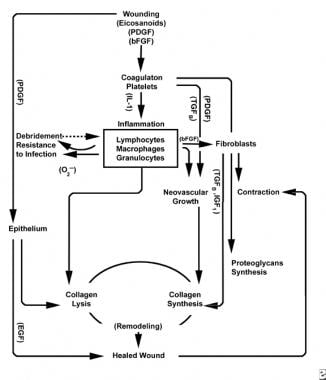 創傷治癒プロセスのスキーム。
創傷治癒プロセスのスキーム。 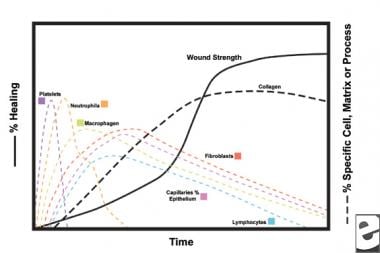 創傷治癒プロセスの細胞特性。
創傷治癒プロセスの細胞特性。 炎症期
炎症期は同時に止血メカニズムと炎症の臨床的に認識可能な基本的な徴候を作り出す経路を起動します:rubor(発赤)、calor(暖かさ)、腫瘍(腫れ)、dolor(痛み)、functio laesa(機能
血管組織への損傷は、第VII因子を活性化する細胞内カルシウムおよび組織因子を放出することによって外因性凝固カスケードを開始する。 このプラグは、初期の炎症期の最も一般的で”署名”細胞型である血小板の凝集のための格子として作用する。
血小板は、アデノシン二リン酸、組織成長因子β(TGF-γ)、および血小板由来成長因子(PDGF)などの多くの炎症誘発物質を精巧にしている。 これらの成長因子は周囲の細胞に作用し、好中球、単球、および線維芽細胞の傷害領域への走化性を刺激する。
損傷した組織は、活性化ホスホリパーゼAを介して、同時にアラキドン酸を触媒して血管活性プロスタグランジンとトロンボキサンを生成し、総称してエイコサノイドとして知られている。 エイコサノイドは血小板のプラグの形成、管の透磁率および傷の治療に影響を与えるために細胞走化性に影響を及ぼす活動を仲介します。 例えば、トロンボキサンA2は、血管収縮および血小板凝集を媒介する。
最初の血管収縮の後、炎症の古典的な徴候は、血管透過性の増加から現れる。 Ruborは、プロスタサイクリン(PGI2)、プロスタグランジンA(PGA)、プロスタグランジンD(PGD)、およびプロスタグランジンE(PGE)によって媒介される血管拡張から生じる。 腫瘍およびcalorは血管内皮のギャップが拡大すると同時に成長しま、間質スペースに血しょう蛋白質および液体の出入口を許可します。 これらの変更はPGE2およびプロスタグランジンF2A(Pgf2A)によって増強され、精巧な細胞を含む傷害の区域に炎症性細胞の進入を、可能にします。 Dolorは、pgi2、PGE、およびpge2が末梢侵害受容体に作用するように感知される。
炎症期の第二段階では、白血球は走化性によって引き付けられる支配的な細胞型として血小板に取って代わります。 白血球(Wbc)は、創傷後の最初の3日間の優勢な細胞であり、その数は約48時間でピークに達する。 多形核球(Pmn)は,炎症性メディエーターと酸素フリーラジカル代謝産物を用いて殺菌活性を開始した最初のものである。 しかし、正常な創傷治癒は、Pmnなしで起こり得る。 別の白血球、ヘルパー T細胞は、インターロイキン-2(IL–2)を精緻化します。 IL−2は、さらなるT細胞増殖を促進して、傷害に対する免疫原性応答を増大させる。
PMN白血球が24-36時間後に衰退し始めると、循環単球が創傷に入り、組織マクロファージに成熟する。 これらの細胞は、顕微鏡レベルで創傷を創面切除し、IL−1および塩基性線維芽細胞増殖因子(bFGF)のような多種多様な重要な物質を産生する。 IL-1は炎症性細胞の増殖を刺激し、内皮細胞の複製を介して血管新生を促進する。 bFGFは、線維芽細胞および内皮細胞の走化性および有糸分裂促進因子である。 PMNsとは異なり、マクロファージの枯渇はひどくデブリードマン、線維芽細胞増殖、および血管新生すべてが減少するように、創傷治癒を損なう。
炎症性周期の終わりの方に、傷のeicosanoidsの展開の環境はコラーゲンおよび地上の物質の繊維芽細胞の統合に終って現在の細胞のタイプと、相互に作用します(PGF2AのPGE2への増加された比率から)。 さらに、マクロファージ由来の成長因子は、線維芽細胞およびケラチノサイトおよび内皮細胞の創傷への流入に強く影響する最適なレベルになった。 単核細胞が白血球およびマクロファージを置換し続けると、増殖期が始まる。
増殖期
創傷の二から三日後、線維芽細胞は、炎症期の間に確立された線維性マトリックス上の創傷縁から内側に移動する。 最初の週の間に、線維芽細胞はマクロファージによって総合されたbFGFおよびTGF-γ、またPDGFに応じてglycosaminoglycansおよびproteoglycans、肉芽組織のための地上の物質、またコラーゲンを、作り始
線維芽細胞はすぐに支配的な細胞型になり、1-2週間でピークに達する。 それらはコラーゲン分子だけでなく、PDGF、TGF-γ、bFGF、ケラチノサイト増殖因子、insulinlike growth factor-1などのサイトカインも生成します。 繊維芽細胞はまた束に架橋結合され、組織される繊維にコラーゲンの分子を組み立てます。 コラーゲンは次の6週の間続いて純生産が激しい傷の結合組織の主要成分、です。 傷のコラーゲンの増加する内容は増加する引張強さと相関します。
ケラチノサイトおよび内皮細胞もこの時間の間に増殖し、最終的にはその成長を維持する自己分泌増殖因子を産生する。 無傷の血管が肉芽組織に芽を生成するので、内皮拡張は血管新生に寄与する。 血管新生は、線維芽細胞の前進ラインの創傷への成長を促進し、必要な栄養素およびサイトカインをそれらに提供する。
フィブリン凝塊および仮マトリックスの分解は、肉芽組織(地上物質、コラーゲン、毛細血管)の沈着を伴い、創傷が覆われるまで続く。 減少したhyaluronic酸の(地上の物質で)レベルおよび増加するコンドロイチンの硫酸塩のレベルは傷の治療の成熟段階に転移する繊維芽細胞の微分を引
成熟期
最初の6週間は、新しいコラーゲン産生が創傷治癒過程を支配し、急性創傷肉芽組織にランダムに沈着した。 傷が成熟すると同時に、コラーゲンは高められた引張強さのより整頓されていた構造に改造されます。 4:1の正常な皮の比率が達成されるまで次第に、タイプIのコラーゲンはタイプIIIを取り替えます。 改造が続くと同時に、マトリックスのmetalloproteinaseのcollagenolysisはコラーゲンの統合との定常状態を達成します。 元の強さの80%の引張強さのプラトーおよそ1年のpostinjury。
この活動に対して表面的には、上皮細胞は、欠陥が覆われるまで創傷縁から内側に移動し続ける。 この時点で、接触阻害は、収縮性アクチン繊維を含む筋線維芽細胞への線維芽細胞の変換を誘導する。 筋線維芽細胞の正確な役割は完全には解明されていないが、創傷収縮は、損傷した組織体積を新しい組織に置き換える、続く。
創傷治癒の抑止
急性創傷は、一般的に整然とした時宜を得た修復プロセスを経て進行し、その結果、解剖学的および機能的完全性の耐久性のある復 しかし、様々な生理学的および機械的要因が治癒応答を損なう可能性があり、その結果、通常の段階的進行を経て進行しない慢性創傷が生じる。 局所感染、低酸素症、外傷、異物、または糖尿病、栄養失調、免疫不全、または薬物療法などの全身性の問題が最も頻繁に責任があります。
すべての傷は汚染されていますが、侵襲性感染症に最もよく抵抗します。 濃度が組織のグラム当たり100,000(105)生物を超えるか、免疫系が侵害されると、感染が頻繁に続きます。 蜂巣炎は、肉芽組織および組織成長因子を低下させる高レベルの炎症誘発性サイトカインおよび組織プロテアーゼを維持し、コラーゲン沈着を遅らせるこ
デブリードマン(外科的、酵素的、および/またはドレッシング変更による)および抗生物質は、抗生物質治療の主力である。 デブリードマンは、線維芽細胞およびケラチノサイトの創傷への移動を阻害するエンドトキシンの源となり得る失活組織を除去する。 絹の縫合糸の存在は、感染を10,000倍に誘発するのに必要な細菌の数を減少させるので、異物も除去を必要とするかもしれない。 (技術の詳細な説明については、Medscapeの参照記事の傷の異物の取り外しを見て下さい。)
細胞性低酸素症は、様々な手段によって創傷治癒を遅らせる。 コラーゲン線維架橋は、プロリンとリジンをヒドロキシル化するために酸素を必要とし、組織圧力が40mm Hg以下であるときに失敗する。 白血球の酸化的リン酸化の殺菌効力はまた、低酸素環境においても低下し、感染の閾値を低下させる。 酸素送達を改善するための措置は、病因に依存する。 血管収縮を引き起こし、血小板の付着を増加させるタバコの使用は、停止する必要があります。 血管形成術または動脈バイパス移植は、末梢血管疾患のために必要とされ得る。 心不全の症例における全身灌流を改善するための補助的手段が示されることがある。 ヘマトクリットの価値より少しにより15%は必要とされるに応じて元通りになり、euvolemia扱われるべきです。 静脈の静止状態かリンパ不十分は圧縮衣服と改善されるかもしれません。
全身性疾患は、創傷治癒を劇的に延長または中断する可能性がある。 糖尿病におけるグリコシル化は、細菌の好中球およびマクロファージ食作用を損ない、炎症期を延長する。 増殖期はまた、赤血球が柔軟性が低くなり、組織代謝およびコラーゲン合成のために創傷に酸素を送達することができなくなるのと同じ疾患において
栄養不良は減少した繊維芽細胞増殖、損なわれたneovascularizationおよび減らされた細胞および体液性免除で起因します。 傷は肉芽組織の内で高められた新陳代謝の要求を、特に出します。 メチオニン、プロリン、グリシンおよびリジンのようなアミノ酸は、皮膚の傷の正常な細胞機能そして修理のために必要です。 脂肪酸は細胞膜の重要な成分であり、炎症過程を媒介するエイコサノイドの基質である。 人体がこれらの分子のde novoの統合ができないので必要な脂肪酸のリノレン酸およびリノール酸は食事療法で供給されなければなりません。
十分なビタミンおよび鉱物は細胞信号および補因子として機能する細胞の新陳代謝のために利用できなければならない。 コラーゲンの三重らせん構造を架橋して安定させるリジンとプロリンのヒドロキシル化にはビタミンC(アスコルビン酸)と鉄が必要であり、銅もコラーゲンの安定化に役割を果たしている。 ビタミンA(レチノイン酸)はコラーゲンの生産および低下の調整の重要な役割を担い、epithelializationで特に重要です。 強力な抗酸化物質であるビタミンE(αトコフェロール)は、動物の皮膚および骨の治癒を促進するように見え、補充はヒトにおいて役割を果たす可能性 微量金属、特に亜鉛の欠乏は、創傷治癒不良とも関連しており、これは必要に応じて補充されるべきである。
オウィディウスは、”薬は時々治癒し、時には殺す”と書いています。”これは確かに創傷治癒に関して真実です。 コルチコステロイドは、炎症期全体のプロセスを鈍らせる。 ビタミンA(局所的または経口25,000IU/d)は、コルチコステロイドの有害な治癒効果を緩和するが、肝毒性は長期間の使用(すなわち、>1mo)に起因する可能性がある。 従ってNonsteroidal炎症抑制の薬物(Nsaid)はまたアラキドン酸の新陳代謝および傷の治療と干渉します。 さらに、Nsaidは、炎症期の最も初期のプロセスの1つである血小板機能を阻害する。
Sutcliffeらの研究は、gap接合タンパク質コネキシンのアップレギュレーションが慢性創傷に共通であることを示唆した。 静脈脚、糖尿病性足、および褥瘡の3つのタイプの創傷におけるコネキシンを調べると、各タイプの創傷が表皮コネキシン43、コネキシン26、およびコネキシン30、ならびに真皮コネキシン43の上方調節を示していることが分かった。