プロテアーゼ阻害剤の発見と1990年代半ばの高活性抗レトロウイルス(ARV)療法の出現に続くヒト免疫不全ウイルス1型(HIV-1)関連の罹患率と死亡率の劇的な低下にもかかわらず、多くの患者は依然として抵抗性および/または不寛容のために治療を失敗していた(1)。 ウイルスライフサイクルの異なるステップに作用し、耐性ウイルスに対して活性であり、より良好な忍容性が必要であることは明らかであった。 HIV-1エントリにおけるケモカイン受容体CCR5とCXCR4の重要な役割の実証は、新しいARVターゲット(2、3)として、このプロセスに関心を巻き起こしました。 CCR5はHIV-1株の大部分の共受容体であり、これらのウイルスはccr5tropic(R5)と呼ばれています。 CXCR4を使用するウイルス株はCXCR4-tropic(X4)と呼ばれ、両方の受容体を使用することができる株はdual-tropic(4)である。 患者由来のウイルスは、多くの場合、総称してCXCR4-usingと呼ばれるR5、X4、および二重熱帯株の混合物を含むことができる。
HIV-1エントリにおけるCCR5の重要な役割は、CCR5遺伝子の32塩基対の欠失(CCR5Δ32)のホモ接合であり、その後機能的CCR5を発現しない個体がR5HIV-1の感染から高度に保護されていることを実証することと相まって、ccr5を魅力的な標的として注目した(5)。 いくつかの研究では、C型肝炎に感染した個体の炎症スコアの低下やヘテロ接合体のB型肝炎からの回復など、免疫機能に対するCCR5Δ32変異の微妙な効果が実証されているが、ホモ接合体はダニ媒介性脳炎や重度のウェストナイルウイルス病の影響を受けやすいが、これらの個体は健康にはほとんど明らかな悪影響を受けない(5、6)。 これは、gタンパク質共役受容体スーパーファミリーのメンバーが強力で選択的で経口的な生物学的利用可能な薬物の開発に扱いやすいことが多いという事実と一緒に(7)、英国のサンドイッチ研究所に拠点を置くファイザーグローバル研究開発のチームを含む複数のグループによるCCR5リガンド発見プログラムの開始につながった。
Maraviroc(UK-427,857,MVC)は、ケモカイン放射性リガンド結合アッセイを用いたファイザー化合物ライブラリーのハイスループットスクリーニングによって発見された。 スクリーニングプロセスから最も有望な化合物は、受容体に対する効力、抗ウイルス活性、薬物動態特性、およびほぼ1000分子が特徴付けられた大規模な医薬化学努力を通じてヒト細胞標的に対する選択性のために最適化された(7)。 MVCはCCR5の膜貫通ポケットに結合し、内在化を防止する遅いオフセット機能拮抗薬である(7、8)。 これは、HIV-1分離株(の広い範囲に対して強力な抗ウイルス活性を有している7)。 その優れた前臨床安全性プロファイルと許容可能な薬物動態とともに、これは2000年12月に臨床候補として指名されることになった(7)。
CCR5拮抗薬の臨床開発は困難であることは常に明らかであり、これらは最初の宿主標的ARV薬であり、我々は未知の領域に進出していた。 重要な問題を先取りするために、ディスカバリープログラムの開始直後に臨床開発チームが設立され、私は初期開発チームをリードするように募集され、1999年にファイザーに入社しました。 私たちは、安全性と有効性を実証することに加えて、臨床プログラムの設計において対処すべきいくつかの重要な課題を特定しました。 これらの第一は、R5HIV-1に感染した患者を同定するための市販の臨床的に検証されたアッセイが存在しなかったことであった。 MVCはR5HIV-1株に対してのみ活性であるため、これは重要でした(7)。 第二に、ccr5Δ32(5、6)を持つ個人の明らかに健康な表現型にもかかわらず、懸念は、ccr5の遮断は、免疫系がCCR5の非存在下で成熟しており、代償機構が開発している可能性がCCR5受容体の先天性不在とは異なる場合がありますように、CCR5拮抗薬への長期暴露の安全性に関する残っていた。 最後に、HIV-1感染者では、CXCR4を使用してHIV-1株の発生率は、病気の進行とCD4細胞数の減少とともに増加します(9)、CXCR4を使用してウイルスとCD4細胞枯渇の間の因果関係は実証されていません。 これは、CCR5拮抗薬からの選択的圧力がCXCR4を使用するウイルス集団を駆動し、CD4細胞の低下をもたらす可能性があるという懸念につながってい
2001年と2002年前半に実施された健康なボランティアを対象とした第1相単回および複数回投与試験では、MVCが一日二回300mgまでの複数回投与(BID)で安全で耐容性が高く、一日一回(QD)またはBID経口投与と互換性のある薬物動態学的プロファイルを有し、他のArvと組み合わせることができ、≤100mg BIDの投与量はin vitroで幾何学的平均抗ウイルスIC90を上回ることが示された(7、10)。 薬理学の証明を実証するために、ccr5受容体飽和を、特注のe x vivo MIP−1β内在化アッセイを用いて測定した。 用量依存的な飽和が実証され、≦25mg QDの用量で最大飽和レベルに近い結果が得られ、MVCが25mg QDの低い用量で有効である可能性があるという興味深い可能性が上昇した。 投与を中止した後、受容体飽和は数日間高いままであり、in vivoでの受容体からの遅いオフセットを反映していた(11)。
私たちはフェーズ1のデータに興奮し、励まされ、フェーズ2aの概念実証プログラムに急速に移行しました。 HIV−1感染患者を、新規表現型指向性アッセイ(Trofile(登録商標),Monogrambiosciences,South San Francisco,C A,USA)を用いて、R5ウイルスのみの存在についてスクリーニングし、MVCを1 0日間単剤療法とした(1 2)。 CCR5受容体飽和は、有効性のためのバイオマーカーとして、治療モニタリングにこれを使用する可能性を評価するために、この研究で測定されました。 待望のデータは私たちの期待に応え、≥100mg BIDの投与量が平均最大HIV-1RNA減少をもたらしたことを示しました>1。5log10(図1A)、誤って含まれているX4ウイルスを有する一人の患者を除くすべての患者で、少なくとも1log10(12)のHIV-1RNA削減を達成する。 これは、アッセイがMVCに応答する可能性の高い患者を正しく同定したという自信を与えた。 HIV−1RNA天底は、MVCの最後の投与の1〜5日後に発生し、第1相試験(1 2)で実証されたように、長期の受容体飽和と一致した。 25mgのQD受容体を除くすべての用量で、>80%の飽和が投与期間を通して観察された。 しかし,ウイルス負荷減少と受容体飽和度との間には相関はなかった。 このための最も可能性の高い説明は、受容体飽和の非常に高いレベルは、抗ウイルス有効性のために必要とされ、アッセイの固有の変動性は、その程度(への分化を可能にしないということである11、12)。
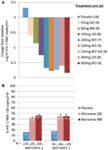
図1. Maravirocの概念実証とフェーズ3の有効性の結果。 (A)MVC単独療法を受けている患者におけるHIV−1RNAのベースラインからの平均最大変化。 フェーズ1のデータおよびモデリングおよびシミュレーションに基づいて、25mg QDから300mg BIDまでの用量(150mg BIDの給餌および絶食を含む)を選択した。 HIV−1RNA、安全性、およびMVC薬物動態を評価した(1 2)。 (B)1および2–HIV-1RNA<50コピー/mL週48を達成している患者の割合をやる気にさせる。 R5HIV-1およびトリプルクラスの経験および/または抵抗性を有するHIV-1感染患者は、最適化された背景抗レトロウイルス療法(OBT)と組み合わせて、MVC QDまたはBID、またはプラセボを受けるために無作為化された。 P< 0.001 (13, 14).
フェーズ2aのデータは、会社全体で興奮を生み出し、私たちは、治療オプションのない、または限られた患者を治療するための新しいArvに対する高い医 広範なフェーズ1プログラム(複数の薬物-薬物相互作用研究を含む)とフェーズ2a概念実証研究で評価された広い用量範囲は、モデリングとシミュレーションと したがって、独立した第2b相用量範囲研究を行う必要なく、MVCを300mg(または同時投与された薬物に応じて同等のもの)QDおよびBIDで評価する第3相効 2004年後半に我々は四つの大規模な研究を開始しました; R5HIV-1(13、14)、R5HIV-1(15)、および研究a4001029、非CCR5熱帯ウイルス(CXCR4を使用または非表現型ウイルス)(16)と治療経験豊富な患者における第2b相安全性研究で第3相ロールインを用いた研究で1と2をやる気にさせる。
これは大規模な事業であり、4794人の患者が米国、カナダ、ヨーロッパ、オーストラリア、南アフリカ、メキシコ、アルゼンチンの200以上のサイトでスクリーニングされた。 他の2つの小分子CCR5拮抗薬(aplavirocおよびvicriviroc)も、この時点で第2b相試験で評価されていた(17、18)。 大規模な臨床試験を管理する通常の課題に加えて、我々は二つの曲線を投げられた、これらの最初のものは、特異的な肝毒性によるaplavirocの中止でした。 CCR5ノックアウトマウスは、コンカナバリン-a媒介性肝毒性(より感受性であるとして、これはCCR5拮抗薬のクラス効果である可能性が推測された17)。 さらに,メリット研究の患者は重度の肝毒性を発症した。 このデータは、イソニアジドまたはコトリモキサゾールに関連している可能性が高いことを示唆していたが、MVCの寄与的役割は除外できなかった(15)。 MVCの肝毒性の証拠に関するすべてのデータの詳細なレビューと、任意のシグナルに対する高いレベルの警戒は、肝酵素または肝毒性の他のマーカーの体系的な増加の証拠を見いだせなかった。 その後まもなく、研究ACTG5211(18)でvicrivirocを受けている四人の患者におけるリンパ腫の発生に続いて、特定の悪性腫瘍の潜在的なリスク増加に関する懸念が提起された。 当初、これはCCR5拮抗薬の免疫調節能に基づくクラス効果である可能性があるという懸念がありましたが、他のvicriviroc研究および進行中のMVC研究からのデー
1と2のデータとA4001029のデータは、治療経験のある患者を対象とした研究では研究期間が一般的に短いため、メリットよりも先行して利用可能であった。 それは私達が24週を待っていたこと大きい興奮と2006年に動機を与える調査のための中間分析および私達はmvcを受け取っているかなりより多くの患者が<50コピー/mL(効力のための主マーカー)のHIV-1RNAを偽薬OBTを受け取っているそれらと比較されて持っていたことを見るために大喜びされた。 これは、第48週のデータによって確認され、応答の耐久性を実証した(図1B)(13、14)。 対照的に、A4001029でMVCを受けている非CCR5熱帯HIV-1患者は、プラセボと比較して有意なウイルス学的利益を得るために表示されませんでした(16)。 安全性データの分析は、大きな懸念を提起しませんでした。 具体的には、MVC治療患者における感染または悪性腫瘍のエピソードの増加なしで、免疫機能に悪影響を及ぼす証拠はなかった。 失敗時のウイルス指向性の評価は、MVC療法を失敗した患者の>50%が失敗時にcxcr4を使用したウイルスを持っていたことを示したが、CD4細胞数に有害な影響の証拠はなかった(14)。 ウイルス学的評価は、MVC選択的圧力の下で浮上したCXCR4を使用してウイルスは、既存の少数民族からであり、デノボ(19)を発生しなかったことを実証した。 全体として、これらの結果は、R5HIV-1の治療経験豊富な患者の管理におけるMVCの利点を明確に示した。 チームによる最高の努力は、暫定データが利用可能になったわずか2ヶ月後に、米国とヨーロッパの両方で登録のための書類を提出することになりました。 MVC(300mg BID)は、2007年6月に米国で(他のArvと組み合わせて)使用の承認を受けた。それが臨床開発のための候補者として指名された5年後。 一ヶ月後、それはまた、EUでこの人口での使用が承認されました。
MVCプラスジドブジン/ラミブジン(HIV-1RNA<50コピー/mL、65.3%)は、エファビレンツプラスジドブジン/ラミブジン(HIV-1RNA<50コピー/mL、65.3%)に対する非劣等性(1面97.5信頼区間の下限-10%)の事前設定された基準を満たさなかったため、メリット研究の第48週の分析は失望していた。ml、69.3%)(15 しかし、この研究のための患者は、元のTrofileアッセイを使用してR5ウイルスのスクリーニングを行った。 この試金はcxcr4を使用してウイルスの少数の人口の検出のためにより敏感であるために一方改良されました。 メリットの患者のためのすべてのスクリーニングサンプルは、その後、強化されたアッセイを使用して再試験され、より敏感なアッセイによってのみR5ウ この分析では、MVCとefavirenzの応答率は、それぞれ68.3と68.5%であり、97.5%信頼区間の下限は-10%(15)を上回っていました。 このデータに基づいて、MVCはまた、2009年11月に米国食品医薬品局によって治療未経験の患者での使用が承認されました。
MVCは、成長を続けるARV薬物armamentariumへの貴重な追加であることが証明されただけでなく、これらの研究からのデータは、HIVの向性と向性と病気の進行との関係 私にとって、個人的には、これは医師と科学者の両方として、大きな興奮と満足の期間を表していました。
著者の貢献
ERは、MVC開発チームのメンバーとしての彼女の個人的な経験に基づいて、この原稿を起草しました。 すべてのデータは他の場所で完全に公開されています。 すべての研究は、ヘルシンキ宣言の原則と調和の良い臨床実践ガイドラインと地域の規制と法的要件に関するすべての国際会議に準拠して行 すべての研究は独立した倫理委員会によって承認され、すべての患者は書面によるインフォームドコンセントを与えた。
利益相反声明
ELNA Van Der Rystは、MVCが開発された時点でファイザー-グローバル-リサーチ-アンド-デベロップメントの従業員でした。 現在はファイザーにコンサルティングサービスを提供している。
謝辞
MVC discovery and developmentプログラムに貢献したファイザーの同僚、ならびに臨床研究に参加した研究者および患者に感謝したいと思います。
1. Richman DD,Morton SC,Wrin T,Hellmann N,Berry S,Schapiro MF,et al. 米国における抗レトロウイルス薬耐性の有病率。 AIDS(2 0 0 4)1 8:1 3 9 3−4 0 1. 土井:10.1097/01.エイズ…0000131310.52526.c7
Pubmed要約/Pubmed全文/CrossRef全文/Google Scholar
2. Dragic T,Litwin V,Allaway GP,Martin SR,Huang Y,Nagashima KA,et al. CD4+細胞へのHIV−1の侵入は、ケモカイン受容体CC−CKR−5によって媒介される。 Nature(1 9 9 6)3 8 1:6 6 7−7 3. doi:10.1038/381667a0
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
3. Feng Y,Broder CC,Kennedy PE,Berger EA. HIV-1エントリ補因子:七膜貫通、Gタンパク質共役受容体の機能的なcDNAクローニング。 Science(1 9 9 6)2 7 2:8 7 2−7. 土井:10.1126/科学。272.5263.872
CrossRef全文|Google Scholar
4. Berger EA,Doms RW,Fenyö EM,Korber BT,Littman DR,Moore JP,et al. HIV-1のための新しい分類。 Nature(1 9 9 8)3 9 1:2 4 0. 土井:10.1038/34571
CrossRef全文|Google Scholar
5. Samson M,Libert F,Doranz BJ,Rucker J,Liesnard C,Farber C,et al. CCR5ケモカイン受容体遺伝子の変異対立遺伝子を有する白人個体におけるHIV-1感染に対する耐性。 Nature(1 9 9 6)3 8 2:7 2 2−5. doi:10.1038/382722a0
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
6. Gilliam BL,Riedel DJ,Redfield RR. HIVおよびそれ以降のCCR5阻害剤の臨床使用。 2011年9月(1) doi:10.1186/1479-5876-9-S1-S9
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
7. Dorr P,Westby M,Dobbs S,Griffin P,Irvine B,Macartney M,et al. Maraviroc(UK-427,857)、広域スペクトルの反人間の免疫不全のウイルスのタイプ1の活動のchemokineの受容器CCR5の有効な、口頭でbioavailable、および選択的で小さい分子の抑制剤。 (2005)49:4721-32. 土井:10.1128/AAC.49.11.4721-4732.2005
CrossRef全文|Google Scholar
8. Kondru R,Zhang J,Ji C,Mirzadegan T,Rotstein D,Sankuratri S,et al. 低分子抗HIV-1CCR5拮抗薬の主要なクラスとCCR5の分子相互作用。 Mol Pharmacol(2 0 0 8)7 3:7 8 9−8 0 0。 土井:10.1124/mol。107.042101
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
9. バーガーエアー、マーフィー PM、ファーバー JM。 HIV-1共受容体としてのケモカイン受容体:ウイルスの侵入、指向性および疾患における役割。 Annu Rev Immunol(1 9 9 9)1 7:6 5 7−7 0 0. ドイ:10.1146/annurev.イムノール17.1.657
Pubmed要約/Pubmed全文/CrossRef全文/Google Scholar
10. Abel S,van der Ryst E,Rosario MC,James I,Ridgway C,Medhurst C,et al. 健康なボランティアにおける新規CCR5アンタゴニストであるmaravirocの薬物動態、安全性、および寛容の評価。 Br J Clin Pharmacol(2 0 0 8)6 5(S1):5−1 8. ドイ:10.1111/j.1365-2125.2008.03130.x
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
11. Rosario MC,Jacqmin P,Dorr P,James I,Jenkins T,Abel S,et al. 健康な被験者およびHIV陽性患者におけるmaravirocによるCCR5受容体占有率の薬物動態-薬力学的分析。 Br J Clin Pharmacol(2 0 0 8)6 5(S1):8 6−9 4. ドイ:10.1111/j.1365-2125.2008.03140.x
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
12. Fätkenheuer G,Pozniak AL,Johnson MA,Plettenberg A,Staszewski S,Hoepelman AIM,et al. Hiv-1感染患者における新しいCCR5アンタゴニストであるmaravirocによる短期単独療法の有効性。 Nat Med(2 0 0 5)1 1:1 1 7 0−2. doi:10.1038/nm1319
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
13. Gulick RM,Lalezari J,Goodrich J,Clumeck N,DeJesus E,Horban A,et al. R5HIV-1感染症を有する以前に治療された患者のためのMaraviroc。 N Engl J Med(2 0 0 8)3 5 9:1 4 2 9−4 1. doi:10.1056/Nejmoa0803152
CrossRef全文/Google Scholar
14. Fätkenheuer G,Nelson M,Lazzarin A,Konourina I,Hoepelman IM,Lampiris H,et al. 以前に治療されたR5HIV-1感染におけるmaravirocのサブグループ分析。 N Engl J Med(2 0 0 8)3 5 9:1 4 4 2−5 5. doi:10.1056/Nejmoa0803154
Pubmed要約/Pubmed全文|CrossRef全文|Google Scholar
15. Cooper DA,Heera J,Goodrich J,Tawadrous M,Saag M,DeJesus E,et al. マラビロク対エファビレンツ、ジドブジン/ラミブジンとの組み合わせの両方で、CCR5-熱帯HIV-1と抗レトロウイルスナイーブ被験者の治療のため。 J Infect Dis(2 0 1 0)2 0 1:8 0 3−1 3. 土井:10.1086/650697
Pubmed Abstract/Pubmed Full Text|CrossRef Full Text|Google Scholar
16. Saag M,Goodrich J,Fatkenheuer G,Clotet B,Clumeck N,Sullivan J,et a l. 非CCR5-tropic HIV-1に感染した治療経験豊富な患者におけるマラビロクの二重盲検、プラセボ対照試験: 24週間の結果。 J.Dis(2009)11:1638-47. 土井:10.1086/598965
Pubmed Abstract/Pubmed Full Text|CrossRef Full Text|Google Scholar
17. Nichols WG,Steel HM,Bonny T,Adkison K,Curtis L,Millard J,et al. Aplavirocの臨床試験で観察された肝毒性(GW873140)。 (2008)52:858-65. 土井:10.1128/AAC.00821-07
Pubmed要約/Pubmed全文/CrossRef全文|Google Scholar
18. Tsibris AM,Paredes R,Chadburn A,Su Z,Henrich TJ,Krambrink A,et al. Vicriviroc療法の間のリンパ腫の診断および血しょうエプスタインBarrのウイルスの負荷:AIDSの臨床試験のグループA5211の結果。 Clin Infect Dis(2 0 0 9)4 8:6 4 2−9. 土井:10.1086/597007
Pubmed Abstract/Pubmed Full Text|CrossRef Full Text|Google Scholar
19. Lewis M,Simpson P,Fransen S,Huang W,Whitcomb J,Mosley M,et al. 第III相試験でmaravirocを受けている患者で検出されたCXCR4-usingウイルスは、1および2は、CXCR4-usingウイルスの既存の少数に由来する動機づけます。 2007年12月25日に発売された。