はじめに
Helicobacter pylori(H.pylori)はグラム陰性の微小好気性細菌であり、その自然な生息地は胃です。 それは典型的には一方の端にいくつかの鞭毛を有する桿状形態を有するが、好ましくない環境条件ではコクコイド外観を採用する。1,2
ピロリ菌は、活動性慢性胃炎、消化性潰瘍、胃粘膜関連リンパ組織(MALT)リンパ腫および胃癌における主要な病因因子である。 この細菌は世界の人口の半分の胃粘膜に存在すると推定されているが、これらの疾患は植民地化された個体の約15-20%でのみ発症する。2,3
最も一般的な治療レジメンは、多くの地理的地域で約85%の根絶率をもたらしている4-6が、特に近年、抗生物質耐性株の急速な出現と治療遵守の悪5,7
活動性慢性胃炎および消化性潰瘍およびいくつかの低悪性度形態の胃MALTリンパ腫の治癒(ならびに合併症の予防)は、h.pylori根絶の成功に依存する さらに、すべての生物学的形態におけるこの微生物の根絶を確実にし、成功させることは、感染の再発を防止し、従って、疾患の再発を防止するであろう。
このレビューの目的は、h.pyloriのコッコイド形態の一般的な概要を提示し、その微生物学的プロファイル、抗生物質感受性および病原性を強調することで 胃疾患におけるその関与も分析され、感染再燃および疾患再発に関連する程度が検討される。
Hの生存と細胞適応。
すべての生物は、不利な環境で生き残るためにそれらを可能にするメカニズムを備えています。 いくつかの場合、それらの応答は、(代謝適応に加えて)細胞形態への変化を意味する。8,9いくつかの微生物は、生存および成長に好ましくない環境条件に応答して、生存可能であるが培養不可能(VBNC)状態に分化する能力を有する。 この戦略は、Salmonella、Campylobacter、Escherichiaなどの微生物によって広く使用されています。10,11
VBNC状態では、細菌は一般的にサイズが小さくなり、形状が変化して小さな球状体になります。 それらは、それらの呼吸速度および栄養輸送を減少させ、遺伝子発現および分子合成を変化させる。 この状態では、従来の培養技術を用いて検出することはできない。 しかし、環境条件の変化は、これらの微生物を「復活させる」(およびそれらの活性状態に再変換する)または退化させる可能性がある。10-13
ピロリ菌は、有害な環境条件(自然の生息地の内外)を経験すると、その古典的なバチルスの形態を変化させ、形態学的および代謝的変化ならびに成長行動の改変をもたらすVBNC状態に入る。14,15
h.pyloriの生存可能ではあるが培養不可能な状態
いくつかの著者は、当初、バチラリータイプからコクコイド型への変換が細胞死をもたらす受動的なプロセスであり、したがって、コクコイド型は死んだ細菌の退化した残骸であることを実証しようとしたが、16,17Hの三つの形態。 ピロリ菌は現在、すなわち(最も毒性が低い順に)、生存可能で培養可能なバチルス型、VBNCコクコイド型および生存不可能な変性型が存在すると考えられている。18-20
形態学的には、バチラリフォームからコクコイドフォームへの変換は、中間体のV型およびU型を介して起こる13、14(図13および図14)。 1および2)、細胞質および細胞膜のような細胞構造がそのまま残る15、21一方、鞭毛は尾状細胞構造の周りを包み込む傾向があり、それによって近くに見えなくなる。 コッコイド形態への他の超微細構造の修正は、二つのサブタイプをもたらす。 タイプAは表面が粗く不規則な縁を持ち、死細胞と考えられ、タイプBは表面が滑らかで小さく、生きている細胞と考えられています。21,22
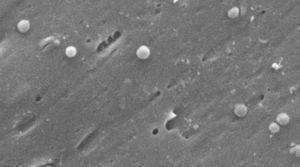
ヘリコバクター-ピロリのコクコイド型の画像。 走査型電子顕微鏡画像提供:Dr.Nuno F.Azevedo。 LEPABE-オポルト大学(ポルトガル)の工学部の化学工学部門。
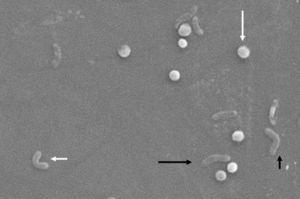
ヘリコバクター-ピロリの形態学的変化。 スパイラルフォーム(長い黒い矢印)、Vフォーム(短い黒い矢印)、Uフォーム(短い白い矢印)とcoccoidフォーム(長い白い矢印)。 走査型電子顕微鏡画像提供:Dr.Nuno F.Azevedo。 LEPABE-オポルト大学(ポルトガル)の工学部の化学工学部門。
に走査型電子顕微鏡(SEM)分析、表面の粘ゲル層の胃癌患者のピロリ菌に感染し、緒方et al.23は、バチラリフォームとコクコイドフォームの両方の共存を観察した。 他の著者らは、ヒトの胃および十二指腸の両方においてコクコイド形態の存在を確認しているが、24-26は、胃よりも十二指腸でコクコイド形態の割合が高く、一部の十二指腸生検でコクコイド形態のみが観察される点にあるようである。26,27この事実は、そのHのいずれかを示唆しています. 幽門は十二指腸の生物的条件に合わせるために強制されますまたはこれらの条件がH.の幽門がVBNCの州の避難所をそこに取ることができるように
In vitroおよびin vivoでの実験では、好気性菌症、28、29アルカリpH、29、30高温、31長いインキュベーション期間、29、32水での長期インキュベーション33またはプロトンポンプ阻害剤32または抗生物質による治療、34コッコイド表現型は、bacillary形で存在する多種多様な遺伝子を発現するため、一定レベルの代謝活性を維持することができ、35検出可能なレベルのウレアーゼ活性を維持し、36タンパク質の合成を続けることが示されている。、少量ではあるが(によって総合される量の蛋白質の1%よりより少し これらのデータはすべて、有害な刺激に応答したh.pyloriの生物学的変化が、有用な寿命の間に種を保存する強力な能力を反映しているという事実を強調している。
バイオフィルム形成
他の細菌と同様に、h.pyloriが感染性実体として持続し、それを根絶することを目的とした抗菌剤の兵器庫に抵抗する能力は、細菌抵抗性を発達させることを可能にする遺伝的変動性によるものである。 その生存戦略は、細菌細胞がバイオフィルムと呼ばれるものを形成するときにさらに強化される。20Biofilmsは細菌が自己作り出されたマトリックスによって生物的か非生物的表面にしっかりと付着する一種の微生物”コミュニティ”である。 細胞外高分子物質で構成されるこのマトリックスは、39、40は、抗菌剤に対して非常に耐性があり、食作用に対して強く耐性である環境を作り出す。 したがって、様々な宿主防御機構が回避され、根絶が困難になる。 バイオフィルムは、細菌間の水平遺伝子導入を容易にする真に複雑で動的なシステムであると考えられている。 したがって、彼らは、細菌の耐性、株の変動性および適応性に大きく寄与する新しい改変ゲノムを細菌集団に付与する。41-43
以前に細菌が根絶された患者からの21生検の研究では、H.pyloriは7生検の培養によって単離され、遺伝子発現技術はほとんどの生検で生存可能なh.pylori細胞を検出した。 一方,semは微生物バイオフィルム中に配置されたクラスター化したコッコイド細菌を示し,コッコイド形態が細菌の持続性と抗生物質耐性を促進できることを示唆した。44
コッコイド型の抗生物質に対する感受性
多くの研究は、h.pyloriが様々な抗菌剤への暴露(in vitro)において、桿菌からコッコイド型に変化することを示している。 アモキシシリン、クラリスロマイシン、メトロニダゾール、エリスロマイシン(利用可能な抗生物質のほんの一部を言及する)の異なる濃度は、この形態学的変34,35,45最大の誘導効果は、h.ピロリに対してin vitroで非常に効果的であることが知られているアモキシシリン、27、34、46で観察されている;しかし、培養物の形態学的観察は、バチラリフォームがコッコイドフォームを支持して数が減少することを示している。34,46、47は、二度最小阻害濃度(MIC)でメトロニダゾールで60%以上、MICでクラリスロマイシンで80-90%で、コッコイドフォームの殺菌効果を達成したが、micとMIC×2でアモキシシリン処理は、実行可能なコッコイドフォームを阻害しなかった。 同様に、Berry e t a l.34は、mic×10のアモキシシリンがh.pyloriのバチラリフォームを排除する一方で、コクコイドフォームの形成を誘導することを観察した。 パーキンズら48h.pyloriに自然に感染した猫の研究では、根絶治療後6週間で胃液がh.pyloriに陽性であったが、ポリメラーゼ連鎖反応(PCR)分析により、研究中のすべての猫にH.pylori遺伝物質が同定された。 Hにもかかわらず、 pyloriは単一のネコで検出され,組織学的病変は慢性胃炎と一致し,リンパろ胞の存在によって特徴づけられた。
これらの微生物学的および基礎研究データを念頭に置いて、h.pyloriに感染した患者で実施された以前の研究では、単離された株のアモキシシリンへの感受性が以前に決定されていたが、二重療法(プロトンポンプ阻害剤およびアモキシシリン)は、アモキシシリン感受性株の治癒率はわずか66%であった。 この結果はこの抗生物質の巧妙な使用と関連している重要な付加的で独立した細菌の抵抗の要因の存在を示します。49これは、コッコイド形態がバチルス形態とは異なるペニシリン結合タンパク質プロファイルを有するため、コッコイド形態がβ-ラクタム抗生物質に感受性であることは不可能であると考える場合に特にそうである。50従ってすべてのh.の幽門の有機体が根絶の処置の後で完全に除去されないことは本当らしいです;むしろ、いくつかはcoccoid形態に変えられ、従って抗菌性の薬剤に抵抗力があるようになるために本当らしいです。 これは処置の失敗およびrecrudescenceを説明する。13,34,45
いくつかの非常に最近の研究では、リノレン酸やリポソームリノレン酸などの遊離脂肪酸が、抗生物質に対する耐性にかかわらず、両方のh.pylori型に殺菌効果を有することが実証されていることを強調する価値がある。従って51,52これらの分子はcoccoid形態のh.の幽門との伝染の、特に扱うことで可能性としては有効な抗菌効果をもたらすことができます。
コクコイド型の病原性および病原性
hのバチラー型の病原性因子。 ピロリ菌とこの細菌が胃腸疾患の発症に関与するメカニズムは広く研究されている。1,3,4しかし、コクコイド形態の病原性および病原性についてはほとんど知られていない。 以下では、このテーマに関する最も関連性の高い調査結果を確認します。
桿菌型と同様に、コクコイド型は尿素、ureB、hpaA、vacAおよびcagA、cagEおよびBabAなどの主要な病原性遺伝子を発現する。35,53,54長い期間にわたって起こるこの表現はおそらく慢性の厳しい胃無秩序の重要な役割を担います。
胃十二指腸上皮へのピロリは、粘膜層の活性慢性炎症の誘導において重要なステップであることが知られている。 SEMの調査はH.の幽門のcoccoid形態が胃の上皮細胞の原形質膜の表面に示すことができ、bacillary形態のように、これらの細胞に侵入する機能があることが分った。15,55細胞浸潤が起こると、コクコイド形態は二重層膜小胞に囲まれ、胃上皮細胞は腫れて溶解し、粘膜層の侵食を示すように見える。コクコイド形態が抗生物質に対して感受性が低いことを考えると、これらの潜在的な原形質膜形態は、有効濃度の抗生物質の非存在下で他の隣接す57
h.pylori感染は、細菌を根絶することができない局所免疫応答を誘発し、それによって胃疾患が慢性化することを可能にすることも知られている。 免疫応答はh.pyloriのbacillary形態を使用して開発される血清学的方法を使用して抗体の検出によって定めることができます。実際には、これらの特異的抗体の存在は、感染の疫学的指標として、および治療の成功を確認するために使用することができる。 しかし、コッコイド形態を検出する血清学的方法はない。 コクコイド形態が植民地化された個体における免疫応答に何らかの影響を及ぼしたかどうかを決定するために、Figueroa et al.59は、症候性および無症候性の感染した個体からの血清パネルに対するコクコイドおよびバチルス型に対する免疫応答を評価し、比較するために、特定のenzyme-linked immunosorbent assay(ELISA)技術を考案した。 Hのコクコイド形。 ピロリ菌は感染した個体においてバチルス型によって誘導されるのと同様の体液性免疫応答を誘導することが示された。 上腹部痛の小児で行われた別の研究では、H.pylori感染におけるコクコイド形態の可能性のある役割を、elisa技術およびバチラリーおよびコクコイド細胞形態から調製された抗原を用いて調べた。 それは、細胞の13.3%と55.8%が喘息の子供のための血清陽性値は、それぞれわずか7.0%と26.5%であったのに対し、それぞれ、バチラー型とコクコイド型の抗原に 症候性および無症候性患者におけるコクコイド型およびバチラー型抗原間の血清陽性率のこの約四倍の差は,h.pyloriのコクコイド型の感染性役割の可能性を示唆した。60
Cellini et al.61balb/cマウスモデルにおけるコクコイド形態のh.ピロリの濃縮懸濁液を胃内接種した。 H.pyloriは2週間後に単離され、病理組織学的変化は1ヶ月後に起こり、すべての植民地化されたマウスはH.pyloriに対する全身抗体応答を示した。 BALB/cマウスを用いた他の実験では,コクコイド型を接種した動物は,びらん性病変および胃粘膜の炎症性細胞浸潤を含む胃の有意な病理学的変化を発症した。36Sheら。病原性および感染性を比較するために、balb/cマウスにh.pyloriを胃内接種し、1群はバチルス型、2群はコクコイド型を接種した。 2群からのサンプルのSEM検査では、彼らは胃壁の上皮細胞へのbacillaryおよびcoccoid形態の両方の付着およびcoccoid形態の鞭毛の存在を観察した。 組織学的検査では,軽度の炎症細胞浸潤からびらんおよび潰ようまで,胃粘膜の病変の程度が異なっていた。 粘膜病変はコクコイド型に感染したマウスでは軽度であったが,滅菌水を受けた対照群では陽性の結果は得られなかった。53Rabelo-Gonçalves et al.62は、hのコッコイド形態を示した。 ピロリ菌は感染の初期段階からマウスの胃に急性炎症反応を誘導した。 上記の結果は、コクコイド形態がin vivoで胃粘膜にコロニーを形成し、感染する能力を強調している。
いくつかの研究により、水中にコクコイド型が存在することが明らかになった。33,63私たちのグループによるそのような研究の一つは、離乳したWistarマウスの2つのグループを比較し、一方は井戸水と水道水を長期間投与し、他方は滅菌蒸留水を投与し、研究グループのマウスはリンパ球プラークの形成とh.pyloriと一致する桿菌の存在を伴う慢性炎症過程を発症したことを見出した。64
前述したように、不利な条件では、Hと仮定することは論理的です。 幽門はゲノムの退化的な変更を作り出さないでcoccoid形態に古典的なbacillary形態を変更し、環境か自然な生息地の条件が改良すればbacillary形態に戻る機能を保
コッコイド型の再燃への参加
h.pyloriの再発は、発展途上国と比較して先進国ではまれであり、年間再発率はそれぞれ2.67%および13%である。65,66
ピロリ菌感染の再発には二つのタイプがあります: 再発の原因となる細菌株が根絶前に単離された株と遺伝的に同一である場合の再感染;および再発が異なる株によって引き起こされる場合の再感染。67再感染と再感染を区別するには、細菌株を同定するためにPCRまたは遺伝的多型解析が必要である。これらの方法は日常的に適用されていないため、日常的な臨床診療において再発赤と再感染を区別することはしばしば不可能である。
消化性潰瘍の再発は感染患者のかなりの割合で観察することができるので、ピロリ再発は臨床的に関連しているが、微生物の再出現は治療後のいくつかのMALTリンパ腫の再発を説明することができる。水道水を飲むこと、歯科および歯肉疾患、再発扁桃炎、入院、歯科および医療機器および家族との接触のような69の要因はh.の幽門の再発に影響を与える70-72感染再発に関連する他の要因は、若年、若年患者の糖尿病、低年収および根絶後の胃酸の長期阻害である。73-76
再感染は根絶後の最初の年に再発する可能性が最も高い理由と考えられていますが、再感染はより長い期間後に発生する可能性があります。68,77先進国における再発の多くのケースは、recrudescenceに起因する現実にあります。 人々は明らかに常にピロリ菌にさらされているので、再感染は発展途上国でより一般的です。65,78
ポリアクリルアミドゲルプロテイン電気泳動技術を用いた、Costas et al.79では、根絶治療から4週間後に再発した患者は、実際にはh.pyloriの別の株に感染しておらず、むしろ元の感染を引き起こした株が治療によって完全に根絶されておらず、感染の再燃につながっていたことが判明した。 したがって、治療レジメンの有効性を考慮に入れることが重要である:H. ピロリ再発は、低有効性療法で治療された患者で頻繁に起こるが、高有効性療法が使用される場合はまれである。 これは、Gisbertらによるスペインにおけるh.pylori再発の発生率に関する研究によって実証された。、80whoは、除菌後6ヶ月後のh.ピロリ再発は、低有効性療法で治療された患者では8.2%であったが、高有効性療法で治療された患者では1.7%であった。
2007年から2010年にかけて韓国で行われた研究では、H. ピロリ再発率は、呼気検査、胃生検および迅速なウレアーゼ試験に基づいて、年間のフォローアップで、成功した第一および第二ライン根絶療法の6ヶ月後81 2年間のフォローアップ内および後の年間再発率は、第一選択療法後にそれぞれ9.3%および2.0%、第二選択療法後にそれぞれ4.5%および2.9%であった。 著者らは、毎年恒例のHと結論付けました。 除菌治療を受けた患者のピロリ再発率は、2年間のフォローアップ期間後に急激な低下を示した。 これは,除菌を確認するのに十分な時間であり,H.pylori株の再発と再燃の区別を可能にするのに十分な時間であると考えられた。81
最終的な考察と結論
Hの能力を考えると。 pyloriがVBNC状態に入るためには,その生息地内または外の不利な条件にさらされると,h.pyloriのバチルス型を根絶するために使用される抗生物質治療レジメンが胃十二指腸環境で長期間生存することができるVBNCコクコイド型を誘導する可能性があると仮定することは合理的である。 ここから、それらは直接的および間接的に病原性を有する可能性があり、それは感染の再発をもたらし、その結果、治療の失敗、感染の再発および胃十二指腸疾患の再発をもたらす。 したがって、根絶に成功するには、バチルス型の根絶だけでなく、コクコイド型の根絶、またはコクコイド型が誘導されないようにする必要があります。
h.pyloriの根絶を確認するために現在臨床診療で実施されているルーチンの方法はコッコイド形態を検出できないため、宿主は誤って感染していないと診断される可能性があり、さらにこれらの方法はh.pyloriを根絶するために使用される薬物の臨床的可能性の完全な証拠を提供できない可能性があることを念頭に置いている。 したがって、根絶が成功したとみなされるためには、非侵襲的な技術または利用可能であれば分子的方法を用いて、細菌が完全に排除されたかどうかを判断するために、特に有病率の高い地域および再発の危険性のある患者において、毎年のフォローアップが推奨される。
最後に、h.pyloriのコッコイドVBNC形態、その病原性、感染および再燃への関与、および胃および宿主内の他の場所でのバイオフィルム形成における役割につ このような研究は、h.ピロリによる植民地化を過小評価することを避けるより効果的な診断プロトコルと、コクコイド形態を排除し、バイオフィルムを”武装解除”することを目的とした新しい治療戦略の両方の開発を可能にするであろう。
利益相反
著者らは、利益相反はないと宣言している。