はじめに
多剤耐性緑膿菌株によって引き起こされる菌血症のような医療関連感染症(Hai)は、罹患率と死亡率が増加し、入院期間が延長され、感受性株によって引き起こされる感染症と比較してコストが高くなります。1-3これらの耐性微生物によって引き起こされる感染症は、多くの場合、年齢、癌、心臓病、糖尿病、抗生物質の集中的な使用、および血液透析、機械換気カテーテル、気管切開術、および他のような侵襲的処置と関連している。4
多剤耐性Pの発生率の増加。 院内感染の原因としての緑膿菌は、染色体遺伝子の突然変異の選択または水平遺伝子導入のいずれかによって、抗菌化学療法中に他のほぼすべての抗菌剤に対する耐性を発達させるこの微生物の能力の結果として、世界的な問題である。5,6ブラジルでは、抗生物質の使用、特にβ-ラクタム、カルバペネム、およびフルオロキノロンの非常に高密度があるため、この問題はさらに重要です。7,8Pの抵抗. カルバペネムに対する緑膿菌は、ブラジルのいくつかの病院で最大60%9,10であり、主にメタロ-β-ラクタマーゼ(MBL)の産生によって起こる。MBL酵素のサブクラスは、IMP(イミペネマーゼ)、VIM(ヴェローナイミペネマーゼ)、SPM−1(サンパウロMBL)、GIM(ドイツイミペネマーゼ)、SIM−1(Seulイミペネマーゼ)、1 1AIM−1(オーストラリアイミペネマーゼ)、1 2KHM(杏林大学病院)、1 3NDM−1(ニューデリー MBL)、1 4DIM−1(オランダ語)の1 0種が知られている。およびTMB(tripoli mbl)を含む。16ブラジルでは、最も一般的なサブクラスはIMP-1とSPM-1です。11
他のいくつかの病原性遺伝子とバイオフィルム形成は、特に侵襲的処置に関連するものを含む、重度の感染症の病原性に寄与する可能性がある。17文献に記載されている主要な病原性因子の中で、我々は鞭毛、線毛、およびアルギン酸18を介して宿主細胞への微生物の付着に関連するものと、上皮の完全性の破壊を容易にし、エラスターゼ、ホスホリパーゼCおよびプロテアーゼアルカリ、さらに外毒素A、ピオシアニン、およびピオバージンなどの免疫系を妨害するものを強調する。19バイオフィルムの生産は、抗生物質が多糖類、タンパク質、およびDNAからなるポリマーマトリックスを分泌するため、特に細胞に浸透することの難しさに関連している。20,21
本研究の目的は、カルバペネム耐性緑膿菌およびMBLの産生によって引き起こされる菌血症に関連する危険因子を同定することであった。 さらに、我々は病原性遺伝子の頻度とバイオフィルムを形成する能力を調べた。
材料および方法患者および病院
P. 2009年から2012年にかけて、Uberlandia大学病院(ブラジル)、Uberlândia連邦大学(HC-UFU)に入院した患者から緑膿菌株を回収し、HC-UFUの微生物学研究所から得た。
研究デザイン
pに感染した患者の危険因子を特定するために、症例(カルバペネム耐性緑膿菌による菌血症患者)と対照(カルバペネム耐性緑膿菌による菌血症患者)を実施した。 カルバペネムに耐性のある緑膿菌。 さらに、入院期間、集中治療室(ICU)への入院、侵襲的処置の使用を含む二次的転帰を評価した。 研究に含まれる各患者の人口統計学的、臨床的、および疫学的特徴は、臨床記録から回収された。
定義
医療関連感染症(Hai)は、患者が入院した後に獲得された感染症と定義されます。 HAIsは、入院中または退院後に現れることがあります。Centers for Disease Control and Preventionによれば、菌血症は、陽性の血液培養結果によって文書化された血液中の生菌の存在として定義することができる。 菌血症は,感染の別の焦点とは無関係であったとき,または静脈内カテーテルに関連していたときに原発性として分類され,臨床的に別の解剖学的部位の感染に関連していたときに二次性として分類された。9多剤耐性は、三つ以上の抗菌カテゴリーにおける少なくとも一つの薬剤に対する獲得された非感受性として定義される。単離された微生物が、患者の治療に使用される抗菌剤に対するin vitro耐性および/または微生物感染の診断後の2 4時間の治療の欠如を示した場合、抗菌培養物を、H C−UFUのMicrobiology Laboratoryによって使用されるプロトコールに従って収集し、automated system BACT/Alert(登録商標)(Biomerieux,Durham,USA)を使用して処理した。<8 2 0 1>臨床微生物学的および分子学的試験<6 6 1 2> 同定および抗菌感受性試験はVITEKIIシステムを用いた自動化によって行われ,中間感受性を示す株は耐性と考えられた。 品質管理プロトコルは、臨床および実験室標準研究所の基準に従って使用された。26-28カルバペネム耐性P. 前述したように、緑膿菌分離株は、二重ディスクシナジー試験を用いてMBL産生のために表現型スクリーニングした。さらに、p.aeruginosa株におけるMBL遺伝子の存在を評価するために、前述のように多重PCRを実施した。31サイクル条件は、MasterCycler personal(Eppendorf)において、94°Cで5分、続いて94°Cで30分、53°Cで45秒、72°Cで30秒、72°Cで10分で最終的な延長であった。 アルカリプロテアーゼ(aprA)、エラスターゼA(lasA)、エラスターゼ(lasB)、32溶血性ホスホリパーゼC(plcH)、非溶血性ホスホリパーゼC(plcN)、外毒素A(toxA)とアルギン酸塩(algD)33を成文化病原性遺伝子の検そして5minのための72°c。
初期接着アッセイ34
初期接着を評価するために、TSBで調製した200μ lの1×107cells/mLを含む細胞懸濁液を96ウェルのポリスチレンプレートに添加した。 初期接着は2hで37℃で120rpmで回転させた。 96ウェルのポリスチレンプレートに付着した細菌を0.9%NaCl溶液で二回洗浄し、90sのためのウェルをこすることによって収穫した。 すべての実験は、三つの独立した実験で三連で行われました。 ATCC1 5 6 9 2株(PAO1)を陽性対照として使用し、細菌を含まないTSBを陰性対照として使用した。
バイオフィルム形成アッセイ35
200μ lのTSBで調製した1×107cells/mLを含む細胞懸濁液を96ウェルのポリスチレンプレートに添加した。 バイオフィルムの形成は、24時間37℃で120rpmで回転して発生させた。 96ウェルのポリスチレンプレートで増殖した細菌は、0.9%NaCl溶液で二回洗浄し、逆位置で乾燥するために残しました。 全バイオマスを、前述のようにメタノール(Merck)固定、結晶バイオレット(merck)染色、および酸酢酸(Merck)溶出によって測定した。 溶出された染料を各ウェルから除去し、新しい9 6ウェルのマイクロタイタプレートに入れ、その吸光度をELISAプレートリーダー(Biotek Instruments Inc.、バーモント州、米国)で570nm。 実験は、三つの独立した実験で各株について八つの複製を用いて行われた。 細菌を含まないTSBを陰性対照として使用した。 光学密度カットオフ値(Odc)は、陰性対照の光学密度(OD)の平均より上の3つの標準偏差(SD)として確立された:Odc=陰性対照の平均OD+陰性対照の3x SD。 結果の解釈を容易にするために、株を光学密度に従って以下のカテゴリに分けた:(Odi):Odi≦OdcまたはOdc<8 2 0 1>Odi2X Odc=非バイオフィルム生産者/弱バイオフィルム細胞濃度36
バイオフィルム細胞濃度はCFU列挙により決定した。 バイオフィルム形成後、バイオフィルムを0.9%NaCl溶液で2回洗浄し、90秒間ウェルを掻き取った後に回収した。得られた細胞懸濁液をTSAプレート上にめっきした。 すべての実験は、三つの独立した機会に、三連で行われました。5(Graphpad Software,San Diego,C A)を用いて統計解析を行った。 定量的アッセイは、Dunnの多重比較試験を適用したKruskal−Wallisを使用して比較した。 すべての検定を95%の信頼水準で実施し、統計的有意性をp
0.05と定義した。倫理的承認
連邦大学Uberlandiaの研究倫理委員会は、私たちの研究デザインを評価し、承認しました。
結果
2009年5月1日から2012年12月31日まで、大学病院の微生物学研究室で緑膿菌血症の発生率の病院サーベイランスを実施した。 この期間に、p.aeruginosa菌血症を有する157の非反復患者が研究に含まれていた。 菌血症の発症に関連する因子および臨床的および人口統計学的特徴、ならびに病棟による患者の分布に関する詳細な情報を表1および2に示す。 原発性菌血症は75.8%で発生し、不明な焦点を持つものは62%を占めた。症例の4%。 二次菌血症は患者の24.2%を占め、気道が感染の主な焦点であった(17.2%)。 さらに、患者の43.9%がカルバペネム耐性緑膿菌による菌血症を有し、これらの患者のほとんどはICUに入院した。 ほとんどの患者は男性(66.8%)で、平均入院日数は63.2±80.17日、平均年齢は52.01±20.24歳であった。
月/2009から月/2012までUberlândiaの連邦大学の臨床病院の異なる単位で緑膿菌に感染した患者の分布。
| 診療所 | 合計 | カルバペネム耐性緑膿菌 |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| 手術 | 35 (22.3) | 16 (23.2) |
| 診療所 | 24 (15.3) | 10 (14.5) |
| 腫瘍学 | 14 (8.9) | 2 (2.9) |
| 緊急治療室 | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| 新生児ICU | 2 (1.3) | 0 |
| 小児ICU | 2 (1.3) | 1 (1.5) |
| 移植 | 2 (1.3) | 0 |
| その他B | 3 (1.9) | 0 |
集中治療室。
緑膿菌によって引き起こされる菌血症患者におけるカルバペネム抵抗性に関連する危険因子。
| 危険因子 | 合計 | カルバペネム耐性 | 多感受性 | 単変量 | 多変量 | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb(CI95%) | pd | OR(CI95%) | p | |
| 年齢-平均(年) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| 男性/女性 | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| 入院の時間、平均(日数)) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| 集中治療室 | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| 手術 | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| 侵襲的処置(72時間)) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| 静脈中央カテーテル | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| サージカルドレイン | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| プローブ経腸/胃の栄養 | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| 血液透析 | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| 非経口栄養 | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| 併存疾患 | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| 心不全 | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| がん | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| 真性糖尿病 | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| 慢性腎不全 | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| ヒト免疫不全ウイルス | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore(アシススコア)≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| 原発性菌血症 | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| 中央線カテーテル関連 | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| 不明 | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| 二次菌血症 | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| 呼吸器 | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| 尿路 | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| 不適切な治療 | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| 抗生物質の以前の使用 | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| 死亡率 | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
多感受性株は、試験されたすべての抗菌剤に対する感受性を示した株と考えられた。
オッズ比。
信頼区間。
p値。
病気の平均重症度スコア。
統計的に有意である(P≥0.05)。
抗生物質の以前の使用(78.3%)、侵襲的処置(88.5%)、併存疾患(77.7%)、および以前の手術(43.9%)が一般的であった。 患者の31.2%が不十分な治療を受け、死亡率は58.6%であったことが判明した。 P株による菌血症の発症のためのいくつかの内因性および外因性因子。 カルバペネム耐性緑膿菌を一変量解析により検出した。 しかし,機械的換気,経腸/経鼻胃管,焦点不明の原発性菌血症,および不適切な治療のみが,カルバペネム耐性緑膿菌血症の発症と独立して関連する危険因子であった。
MBL産生は、56カルバペネム耐性緑膿菌分離株について分析した。 ナイン(25.0%)分離株は表現型陽性であり、16.1%(n=9/56)の合計は10.71%blaSPM-1と5である、アンプリコンMBL遺伝子と一致していた。3%blaVIM遺伝子一般に、株は多剤耐性プロファイルを示した。 評価した他の病原性遺伝子(apra、plch、plcn、lasa、lasb、toxa、およびalgd)については、すべての株が高い頻度(8 8%)を示した。
カルバペネム感受性緑膿菌88株のうち、21株(23.9%)が他のβ-ラクタムに耐性であった。 カルバペネム耐性69株については、耐性プロファイルが高かった:β-ラクタム50/69(72.5%)、フルオロキノロン48/69(69.6%)、およびアミノグリコシド50/69(72.5%)(表3)。
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
MBL研究に加えて、五つの株(SPM-1を含む二つ、VIMを含む一つ、およびMBLのための二つの表現型陽性)を選択し、結晶バイオマスで染色することにより、総バイオマ MBL遺伝子の存在を考慮すると、すべての株は、バイオマスの0.90±0.61の平均と強くバイオフィルム生産者として同定された。 個々の株の初期接着の違いは観察されなかった。 しかし、BLAVIM遺伝子を含有する株については、より低いODが存在した(図1 0A)。 1).
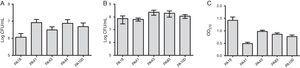
(A)2h後にポリスチレン表面に付着した細胞数を、血液から単離された緑膿菌の5サンプルについてlog CFU/mLとして表した。 (B)バイオフィルム中の生存細胞の数(log CFU/ml)。 (C)バイオフィルムのバイオマスを結晶バイオレットの光学密度(Od570Nm)として表した。
ディスカッション
グラム陽性またはグラム陰性の多耐性微生物によって引き起こされる病院の菌血症は、多くの場合、病院のコストを増加させ、適切な抗菌療法を確立することを困難にし、予後を悪化させる重大な健康上の問題として記述されている。37カルバペネムに耐性のある緑膿菌によって引き起こされる病院の菌血症の割合が高いことは、当院におけるこの感染の重要な原因としてこの有 カルバペネム耐性緑膿菌による病院菌血症の割合が高いことは,当院におけるこの感染の重要な原因としてこの生物の重要性を示している。 異なる研究の結果は、機械的換気、経鼻胃管の使用、および抗生物質の事前使用などの固有の危険因子が、カルバペネム耐性緑膿菌による菌血症の発38
本研究では、一変量解析によると、危険因子の50%以上がこの微生物による感染と関連していた。 しかし,多変量解析により,機械的換気,経腸/胃栄養管,原因不明の原発性菌血症,不適切な治療のみが独立した危険因子と考えられた。
中心静脈カテーテルは、これらの感染症の90%以上に関連しているため、病院における後天性菌血症の最も重要な危険因子の1つです。39この研究では有意な危険因子ではなかったが、カルバペネム耐性緑膿菌を有する菌血症患者の85.5%がこの侵襲的処置を有していた。
多くの場合、抗生物質耐性緑膿菌によって引き起こされる菌血症は、特に不適切な抗生物質療法の投与による死亡率が高い。40本研究では、我々はカルバペネム耐性緑膿菌分離株に感染したそれらの69と、緑膿菌株によって引き起こされる菌血症を持つ157人の患者のコホートを調 総死亡率はカルバペネム耐性群で高かった; しかし、耐性株の存在は不適切な抗菌療法と有意に関連しており、このグループは通常予後が悪いことを証明している。 我々の調査結果と同様に、以前の研究では、不適切な治療を受けた患者から単離された緑膿菌は、46.1%41および53.8%の割合で、予後が悪いことが示された。42
重度の感染症に関連することに加えて、緑膿菌のカルバペネムに対する耐性は、しばしばMBLの産生をもたらす。43我々の結果は、カルバペネム耐性Pことを示した。 緑膿菌は、遺伝子型blaSPM-1の10.7%および遺伝子型blaVIMの5.4%である株の16.1%でこれらの酵素をコードする遺伝子を有する病院全体で流行していた。 多剤耐性株の頻度が高かったので,これらの結果は,流出ポンプや膜の不透過性のような他の抵抗機構がこれらの株に共存することを示唆した。44
抵抗メカニズムとしてのMBLの有病率は、特にラテンアメリカで増加している。ブラジルでは45、MBL産生Pの有病率。 緑膿菌は地域や病院によって異なり、率は7.5%から44%の範囲です。11
SPM-1酵素はブラジルで最も一般的であると考えられており、IMP-1,11,46が続いていますが、VIM酵素を含む緑膿菌分離株の頻度も増加しています。45,47我々の研究では、SPM-1酵素は、MBLの表現型産生サンプルの16.7%で検出され、続いてVIM酵素が検出され、8.3%の症例で検出された。 これらの結果は、我々の領域におけるMBLコード遺伝子の有意な広がりを示している。
MBLとバイオフィルムの生産の存在を考慮すると、株の100%が強力な生産者として分類されました。 ブラジルでの別の研究では、強力なバイオフィルム生産として分類された緑膿菌の40%もMBL生産者であることが判明しました。35これらの特性(バイオフィルム生産とMBL)が重複し、これらの細菌によって引き起こされる感染が治療が困難になると、これらの結果が重要であると これは、部分的には、バイオフィルム中の細菌の増殖が抗菌剤に対して約64倍耐性であるため、正当化される。48
緑膿菌は、apra、plch、plcn、lasa、lasb、toxa、およびalgd遺伝子によってコードされるものなど、これらの感染の病原性および重症度にも寄与する多数の細胞外病原性因子を有する。32,33我々のデータは、株(88%)のほとんどで、多抵抗性プロファイルの存在は、さらに重度の感染に関連付けられている悪化予後に貢献することができtoxAとplcH遺伝子を示さなかった一つの株を除いて、aprA、plcH、plcN、lasA、lasB、toxA、およびalgD病原性遺伝子に対して陽性であったことを示した。
我々の結果は、p.aeruginosaカルバペネム耐性菌血症の発症の危険因子に関する以前の知見と、SPM-1型のMBL産生株の普及を確認した。 しかし、この研究は、非常に毒性の強い株と強くバイオフィルム生産者におけるMBL産生株、特にVIMタイプの広がりのさらなる証拠に貢献しています。
利益相反
著者は利益相反を宣言していません。