Introduzione
Helicobacter pylori (H. pylori) è un batterio microaerofilo gram-negativo, il cui habitat naturale è lo stomaco. Sebbene abbia tipicamente una forma bacillare con diversi flagelli ad un’estremità, adotta un aspetto coccoide in condizioni ambientali sfavorevoli.1,2
H. pylori è un importante fattore eziologico nella gastrite cronica attiva, ulcera peptica, linfoma del tessuto linfoide associato alla mucosa gastrica (MALTO) e cancro gastrico. Anche se si stima che il batterio sia presente nella mucosa gastrica di metà della popolazione mondiale, queste malattie si sviluppano solo in circa il 15-20% degli individui colonizzati.2,3
I regimi di trattamento più comuni hanno portato a un tasso di eradicazione di circa l ‘ 85% in molte aree geografiche,4-6, ma l’efficacia è stata compromessa, soprattutto negli ultimi anni, dalla rapida comparsa di ceppi resistenti agli antibiotici e dalla scarsa aderenza al trattamento.5,7
È importante considerare che la cura (così come la prevenzione delle complicanze) per la gastrite cronica attiva e l’ulcera peptica e per alcune forme di basso grado di linfoma di MALTO gastrico dipende dal successo dell’eradicazione di H. pylori. Inoltre, garantire e sostenere l’eradicazione riuscita di questo microrganismo in tutte le sue forme biologiche impedirebbe la ricrudescenza dell’infezione e, quindi, le ricadute della malattia.
Lo scopo di questa recensione è quello di presentare una panoramica generale della forma coccoide di H. pylori, evidenziandone il profilo microbiologico, la suscettibilità agli antibiotici e la virulenza. Sarà anche analizzato il suo coinvolgimento nella malattia gastrica e verrà esaminata la misura in cui è associata alla recrudescenza dell’infezione e alla recidiva della malattia.
Sopravvivenza e adattamento cellulare di H. Considerazioni generali
Tutti gli organismi viventi sono dotati di meccanismi che consentono loro di sopravvivere in ambienti avversi. Per alcuni, la loro risposta implica (oltre agli adattamenti metabolici) cambiamenti nella morfologia cellulare.8,9 Diversi microrganismi hanno la capacità di differenziarsi in uno stato vitale ma non coltivabile (VBNC) in risposta a condizioni ambientali sfavorevoli alla sopravvivenza e alla crescita. Questa strategia è ampiamente utilizzata da microrganismi come Salmonella, Campylobacter ed Escherichia.10,11
Nello stato VBNC, i batteri generalmente diminuiscono le loro dimensioni e cambiano forma per diventare piccoli corpi sferici. Riducono la loro frequenza respiratoria e il trasporto dei nutrienti e cambiano l’espressione genica e la sintesi molecolare. In questo stato non possono essere rilevati utilizzando tecniche di coltura convenzionali. Tuttavia, i cambiamenti nelle condizioni ambientali possono portare questi microrganismi a “rivivere” (e riconvertirsi al loro stato attivo) o degenerare.10-13
Allo stesso modo, H. il pylori, quando sperimenta condizioni ambientali dannose (all’interno o all’esterno del suo habitat naturale), cambia la sua classica forma bacillare ed entra in uno stato VBNC che porta a cambiamenti morfologici e metabolici e modifiche nel comportamento di crescita.14,15
Stato vitale ma non coltivabile di H. pylori
Sebbene alcuni autori inizialmente cercassero di dimostrare che la conversione da bacillare a forma coccoide era un processo passivo che provocava la morte cellulare e, quindi, che le forme coccoidi erano i resti degenerati di batteri morti, 16, 17 tre forme di H. i pylori sono attualmente considerati esistenti, vale a dire (in ordine di più a meno virulento), la forma bacillare vitale e culturabile, la forma coccoide VBNC e la forma degenerativa non vitale.18-20
Morfologicamente, la conversione dalla forma bacillare alla forma coccoide avviene attraverso forme intermedie V e U13, 14 (Fig. 1 e 2), in cui le strutture cellulari come il citoplasma e la membrana cellulare rimangono intatte, 15, 21 mentre i flagelli tendono ad avvolgere la struttura cellulare coccoide, diventando così quasi invisibili. Altre modifiche ultrastrutturali alla forma coccoide danno luogo a due sottotipi. Il tipo A ha bordi irregolari con una superficie ruvida ed è considerato una cellula morta, mentre il tipo B ha una superficie più liscia, è più piccolo ed è considerato una cellula vivente.21,22
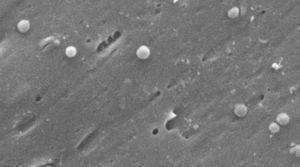
Immagini della forma coccoide di Helicobacter pylori. Microscopio elettronico a scansione immagine gentilmente concessa dal Dr. Nuno F. Azevedo. LEPABE-Dipartimento di Ingegneria Chimica della Facoltà di Ingegneria dell’Università di Oporto (Portogallo).
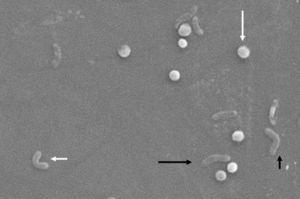
Cambiamenti morfologici nell’Helicobacter pylori. Forma a spirale (freccia nera lunga), forma a V (freccia nera corta), forma a U (freccia bianca corta) e forma coccoide (freccia bianca lunga). Microscopio elettronico a scansione immagine gentilmente concessa dal Dr. Nuno F. Azevedo. LEPABE-Dipartimento di Ingegneria Chimica della Facoltà di Ingegneria dell’Università di Oporto (Portogallo).
In microscopio elettronico a scansione (SEM) analisi dello strato di gel mucoso superficiale di pazienti affetti da cancro gastrico infettati con H. pylori, Ogata et al.23 ha osservato la coesistenza di entrambe le forme bacillari e coccoidi. Altri autori hanno confermato la presenza della forma coccoide sia nello stomaco umano che nel duodeno, 24-26 anche se sembra che la percentuale di forme coccoidi sia più alta nel duodeno che nello stomaco, al punto in cui solo la forma coccoide è osservata in alcune biopsie duodenali.26,27 Questo fatto suggerisce che H. pylori è costretto ad adattarsi alle condizioni biologiche nel duodeno o che queste condizioni sono ideali per H. pylori a rifugiarsi lì nello stato VBNC.
In vitro e in vivo gli esperimenti hanno dimostrato che, in condizioni sfavorevoli, come aerobiosis,28,29 pH alcalino,29,30 ad alta temperatura,31 lunghi periodi di incubazione,29,32 incubazione prolungata in water33 o il trattamento con pompa protonica inhibitors32 o antibiotici,34 il asporigeni fenotipo può mantenere un certo livello di attività metabolica, in quanto esprime un’ampia varietà di geni presenti nel bacillary forma,35 mantiene livelli rilevabili di ureasi attività,36 continua sintesi delle proteine, anche se in piccole quantità (meno di 1% della quantità di proteine sintetizzate dal bacillary forma)37 e produce piccole quantità di DNA, mantenuta anche dopo 3 mesi di stoccaggio in soluzione salina fisiologica a 4°C. 29,38 Tutti questi dati sottolineano il fatto che i cambiamenti biologici in H. pylori in risposta a stimoli dannosi riflettere la sua potente capacità, durante la sua vita utile, per conservare la specie.
Formazione di biofilm
Come con altri batteri, la capacità di H. pylori di persistere come entità infettiva e resistere all’arsenale di agenti antimicrobici volti a sradicarlo è dovuta alla variabilità genetica che gli consente di sviluppare resistenza batterica. La sua strategia di sopravvivenza è ulteriormente migliorata quando le cellule batteriche formano quelli che vengono chiamati biofilm.20 I biofilm sono una sorta di “comunità” microbica in cui i batteri aderiscono saldamente alle superfici biotiche o abiotiche per mezzo di una matrice autoprodotta. Questa matrice, composta da sostanze polimeriche extracellulari, 39, 40 crea un ambiente molto tollerante agli agenti antimicrobici e fortemente resistente alla fagocitosi. Vari meccanismi di difesa dell’ospite sono quindi elusi, rendendo difficile l’eradicazione. I biofilm sono considerati sistemi veramente complessi e dinamici che facilitano il trasferimento genico orizzontale tra i batteri. Conferiscono così alle popolazioni batteriche nuovi genomi modificati che contribuiscono in modo significativo alla resistenza batterica, alla variabilità del ceppo e all’adattabilità.41-43
In uno studio su 21 biopsie di pazienti in cui il batterio era stato precedentemente eradicato, H. pylori è stato isolato per coltura in 7 delle biopsie, mentre le tecniche di espressione genica hanno rilevato cellule vitali di H. pylori nella maggior parte delle biopsie. SEM, nel frattempo, ha mostrato batteri coccoidi raggruppati disposti in un biofilm microbico, suggerendo che le forme coccoidi potrebbero facilitare la persistenza batterica e la resistenza agli antibiotici.44
Suscettibilità agli antibiotici della forma coccoide
Molti studi hanno dimostrato che H. pylori può cambiare dalla forma bacillare a coccoide all’esposizione (in vitro) a vari agenti antimicrobici. Diverse concentrazioni di amoxicillina, claritromicina, metronidazolo ed eritromicina (per citare solo alcuni degli antibiotici disponibili) possono indurre questa trasformazione morfologica.34,35,45 Il più grande effetto di induzione è stato osservato con amoxicillina, 27, 34, 46 noto per essere altamente efficace in vitro contro H. pylori; tuttavia, le osservazioni morfologiche delle colture mostrano che le forme bacillari diminuiscono di numero a favore delle forme coccoidi.34,46 Faghri et al., 47 ha raggiunto effetti battericidi per le forme coccoidi, a oltre il 60% con metronidazolo a due volte la concentrazione inibitoria minima (MIC) e all ‘ 80-90% con claritromicina al MIC; tuttavia, il trattamento con amoxicillina con MIC e MIC× 2 non ha inibito le forme coccoidi vitali. Allo stesso modo, Berry et al.34 ha osservato che mentre l’amoxicillina a MIC× 10 ha eliminato le forme bacillari di H. pylori, ha anche indotto la formazione di forme coccoidi. Perkins et al.48 ha osservato, in uno studio su gatti infetti naturalmente da H. pylori, che 6 settimane dopo il trattamento di eradicazione, i succhi gastrici erano positivi per H. pylori in un solo gatto, tuttavia l’analisi della reazione a catena della polimerasi (PCR) ha identificato il materiale genetico di H. pylori in tutti i gatti nello studio. Anche se H. pylori è stato rilevato in un singolo gatto, le lesioni istologiche erano coerenti con la gastrite cronica e sono state contrassegnate dalla presenza di follicoli linfoidi.
Tenendo conto di questi dati microbiologici e di ricerca di base, in un precedente studio condotto su pazienti infettati da H. pylori—in cui era stata precedentemente determinata la sensibilità dei ceppi isolati all’amoxicillina—la doppia terapia (inibitori della pompa protonica e amoxicillina) ha ottenuto un tasso di guarigione per i ceppi sensibili all’amoxicillina di solo il 66%. Questo risultato dimostra la presenza di importanti fattori di resistenza batterica indipendenti aggiuntivi legati all’uso efficace di questo antibiotico.49 Ciò è particolarmente vero se si considera che sembra impossibile che le forme coccoidi possano essere sensibili agli antibiotici β-lattamici, poiché le forme coccoidi hanno profili proteici diversi da quelli bacillari che legano la penicillina.50 È quindi probabile che non tutti gli organismi H. pylori siano completamente eliminati dopo il trattamento di eradicazione; piuttosto, alcuni sono suscettibili di essere convertiti in forme coccoidi e quindi diventare resistenti ai farmaci antibatterici. Questo spiegherebbe il fallimento del trattamento e la ricrudescenza.13,34,45
Vale la pena sottolineare che alcuni studi molto recenti hanno dimostrato che gli acidi grassi liberi, come l’acido linolenico e l’acido linolenico liposomiale, hanno un effetto battericida su entrambe le forme di H. pylori, indipendentemente dalla loro resistenza agli antibiotici.51,52 Queste molecole potrebbero quindi avere un effetto antimicrobico potenzialmente efficace nel trattamento dell’infezione da H. pylori, specialmente nella sua forma coccoide.
Virulenza e patogenicità della forma coccoide
I fattori di virulenza per la forma bacillare di H. pylori e i meccanismi con cui questo batterio è coinvolto nello sviluppo di malattie gastrointestinali sono stati ampiamente studiati.1,3,4 Tuttavia, si sa poco della virulenza e della patogenicità della forma coccoide. Di seguito esaminiamo i risultati più rilevanti su questo argomento.
Come la forma bacillare, la forma coccoide esprime i principali geni di virulenza, come ureA, ureB, hpaA, vacA e cagA, cagE e BabA.35,53,54 Questa espressione, che si verifica per un lungo periodo, probabilmente svolge un ruolo importante nei disturbi cronici gravi dello stomaco.
Aderenza di H. pylori all’epitelio gastroduodenale è noto per essere un passo importante nell’induzione dell’infiammazione cronica attiva dello strato mucoso. Gli studi SEM hanno scoperto che la forma coccoide di H. pylori può presentare sulla superficie della membrana plasmatica delle cellule epiteliali gastriche e, come la forma bacillare, ha la capacità di invadere queste cellule.15,55 Se si verifica l’invasione cellulare, le forme coccoidi sono racchiuse in vescicole a membrana a doppio strato e le cellule epiteliali gastriche appaiono gonfie e litiche, mostrando l’erosione dello strato mucoso.56 Dato che la forma coccoide è meno suscettibile agli antibiotici, si ritiene che queste forme latenti di membrana plasmatica possano diffondersi e infettare altre cellule epiteliali vicine in assenza di una concentrazione efficace di antibiotici.57
L’infezione da H. pylori è anche nota per indurre una risposta immunitaria locale che non riesce a sradicare i batteri, permettendo così alla malattia gastrica di diventare cronica. La risposta immunitaria può essere determinata mediante rilevazione di anticorpi utilizzando metodi sierologici sviluppati utilizzando la forma bacillare di H. pylori.58 Infatti, la presenza di questi anticorpi specifici può essere utilizzata come indicatore epidemiologico dell’infezione e per confermare il successo del trattamento. Non ci sono, tuttavia, metodi sierologici che rilevano forme coccoidi. Al fine di determinare se le forme coccoidi hanno avuto alcun effetto sulla risposta immunitaria in individui colonizzati, Figueroa et al.59 ha messo a punto una specifica tecnica ELISA (enzyme-linked immunosorbent Assay) per valutare e confrontare la risposta immunitaria alle forme coccoidi e bacillari con un gruppo di sieri provenienti da individui infetti sintomatici e asintomatici. Le forme coccoidi di H. i pylori hanno dimostrato di indurre una risposta immunitaria umorale simile a quella indotta dalle forme bacillari negli individui infetti. In un altro studio condotto su bambini con dolore epigastrico, il possibile ruolo della forma coccoide nell’infezione da H. pylori è stato esaminato utilizzando una tecnica ELISA e antigeni preparati da forme cellulari bacillari e coccoidi. Si è riscontrato che il 13,3% e il 55,8% delle cellule erano sieropositivi per gli antigeni della forma bacillare e della forma coccoide, rispettivamente, mentre i valori di sieropositività per i bambini asmatici erano solo del 7,0% e del 26,5%, rispettivamente. Questa differenza di circa quattro volte nella sieropositività tra gli antigeni di forma coccoide e bacillare in pazienti sintomatici e asintomatici potrebbe suggerire un possibile ruolo infettivo della forma coccoide di H. pylori.60
Cellini et al.61 sospensioni concentrate intragastricamente inoculate di H. pylori in forma coccoide in un modello murino BALB/C. H. pylori è stato isolato 2 settimane dopo, i cambiamenti istopatologici si sono verificati 1 mese dopo e tutti i topi colonizzati hanno mostrato una risposta anticorpale sistemica a H. pylori. In altri esperimenti con topi BALB/c, gli animali inoculati con forme coccoidi hanno sviluppato significativi cambiamenti patologici nello stomaco, tra cui lesioni erosive e infiltrazione cellulare infiammatoria della mucosa gastrica.36 Lei et al., 53 per confrontare virulenza e infettività, topi BALB/c intragastricamente inoculati con H. pylori, un gruppo con la forma bacillare e un secondo gruppo con la forma coccoide. Nell’esame SEM di campioni dei 2 gruppi, hanno osservato l’aderenza di entrambe le forme bacillari e coccoidi alle cellule epiteliali della parete gastrica e la presenza di flagelli nelle forme coccoidi. L’esame istologico ha mostrato diversi gradi di lesioni nella mucosa gastrica, da lieve infiltrazione cellulare infiammatoria a erosioni e ulcere. La lesione della mucosa era più lieve nei topi infettati dalla forma coccoide, mentre un risultato positivo non è stato ottenuto nel gruppo di controllo che ha ricevuto acqua sterile.53 Rabelo-Gonçalves et al.62 ha mostrato che le forme coccoidi di H. pylori ha indotto una risposta infiammatoria acuta nello stomaco dei topi fin dalle prime fasi dell’infezione. I risultati di cui sopra evidenziano la capacità delle forme coccoidi di colonizzare e infettare la mucosa gastrica in vivo.
Diversi studi hanno rivelato la presenza della forma coccoide nell’acqua.33,63 Uno di questi studi—del nostro gruppo-ha confrontato 2 gruppi di topi Wistar svezzati, uno ha somministrato acqua di pozzo e acqua di rubinetto per un periodo di tempo prolungato e l’altro ha somministrato acqua distillata sterile, scoprendo che i topi del gruppo di studio hanno sviluppato un processo infiammatorio cronico con formazione di placche linfocitiche e presenza di bacilli64
Come accennato in precedenza, sarebbe logico supporre che, in condizioni sfavorevoli, H. pylori entra in uno stato “quiescente”, modificando la sua forma bacillare classica alla forma coccoide senza produrre cambiamenti degenerativi nel suo genoma e mantenendo la capacità di tornare alla forma bacillare una volta che le condizioni ambientali o naturali dell’habitat migliorano.
La partecipazione della forma coccoide alla recrudescenza
Recidiva di H. pylori a seguito di eradicazione riuscita è rara nei paesi sviluppati rispetto ai paesi in via di sviluppo, con tassi annuali di recidiva del 2,67% e del 13%, rispettivamente.65,66
Esistono due tipi di recidiva dell’infezione da H. pylori: recrudescenza, quando il ceppo batterico responsabile della ricorrenza è geneticamente identico a quello isolato prima dell’eradicazione; e reinfezione, quando la ricorrenza è causata da un ceppo diverso.67 Per differenziare la ricrudescenza dalla reinfezione è necessaria una PCR o un’analisi di polimorfismo genetico per identificare i ceppi batterici.67,68 Poiché questi metodi non sono applicati di routine, è spesso impossibile distinguere tra ricrudescenza e reinfezione nella pratica clinica di routine.
H. la recidiva del pylori è clinicamente rilevante, poiché la recidiva dell’ulcera peptica può essere osservata in una percentuale considerevole di pazienti infetti, mentre la ricomparsa di microrganismi potrebbe spiegare alcune recidive di linfoma di MALTO dopo il trattamento.Si ritiene che 69 Fattori come bere acqua di rubinetto, malattie dentali e gengivali, tonsillite ricorrente, ospedalizzazione, attrezzature dentistiche e mediche e contatto con i membri della famiglia influenzino la recidiva di H. pylori.70-72 Altri fattori associati alla recidiva dell’infezione sono l’età più giovane, il diabete nei pazienti giovani, il basso reddito annuale e l’inibizione a lungo termine dell’acido gastrico dopo l’eradicazione.73-76
La ricrudescenza è considerata la causa più probabile di recidiva nel primo anno successivo all’eradicazione, mentre la reinfezione può verificarsi dopo un periodo più lungo.68,77 Molti casi di recidiva nei paesi sviluppati sono in realtà dovuti alla recrudescenza. La reinfezione è più comune nei paesi in via di sviluppo, poiché le persone sono apparentemente costantemente esposte all’H. pylori.65,78
Utilizzando tecniche di elettroforesi delle proteine in gel di poliacrilammide, Costas et al.79 ha rilevato che i pazienti con recidiva 4 settimane dopo il trattamento di eradicazione non erano in realtà infettati da un altro ceppo di H. pylori; piuttosto, il ceppo che aveva causato l’infezione originale non era stato completamente sradicato dal trattamento, portando alla ricrudescenza dell’infezione. Pertanto, è importante prendere in considerazione l’efficacia del regime terapeutico: H. la recidiva di pylori è frequente nei pazienti trattati con terapie a bassa efficacia, ma è rara quando vengono utilizzate terapie ad alta efficacia. Ciò è stato dimostrato da uno studio sull’incidenza della recidiva di H. pylori in Spagna di Gisbert et al., 80 che ha trovato che la ricorrenza di H. pylori 6 mesi dopo eradicazione era 8.2% in pazienti trattati con le terapie di bassa efficacia ma soltanto 1.7% in pazienti trattati con le terapie di alta efficacia.
In uno studio condotto in Corea dal 2007 al 2010, H. i tassi di recidiva di pylori sono stati analizzati dopo 6 mesi di terapie di eradicazione di prima e seconda linea di successo, con follow-up annuale—fino alla fine del periodo di studio—sulla base di test respiratori, biopsia gastrica e test ureasi rapidi.81 Si è riscontrato che i tassi annuali di recidiva entro e dopo il follow-up di 2 anni erano rispettivamente del 9,3% e del 2,0% dopo la terapia di prima linea e del 4,5% e del 2,9% rispettivamente dopo la terapia di seconda linea. Gli autori hanno concluso che annuale H. i tassi di recidiva di pylori per i pazienti che hanno ricevuto un trattamento di eradicazione hanno mostrato un forte calo dopo il periodo di follow-up di 2 anni. Questo tempo è stato considerato sufficiente dopo il trattamento per confermare l’eradicazione, e anche tempo sufficiente per consentire una distinzione tra recidiva e recrudescenza dei ceppi di H. pylori.81
Considerazioni finali e conclusioni
Data la capacità di H. pylori di entrare in uno stato VBNC quando sottoposto a condizioni sfavorevoli all’interno o al di fuori del suo habitat, è ragionevole supporre che i regimi di trattamento antibiotico utilizzati per sradicare la forma bacillare di H. pylori possono indurre VBNC forme coccoidi in grado di sopravvivere per lunghi periodi in ambiente gastroduodenale. Da qui possono avere un potenziale patogeno diretto e indiretto che porta alla ricrudescenza dell’infezione e, di conseguenza, fallimenti del trattamento, recidive di infezione e recidiva della malattia gastroduodenale. L’eradicazione di successo può quindi richiedere non solo l’eradicazione delle forme bacillari ma anche delle forme coccoidi, o garantire che le forme coccoidi non siano indotte.
Tenendo presente che, poiché i metodi di routine attualmente implementati nella pratica clinica per confermare l’eradicazione di H. pylori non possono rilevare forme coccoidi, gli host possono essere erroneamente diagnosticati come privi di infezione; inoltre, questi metodi potrebbero non essere in grado di fornire prove complete del potenziale clinico dei farmaci utilizzati per eradicare H. pylori. Pertanto, affinché l’eradicazione sia considerata efficace, si raccomanda un follow-up annuale-utilizzando tecniche non invasive o, se disponibili, metodi molecolari—per determinare se i batteri sono stati completamente eliminati, soprattutto nelle aree ad alta prevalenza e nei pazienti a rischio di recidiva.
Infine, sono necessari ulteriori studi sulla forma coccoide VBNC di H. pylori, sul suo potenziale patogeno, sul suo coinvolgimento nell’infezione e nella ricrudescenza e sul suo ruolo nella formazione di biofilm nello stomaco e in altre posizioni all’interno dell’ospite. Tali studi consentirebbero lo sviluppo sia di protocolli diagnostici più efficaci che evitino di sottovalutare la colonizzazione da parte di H. pylori sia di nuove strategie terapeutiche volte ad eliminare le forme coccoidi e i biofilm “disarmanti”.
Conflitto di interessi
Gli autori dichiarano di non avere alcun conflitto di interessi.