Introduzione
Il tromboembolismo venoso (TEV), compresa la trombosi venosa profonda (TVP), l’embolia polmonare (PE) e la trombosi venosa splancnica, è una complicanza frequente del cancro.1 Lo sviluppo del TEV associato al cancro è associato a una ridotta qualità della vita e comporta un notevole onere economico sia per il paziente che per il sistema sanitario.2 TEV è la seconda causa di morte nei pazienti oncologici ambulatoriali sottoposti a chemioterapia ed è stato dimostrato di essere un predittore indipendente della mortalità nella popolazione di pazienti affetti da tumore.3,4 La gestione del trattamento con TEV associato al cancro può essere difficile perché i rischi di TEV ricorrente e sanguinamento correlato agli anticoagulanti sono elevati nonostante una gestione appropriata.5 Inoltre, le interazioni farmacologiche e le comorbidità correlate al cancro, come la disfunzione renale e/o epatica, la diminuzione dell’assunzione orale, la nausea e il vomito indotti dalla chemioterapia e la trombocitopenia aggiungono complessità al trattamento limitando la scelta dell’agente anticoagulante.
Studi clinici che valutano l’eparina a basso peso molecolare per il trattamento del TEV associato al cancro
L’uso a lungo termine dell’eparina a basso peso molecolare (LMWH) per il trattamento del TEV in pazienti con cancro attivo è raccomandato come terapia di prima linea sulla base dei risultati di più studi controllati randomizzati in aperto (RCT).6,7 I due più grandi studi pubblicati fino ad oggi, gli studi CLOT (Comparison of Low-molecular-weight heparin versus Oral anticoagulant Therapy for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer) e CATCH (Comparison of Acute Treatments in Cancer Emostasis), hanno confrontato un LMWH con una terapia con antagonisti della vitamina K in pazienti con carcinoma attivo e TVP prossimale sintomatica acuta o EP. Vedere la Tabella 1 per le caratteristiche al basale e la Tabella 2 per i risultati dello studio.8,9 Entrambi gli studi hanno utilizzato un progetto di studio in aperto, lo stesso target international Normalized ratio (INR) nel braccio di controllo antagonista della vitamina K, la stessa definizione di cancro attivo e la stessa durata del trattamento e avevano criteri di eleggibilità dei pazienti comparabili.
Tabella 1: Progettazione dello studio e caratteristiche basali degli studi sulle CATTURE e sui COAGULI
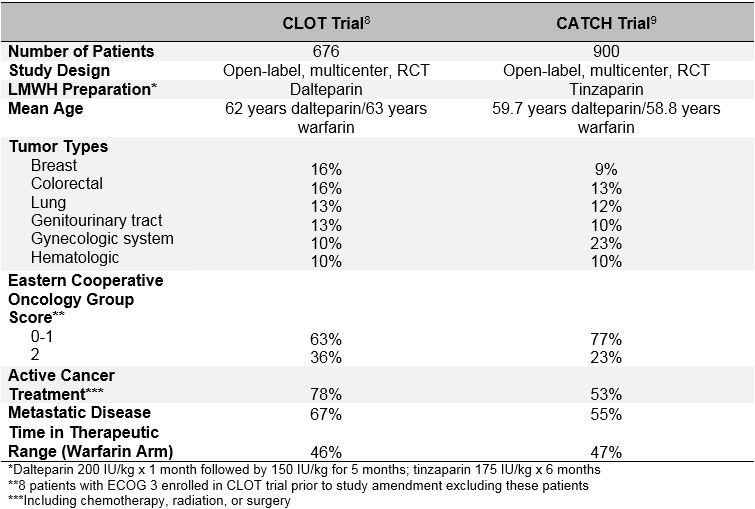
Tabella 2: I risultati del COAGULO e la CATTURA di Prove

Il COAGULO di prova, pubblicato nel 2003, randomizzato 676 pazienti di ricevere dalteparina (200 UI/kg al giorno per 1 mese, seguita da 150 UI/kg al giorno per 5 mesi) o antagonisti della vitamina K (warfarin o acenocumarolo con INR target 2,5 per un totale di 6 mesi, con un iniziale 5-7 giorni sovrapposizione con dalteparina 200 UI/kg).8 TVP ricorrente sintomatica o EP, inclusa la morte correlata a EP, è stata osservata in 27 pazienti (7,0%) randomizzati a dalteparina e in 53 pazienti (15%) randomizzati a antagonista della vitamina K (hazard ratio 0,48; intervallo di confidenza del 95%, 0,30-0,77; p = 0,002). Non sono state osservate differenze nei tassi di sanguinamento maggiore (6 vs. 4%; p = 0,27), qualsiasi sanguinamento (15 vs. 19%; p = 0,09) o morte (39 vs. 41%; p = 0,53) tra i 2 gruppi.
Nello studio CATCH, pubblicato più di 10 anni dopo nel 2015, 900 pazienti sono stati randomizzati a tinzaparina (175 UI/kg al giorno senza riduzione della dose) o warfarin (target INR 2,0-3,0 con sovrapposizione iniziale di tinzaparina 175 UI/kg per 5-10 giorni) per un totale di 6 mesi.9 L ‘ endpoint composito primario di TEV ricorrente comprendente TVP prossimale incidentale ed EP si è verificato in 31 pazienti (6,9%) nel braccio tinzaparin e in 45 pazienti (10%) nel braccio warfarin (HR 0,65; IC al 95%, 0,41-1,03; p = 0,07). TVP sintomatica si è verificata in un numero significativamente inferiore di pazienti trattati con tinzaparina (2,7 vs. 5,3%; HR 0,48; IC al 95%, 0,24-0,96; p = 0,04). Sebbene i tassi di sanguinamento maggiore fossero simili in entrambi i bracci, con tinzaparina è stata osservata una riduzione significativa del sanguinamento non maggiore clinicamente rilevante (10,9 vs. 15,3%; HR 0,58; IC al 95%, 0,40-0,84; p = 0,004). La mortalità era simile in entrambi i gruppi, con circa un terzo dei pazienti che morivano durante il periodo di studio (33,4 vs. 30,6%; p = 0,54). Sebbene la tinzaparina non abbia ridotto significativamente l’endpoint composito primario del TEV ricorrente, i risultati dello studio CATCH supportano l’uso di LMWH a lungo termine come trattamento preferito per il TEV associato al cancro a causa di un minor rischio di sanguinamento maggiore clinicamente rilevante e di una significativa riduzione della TVP ricorrente.
Il fallimento dello studio CATCH per soddisfare la significatività statistica per l’endpoint primario può essere dovuto al tasso di TEV ricorrente inferiore al previsto osservato nel braccio warfarin. Una possibile spiegazione di questa osservazione potrebbe essere un miglioramento nella gestione del warfarin nella sperimentazione delle catture. Tuttavia, livelli simili di controllo dell’INR in entrambi gli studi sostengono questo (il tempo nell’intervallo terapeutico era del 46% nel COAGULO contro il 47% nel CATCH; il tempo al di sopra dell’intervallo terapeutico era del 24% nel COAGULO contro il 27% nel CATCH). Una spiegazione più probabile è un pregiudizio nella selezione di pazienti “meno malati” per l’iscrizione al processo CATCH. Sebbene gli studi CATCH e CLOT abbiano utilizzato criteri di inclusione ed esclusione simili, esistono differenze chiave nelle caratteristiche basali tra le due popolazioni di pazienti, in particolare per quanto riguarda i fattori di rischio trombotici e prognostici. Una percentuale più elevata di pazienti nello studio COAGULO stava ricevendo un trattamento oncologico attivo (72% COAGULO vs. 53% CATCH), aveva una storia di TEV precedente (11% COAGULO vs. 6% CATCH), aveva evidenza di malattia metastatica (67% COAGULO vs. 55% CATTURA), e ha avuto uno stato di performance più povero (Eastern Cooperative Oncology Group score di 2 in 36% COAGULO vs. 23% CATTURA). Inoltre, la mortalità durante il periodo di trattamento di 6 mesi è stata anche più elevata nella popolazione di COAGULI (39% di COAGULI contro 32% di CATTURE). Pertanto, la popolazione di pazienti CATCH aveva probabilmente un rischio intrinseco inferiore di TEV ricorrente rispetto ai pazienti dello studio CLOT. È altamente probabile che i ricercatori non abbiano arruolato i pazienti nel CATCH se ritenessero che LMWH sarebbe più vantaggioso del warfarin, con conseguente arruolamento selettivo di pazienti che avevano meno probabilità di sviluppare VTE ricorrente.
Studi che valutano gli anticoagulanti orali diretti nel TEV associato al cancro
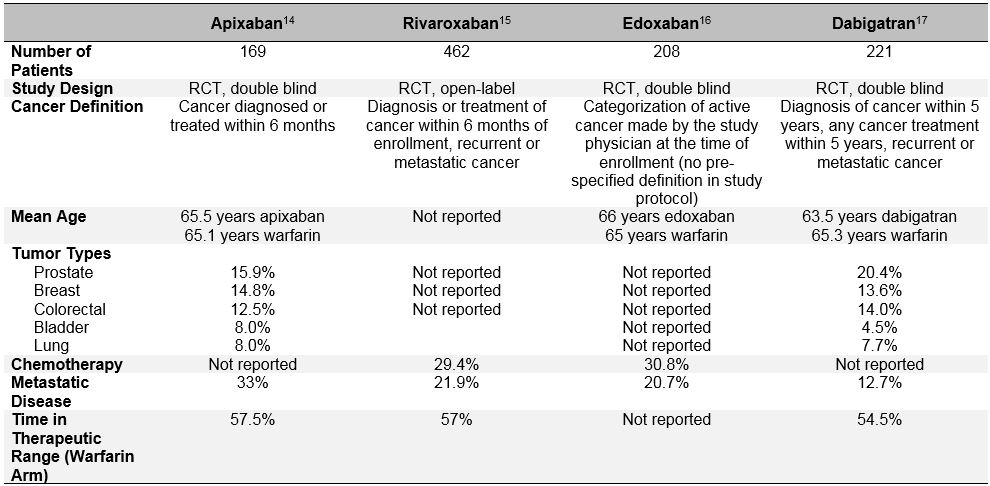
Il bias di selezione del paziente è ancora più evidente nei recenti studi randomizzati che valutano l’efficacia e la sicurezza degli anticoagulanti orali diretti (DOACs) per il trattamento del TEV acuto.10 Questi anticoagulanti orali sono stati ampiamente studiati nell’ultimo decennio nella fibrillazione atriale, nel trattamento del TEV e nella prevenzione del TEV. Negli studi clinici di fase III di riferimento per il trattamento con TEV acuta, è stato costantemente dimostrato che i DOAC non sono inferiori al warfarin (rischio relativo aggregato 0,90; IC al 95%, 0,77-1.06) nella prevenzione di TEV ricorrenti, e hanno un rischio simile o ridotto di sanguinamento maggiore (RR aggregato 0,40; IC al 95%, 0,45-0,83).11 Tra quei pazienti che sono stati classificati come “cancro” o “cancro attivo” in questi studi, anche i DOAC sembrano funzionare in modo simile al warfarin.12 Ma un esame più approfondito di questi dati post-hoc rivela importanti pregiudizi di selezione del paziente e mette in discussione la generalizzabilità dei risultati dello studio DOAC per i pazienti “reali” con cancro con TEV. Oltre alle definizioni eterogenee di “cancro attivo” utilizzate in questi studi che differivano dagli studi CLOT e CATCH, importanti determinanti del TEV ricorrente e del sanguinamento erano anche molto diversi nei pazienti con cancro DOAC dagli studi specifici per il cancro LMWH (Tabella 3). Questi includono la presenza di malattia metastatica e l’uso concomitante di terapia antitumorale. Le grandi differenze nella mortalità durante il periodo di studio sostengono anche che gruppi molto diversi di pazienti con “cancro” sono stati inclusi negli studi DOAC rispetto a LMWH. Inoltre, a differenza di LMWH, che è associato a una significativa riduzione del rischio di TEV ricorrente rispetto agli antagonisti della vitamina K (RR 0,52; 95% CI, 0,36-0.74), DOACs non riduce significativamente questo rischio in una meta-analisi di 1,132 pazienti con cancro iscritti al EINSTEIN programma di esperimenti clinici, HOKUSAI-VTE (Edoxaban Versus Warfarin per il Trattamento Sintomatico di Tromboembolismo Venoso), RECUPERO (Efficacia e Sicurezza di Dabigatran Rispetto al Warfarin per 6 Mesi di Trattamento di Acuta Sintomatica Tromboembolismo Venoso), e AMPLIFICARE (Apixaban per la Gestione Iniziale di Embolia Polmonare e Trombosi Venosa Profonda come Terapia di Prima Linea) Rct (RR 0,66; 95% CI, 0.39-1.11).10 Tutte queste considerazioni devono prestare attenzione all ‘ uso non selezionato di DOAC in pazienti con tumore attivo e TEV acuta sintomatica.13
Tabella 3: Design dello studio e caratteristiche basali dei sottogruppi di pazienti affetti da tumore Dagli studi DOAC di fase III
Conclusioni
Tutte le principali linee guida di consenso basate sull’evidenza raccomandano LMWH per il trattamento iniziale e a lungo termine del TEV associato al cancro.6,7,13 Questa raccomandazione si basa sull’osservazione che LMWH non solo è più efficace del warfarin per la prevenzione del TEV ricorrente, ma offre anche ulteriori vantaggi rispetto agli agenti orali, tra cui anticoagulazione stabile in pazienti con scarsa assunzione orale, mancanza di interazioni farmacologiche e esperienza clinica nella gestione dell’anticoagulazione che circonda le procedure invasive e la trombocitopenia. Sebbene le DOAC non siano attualmente raccomandate per il trattamento con TEV in pazienti affetti da tumore, le RCT che confrontano rivaroxaban ed edoxaban con LMWH sono attualmente in corso e aiuteranno a chiarire il loro ruolo nel TEV associato al cancro.6,13
- Khorana AA, Dalal M, Lin J, Connolly GC. Incidenza e predittori del tromboembolismo venoso (TEV) tra pazienti oncologici ambulatoriali ad alto rischio sottoposti a chemioterapia negli Stati Uniti. Cancro 2013;119: 648-55.
- Kourlaba G, Relakis J, Mylonas C, et al. Il carico umanistico ed economico del tromboembolismo venoso nei pazienti oncologici: una revisione sistematica. Coagulazione del sangue fibrinolisi 2015;26:13-31.
- Kuderer NM, Ortel TL, Francis CW. Impatto del tromboembolismo venoso e anticoagulante sul cancro e sulla sopravvivenza del cancro. J Clin Oncol 2009;27: 4902-11.
- Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. Il tromboembolismo è una delle principali cause di morte nei pazienti oncologici sottoposti a chemioterapia ambulatoriale. J Thrombb Haemost 2007;5: 632-4.
- Prandoni P, Lensing AW, Piccioli A, et al. Tromboembolia venosa ricorrente e complicanze emorragiche durante il trattamento anticoagulante in pazienti con cancro e trombosi venosa. Sangue 2002; 100: 3484-8.
- Lyman GH, Bohlke K, Khorana AA, et al. Profilassi e trattamento del tromboembolismo venoso in pazienti con cancro: american society of clinical oncology clinical practice guideline update 2014. J Clin Oncol 2015;33:654-6.
- Streiff MB, Holmstrom B, Ashrani A, et al. Malattia tromboembolica venosa associata al cancro, versione 1.2015. J Natl Compr Canc Netw 2015;13: 1079-95.
- Lee AY, Levine MN, Baker RI, et al. Eparina a basso peso molecolare rispetto a una cumarina per la prevenzione del tromboembolismo venoso ricorrente in pazienti con cancro. N Engl J Med 2003; 349: 146-53.
- Lee AY, Kamphuisen PW, Meyer G, et al. Tinzaparin vs Warfarin per il trattamento del tromboembolismo venoso acuto in pazienti con cancro attivo: uno studio clinico randomizzato. JAMA 2015; 314: 677-86.
- Carrier M, Cameron C, Delluc A, Castellucci L, Khorana AA, Lee AY. Efficacia e sicurezza della terapia anticoagulante per il trattamento della trombosi acuta associata al cancro: una revisione sistematica e meta-analisi. Thromb Res 2014;134:1214-9.
- van Es N, Coppens M, Schulman S, Middeldorp S, Büller HR. Anticoagulanti orali diretti rispetto agli antagonisti della vitamina K per il tromboembolismo venoso acuto: evidenza da studi di fase 3. Sangue 2014;124:1968-75.
- Vedovati MC, Germini F, Agnelli G, Becattini C. Anticoagulanti orali diretti in pazienti con TEV e cancro: una revisione sistematica e meta-analisi. Petto 2015;147: 475-83.
- Kearon C, Akl EA, Ornelas J, et al. Terapia antitrombotica per la malattia da TEV: Linea guida del TORACE e rapporto del panel di esperti. Petto 2016; 149:315-52.
- Agnelli G, Büller HR, Cohen A, et al. apixaban orale per il trattamento del tromboembolismo venoso in pazienti oncologici: risultati dello studio AMPLIFY. J Thrombb Haemost 2015;13:2187-91.
- Prins MH, Lensing AW, Brighton TA, et al. Rivaroxaban orale versus enoxaparina con antagonista della vitamina K per il trattamento del tromboembolismo venoso sintomatico in pazienti affetti da tumore (EINSTEIN-TVP e EINSTEIN-EP): analisi aggregata di due studi clinici randomizzati controllati. Lancet Haematol 2014;1:e37-46.
- Raskob GE, van Es N, Segers A, et al. Edoxaban per il tromboembolismo venoso in pazienti oncologici: risultati di un’analisi di sottogruppo di non inferiorità dello studio Hokusai-TEV randomizzato, in doppio cieco, con doppio dummy. Lancet Haematol 2016;3:e379-87.
- Schulman S, Goldhaber SZ, Kearon C, et al. Trattamento con dabigatran o warfarin in pazienti con tromboembolia venosa e cancro. Thrombb Haemost 2015;114: 150-7.
Argomenti clinici: Anticoagulation Management, Arrhythmias and Clinical EP, Cardio-Oncology, Pulmonary Hypertension and Venous Thromboembolism, Anticoagulation Management and Atrial Fibrillation, Anticoagulation Management and Venothromboembolism, Atrial Fibrillation/Supraventricular Arrhythmias
Keywords: Cardiotoxins, Cardiotossicità, Eparina a Basso Peso Molecolare, Warfarin, Anticoagulanti, International Normalized Ratio, Acenocumarolo, Dalteparina, Antithrombins, Tromboembolismo Venoso, Fattori di Rischio, la Fibrillazione Atriale, Ambulatorio, Ricerca di Personale, Qualità della Vita, Pyridones, Pyrazoles, Piridine, Thiazoles, Trombosi Venosa, Embolia Polmonare, Trombosi, Trombocitopenia, Comorbidità, Emostasi, Neoplasie
< Torna a Annunci