Tutte le cellule tissutali dipendono dal metabolismo aerobico per la generazione dell’energia (sotto forma di adenosina tri-fosfato, ATP) necessaria per la sopravvivenza e la funzione. Questo processo mitocondriale fondamentalmente vitale è caratterizzato dal consumo di ossigeno e dalla produzione di anidride carbonica, che può variare da circa 200 mL/minuto nello stato di riposo a oltre cinque volte questo tasso durante l’esercizio.
Il destino ultimo di questa anidride carbonica è l’eliminazione dal corpo in aria espirata e un’importante funzione del sangue è il trasporto di anidride carbonica dalle cellule dei tessuti ai polmoni.
Una comprensione di questo processo di trasporto dipende da un apprezzamento di ciò che si intende per pressione parziale di un gas e da alcune leggi fisiche di base che governano la solubilità e il movimento (diffusione) dei gas.
- CHE COS’È LA PRESSIONE PARZIALE DI UN GAS?
- SOLUBILITÀ E DIFFUSIONE DEI GAS
- TRASPORTO DI ANIDRIDE CARBONICA DALLE CELLULE TISSUTALI AI POLMONI
- BIOSSIDO di CARBONIO E PH del SANGUE
- IN LABORATORIO – DEFINIZIONE DEI PARAMETRI DI CO2
- PRESSIONE PARZIALE DI ANIDRIDE CARBONICA pCO2
- CONCENTRAZIONE DI BICARBONATO (HCO3-)
- CONCENTRAZIONE TOTALE DI ANIDRIDE CARBONICA NEL PLASMA (ctCO2)
- METODI CHIMICI PER MISURARE ctCO2
- DISCORDANZA TRA ctCO2 MISURATO E BICARBONATO CALCOLATO
- SOMMARIO
CHE COS’È LA PRESSIONE PARZIALE DI UN GAS?
La quantità di gas in un sistema, compresi i sistemi biologici, è definita dalla pressione che esercita, tradizionalmente misurata come l’altezza di una colonna di mercurio (mmHg). Quindi nel dire che la pressione atmosferica è 760 mmHg intendiamo che i gas (ossigeno, azoto e anidride carbonica) nell’aria che respiriamo hanno una pressione combinata sufficiente a sostenere una colonna standard di mercurio alta 760 mm.
Questa pressione totale è semplicemente la somma delle pressioni parziali di ciascun gas costituente. Pertanto, poiché l’aria comprende circa il 20% di ossigeno, il 79% di azoto e 0.03% di anidride carbonica, la pressione parziale dell’ossigeno (pO2) nell’aria inspirata è approssimativamente (20 x 760) / 100 = 152 mmHg e la pressione parziale dell’anidride carbonica (pCO2) è (0,03 x 760) / 100 = 0,2 mmHg.
L’unità di pressione systeme internationale (SI), utilizzata nei laboratori clinici al di fuori del Nord America, è il kilopascal (kPa). Il fattore di conversione 0.133 può essere utilizzato per convertire mmHg in kPa.
SOLUBILITÀ E DIFFUSIONE DEI GAS
La legge di Henry afferma che all’equilibrio la quantità di gas disciolto in un liquido è proporzionale alla pressione parziale di quel gas, purché la temperatura sia costante:
Gas disciolto = pressione parziale (p) x coefficiente di solubilità (S)
Dove S è una costante dipendente dalla temperatura per il gas particolare. Il coefficiente di solubilità per l’anidride carbonica a temperatura corporea è 0,23 mmol / L / kPa (o 0,03 mmol/mmHg) . Così poiché pCO2 arterioso è approssimativamente 5.3 kPa (40 mmHg), la quantità di CO2 disciolta nel sangue arterioso (dCO2) è (5,3 x 0,23) o 40 x 0,03) = 1,2 mmol/L.
Il movimento (diffusione) dei gas è determinato in gran parte dai gradienti di concentrazione. Il gas si diffonde da alta pressione parziale a bassa pressione parziale .
TRASPORTO DI ANIDRIDE CARBONICA DALLE CELLULE TISSUTALI AI POLMONI
Il viaggio dell’anidride carbonica (FIGURA 1a) inizia nel mitocondrio delle cellule tissutali dove viene prodotta. A causa del gradiente di concentrazione prevalente, l’anidride carbonica si diffonde dai mitocondri (dove pCO2 è più alto) attraverso il citoplasma, fuori dalla cellula e nella rete capillare.
FIGURA 1a: CO2 nei tessuti
Clicca per ingrandire
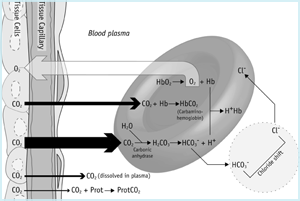
Un po ‘ della CO2 che arriva nel sangue dalle cellule dei tessuti rimane fisicamente disciolta nel plasma sanguigno (vedi sopra) e una proporzione ancora minore si lega ai gruppi terminali NH2 (amminici) delle proteine plasmatiche, formando i cosiddetti composti carbammino. La maggior parte tuttavia, diffonde giù un gradiente di concentrazione nei globuli rossi.
Un po ‘ di questo rimane disciolto nel citoplasma dei globuli rossi e alcuni è vagamente legato a gruppi terminali amminici di emoglobina ridotta formando carbamino-Hb. Tuttavia, la maggior parte dell’anidride carbonica che arriva nei globuli rossi viene rapidamente idratata ad acido carbonico dall’isoforma dei globuli rossi dell’enzima anidrasi carbonica. A pH fisiologico quasi tutto (≈ 96 %) di questo acido carbonico si dissocia in ioni bicarbonato e idrogeno:
Equazione 1:
![]()
Gli ioni idrogeno sono tamponati da emoglobina ridotta e la maggior parte degli ioni bicarbonato passano dal globulo rosso al plasma in cambio di ioni cloruro (questo cosiddetto ‘chloride shift’ mantiene la neutralità elettrochimica). È chiaro da quanto sopra che la maggior parte dell’anidride carbonica viene trasportata come bicarbonato (prevalentemente nel plasma sanguigno), ma ci sono in totale quattro modi di trasporto di CO2 :
- 90 % è trasportato come bicarbonato nel plasma (65 %) e globuli rossi (25 %)
- 5 % viene trasportato fisicamente disciolto nel plasma e globuli rossi citoplasma
- 5 % è trasportato vagamente legato all’emoglobina nei globuli rossi e
emissioni Totali di anidride carbonica del sangue contenuto è la somma di queste quattro componenti.
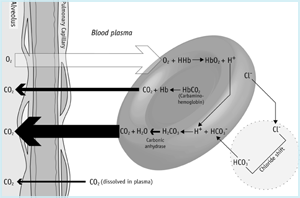
All’interno della microvascolatura dei polmoni (FIGURA 1b) il gradiente di pressione parziale attraverso la membrana alveolare determina che la CO2 disciolta passa dal sangue agli alveoli. Questa perdita di anidride carbonica dal sangue favorisce l’inversione delle reazioni dei globuli rossi sopra descritte.
Quindi il bicarbonato passa dal plasma agli eritrociti, tamponando gli ioni idrogeno rilasciati dall’emoglobina, mentre viene ossigenato. L’inversione della reazione dell’anidrasi carbonica, provoca la produzione di CO2 che si diffonde dai globuli rossi al plasma e successivamente agli alveoli.
Il sangue venoso misto che arriva ai polmoni ha un contenuto totale di CO2 di circa 23,5 mmol/L (o 52 mL/dL) mentre il sangue arterioso che esce dai polmoni ha un contenuto totale di CO2 di 21,5 mmol/L (48 mL/dL).
Questa differenza artero-venosa (2 mmol/L o 4 mL/dL) rappresenta la quantità di CO2 aggiunta al sangue dalle cellule dei tessuti e persa dal sangue mentre passa attraverso la microvascolatura polmonare, per essere infine espulsa dal corpo in aria espirata.
FIGURA 1b: CO2 nei polmoni
Clicca per ingrandire
BIOSSIDO di CARBONIO E PH del SANGUE
acido potenziale di emissioni di CO2, a causa della sua idratazione reazione acido carbonico (vedi equazione 1), assicura che la sua concentrazione nel sangue è un importante determinante di pH del sangue. All’aumentare della concentrazione di CO2, aumenta anche la concentrazione di ioni idrogeno (H+). La regolazione della CO2 del sangue, che corrisponde al tasso di eliminazione della CO2 nell’aria espirata al tasso di produzione nel mitocondrio delle cellule dei tessuti, essenziale per mantenere il normale pH del sangue, è il business del sistema respiratorio.
La frequenza respiratoria (controllata da chemorecettori sensibili alla pCO2 situati nel tronco cerebrale e nell’arteria carotide) aumenta se la pCO2 è in aumento e diminuisce se la pCO2 è in declino. L’aumento della frequenza respiratoria (respiri/min) provoca un aumento del tasso di eliminazione della CO2 e una diminuzione della frequenza respiratoria favorisce la ritenzione di CO2.
La relazione tra pH e anidride carbonica è descritta da una forma dell’equazione di Henderson-Hasselbach (equazione 2). Ciò deriva dall’applicazione della legge dell’azione di massa alle reazioni di idratazione e dissociazione descritte nell’equazione 1 .
Equazione 2:
![]()
dove
| pK/1 | = | ‘apparente’ costante di dissociazione dell’acido carbonico = 6.1 |
| = | la concentrazione plasmatica di bicarbonato (mmol/L) | |
| S | = | solubilità coefficiente di CO2 a 37 oC (0.23 se la pCO2 è misurata in kPa o 0.03 se misurata in mmHg pCO2) |
| pCO2 | = | la pressione parziale di pCO2 (kPa o mmHg) |
Come spiegato in precedenza, il denominatore in questa equazione (S x pCO2) è la quantità di anidride carbonica disciolta (dCO2) mmol/L.
rimuovendo tutte le costanti, l’equazione 2 può essere semplificata per:
Equazione 3:
pH ∞ / pCO2
Quindi il pH del sangue dipende dal rapporto tra la concentrazione plasmatica di bicarbonato (la componente metabolica) e pCO2 (la componente respiratoria). Così se pCO2 aumenta senza un aumento equivalente in bicarbonato, pH cade. Al contrario, se pCO2 cade senza una caduta equivalente in bicarbonato, il pH aumenta.
La relazione inversa vale per la concentrazione di bicarbonato cioè aumento HCO3 – = aumento del pH; diminuzione del bicarbonato = diminuzione del pH.
Il bicarbonato è il principio tampone del sangue e la sua concentrazione in un determinato momento riflette l’equilibrio tra quello prodotto dalla CO2 e quello consumato negli ioni di idrogeno tampone (H+) (vedi equazione 1).
IN LABORATORIO – DEFINIZIONE DEI PARAMETRI DI CO2
I parametri di CO2 generati dall’analizzatore di gas nel sangue sono:
- Pressione parziale dell’anidride carbonica (pCO2) (kPa/mmHg)
- Concentrazione plasmatica di bicarbonato (HCO3 -) (mmol/L)
- Concentrazione plasmatica totale anidride carbonica (ctCO2) (mmol / L)
L’ultimo di questi, ctCO2, può anche essere misurato in plasma o siero con metodi chimici indipendenti dall’analizzatore di gas nel sangue.
PRESSIONE PARZIALE DI ANIDRIDE CARBONICA pCO2
Questo parametro è una misura della pressione esercitata da quella piccola porzione (≈ 5 %) di anidride carbonica totale nel sangue che rimane allo stato gassoso, ‘disciolta’ nella fase acquosa del plasma e del citoplasma delle cellule del sangue. La misurazione viene effettuata utilizzando un elettrodo pH specifico CO2 incorporato in analizzatori di gas ematici.
In salute il pCO2 del sangue arterioso è mantenuto nell’intervallo 4,7-6,0 kPa (35-45 mmHg); Il pCO2 del sangue venoso è un po ‘ più alto 5,6-6,8 kPa (41-51 mmHg).
CONCENTRAZIONE DI BICARBONATO (HCO3-)
Questa è la quantità di bicarbonato in volume unitario di plasma. Come notato in precedenza, questa è la forma in cui la maggior parte dell’anidride carbonica (90 %) viene trasportata nel sangue. Questo parametro non può essere misurato ma viene generato dal calcolo durante l’analisi dei gas ematici. Il calcolo utilizzato è un riarrangiamento dell’equazione 2:
Equazione 4:
log = pH + log (S x pCO2) – pK/1
e dipende dall’avere valori per pH e pCO2, entrambi misurati durante l’analisi dei gas nel sangue.
Teoricamente il bicarbonato plasmatico è la differenza tra CO2 totale (ctCO2) e la somma di tutte le altre forme di CO2 nel plasma, cioè CO2 disciolta (dCO2), CO2 legata alle proteine plasmatiche (carbamino CO2) e acido carbonico (H2CO3).
Così:
Bicarbonato plasmatico (mmol / L) =
ctCO2- (dCO2 + carbammino-CO2 + H2CO3)
In pratica, poiché carbamino-CO2 e H2CO3 sono quantitativamente insignificanti, si ipotizza che la CO2 totale sia la somma di solo bicarbonato e CO2 disciolta . Quindi il bicarbonato di plasma è effettivamente la differenza tra CO2 totale del plasma (ctCO2) e CO2 disciolto nel plasma (dCO2).
In salute il bicarbonato di plasma arterioso (calcolato durante l’analisi dei gas ematici) viene mantenuto entro l’intervallo di riferimento approssimativo: 22-28 mmol/L. Il bicarbonato venoso è leggermente più alto: 24-30 mmol/L.
In alcuni laboratori viene fatta una distinzione tra bicarbonato “effettivo” (il parametro sopra descritto) e bicarbonato “standard”. Il bicarbonato standard è un secondo parametro calcolato ed è la concentrazione plasmatica di bicarbonato di sangue che è stata equilibrata con gas di normale tensione pCO2 (40 mmHg, 5,3 kPa).
In salute, la concentrazione effettiva di bicarbonato è la stessa della concentrazione di bicarbonato standard perché in entrambi i casi pCO2 è normale. Normalizzando pCO2, la componente respiratoria dell’equilibrio acido-base, il bicarbonato standard è una misura esclusivamente della componente metabolica ed è quindi considerato utile per chiarire la causa di disturbi complessi nell’equilibrio acido-base.
CONCENTRAZIONE TOTALE DI ANIDRIDE CARBONICA NEL PLASMA (ctCO2)
Questa è teoricamente la somma di tutte le forme di anidride carbonica nel plasma. Non è misurato durante l’analisi dei gas del sangue, ma – come bicarbonato – calcolato assumendo come sopra che l’anidride carbonica totale è la somma del bicarbonato sciolto in CO2:
Dal plasma dCO2 mmol/L = (S x pCO2), ctCO2 è calcolato così :
plasma ctCO2 (mmol/L) =
plasma bicarbonato (mmol/L) + (S x pCO2) (mmol/L)
CO2 Dissolta (S x pCO2) contribuisce a circa 1.2 mmol/L alla CO2 totale nel plasma del sangue arterioso (vedi sopra), in modo che ctCO2 sia circa 1,2 mmol superiore al bicarbonato plasmatico. L’intervallo di riferimento ctCO2 è quindi di circa 23-29 mmol / L per il sangue arterioso.
Si noterà che come il valore calcolato del bicarbonato generato durante l’analisi dei gas ematici dipende dalla relazione descritta nell’equazione 2, così anche il valore calcolato per ctCO2 generato durante l’analisi dei gas ematici.
Sebbene ctCO2 e bicarbonato forniscano informazioni cliniche equivalenti, nella pratica clinica è invariabilmente bicarbonato piuttosto che ctCO2 che viene utilizzato in combinazione con pH e pCO2 per valutare lo stato acido-base. Il valore clinico del ctCO2 calcolato generato durante l’analisi dei gas ematici è quindi limitato.
METODI CHIMICI PER MISURARE ctCO2
A differenza del bicarbonato, che non può essere misurato, ctCO2 può e il test è comunemente un componente del profilo urea ed elettrolita (U & E) del plasma/siero venoso. Poiché U& E è ordinato molto più frequentemente dei gas del sangue arterioso, il ctCO2 misurato può essere la prima indicazione di disturbo nell’omeostasi di anidride carbonica (e quindi acido-base).
È pratica comune per alcuni laboratori clinici riferirsi a questo componente misurato del profilo U& E come “bicarbonato di plasma”. Questo è errato perché i metodi chimici misurano tutta la CO2 liberata dal plasma (o siero) mediante aggiunta di acido forte o in alternativa tutto il bicarbonato prodotto come risultato dell’aggiunta di un forte alcali al plasma .
Comprende quindi non solo il bicarbonato, ma anche la CO2 disciolta e l’acido carbonico. Se il plasma o il siero utilizzati in questi test fossero derivati dal sangue arterioso, il ctCO2 misurato si approssimerebbe teoricamente al valore calcolato di ctCO2 generato durante l’analisi dei gas del sangue arterioso.
Infatti i profili U& E vengono eseguiti esclusivamente su plasma o siero recuperato dal sangue venoso in modo che vi sia una inevitabile piccola differenza teorica di 1-2 mmol/L (misurata ctCO2 > calcolata ctCO2) dovuta alla differenza artero-venosa.
La differenza teorica tra ctCO2 misurato e bicarbonato plasmatico calcolato è leggermente superiore (ctCO2 misurato > bicarbonato plasmatico calcolato) perché oltre alla differenza artero-venosa di 1-2 mmol/L c’è un’ulteriore differenza di 1,5 mmol/L dovuta all’inclusione di CO2 disciolto e acido carbonico nel ctCO2 misurato.
Tuttavia questa differenza presuppone che nessun biossido di carbonio disciolto venga perso nell’atmosfera prima dell’analisi. Questo potrebbe non essere il caso perché i campioni U&E non vengono gestiti anaerobicamente.
Alcuni hanno sostenuto che il termine “bicarbonato siero/plasma” per il ctCO2 misurato è giustificato dal fatto che la normale pratica di laboratorio è associata a un’inevitabile perdita di CO2 disciolto dal campione U & E prima dell’analisi, nel qual caso il ctCO2 misurato sarebbe, almeno teoricamente, approssimativo al bicarbonato calcolato.
DISCORDANZA TRA ctCO2 MISURATO E BICARBONATO CALCOLATO
Nonostante le lievi differenze teoriche tra i valori misurati e quelli calcolati sopra, è generalmente accettata l’idea che il ctCO2 misurato generato come parte di un profilo U & E sia per tutti gli scopi clinici pratici uguale alla concentrazione plasmatica di bicarbonato calcolata durante l’analisi dei gas ematici.
Ciò si riflette nell’uso del termine “bicarbonato di plasma” per descrivere il ctCO2 misurato.
La migliore prova fino ad oggi che i risultati di bicarbonato misurati e calcolati possono in pratica essere clinicamente intercambiabili arriva in un rapporto molto recente della Mayo Clinic . Gli autori di questo rapporto hanno recuperato 17.621 record di concentrazione di bicarbonato misurata e calcolata per campioni raccolti simultaneamente dagli stessi pazienti durante il 2006/7. La concentrazione di bicarbonato di questo enorme database variava da 5 a 49 mmol / L.
La differenza media (SD) tra i valori misurati e calcolati era -0,36 (1,23 mmol/L) e per 98.il 5% dei risultati dei campioni accoppiati era entro 3 mmol/L l’uno dall’altro. Sebbene, come suggerisce il rapporto Mayo, vi sia di solito un accordo accettabile tra i due parametri, non è affatto raro che i risultati siano del tutto discordanti, con ctCO2 misurato che differisce dal bicarbonato calcolato di ben 15 mmol/L .
Numerosi studi negli ultimi quarant’anni hanno cercato di stabilire la frequenza, l’entità e la causa della discrepanza tra il bicarbonato calcolato e il ctCO2 misurato.
Un primo focus di questo lavoro ha messo in discussione l’affidabilità del calcolo del bicarbonato, che dipende in modo cruciale dalla costanza di pK/1 (vedi equazione 4). In realtà questa non è una vera costante termodinamica, ma una costante di dissociazione ‘apparente’ determinata sperimentalmente dalla misurazione di pH, pCO2 e CO2 disciolto utilizzando la seguente relazione derivata dall’equazione di Henderson-Hasselbach:
PK/1 = pH + log dCO2 – log
Diversi studi hanno rivelato una sufficiente variabilità nella pK/1, in particolare tra i malati critici, per errore clinicamente significativo nel bicarbonato calcolato. Ad esempio in uno studio pK/1 è risultato compreso tra 5,84 e 6,29.
Gli autori calcolano che deviazioni da pK/1 6.1 di questa grandezza comporterebbero errori nel bicarbonato calcolato dell’ordine ± 60 %. Un altro descrive il caso di un bambino diabetico in chetoacidosi la cui pK / 1 variava da 5,49 a 6,02 in un periodo di sette ore.
In uno studio su 79 bambini in cura in un’unità di terapia intensiva pediatrica , il 25% è risultato avere pK/1 al di fuori dell’intervallo “normale” 6,055-6,195 definito dallo studio, e in tre casi pK/1 era > 6,3, con un valore “sorprendente” di 7,11. Queste e altre segnalazioni di variabilità clinicamente significativa nella pK / 1 sono state contestate e l’affidabilità o meno del bicarbonato calcolato rimane un problema irrisolto e controverso.
La base teorica per l’opinione che il bicarbonato calcolato è inaffidabile nella malattia critica è stata esposta da Flear . Un approccio altrettanto teorico accompagnato da una ricchezza di prove sperimentali è stato schierato da Mass et al per rendere il caso opposto in difesa del bicarbonato calcolato.
Gli autori di studi che non sono riusciti a dimostrare una variabilità clinicamente significativa nella pK/1 suggeriscono che la maggiore discordanza tra bicarbonato calcolato e ctCO2 misurato, occasionalmente osservata nella pratica clinica, è molto probabilmente il risultato di una combinazione di variabili pre-analitiche, differenza analitica ed errore analitico casuale .
La misurazione del ctCO2 è particolarmente soggetta a variabilità pre-analitica perché il sangue per U& E profiling è universalmente raccolto ed elaborato aerobicamente. I campioni possono essere lasciati senza cappuccio per ore prima dell’analisi. Poiché l’aria ambiente contiene meno CO2 del sangue, si tende a perdere CO2 disciolto dal campione. Si stima che ciò riduca la CO2 misurata alla velocità di 6 mmol / ora.
invece calcolato bicarbonato non è associato con il rischio di pre-analitica variazione perché il sangue per il sangue di analisi di gas di routine sono campionati anaerobica, e non c’è il minimo ritardo (quasi sempre
un’Altra concausa di discordanza tra i valori misurati e calcolati potrebbe essere campione differenza, dato che il sangue arterioso è usato per calcolare un valore e campioni di siero o plasma sono utilizzati per misurare un valore.
Qualunque sia la causa, gli studi continuano a dimostrare una discordanza moderata ma clinicamente significativa tra i due parametri tra i malati critici . Tuttavia, come per confermare la natura controversa del dibattito, lo studio più recente su pazienti critici fornisce prove di un accordo accettabile tra bicarbonato calcolato e ctCO2 misurato .
Nonostante questo ultimo studio, c’è un corpo di opinione che per i pazienti critici almeno, potrebbe essere prudente abbandonare il bicarbonato calcolato a favore del ctCO2 misurato , anche se va sottolineato che questa visione è controversa e potrebbe essere che l’impatto clinico delle differenze sia limitato.
Le prove di un accordo accettabile fornite dallo studio very large Mayo Clinic non possono purtroppo essere utilizzate nel particolare dibattito che si concentra sui malati critici, perché la popolazione di pazienti non è stata definita.
Dei due parametri, il bicarbonato calcolato ha il netto vantaggio di convenienza rispetto al ctCO2 misurato perché consente a tutti e tre i parametri (pH pCO2 e bicarbonato) utilizzati nella valutazione dell’acido-base di essere disponibili contemporaneamente da un singolo campione.
Non vi è alcun consenso in letteratura su molte delle questioni discusse sopra. Quindi non è ancora chiaro se ci sia o meno discordanza tra CO2 misurata e calcolata, anche se l’equilibrio delle prove si è recentemente spostato a favore di nessuna discordanza dal grande studio della Mayo Clinic .
Per coloro che credono che l’equilibrio delle prove suggerisca che ci sia discordanza, ci sono altri due problemi irrisolti.
Questi sono: il significato clinico di quella discordanza e la causa di quella discordanza. Il dibattito sulla causa della discordanza si è concentrato principalmente sul fatto che la pKl1 vari significativamente tra i pazienti e sulla misura in cui le differenze preanalitiche, le differenze analitiche e l’errore casuale contribuiscono alla discordanza.
Infine almeno un commentatore ha messo in dubbio la necessità clinica di bicarbonato calcolato o ctCO2 misurato, suggerendo che pH e pCO2 da soli consentono una valutazione completa dei disturbi acido-base.
SOMMARIO
L’anidride carbonica è un prodotto del metabolismo cellulare aerobico che viene trasportato nel sangue ai polmoni per l’escrezione in aria espirata. Un po ‘ viene trasportato invariato disciolto nel sangue, ma la maggior parte viene trasportata come bicarbonato.
La regolazione della quantità di anidride carbonica nel sangue, o più precisamente la regolazione del rapporto tra bicarbonato e concentrazione di anidride carbonica disciolta, è essenziale per il mantenimento del pH del sangue (normale equilibrio acido-base).
L’indagine clinica del disturbo acido-base include l’analisi dei gas del sangue arterioso, un test che genera tre parametri dello stato di anidride carbonica. Di questi solo uno, pCO2, è effettivamente misurato; gli altri due – bicarbonato di plasma e concentrazione totale di anidride carbonica – sono derivati da calcoli dal pH misurato e pCO2.
La validità di questi calcoli è stata messa in discussione e vi sono prove contrastanti che in alcuni gruppi di pazienti potrebbe essere più clinicamente affidabile misurare l’anidride carbonica totale con metodi chimici, piuttosto che basarsi su valori calcolati.
Quest’ultimo rimane un problema molto controverso che può essere risolto solo da ulteriori studi.