Nonostante il drammatico declino virus dell’immunodeficienza umana di tipo 1 (HIV-1)-morbilità e la mortalità correlata a seguito della scoperta di inibitori di proteasi e l’avvento di combinazione antiretrovirale altamente attiva (ARV) la terapia a metà degli anni 1990, molti pazienti non erano ancora riusciti terapia a causa di resistenza e/o intolleranza (1). Era chiaro che erano necessari più ARV che agivano su diverse fasi del ciclo di vita del virus, attivi contro i virus resistenti e meglio tollerati. La dimostrazione del ruolo chiave dei recettori delle chemochine CCR5 e CXCR4 nell’ingresso dell’HIV-1 ha suscitato interesse in questo processo come nuovo obiettivo ARV (2, 3). CCR5 è il co-recettore per la maggior parte dei ceppi di HIV-1, e questi virus sono chiamati CCR5 tropico (R5). I ceppi virali che utilizzano CXCR4 sono chiamati CXCR4-tropic (X4), mentre i ceppi che possono utilizzare entrambi i recettori sono dual-tropic (4). Virus da un paziente può spesso contenere miscele di R5, X4, e ceppi dual-tropici, collettivamente chiamati CXCR4-utilizzando.
Il ruolo chiave di CCR5 nell’ingresso dell’HIV-1, accoppiato con la dimostrazione che gli individui che erano omozigoti per una delezione a 32 coppie di basi nel gene CCR5 (CCR5Δ32), e successivamente non esprimono CCR5 funzionale, erano altamente protetti dall’infezione da R5 HIV-1, focalizzavano l’attenzione su CCR5 come bersaglio attraente (5). Sebbene alcuni studi abbiano dimostrato effetti sottili della mutazione CCR5Δ32 sulla funzione immunitaria, come la diminuzione dei punteggi infiammatori negli individui infetti da epatite C e il recupero dall’epatite B negli eterozigoti; mentre gli omozigoti sono più suscettibili all’encefalite trasmessa da zecche e alla grave malattia da virus del Nilo occidentale, questi individui soffrono di effetti negativi apparenti sulla loro salute (5, 6). Questo, insieme al fatto che i membri della superfamiglia dei recettori accoppiati alla proteina G sono spesso trattabili per lo sviluppo di farmaci potenti, selettivi e biodisponibili per via orale (7), ha portato all’avvio di programmi di scoperta del ligando CCR5 da parte di più gruppi, tra cui un team di Pfizer Global Research and Development con sede presso i Sandwich laboratories nel Regno Unito.
Maraviroc (UK-427,857, MVC) è stato scoperto attraverso lo screening ad alta velocità della libreria di composti Pfizer utilizzando un saggio di legame con radioligando chemochina. Il composto più promettente del processo di screening è stato ottimizzato per la potenza contro il recettore, l’attività antivirale, le caratteristiche farmacocinetiche e la selettività contro bersagli cellulari umani attraverso un grande sforzo di chimica medicinale in cui sono state caratterizzate quasi 1000 molecole (7). MVC si lega nella tasca transmembrana di CCR5 ed è un antagonista funzionale a offset lento che impedisce l’internalizzazione (7, 8). Ha una potente attività antivirale contro una vasta gamma di isolati di HIV-1 (7). Insieme al suo eccellente profilo di sicurezza pre-clinica e alla sua farmacocinetica accettabile, nel dicembre 2000 è stato nominato come candidato clinico (7).
Era sempre chiaro che lo sviluppo clinico degli antagonisti CCR5 sarebbe stato impegnativo, poiché questi sarebbero stati i primi farmaci ARV mirati all’ospite e ci stavamo quindi avventurando in un territorio inesplorato. Al fine di anticipare le questioni chiave, un team di sviluppo clinico è stato istituito molto presto dopo l’inizio del programma discovery e sono stato reclutato per guidare il team di sviluppo iniziale, entrando a far parte di Pfizer nel febbraio 1999. Abbiamo identificato diverse sfide chiave da affrontare nella progettazione del programma clinico, oltre a dimostrare la sicurezza e l’efficacia. Il primo di questi era che non esisteva un test clinicamente validato disponibile in commercio per identificare i pazienti infetti da R5 HIV-1. Questo è stato fondamentale, poiché MVC è attivo solo contro i ceppi R5 HIV-1 (7). In secondo luogo, nonostante il fenotipo apparentemente sano di individui con CCR5Δ32 (5, 6), sono rimaste preoccupazioni per la sicurezza dell’esposizione a lungo termine agli antagonisti CCR5, poiché il blocco di CCR5 può essere diverso dall’assenza congenita del recettore CCR5, dove il sistema immunitario è maturato in assenza di CCR5 e possono essersi sviluppati meccanismi compensatori. Infine, negli individui infetti da HIV-1, l’incidenza dei ceppi di HIV-1 che utilizzano CXCR4 aumenta con la progressione della malattia e diminuisce la conta delle cellule CD4 (9), sebbene non sia stato dimostrato alcun nesso causale tra il virus che utilizza CXCR4 e la deplezione delle cellule CD4. Ciò ha portato alla preoccupazione che la pressione selettiva di un antagonista CCR5 possa indurre la popolazione virale a utilizzare CXCR4 e provocare il declino delle cellule CD4.
Fase 1 dosi singole e multiple di studi in volontari sani, condotta nel 2001 e la prima metà del 2002, ha dimostrato che MVC era sicuro e ben-tollerato in più dosi fino a 300 mg due volte al giorno (BID), aveva un profilo farmacocinetico compatibile con una volta al giorno (QD) o di OFFERTA somministrazione per via orale, può essere combinato con altri farmaci Antiretrovirali, e che le dosi ≥100 mg BID ha portato in esposizione sopra la media geometrica antivirale IC90 in vitro (7, 10). Per dimostrare la prova della farmacologia, la saturazione del recettore CCR5 è stata misurata utilizzando un test di internalizzazione ex vivo MIP-1β su misura. È stata dimostrata la saturazione dose-dipendente, con dosi ≥25 mg QD che hanno portato a livelli di saturazione prossimi ai massimi, aumentando l’interessante possibilità che MVC possa essere efficace in dosi fino a 25 mg QD. La saturazione del recettore è rimasta elevata per diversi giorni dopo l’interruzione della somministrazione, riflettendo un lento offset dal recettore in vivo (11).
Siamo stati entrambi entusiasti e incoraggiati dai dati di fase 1 e rapidamente passati a una fase 2a proof of concept programma. I pazienti infetti da HIV-1 sono stati sottoposti a screening per la presenza del solo virus R5, utilizzando un nuovo test di tropismo fenotipico (Trofile®, Monogram Biosciences, South San Francisco, CA, USA) e hanno ricevuto MVC in monoterapia per 10 giorni (12). La saturazione del recettore CCR5 è stata misurata in questo studio per valutare la possibilità di utilizzare questo come biomarcatore per l’efficacia e nel monitoraggio terapeutico. I dati attesi sono stati all’altezza delle nostre aspettative e hanno dimostrato che dosi ≥100 mg BID hanno determinato riduzioni medie massime di HIV-1 RNA di >1.5log10 (Figura 1A), con tutti i pazienti, escluso un paziente con virus X4 che è stato erroneamente incluso, ottenendo una riduzione dell’HIV-1 RNA di almeno 1log10 (12). Questo ci ha dato fiducia che il test ha identificato correttamente i pazienti suscettibili di rispondere a MVC. Il nadir dell’HIV-1 RNA si è verificato 1-5 giorni dopo l’ultima dose di MVC, coerentemente con una prolungata saturazione del recettore come dimostrato negli studi di fase 1 (12). Per tutte le dosi, ad eccezione di 25 mg, è stata osservata una saturazione del recettore QD >80% per tutto il periodo di somministrazione. Tuttavia, non vi era alcuna correlazione tra riduzione della carica virale e grado di saturazione del recettore. La spiegazione più probabile per questo è che sono necessari livelli molto elevati di saturazione del recettore per l’efficacia antivirale e la variabilità intrinseca del test non consente la differenziazione a quel grado (11, 12).
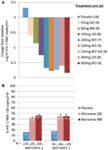
Figura 1. Maraviroc proof of concept e risultati di efficacia di fase 3. A) Variazione media massima rispetto al basale dell ‘ HIV-1 RNA nei pazienti trattati con MVC in monoterapia. Sulla base dei dati di fase 1 e dei modelli e delle simulazioni, sono state selezionate dosi da 25 mg QD a 300 mg BID (inclusi 150 mg BID alimentati e digiunati). HIV-1 RNA, sicurezza e farmacocinetica MVC sono stati valutati (12). (B) MOTIVARE 1 e 2 – percentuale di pazienti che raggiungono HIV-1 RNA <50 copie/mL alla settimana 48. I pazienti con infezione da HIV-1 con esperienza e/o resistenza di classe tripla R5 HIV-1 sono stati randomizzati a ricevere MVC QD o BID, o placebo, in combinazione con un regime antiretrovirale di base ottimizzato (OBT). P < 0.001 (13, 14).
I dati di fase 2a hanno generato entusiasmo in tutta l’azienda e siamo stati desiderosi di far progredire il programma di sviluppo clinico il più rapidamente possibile in quanto vi era un’elevata necessità medica di nuovi ARV per il trattamento di pazienti con opzioni di trattamento non o limitate. L’ampio programma di fase 1 (inclusi più studi di interazione farmaco-farmaco) e l’ampio intervallo di dosi valutati negli studi di fase 2a proof of concept, insieme alla modellazione e alla simulazione, ci hanno dato un’ottima comprensione della probabile dose efficace di MVC in combinazione con altri ARV. Siamo stati quindi in grado di passare direttamente agli studi di efficacia di fase 3 valutando MVC a 300 mg (o equivalente, a seconda dei farmaci co-somministrati) QD e BID, senza la necessità di fare studi di dose-ranging di fase 2b stand-alone, riducendo così significativamente la timeline di sviluppo. Alla fine del 2004, abbiamo avviato quattro grandi studi; MOTIVATE 1 e 2 in pazienti già trattati con R5 HIV-1 (13, 14), MERIT (uno studio di fase 3 con roll-in di fase 2b) in pazienti naïve al trattamento con R5 HIV-1 (15), e studio A4001029, uno studio di sicurezza di fase 2b in pazienti già trattati con virus tropico non CCR5 (virus CXCR4-usante o non fenotipizzabile) (16).
Questa è stata un’impresa enorme, con 4794 pazienti sottoposti a screening in più di 200 siti negli Stati Uniti, Canada, Europa, Australia, Sud Africa, Messico e Argentina. In questo periodo sono stati valutati anche altri due antagonisti CCR5 di piccole molecole (aplaviroc e vicriviroc) negli studi di fase 2b (17, 18). Oltre alle solite sfide di gestione di grandi studi clinici, ci sono state lanciate due palle curve, la prima di queste è stata la sospensione di aplaviroc a causa di epatotossicità idiosincratica. Si è ipotizzato che questo potesse essere un effetto di classe degli antagonisti CCR5 poiché i topi knockout CCR5 sono più suscettibili all’epatossicità mediata da concanavalin-A (17). Inoltre, un paziente nello studio MERIT ha sviluppato una grave epatotossicità. I dati implicavano che era probabilmente correlato all’isoniazide o al cotrimossazolo, ma non si poteva escludere un ruolo contributivo per MVC (15). Una revisione approfondita di tutti i dati per l’evidenza di epatotossicità per MVC e un alto livello di vigilanza per qualsiasi segnale, non ha trovato alcuna prova per un aumento sistematico degli enzimi epatici o altri marcatori per l’epatotossicità. Poco dopo sono state sollevate preoccupazioni per un potenziale aumento del rischio di alcune neoplasie maligne, a seguito della comparsa di linfoma in quattro pazienti trattati con vicriviroc nello studio ACTG5211 (18). Inizialmente c’erano preoccupazioni che questo potesse essere un effetto di classe basato sul potenziale immunomodulatorio degli antagonisti CCR5, ma la revisione dei dati di altri studi di vicriviroc, così come gli studi MVC in corso non supportavano questa teoria (18).
I dati di MOTIVATE 1 e 2 e A4001029 erano disponibili prima di quelli di MERIT, poiché la durata dello studio è in genere più breve per gli studi in pazienti già trattati. È stato con grande entusiasmo che abbiamo atteso le analisi intermedie della settimana 24 per gli studi MOTIVATE nell’ottobre 2006 e siamo stati euforici nel vedere che significativamente più pazienti che ricevevano MVC avevano un RNA HIV-1 di <50 copie/mL (il marcatore chiave per l’efficacia) rispetto a quelli che ricevevano placebo OBT. Ciò è stato confermato dai dati della settimana 48, che dimostrano la durata della risposta (Figura 1B) (13, 14). Al contrario, i pazienti con HIV-1 non tropico CCR5 che ricevevano MVC in A4001029 non sembravano ottenere un beneficio virologico significativo rispetto al placebo (16). L’analisi dei dati di sicurezza non ha sollevato preoccupazioni significative. In particolare, non vi è stata evidenza di un effetto avverso sulla funzione immunitaria, senza aumento degli episodi di infezione o neoplasie nei pazienti trattati con MVC. La valutazione del tropismo virale al momento del fallimento ha dimostrato che >il 50% dei pazienti che fallivano la terapia con MVC aveva virus CXCR4 al momento del fallimento, ma non c’era evidenza di un effetto deleterio sul numero di cellule CD4 (14). La valutazione virologica ha dimostrato che il virus CXCR4-using emerso sotto pressione selettiva MVC proveniva da una popolazione di minoranza preesistente e non si presentava de novo (19). Complessivamente, questi risultati hanno chiaramente dimostrato il beneficio di MVC nella gestione di pazienti già trattati con R5 HIV-1. Uno sforzo supremo da parte del team ha portato alla presentazione di fascicoli per la registrazione sia negli Stati Uniti che in Europa solo 2 mesi dopo che i dati provvisori sono diventati disponibili. MVC (300 mg BID) ha ricevuto l’approvazione per l’uso (in combinazione con altri ARV) negli Stati Uniti nell’agosto 2007, solo 6.5 anni dopo è stato nominato come candidato per lo sviluppo clinico. Un mese dopo, è stato anche approvato per l’uso in questa popolazione nell’UE.
L’analisi alla settimana 48 dello studio MERIT è stata deludente, poiché MVC più zidovudina/lamivudina (HIV-1 RNA <50 copie/mL, 65,3%) non soddisfaceva i criteri prestabiliti di non inferiorità (limite inferiore dell’intervallo di confidenza di 97,5 lati 1 inferiore a -10%) a efavirenz più zidovudina/lamivudina (HIV-1 RNA <50 copie/mL, 69,3%) (15). Tuttavia, i pazienti per questo studio sono stati sottoposti a screening per il virus R5 utilizzando il test Trofile originale. Questo test è stato migliorato nel frattempo per essere più sensibile per il rilevamento di popolazioni minoritarie di virus che utilizzano CXCR4. Tutti i campioni di screening per i pazienti in merito sono stati successivamente riesaminati utilizzando il test enhanced e un’analisi post hoc eseguita includendo solo i pazienti che avevano il virus R5 solo con il test più sensibile. In questa analisi i tassi di risposta per MVC ed efavirenz sono stati rispettivamente del 68,3 e del 68,5%, con il limite inferiore dell’intervallo di confidenza del 97,5% superiore a -10% (15). Sulla base di questi dati, MVC è stato anche approvato per l’uso in pazienti naïve al trattamento nel novembre 2009 dalla Food and Drug Administration degli Stati Uniti.
MVC non solo ha dimostrato di essere una preziosa aggiunta al sempre crescente armamentario di farmaci ARV, ma i dati di questi studi hanno migliorato la nostra comprensione del tropismo dell’HIV e della relazione tra tropismo e progressione della malattia. Per me personalmente questo ha rappresentato un periodo di grande eccitazione e soddisfazione, sia come medico che come scienziato.
Contributi dell’autore
ER ha redatto questo manoscritto sulla base della sua esperienza personale come membro del team di sviluppo MVC. Tutti i dati sono stati pubblicati integralmente altrove. Tutti gli studi sono stati condotti in conformità con i principi della Dichiarazione di Helsinki e con tutte le Conferenze internazionali sull’armonizzazione Buone linee guida di pratica clinica e requisiti normativi e legali locali. Tutti gli studi sono stati approvati da comitati etici indipendenti e tutti i pazienti hanno dato il consenso informato scritto.
Dichiarazione sul conflitto di interessi
Elna Van Der Ryst era dipendente di Pfizer Global Research and development al momento dello sviluppo di MVC. Attualmente fornisce servizi di consulenza a Pfizer.
Riconoscimenti
Vorrei ringraziare i colleghi di Pfizer che hanno contribuito al programma di scoperta e sviluppo MVC, così come i ricercatori e i pazienti che hanno partecipato agli studi clinici.
1. I nostri servizi sono a vostra disposizione per ogni esigenza. La prevalenza della resistenza ai farmaci antiretrovirali negli Stati Uniti. AIDS (2004) 18:1393-401. doi: 10.1097 / 01.AIDS.0000131310.52526.c7
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
2. I nostri servizi sono a vostra completa disposizione. L’ingresso dell’HIV-1 nelle cellule CD4 + è mediato dal recettore della chemochina CC-CKR-5. Natura (1996) 381:667-73. doi: 10.1038 | 381667a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Cofattore di ingresso HIV-1: clonazione funzionale di cDNA di un recettore a sette transmembrana, accoppiato alla proteina G. Scienza (1996) 272:872-7. doi: 10.1126 / scienza.272.5263.872
CrossRef Testo completo / Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Una nuova classificazione per l’HIV-1. Natura (1998) 391:240. doi:10.1038/34571
CrossRef Testo completo / Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Resistenza all’infezione da HIV-1 in individui caucasici portatori di alleli mutanti del gene del recettore della chemochina CCR5. Natura (1996) 382:722-5. doi: 10.1038 | 382722a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Uso clinico di inibitori CCR5 in HIV e oltre. J Transl Med (2011) 9(Suppl 1):S9. doi:10.1186/1479-5876-9-S1-S9
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
7. Il nostro sito utilizza cookie tecnici e di terze parti. Maraviroc (UK-427,857), un inibitore potente, oralmente biodisponibile e selettivo della piccola molecola del recettore della chemochina CCR5 con attività anti-virus dell’immunodeficienza umana ad ampio spettro di tipo 1. Agenti antimicrob Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Testo completo / Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, et al. Interazioni molecolari di CCR5 con le principali classi di antagonisti CCR5 anti-HIV-1 di piccole molecole. Mol Pharmacol (2008) 73:789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
9. Berger EA, Murphy PM, Farber JM. I recettori della chemochina come co-recettori dell’HIV-1: ruoli nell’ingresso virale, nel tropismo e nella malattia. Annu Rev Immunol (1999) 17:657-700. doi:10.1146 / annurev.immunolo.17.1.657
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
10. Abel S, van der Ryst E, Rosario MC, Giacomo I, Ridgway C, Medhurst C, et al. Valutazione della farmacocinetica, della sicurezza e della tolleranza di maraviroc, un nuovo antagonista del CCR5, in volontari sani. Br J Clin Pharmacol (2008) 65(S1):5-18. doi:10.1111 / j. 1365-2125.2008.03130.x
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
11. Il nostro sito utilizza cookie tecnici e di terze parti. Analisi farmacocinetico-farmacodinamica dell’occupazione del recettore CCR5 da parte di maraviroc in soggetti sani e pazienti HIV positivi. Br J Clin Pharmacol (2008) 65(S1):86-94. doi:10.1111 / j. 1365-2125.2008.03140.x
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM, et al. Efficacia della monoterapia a breve termine con maraviroc, un nuovo antagonista del CCR5 nei pazienti con infezione da HIV-1. Nat Med (2005) 11:1170-2. doi: 10.1038 | nm1319
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
13. Gullik RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maraviroc per pazienti precedentemente trattati con infezione da HIV-1 R5. N Engl J Med (2008) 359:1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef Testo completo / Google Scholar
14. Fätkenheuer G, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Analisi di sottogruppi di maraviroc nell’infezione da HIV-1 R5 precedentemente trattata. N Engl J Med (2008) 359:1442-55. doi: 10.1056 / NEJMoa0803154
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maraviroc versus efavirenz, entrambi in associazione con zidovudina / lamivudina, per il trattamento di soggetti naïve agli antiretrovirali con HIV-1 CCR5-tropico. J Infettare Dis (2010) 201:803-13. doi:10.1086/650697
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
16. Saag M, Goodrich J, Fätkenheuer G, Clotet B, Clumeck N, Sullivan J, et al. Uno studio in doppio cieco, controllato con placebo, di maraviroc in pazienti già trattati con infezione da HIV-1 non-CCR5-tropico: risultati a 24 settimane. J Infettare Dis (2009) 11:1638-47. doi:10.1086/598965
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
17. I nostri servizi sono a vostra disposizione per ogni esigenza. Epatotossicità osservata negli studi clinici con aplaviroc (GW873140). Agenti antimicrob Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A, et al. Diagnosi di linfoma e carico di virus Epstein-Barr plasmatico durante la terapia con vicriviroc: risultati degli studi clinici sull’AIDS gruppo A5211. Clin Infettare Dis (2009) 48:642-9. doi:10.1086/597007
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
19. Il sito utilizza cookie tecnici e di terze parti. Il virus che utilizza CXCR4 rilevato nei pazienti trattati con maraviroc negli studi di fase III MOTIVATE 1 e 2 proviene da una preesistente minoranza di virus che utilizza CXCR4. Antivir Ther (2007) 12:S65.
Google Scholar