- Introduzione
- Risultati
- Il driver DBH-Cre segna ed è limitato alle regioni noradrenergiche che esprimono TH nel tronco cerebrale che sono inibite dalla somministrazione di CNO
- Perturbazione mediata da CNO-hM4D dei neuroni noradrenergici nei topi adulti
- La perturbazione CNO-hM4D dei neuroni DBH-Cre provoca un deficit ipercapnico
- I controlli di fratelli abituati iniettati con 10 mg/kg di CNO hanno mostrato un deficit ventilatorio ipercapnico
- Abituati e Unhabituated Wildtype Animali Iniettati Con soluzione Fisiologica Mostrato Nessun cambiamento Presaline e Postsaline
- I rapporti di concentrazione tra clozapina e CNO sono più alti nel cervello che nel siero
- Discussione
- Materiali e metodi
- Approvazione etica
- Allevamento, background genetico e mantenimento di topi
- Istologia
- Elettrofisiologia
- Pletismografia
- Cromatografia liquida-Spettrometria di massa
- Raccolta e analisi dei dati
- Pletismografia
- Statistiche
- Pletismografia
- Cromatografia liquida-Spettrometria di massa
- Dichiarazione etica
- Contributi dell’autore
- Finanziamento
- Dichiarazione sul conflitto di interessi
- Ringraziamenti
Introduzione
Le reti neurali che sottendono respiratorio chemosensory reflex sono un obiettivo primario per la comprensione dell’eziologia dei diversi comportamenti e disturbi fisiologici. I riflessi chemosensoriali perturbati sono ipotizzati per svolgere un ruolo in entrambi i disturbi congeniti e adulti, tra cui la sindrome della morte improvvisa infantile( SIDS), la sindrome da ipoventilazione centrale congenita (CCHS), le apnee centrali del sonno, la respirazione anormale nella sindrome di Rett e la sindrome da ipoventilazione dell’obesità (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi et al., 2013). Sotto l’ipotesi di allarme falso soffocamento, si pensa che l’attivazione chemosensoriale inappropriata o l’ipersensibilità svolgano un ruolo in sottoinsiemi di pazienti affetti da disturbo di panico (Klein, 1993). La disfunzione chemosensoriale può anche svolgere un ruolo nelle malattie neurodegenerative attraverso la respirazione disordinata del sonno che è associata a progressione accelerata (Hakim et al., 2012; Verbraecken e McNicholas, 2013; Bahia e Pereira, 2015; Snyder et al., 2017). Pertanto, una migliore comprensione delle reti chemosensoriali del tronco cerebrale fornirà importanti indizi su una serie di patologie comportamentali e fisiologiche.
Recettori designer farmacogenetici attivati esclusivamente da farmaci designer (DREADDs) (Armbruster et al., 2007) sono stati impiegati in una serie di studi per mappare le popolazioni neurali nel chemoreflex respiratorio (risposta respiratoria a livelli elevati di CO2 nel sangue). La tecnologia DREADD in combinazione con la distribuzione genetica intersezionale è stata utilizzata per silenziare popolazioni neuronali altamente mirate osservando la funzione respiratoria in topi coscienti e sfrenati dal nostro laboratorio e da altri, evitando molti confondi dai precedenti approcci di mappatura dei circuiti (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sole e raggio, 2017; Sun et al., 2017). Questi e la maggior parte degli altri studi includevano quasi sempre CNO solo non-DREADD che esprimeva controlli fratelli che non mostravano effetti chemiosensoriali o altri effetti respiratori, sostenendo che CNO non aveva effetti fuori bersaglio sulla respirazione in topi coscienti e sfrenati nonostante l’alta dose utilizzata, 10 mg/kg. Tuttavia, è stato trovato in diversi altri studi che CNO e i suoi prodotti per il metabolismo posteriore potrebbero avere effetti fuori bersaglio sul comportamento e sulla locomozione in una varietà di saggi, ma l’uscita respiratoria non è stata affrontata (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gomez et al., 2017; Ilg et al., 2018; Mahler e Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez e Knackstedt, 2018). È stato anche dimostrato che il CNO ei suoi metaboliti non sono equamente distribuiti tra il sistema circolatorio e il cervello (Gomez et al., 2017).
Una seconda preoccupazione non indirizzata deriva dallo stress indotto dal paradigma sperimentale, tra cui la detenzione di animali in una camera di pletismografia barometrica a tutto il corpo, la manipolazione, l’iniezione intra-peritoneale e le misurazioni della temperatura rettale. In precedenti studi respiratori DREADD, i topi naïve sono stati introdotti in una piccola camera (140-400 ml) e hanno permesso di acclimatarsi 20-40 min prima dell’acquisizione dei dati (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sole e raggio, 2017; Sun et al., 2017). Tuttavia, non è chiaro se questa quantità di tempo sia sufficiente per ridurre al minimo i cambiamenti respiratori indotti dallo stress che possono agire come un fattore di interazione con gli effetti della clozapina.
Nei nostri studi per esaminare il ruolo del sistema noradrenergico (NA) nel controllo respiratorio, abbiamo cercato di impiegare il ben consolidato RC::Allele P_hM4D DREADD (Ray et al., 2011) per testare il ruolo dei neuroni NA nella respirazione basale e ipercapnica in animali adulti sfrenati usando la pletismografia di tutto il corpo. Perché i neuroni noradrenalina e NA sono anche noti per svolgere un ruolo centrale nelle risposte allo stress (Valentino e Van Bockstaele, 2008; Chen et al., 2018), abbiamo condotto una serie di studi per confrontare l’assuefazione estesa (esposizioni multiple al paradigma sperimentale per cui l’animale apprende che l’esperienza non è minacciosa o sopravvivibile) e alta vs. dosi basse (1 mg/kg) di CNO con precedenti protocolli DREADD pubblicati (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sole e raggio, 2017; Sun et al., 2017). Qui, mostriamo per la prima volta che alte dosi sistemiche di CNO sono in grado di suscitare effetti fuori bersaglio su una funzione respiratoria autonoma nei topi coscienti. Riveliamo anche che l’effetto off-target di CNO sulla produzione respiratoria chemosensoriale è effettivamente smascherato da un’ampia assuefazione e non sarebbe quindi evidente in precedenti studi di controllo CNO che non hanno abituato gli animali prima della misurazione respiratoria, utilizzando solo un breve periodo di acclimatazione prima della raccolta dei dati. Insieme, questi risultati suggeriscono che le popolazioni neuronali precedentemente mappate possono influenzare indirettamente il controllo respiratorio attraverso potenziali ruoli nella regolazione delle risposte allo stress. In particolare, questi dati si allineano con recenti rapporti che suggeriscono che il CNO non è biologicamente inerte ad alte dosi attraverso la conversione metabolica in clozapina (MacLaren et al., 2016; Gomez et al., 2017) e che gli effetti comportamentali fuori bersaglio possono manifestarsi non solo dalla perturbazione dei circuiti comportamentali ma anche dalle interruzioni ai circuiti autonomi sottostanti e all’omeostasi.
Risultati
Il driver DBH-Cre segna ed è limitato alle regioni noradrenergiche che esprimono TH nel tronco cerebrale che sono inibite dalla somministrazione di CNO
Per esaminare l’espressione e la specificità della linea DBH-Cre, abbiamo usato un singolo schema di allevamento di ricombinasi (Figura 1A) in cui abbiamo attraversato il driver alla linea Ai9 (Madisen et al., 2010), che esprime un tdTomato flossato. La colorazione con un anticorpo di tirosina idrossilasi (TH) ha rivelato che l’espressione di tdTomato nel tronco cerebrale era limitata alle regioni che esprimevano TH, inclusi i nuclei locus coeruleus, A5, A1, A2, A7, SubCV e SubCD come previsto (Figura 1B). Per confermare che i neuroni NA che esprimevano il recettore hM4D erano sensibili al CNO, abbiamo eseguito registrazioni sui neuroni locus coeruleus (LC), dove abbiamo osservato un’inibizione del neurone che sparava sull’applicazione del bagno CNO (n = 3, Figura 1C).
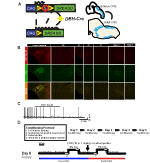
Figura 1. Schemi di allevamento e protocolli respiratori. Il RC::L’allele P_hM4D è combinato con una linea dopamina-beta-idrossilasi (DBH)-Cre per ottenere l’espressione cellulare specifica del recettore hM4D nei neuroni noradrenergici (NA) (A). Espressione fluorescente di tdTomato in DBH-Cre; Sezioni cerebrali coronali Ai9 co-esprime con tirosina-idrossilasi (TH) nei nuclei del tronco cerebrale NA (B). Nella registrazione slice di NA locus coeruleus prima e dopo l’applicazione di CNO, dimostrando la funzionalità del recettore DREADD nei neuroni mirati (C). Protocollo respiratorio. I topi abituati sono sottoposti a un protocollo abituale di 5 giorni che consiste nella manipolazione, nella misurazione della temperatura della sonda rettale, nell’iniezione salina e nell’esposizione alla camera di pletismografia. Il sesto giorno, sia i topi abituati che non abilitati sotto un test ipercapnico in cui l’animale viene posto nella camera respiratoria e permesso di acclimatarsi in condizioni di aria ambiente di base. L’animale viene quindi esposto a 20 min di 5% di CO2 seguito da 20 min di aria ambiente. L’animale viene quindi iniettato per via intraperitoneale con CNO o soluzione salina, seguito da altri 20 min di aria ambiente post-iniezione, 20 min di 5% CO2 e 20 min di aria ambiente. Le caselle aperte delineano i tempi di raccolta dei dati (D).
Perturbazione mediata da CNO-hM4D dei neuroni noradrenergici nei topi adulti
Per esaminare il ruolo dei neuroni NA sotto la respirazione basale e ipercapnica, abbiamo impiegato il sistema DREADD inibitorio RC:P_hM4D incrociato con il driver DBH-Cre. Utilizzando pletismografia a tutto il corpo (Ray et al., 2011), abbiamo misurato le risposte ventilatorie di animali adulti sfrenati in condizioni di aria ambiente (21% O2/79% N2) e ipercapnico (5% CO2/21% O2/74% N2) prima e dopo la somministrazione di CNO (Figura 1D). Indirizzo CNO dosaggio e potenziali di stress indotta dal nostro disegno sperimentale, gli animali sono stati sottoposti a una delle quattro condizioni: (1) unhabituated e iniettato con 10 mg/kg CNO; (2) abituati e iniettato con 10 mg/kg CNO; (3) unhabituated e iniettato con 1 mg/kg CNO; o (4) abituati e iniettato con 1 mg/kg CNO. L’assuefazione consisteva in un processo di 5 giorni che comportava manipolazione, sonda di temperatura rettale, iniezione salina ed esposizione alla camera di pletismografia ogni giorno per 30 min, mentre gli animali naïve erano esposti solo a un periodo di acclimatazione della camera di 20-45 min immediatamente prima della raccolta dei dati come fatto in studi precedenti (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sole e raggio, 2017; Sun et al., 2017). I parametri respiratori misurati includevano frequenza respiratoria RR, volume di marea (VT), ventilazione minuto (VE), consumo di ossigeno (VO2), ventilazione minuto normalizzata al consumo di ossigeno (VE/VO2), frequenza di apnea, frequenza di sospiro e coefficienti di variazione per intervallo e ampiezza interbreath (instabilità periodica e di volume). Come ulteriore controllo, abbiamo anche confrontato animali selvatici abituati e non abituati iniettati con soluzione salina.
La perturbazione CNO-hM4D dei neuroni DBH-Cre provoca un deficit ipercapnico
In tre delle condizioni, DBH-Cre; RC::Gli animali P_hM4D hanno mostrato una riduzione di VE e VE / VO2 dopo la somministrazione di CNO, mentre i controlli fratelli non hanno mostrato differenze nei valori pre e post – CNO. Gli animali non qualificati iniettati con 10 mg/kg di CNO hanno mostrato una RR significativamente ridotta (-12,17%, p = 0,034) e VT (-30,87%, p = 0,0016), con conseguente riduzione di VE (-38,64%, p = 0,0031) e una leggera riduzione di VO2 (-14,25%, p = 0,042) (Figura 2). La riduzione di VE è stata maggiore della diminuzione di VO2, con conseguente riduzione complessiva di VE / VO2 (-26,89%, p = 0,0095). Unhabituated animali iniettati con 1 mg/kg di CNO ha mostrato una tendenza verso la riduzione RR (-12.88%, p = 0.066) e significativamente ridotto VT (-16.52%, p = 0.00085) e VE (-28.08%, p = 0.0070), portando ad una riduzione complessiva VE/VO2 (-22.23%, p = 0.016) (Figura 3). Infine, gli animali abituati iniettati con 1 mg/kg di CNO hanno mostrato una RR ridotta (-10,77%, p = 0,074), una tendenza verso una VE ridotta (-25,07%, p = 0,074) e una riduzione complessiva di VE/VO2 (-23,70%, p = 0,024) (Figura 4). Non sono stati osservati cambiamenti significativi nella frequenza dell’apnea, nella frequenza del sospiro, nell’instabilità periodica o del volume o nella temperatura in qualsiasi coorte.
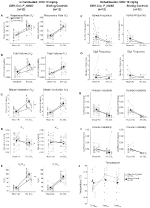
Figura 2. DBH-Cre Unhabituated; RC::P_hM4D gli animali amministrati 10 mg / kg di CNO mostrano un deficit ipercapnic mentre i controlli del fratello non mostrano cambiamento. Dopo l’amministrazione di CNO, DBH-Cre; RC::Gli animali P_hM4D non mostrano cambiamenti nella ventilazione dell’aria della stanza e riduzioni di RR (A), VT (B), VE (C), VO2 (D) e VE/VO2 (E) in condizioni ipercapniche senza cambiamenti nella frequenza dell’apnea (F), nella frequenza del sospiro (G), nell’instabilità periodica (H) o del volume (I) e nella temperatura (J). I controlli fratelli non hanno mostrato alcuna differenza in tutti i valori pre e post-CNO.
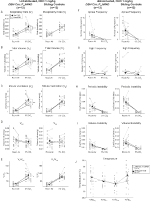
Figura 3. DBH-Cre Unhabituated; RC::P_hM4D gli animali amministrati 1 mg / kg di CNO mostrano un deficit ipercapnic mentre i controlli del fratello non mostrano cambiamento. Dopo l’amministrazione di CNO, DBH-Cre; RC::Gli animali P_hM4D non mostrano cambiamenti significativi nella ventilazione dell’aria ambiente o RR (A) e hanno mostrato riduzioni di VT (B), VE (C) e VE/VO2 (E) in condizioni ipercapniche senza cambiamenti in VO2 (D), frequenza di apnea (F), frequenza di sospiro (G), instabilità periodica (H) o di volume (I) e temperatura (J). I controlli fratelli non hanno mostrato alcuna differenza in tutti i valori pre e post-CNO.
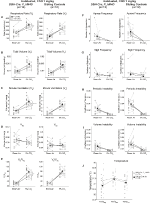
Figura 4. DBH-Cre assuefatto; RC:: P_hM4D gli animali somministrati 1 mg / kg di CNO mostrano un deficit ipercapnico mentre i controlli fratelli non mostrano alcun cambiamento. Dopo la somministrazione di CNO, DBH-Cre; RC:: Gli animali P_hM4D non mostrano cambiamenti nella ventilazione dell’aria ambiente e una riduzione di RR (A) e VE/VO2 (E) in condizioni ipercapniche senza cambiamenti significativi in VT (B),VE (C),VO2 (D), frequenza dell’apnea (F), frequenza del sospiro (G), instabilità periodica (H) o del volume (I) e temperatura (J). I controlli fratelli non hanno mostrato alcuna differenza in tutti i valori pre e post-CNO.
I controlli di fratelli abituati iniettati con 10 mg/kg di CNO hanno mostrato un deficit ventilatorio ipercapnico
in entrambi i DBH-Cre; RC::P_hM4D e controllo fratello animali abituati iniettati con 10 mg / kg di CNO, abbiamo notato una significativa riduzione di VE / VO2 (p = 0.0235) mediata da diminuzioni di RR (p = 0.00036) e VE (p = 0.037) (Figura 5). Tuttavia, a differenza delle altre coorti, non c’era differenza tra DBH-Cre; RC::P_hM4D e animali di controllo fratelli in questi parametri: RR (-12.72 vs. -10.22%, p = 0.6268), VE (-24.88 vs. -23.94%, p = 0.4150), o VE/VO2 (-15.4 vs. -22.55%, p = 0.4643).
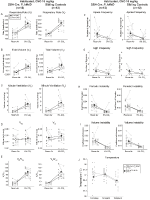
Figura 5. Entrambi abituati DBH-Cre; RC::Gli animali P_hM4D e i controlli fratelli somministrati 10 mg / kg di CNO mostrano un deficit ipercapnico. Dopo la somministrazione di CNO, DBH-Cre; RC::P_hM4D gli animali e i controlli fratelli non mostrano alcun cambiamento nella ventilazione dell’aria ambiente e una riduzione di RR (A), VE (C) e VE/VO2 (E) in condizioni ipercapniche senza cambiamenti significativi in VT (B), VO2 (D), frequenza dell’apnea (F), frequenza del sospiro (G), instabilità periodica (H) o del volume (I) e temperatura (J).
Abituati e Unhabituated Wildtype Animali Iniettati Con soluzione Fisiologica Mostrato Nessun cambiamento Presaline e Postsaline
anche se non fenotipi sono stati osservati nei controlli iniettato con 1 mg/kg di CNO, abbiamo affrontato la possibilità che l’iniezione stessa ha causato il fenotipo osservato nei controlli iniettato con 10 mg/kg di CNO da test abituati e unhabituated wildtype animali iniettati con soluzione fisiologica (Figura 6). In entrambe le coorti abituate e non abitate, gli animali non hanno mostrato alcuna differenza nei parametri respiratori presalina e postsalina. Non sono stati osservati cambiamenti significativi nella frequenza dell’apnea, nella frequenza del sospiro, nell’instabilità periodica o del volume o nella temperatura.
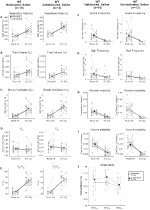
Figura 6. Sia gli animali wildtype non abilitati che quelli abituati somministrati con soluzione salina non mostrano alcuna differenza tra i valori pre – e post-iniezione. Dopo somministrazione salina, sia gli animali wildtype non abilitati che quelli abituati non hanno mostrato cambiamenti in condizioni di aria ambiente o ipercapniche in RR (A), VT (B), VE (C), VO2 (D), VE/VO2 (E), frequenza di apnea (F), frequenza di sospiro (G), instabilità periodica (H) o di volume (I) e temperatura (J).
I rapporti di concentrazione tra clozapina e CNO sono più alti nel cervello che nel siero
Per determinare la biodisponibilità di CNO e clozapina, abbiamo misurato le loro concentrazioni nel siero e nel cervello tramite spettrometria di massa. Trenta minuti dopo un’iniezione intraperitoneale di CNO nei topi, CNO si trova in abbondanza relativa inferiore rispetto al suo metabolita posteriore clozapina nel siero e nel cervello per tutte le dosi testate, 0,1 mg/kg (siero p = 0,0054, cervello p = 0,0001) (Figura 7A), 1 mg/kg (siero p > 0,05, cervello p = 0,0197) (Figura 7B) e 10 0,0036, cervello p = 0.0005) (Figura 7C). Quando sono stati analizzati i rapporti complessivi tra clozapina e CNO, erano sempre sopra lo zero ed erano più alti nel cervello rispetto al siero (veicolo p > 0,5, 0,1 mg/kg p > 0,5, 1 mg/kg p = 0,0018, 10 mg/kg p = 0,0160) (Figura 7D).
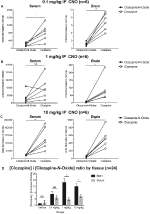
Figura 7. Clozapina a CNO concentrazioni rapporti sono più elevati nel cervello che nel siero. Campioni di siero e cervello sono stati raccolti da topi wildtype 30 min dopo la somministrazione di CNO a 3 dosi diverse 0,1 mg/kg (A), 1 mg/kg (B), 10 mg/kg (C). I singoli punti dati rappresentano l’abbondanza relativa di clozapina-N-ossido o clozapina ottenuta da LC-MS. Clozapina al rapporto CNO per ogni dose e SEM sono anche mostrati (D).
Discussione
L’obiettivo iniziale di questo studio era quello di esaminare il ruolo dei neuroni DBH-Cre nella fisiologia respiratoria dopo perturbazione acuta in animali adulti sfrenati e coscienti. Perché i neuroni noradrenalina e NA svolgono un ruolo ben documentato nei comportamenti di stress (Valentino e Van Bockstaele, 2008; Chen et al., 2018), abbiamo anche cercato di esaminare se l’assuefazione a un probabile protocollo fisiologico stressante avrebbe avuto un effetto sui fenotipi respiratori precedentemente osservati. Nel protocollo DREADD della pletismografia di tutto il corpo utilizzato nel nostro laboratorio e in altri, gli animali vengono manipolati, sondati per via rettale per la temperatura, esposti a un nuovo ambiente (la camera della pletismografia) e iniettati per via intraperitoneale. Studi precedenti hanno dimostrato che la manipolazione e l’assuefazione all’iniezione e ad altre procedure “di routine” possono modificare i parametri comportamentali e fisiologici, inclusa la respirazione (Misslin et al., 1982; Andrews e File, 1993; Lapin, 1995; Ryabinin et al., 1999). Altri fattori di stress applicati modificano anche la respirazione sia in condizioni ventilatorie basali che ipercapniche (Isom e Elshowihy, 1982; Kinkead et al., 2001).
Nei nostri studi che utilizzano alte dosi di CNO, abbiamo scoperto che l’inibizione mediata da hM4D dei neuroni NA definiti da DBH-Cre ha determinato un ridotto riflesso ipercapnico in VE/VO2 in quattro coorti sperimentali definite, con RR, VT e VE ridotti, a supporto di studi precedenti (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et al., 2010). Tuttavia, i controlli di fratelli abituati a una dose di 10 mg/kg di CNO utilizzati in precedenti studi respiratori hanno mostrato un deficit ventilatorio in condizioni ipercapniche della stessa entità di quella osservata negli animali DBH-Cre; RC::P_hM4D. Nessun altro gruppo di controllo fratello ha mostrato questo fenotipo, inclusa la coorte abituata che ha ricevuto solo (1 mg/kg di CNO) o soluzione salina. Questi risultati suggeriscono che dosi più elevate di CNO (10 mg/kg) hanno un effetto sulla risposta ipercapnica che viene smascherata dopo un’ampia assuefazione riducendo presumibilmente i livelli di stress negli animali e che dosi più basse di CNO non hanno un effetto sul controllo respiratorio negli animali assuefatti. Questi risultati sono anche in accordo con il lavoro di Korsak et al. l’oms ha dimostrato che la CNO a basse dosi (2 mg / kg) non produce effetti fuori bersaglio nella capacità di lavoro in un test di esercizio che includeva un allenamento precedente (Korsak et al., 2018) e Fleury Curado et al. l’oms non ha mostrato effetti specifici CNO a basse dosi (1 mg/kg) sulla gittata respiratoria (Fleury Curado et al., 2018).
I rapporti aumentati di clozapina ai livelli di CNO nel siero e nel cervello (Figura 7) sono in concordanza con studi recenti che suggeriscono che il CNO è prontamente metabolizzato a clozapina e mostra una maggiore permeabilità cerebrale rispetto al CNO nei topi e altrove (Jann et al., 1994; Chang et al., 1998; Guettier et al., 2009; Gomez et al., 2017; Raper et al., 2017). Tuttavia, non è chiaro se gli effetti fuori bersaglio osservati siano dovuti a CNO o clozapina. Poiché le nostre misurazioni ipercapniche si sono verificate < 30 min dopo l’applicazione di CNO, è probabile che gli effetti respiratori fuori bersaglio siano mediati dalla clozapina. I nostri risultati (Figura 7) mostrano alti livelli relativi di clozapina nel cervello, sebbene la CNO non sia completamente assente. Tuttavia, Huckstepp e colleghi hanno utilizzato l’applicazione diretta di CNO al midollo ventrale in ratti anestetizzati per dimostrare che solo all’aria ambiente, e non sotto sfide ipercapniche o ipossiche, l’applicazione di CNO ha un piccolo effetto, aumentando la frequenza e diminuendo la durata espiratoria ma lasciando VT invariato, senza alcun effetto chiaro osservato durante l’ipercapnia (Huckstepp et al., 2015). Data l’applicazione diretta in ratti anestetizzati e il lasso di tempo degli esperimenti, è probabile che i piccoli effetti fuori bersaglio osservati siano stati mediati da CNO e non da clozapina.
retro metabolita clozapina è un comunemente usato sedativo e farmaco antipsicotico nella schizofrenia con molti endogena di obiettivi, sia di bassa che di alta affinità antagonista azioni D1, D2 e D4 recettori dopaminergici, 5-HT2A E 5-HT2C, 5-HT3, 5-HT6, e 5-HT7 serotoninergici recettori H1 dell’istamina, e α1 e α2 recettori adrenergici, tra gli altri (Fitton e Tallone, 1990; Ashby e Wang, 1996). Gli effetti fuori bersaglio osservati qui possono derivare da meccanismi e obiettivi distinti o combinati. La clozapina può influenzare la respirazione come sedativo. Uno studio precedente ha mostrato una riduzione di RR e VT sotto il 5 e il 10% di CO2 sia durante il sonno a onde lente che negli stati di sonno a movimento rapido rispetto allo stato di veglia tranquilla nei topi (Nakamura et al., 2007). In alternativa, l’inibizione dei neuroni che esprimono DREADD mirati può provocare un effetto antianxiogenico o ansiolitico simile al nostro protocollo di assuefazione per rivelare effetti chemiosensoriali fuori bersaglio mediati da CNO / clozapina. Entrambe le spiegazioni sono supportate da diversi studi che hanno dimostrato che la CO2 gioca un ruolo nelle risposte di paura innate e apprese e nei comportamenti legati all’ansia (Ziemann et al., 2009; Feinstein et al., 2013; Insegnante et al., 2014; Dlouhy et al., 2015; Inverno et al., 2017). Pertanto, i neuroni mirati in alcuni di questi studi possono effettivamente svolgere un ruolo nel guidare le risposte comportamentali ansiogene piuttosto che i riflessi chemosensoriali fisiologici poiché entrambi i sistemi catecolaminergici e serotoninergici sono coinvolti nei comportamenti di paura/ansia e nell’omeostasi chemosensoriale (Brust et al., 2014; Hennessy et al., 2017).
Al contrario, i fenotipi chemosensoriali osservati con alti livelli di CNO possono essere genuini, poiché siamo stati in grado di ricapitolare il deficit ipercapnico mediato da NA a dosi di CNO, una grandezza di ordine inferiore nei topi abituati, mentre i gruppi di controllo non hanno mostrato alcun effetto CNO. Tuttavia, i confronti completi tra studi precedenti sono difficili a causa della mancanza, in alcuni casi, di dati VO2, VT, RR e VE/VO2 riportati. Ad esempio, i cambiamenti alla temperatura corporea o al tasso metabolico possono anche influire in diversi modi sull’output respiratorio e chemosensoriale, e che le temperature della camera del pletismografo erano notevolmente diverse in alcuni casi (34 vs. 30°C nei nostri studi), influenzando la gamma dinamica della componente barometrica della forma d’onda e quindi il volume delle maree. In particolare, non abbiamo visto cambiamenti apprezzabili nelle caratteristiche della forma d’onda respiratoria in nessuna delle nostre condizioni né arresto cardio-respiratorio acuto che è stato osservato nei nostri precedenti studi ad alta dose, interi rombomeri (Sun et al., 2017).
I nostri risultati mostrano per la prima volta che il CNO ha un effetto inaspettato sul riflesso chemosensoriale ipercapnico che viene smascherato da un’ampia assuefazione. È importante sottolineare che, nonostante i livelli elevati, un effetto CNO off-target era stato precedentemente escluso a causa della mancanza di fenotipo nei controlli fratelli, ma che mostriamo diventa chiaro su assuefazione. Offriamo una caratterizzazione fuori bersaglio di CNO nel sistema del modello del topo per completare gli studi in ratto e nei primati non umani. I risultati qui sollevano la possibilità che ulteriori effetti CNO-mediati, fuori bersaglio sui circuiti in studio o sui circuiti autonomi o omeostatici possano esistere ma possono essere mascherati in altri esperimenti controllati. È importante sottolineare che questi dati rivelano che gli investigatori dovrebbero sforzarsi di utilizzare le dosi minime del ligando attivante possibile in combinazione con alti livelli di assuefazione e che i controlli appropriati devono essere inclusi nelle manipolazioni genetiche chimiche per apprezzare e interpretare pienamente i dati sperimentali.
Materiali e metodi
Approvazione etica
Gli studi sono stati approvati dal Baylor College of Medicine Institutional Animal Care and Use Committee ai sensi del protocollo AN-6171.
Allevamento, background genetico e mantenimento di topi
Abbiamo mantenuto colonie di tutti i nostri ceppi di topi eterozigoti attraverso il backcrossing a topi C57BL/6J e ceppi omozigoti da incroci di fratelli. Per gli esperimenti istologici, DBH-Cremice sono stati accoppiati con il topo omozigote Ai9 (Madisen et al., 2010) (JAX 007909). Per gli esperimenti di pletismografia, i topi DBH-Cre sono stati accoppiati con RC omozigoti:: P_hM4D (Ray et al., 2011) topi per derivare animali, in cui tutti i topi portavano l’allele RC:: P_hM4D. Gli animali fratelli che non hanno ereditato l’allele Cre sono stati utilizzati come animali di controllo per la prole positiva Cre. I primer specifici Rosa26 per i topi Ai9, RC::P_hM4D e RC::ePe erano 5′-GCACTTGCTCTCCCAAAGTC, 5′-GGGCGTACTTGGCATATGAT e 5 ‘ – CTTTAAGCCTGCCAGAAGA e producono una banda di 495 bp (mirata) e una banda di 330 bp (wt). Primer Cre-specifici per tutti i driver rhombomere Cre erano 5′-ATCGCCATCTTCCAGCAGGCGCACCATTGCCC e 5’-GCATTTCTGGGGATTGCTTA e ha prodotto una banda 550 bp se positivo. Per gli esperimenti LC-MS, i topi C57BL / 6J sono stati ottenuti dal Center of Comparative Medicine (CCM), Baylor College of Medicine.
Istologia
DBH-Cre di età compresa tra quattro e otto settimane; Topi adulti Ai9 sono stati perfusi transcardicamente con 0,1 M di soluzione salina tamponata con fosfato (PBS) e poi con 4% di paraformaldeide (PFA) in PBS. Cervelli sono stati sezionati fuori e goccia fissato per 2 h in 4% PFA prima di un risciacquo PBS e l’equilibrio in 20% saccarosio in PBS. I cervelli sono stati quindi sezionati in sezioni da 30 µm, montati su vetrini ed etichettati con anticorpi immunofluorescenti. Abbiamo macchiato durante la notte con anticorpi anti-tirosina idrossilasi per identificare i neuroni catecolaminergici (1:1.000, Millipore AB152) seguiti da 2 h con asino anti-coniglio Cy3 secondario (1: 500, Jackson 711-165-152) in 0.1% Triton-X in PBS (PBST) con siero di asino 5%. Le immagini sono state raccolte su un microscopio epifluorescente verticale Zeiss.
Elettrofisiologia
Fette di cervello orizzontali contenenti il locus coeruleus (300 µm) sono state tagliate con un vibratoma (Leica VT 1000S, Leica Microsystems, Buffalo Grove, IL) da topi adulti DBH-Cre; RR2P; RC::EPE (~1 mese di età) in liquido cerebrospinale artificiale a 4°C (ACSF). Le fette sono state immerse in una camera perfusa con ACSF ossigenato (95% O2 e 5% CO2) contenente in mm: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 e 10 glucosio (2-3 ml/min). Le registrazioni a celle intere sono state eseguite a 30°C utilizzando tecniche convenzionali di patch-clamp e un amplificatore MultiClamp 700B (Molecular Devices, Union City, CA). I neuroni GFP-positivi del locus coeruleus sono stati identificati visivamente e successivamente ripresi da un video di contrasto a interferenza differenziale a infrarossi sul palco di un microscopio verticale (Axioskope FS2, Carl Zeiss, Oberkochen, Germania). Le pipette patch (resistenze 4-6 MU) sono state riempite con (in mm): 110 K-gluconato, 10 KCI, 10 HEPES, 10 Na2-fosfocreatina, 2 Mg3-ATP e 0,2 Na3-GTP; il pH è stato regolato a 7,2 e l’osmolarità a 300 mOsm. Il potenziale di tenuta era -70 mV. CNO è stato applicato il bagno.
Pletismografia
La pletismografia su topi coscienti e sfrenati è stata eseguita come descritto su animali adulti da 6 a 12 settimane (Ray et al., 2011). I topi assuefatti sono stati sottoposti a un protocollo di assuefazione di 5 giorni con ogni giorno costituito da diversi minuti di manipolazione, temperatura assunta dalla sonda rettale, iniezione salina intraperitoneale e 30 min nella camera di pletismografia. I topi sono stati quindi testati entro 1 settimana dall’ultimo giorno di assuefazione. I topi non addomesticati non sono stati esposti alla manipolazione o alla camera del pletismografo. Tutti i topi erano naïve al CNO e usati solo una volta.
Il giorno del test, i topi sono stati prelevati dalla loro gabbia di casa, pesati e la temperatura rettale è stata presa. Gli animali sono stati quindi collocati in una camera di pletismografia a flusso continuo, a temperatura controllata (con rivestimento d’acqua a 30°C) e lasciati acclimatare per almeno 20 minuti in condizioni di aria ambiente (21% O2/79% N2). Dopo l’acclimatazione e la misurazione sotto aria ambiente, il gas della camera è stato commutato in una miscela ipercapnica di 5% CO2 / 21% O2/74% N2 per 20 min. Il gas della camera è stato quindi riportato all’aria ambiente per 20 min. I topi sono stati brevemente rimossi per la misurazione della temperatura rettale e l’iniezione intra-peritoneale di CNO (National Institute of Mental Health Chemical Synthesis and Drug Supply Program) disciolto in soluzione salina (1 o 0,1 mg/ml) per una concentrazione efficace di 10 o 1 mg/kg, rispettivamente. L’animale è stato restituito alla camera per un altro 20 min di aria ambiente, 20 min di ipercapnia, e 20 min di aria ambiente. L’animale è stato quindi rimosso dalla camera e la temperatura rettale è stata presa immediatamente dopo la conclusione dell’esperimento.
Cromatografia liquida-Spettrometria di massa
Ventiquattro topi wildtype, equamente divisi per sesso, sono stati pesati e trattati con 10 mg/kg CNO, 1 mg/kg CNO, 0,1 mg/kg CNO o veicolo. Trenta minuti dopo l’iniezione, i campioni di sangue sono stati raccolti tramite puntura cardiaca e posti in microtainer BD. I campioni sono stati centrifugati a 4°C a 13.500 giri / min in centrifuga da banco e sono stati raccolti supernatanti. Siero e cervello sono stati mantenuti a -20°C fino all’estrazione.
Solventi di grado HPLC acqua, cloroformio acetonitrile e metanolo e acido formico di grado spettrometrico di massa sono stati ottenuti da Sigma-Aldrich (St. Louis, MO). La soluzione di calibrazione contenente più calibranti in una soluzione di acetonitrile, acido trifluoracetico e acqua è stata acquistata da Agilent Technologies (Santa Cruz, CA). Metaboliti e standard interni, tra cui acido N-acetil aspartico-d3, triptofano-15N2, acido glutammico-d5, timina-d4, acido gibberellico, trans-zeatina, acido jasmonico, acido antranilico 15N e testosterone-d3 sono stati acquistati da Sigma-Aldrich (St. Louis, MO). Microtainer R SST TM è stato ottenuto da Becton Dickinson (Franklin Lakes, NJ).
L’estrazione consisteva in 750 µl di metanolo ghiacciato:acqua (4:1) contenente 20 µl di standard interni a spillo che venivano aggiunti a ciascun campione cerebrale (50 mg) e controlli di qualità e quindi omogeneizzati per 1 min ciascuno. Quindi, 750 µl di acetonitrile al 100% contenente 20 µl di standard interni a spillo sono stati aggiunti al campione di lavaggio (100 µl) e ai controlli di qualità e quindi sonicati per 5 min. Tutti i campioni sono stati centrifugati a 5.000 giri / min per 10 min a 4°C. Il surnatante risultante è stato raccolto e 20 µl sono stati iniettati in LC-MS.
Tutti i campioni sono stati analizzati utilizzando lo spettrometro di massa a triplo quadrupolo 6,490 (Agilent Technologies, Santa Clara, CA) accoppiato al sistema HPLC (Agilent Technologies, Santa Clara, CA) mediante monitoraggio a reazione multipla (MRM). Circa 8-11 punti dati sono stati acquisiti per metabolita rilevato. I metaboliti rilevati sono stati clozapina, CNO e norclozapina (N-desmetil clozapina). La modalità positiva ESI è stata utilizzata nel metodo. La colonna HPLC era la colonna ACQUITYUPLC C18 (100 Å, 1,8 µm e 2,1 mm × 100 mm. Milford, MA, USA) con una portata di 0,5 ml / min.
Raccolta e analisi dei dati
Pletismografia
Le variazioni di pressione della pletismografia sono state misurate utilizzando un trasduttore di pressione differenziale Validyne DP45 e una camera di riferimento e un demodulatore portante CD15 e registrate con LabChartPro in tempo reale. Le forme d’onda sono state analizzate offline utilizzando LabChartPro e codice MATLAB scritto su misura per determinare la frequenza respiratoria (RR), il volume delle maree (VT) (Ray et al., 2011), ventilazione minuto (VE) e analisi del modello. Le forme d’onda respiratorie sono state raccolte offline durante i periodi in cui l’animale era a riposo e le letture erano prive di artefatti di movimento. Un minimo di 1 min dati cumulativi compilati da tracce di almeno 10 s lungo dagli ultimi 10 min di una data condizione sperimentale sono stati analizzati. Il consumo di O2 è stato determinato confrontando la composizione del gas tra la calibrazione in una camera vuota e la respirazione dal vivo utilizzando un sensore di ossigeno e un analizzatore AEI. La temperatura della camera è stata costantemente monitorata utilizzando un ThermoWorks MicroThermo 2 e una sonda ed è stata registrata con LabChartPro in tempo reale.
Le misurazioni di Poincaré e la frequenza di sospiro e apnea sono state determinate utilizzando 1 min di tracce prive di movimento da ciascuna condizione respiratoria. I sospiri erano definiti come un respiro con ampiezza di almeno il doppio del respiro medio. Le apnee sono state definite come un intervallo interbreath (IBI) almeno due volte più grande dell’IBI medio. Il coefficiente di variazione (CV) dell’IBI e dell’ampiezza è stato calcolato anche dalla stessa compilazione di tracce di 1 minuto di ciascuna condizione respiratoria (errore standard IBI o ampiezza/IBI medio o ampiezza).
Statistiche
Pletismografia
Risultati (RR, VT, VE, VO2, VE/VO2, numero di apnee e sospiri, e CVs di IBI e ampiezza) per camera d’aria e hypercapnic dati sono stati confrontati tra DBH-Cre; RC::P_hM4D coorti e fratello controlli utilizzando un lineare a effetti misti modello di regressione con tipo animale (sperimentale vs controllo) e CNO amministrazione (pre vs post iniezione) come effetti fissi e ID dell’animale come un effetto casuale. I dati di temperatura sono stati confrontati utilizzando un modello di regressione lineare a effetti misti con tipo animale (sperimentale rispetto al controllo) come effetto fisso. Un p < 0.05 è stato utilizzato per indicare la significatività statistica e i singoli punti di dati, la media e l’errore standard della media sono mostrati su tutti i grafici.
Cromatografia liquida-Spettrometria di massa
L’area ottenuta sotto il picco per ciascun campione è stata normalizzata dal controllo interno e quindi dal veicolo prima dell’analisi statistica. Il test t spaiato è stato utilizzato per confrontare l’abbondanza relativa di clozapina e CNO in ciascun tessuto per gruppo di concentrazione.
Dichiarazione etica
Tutti gli esperimenti sono stati approvati dal Comitato istituzionale per la cura e l’uso degli animali del Baylor College of Medicine. Gli esperimenti sono conformi alle norme nazionali per la cura e l’uso degli animali da esperimento stabilite dall’Associazione per la valutazione e l’accreditamento della cura degli animali da laboratorio.
Contributi dell’autore
JS, FS-M, MC-M e RR hanno concepito e progettato gli esperimenti. JS, FS-M e PZ hanno eseguito gli esperimenti e contribuito all’analisi dei dati. JS, FS-M, VM, MC-M e RR hanno scritto il documento.
Finanziamento
Questo studio è stato supportato da sovvenzioni R01HL130249 e R01HL130249-S1 dal National Heart, Lung, and Blood Institute; March of Dimes Basil O’Connor Award; e il McNair Medical Institute.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ringraziamenti
Ringraziamo il dottor Shaila K. Mani e Benjamin Arenkiel per le discussioni utili. Ringraziamo anche il Baylor College of Medicine Proteomics Core facility per l’esecuzione della cromatografia liquida-Spettrometria di massa.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B nel controllo respiratorio: lezioni dalla sindrome da ipoventilazione centrale congenita e i suoi modelli murini. Respiri. Physiol. Neurobiolo. 168, 125–132. doi: 10.1016 / j.resp.2009.03.005
CrossRef Testo completo / Google Scholar
Andrews, N., e File, S. E. (1993). La gestione della storia dei ratti modifica gli effetti comportamentali dei farmaci nel test più elevato di ansia. EUR. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2007 è stato pubblicato il primo album in studio della band. Evolvendo la serratura per adattarsi alla chiave per creare una famiglia di recettori accoppiati alla proteina G potentemente attivati da un ligando inerte. Proc. Natl. Acad. Sic. Stati Uniti 104, 5163-5168. doi: 10.1073 / pnas.0700293104
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 1996 si trasferisce a New York. Azioni farmacologiche del farmaco antipsicotico atipico clozapina: una revisione. Sinapsi 24, 349-394. doi: 10.1002/(SICI)1098-2396(199612)24:4<349::AIUTO-SYN5>3.0.CO; 2-D
PubMed Abstract / CrossRef Full Text / Google Scholar
Pereira, J. S. (2015). Apnea ostruttiva del sonno e malattie neurodegenerative: una relazione bidirezionale. Dement. Neuropsicolo. 9, 9–15. doi: 10.1590 / S1980-57642015DN91000003
PubMed Abstract / CrossRef Testo completo / Google Scholar
Biancardi, V., Bícego, K. C., Almeida, M. C., e Gargaglioni, L. H. (2008). Locus coeruleus neuroni noradrenergici e CO2 guidano alla respirazione. Pflugers Arch. – EUR. J. Physiol. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2014 è stato pubblicato il primo album in studio del gruppo musicale statunitense Brust, pubblicato nel 2014. Identificazione funzionale e evolutiva di un sottotipo molecolare di neurone serotoninergico cerebrale specializzato nella regolazione della dinamica respiratoria. Cella Rep. 9, 2152-2165. doi: 10.1016 / j.celrep.2014.11.027
PubMed Abstract / CrossRef Testo completo / Google Scholar
Chang, WH, Lin, SK, Lane, HY, Wei, FC, Hu, WH, Lam, YW, et al. (1998). Metabolismo reversibile di clozapina e clozapina N-ossido in pazienti schizofrenici. Prog. Neuro-Psicofarmacolo. Biol. Psichiatria 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
PubMed Abstract / CrossRef Testo completo / Google Scholar
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Identificazione genetica di una popolazione di neuroni noradrenergici implicati nell’attenuazione delle risposte correlate allo stress. Mol. Psichiatria 1-16. doi: 10.1038 / s41380-018-0245-8
PubMed Abstract / CrossRef Testo completo / Google Scholar
Dlouhy, BJ, Gehlbach, BK, Kreple, CJ, Kawasaki, H., Oya, H., Buzza, C., et al. (2015). Respirazione inibita quando le convulsioni si diffondono all’amigdala e alla stimolazione dell’amigdala. J. Neurosci. 35, 10281–10289. doi: 10.1523 / JNEUROSCI.0888-15. 2015
PubMed Abstract / CrossRef Testo completo / Google Scholar
Feinstein, JS, Buzza, C., Hurlemann, R., Follmer, RL, Dahdaleh, NS, Coryell, WH, et al. (2013). Paura e panico negli esseri umani con danno bilaterale all’amigdala. NAT. Neurosci. 16, 270–272. doi: 10.1038 / nn.3323
PubMed Abstract / CrossRef Testo completo / Google Scholar
Fitton, A. e Heel, R. C. (1990). Clozapina. Una revisione delle sue proprietà farmacologiche e l’uso terapeutico nella schizofrenia. Droga 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed Abstract / CrossRef Testo completo / Google Scholar
Fleury Curado, TA, Pho, H., Dergacheva, O., Berger, S., Lee, R., Freire, C., et al. (2018). Il silenzio dei motoneuroni ipoglossali porta alla respirazione disordinata del sonno nei topi magri. Anteriore. Neurolo. 9:962. doi: 10.3389 / fneur.2018.00962
Testo completo CrossRef / Google Scholar
Gargaglioni, L. H., Hartzler, L. K., e Putnam, RW (2010). Il locus coeruleus e la chemiosensibilità centrale. Respiri. Physiol. Neurobiolo. 173, 264–273. doi: 10.1016 / j.resp.2010.04.024
PubMed Astratto | CrossRef Testo Completo | Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sys-Shah, P., Rodriguez, L. A., et al. (2017). Chemogenetica rivelato: occupazione DREADD e attivazione tramite clozapina convertita. Scienza 357, 503-507. doi: 10.1126 / scienza.aan2475
PubMed Abstract / CrossRef Testo completo / Google Scholar
Guettier, J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). Un approccio chimico-genetico per studiare la regolazione della proteina G della funzione delle cellule beta in vivo. Proc. Natl. Acad. Sic. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
CrossRef Testo completo / Google Scholar
Nel 2012 è stato nominato presidente del Consiglio dei Ministri. Alterazioni simpatiche e catecolaminergiche nell’apnea notturna con particolare attenzione ai bambini. Anteriore. Neurolo. 3:7. doi: 10.3389 / fneur.2012.00007
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2017 è stato pubblicato il primo album in studio del gruppo musicale britannico The Rock, pubblicato nel 2017. L’attività dei neuroni del rafe Pet1 che esprimono la tachichinina1 modula il chemoriflesso respiratorio. J. Neurosci. 37, 1807–1819. doi: 10.1523 / JNEUROSCI.2316-16. 2016
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2015 è stato pubblicato il primo album in studio della band. Ruolo dei nuclei parafacciali nel controllo della respirazione nei ratti adulti. J. Neurosci. 35, 1052–1067. doi: 10.1523 / JNEUROSCI.2953-14. 2015
PubMed Abstract / CrossRef Testo completo / Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D., e Bähner, F. (2018). Effetti comportamentali della clozapina sistemica acuta a basso dosaggio nei ratti wild-type: implicazioni per l’uso dei DREADDs nelle neuroscienze comportamentali. Anteriore. Comportati bene. Neurosci. 12:173. doi: 10.3389 / fnbeh.2018.00173
Testo completo CrossRef / Google Scholar
Isom, G. E., e Elshowihy, RM (1982). Interazione di stress acuto e cronico con la respirazione: modifica mediante naloxone. Pharmacol. Biochimica. Comportati bene. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed Abstract / CrossRef Testo completo / Google Scholar
Jann, M. W., Lam, Y. W., e Chang, W. H. (1994). Rapida formazione di clozapina nelle cavie e nell’uomo dopo somministrazione di clozapina-N-ossido. Arco. Int. Pharmacodyn. Ther. 328, 243–250.
PubMed Abstract / Google Scholar
Joober, R. (2010). Clozapina: una molecola distinta, poco conosciuta e sottoutilizzata. J. Psichiatria Neurosci. 35, 147–149. doi: 10.1503 / jpn.100055
PubMed Abstract / CrossRef Testo completo / Google Scholar
Kinkead, R., Dupenloup, L., Valois, N. e Gulemetova, R. (2001). Attenuazione indotta dallo stress della risposta ventilatoria ipercapnica nei ratti svegli. J. Appl. Physiol. 90, 1729–1735. doi: 10.1152 / jappl.2001.90.5.1729
PubMed Abstract / CrossRef Testo completo / Google Scholar
Klein, D. F. (1993). Falsi allarmi di soffocamento, panico spontaneo e condizioni correlate. Un’ipotesi integrativa. Arco. Gen. Psichiatria 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2018 è stato pubblicato il primo album in studio della band, “The World”, pubblicato nel 2018. Il ruolo dei neuroni parafacciali nel controllo della respirazione durante l’esercizio. Sic. Agente 8: 400. doi: 10.1038 / s41598-017-17412-z
CrossRef Testo completo / Google Scholar
Lapin, I. P. (1995). Solo controlli: effetto della manipolazione, iniezione fittizia e iniezione intraperitoneale di soluzione salina sul comportamento dei topi in un labirinto più elevato. J. Pharmacol. Toxicol. Metodi 34, 73-77. doi: 10.1016 / 1056-8719 (95)00025-D
PubMed Abstract / CrossRef Testo completo / Google Scholar
Lavezzi, A. M., Alfonsi, G., e Matturri, L. (2013). Fisiopatologia del complesso locus coeruleus umano in morte improvvisa inspiegabile fetale/neonatale. Neurolo. Res. 35, 44-53. doi: 10.1179 | 1743132812Y. 0000000108
PubMed Abstract / CrossRef Testo completo / Google Scholar
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., España, R. A., et al. (2016). La somministrazione di N-ossido di clozapina produce effetti comportamentali nei ratti long-evans: implicazioni per la progettazione di esperimenti DREADD. eNeuro 3, 1-14. doi: 10.1523 / ENEURO.0219-16. 2016
PubMed Abstract / CrossRef Testo completo / Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Un sistema di reporting e caratterizzazione Cre robusto e ad alto throughput per l’intero cervello del topo. NAT. Neurosci. 13, 133–140. doi: 10.1038 / nn.2467
PubMed Abstract / CrossRef Testo completo / Google Scholar
Mahler, SV, e Aston-Jones, G. (2018). CNO male? Considerazioni per l’uso dei dreadds nelle neuroscienze comportamentali. Neuropsicofarmacologia 43, 934-936. doi: 10.1038 / npp.2017.299
PubMed Astratto | CrossRef Testo Completo | Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, M. S., Ritchie, J. C., Porter, J. H., et al. (2018). L’agonista DREADD clozapina N-ossido (CNO) è metabolizzato in modo inverso a clozapina e produce effetti di stimolo interocettivo simili a clozapina nei ratti e nei topi. Sic. Agente 8, 3840. doi: 10.1038 / s41598-018-22116-z
CrossRef Testo completo / Google Scholar
Misslin, R., Herzog, F., Koch, B., e Ropartz, P. (1982). Effetti di isolamento, manipolazione e novità sulla risposta ipofisaria-surrenale nel topo. Psiconeuroendocrinologia 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2007 è stato pubblicato il primo album in studio del gruppo musicale statunitense Nakamura, pubblicato nel 2007. Attenuazione dipendente dallo stato di vigilanza del chemoreflex ipercapnico e dell’apnea del sonno esagerata nei topi knockout di orexina. J. Appl. Physiol. 102, 241–248. doi: 10.1152 / japplphysiol.00679.2006
PubMed Abstract / CrossRef Full Text / Google Scholar
Nel 1998, Takashima, T., Yasuhara, M., Nakamura, T., e Takashima, S. (1998). Neuroni catecolamine alterazione nel tronco cerebrale delle vittime di sindrome di morte improvvisa infantile. Pediatria 101, 285-288. doi: 10.1542 / peds.101.2.285
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2003 è stato pubblicato il primo album in studio del gruppo. Alterazioni del sottotipo del recettore Alfa2-adrenergico nel tronco cerebrale nella sindrome della morte improvvisa infantile. Early Hum. Dev. 75 (Suppl.), S129-S138. doi: 10.1016 / j. pathophys.2004.01.015
CrossRef Testo completo / Google Scholar
Padovan-Hernandez, Y., e Knackstedt, Los Angeles (2018). Riduzione dose-dipendente della locomozione indotta dalla cocaina da clozapina-N-ossido nei ratti con una storia di auto-somministrazione di cocaina. Neurosci. Lett. 674, 132–135. doi: 10.1016 / j.neulet.2018.03.045
PubMed Abstract / CrossRef Testo completo / Google Scholar
Ramanantsoa, N., Hirsch, M.-R., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Respirazione senza CO (2) chemosensibilità in mutanti condizionali Phox2b. J. Neurosci. 31, 12880–12888. doi: 10.1523 / JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). neurons2-i neuroni controllano la risposta respiratoria dell’adulto all’ipercapnia. Cervello Res. 1511, 115-125. doi: 10.1016 / j. brainres.2012.12.017
PubMed Abstract / CrossRef Testo completo / Google Scholar
Il sito utilizza cookie tecnici e cookie di profilazione di terze parti. (2011). Compromissione del controllo respiratorio e della temperatura corporea in caso di inibizione acuta del neurone serotoninergico. Scienza 333, 637-642. doi: 10.1126 / scienza.1205295
PubMed Abstract / CrossRef Testo completo / Google Scholar
Ryabinin, A. E., Wang, Y. M., e Finn, D. A. (1999). Diversi livelli di immunoreattività Fos dopo la manipolazione ripetuta e lo stress di iniezione in due ceppi inbred di topi. Pharmacol. Biochimica. Comportati bene. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2017 è stato pubblicato il primo album in studio della band. L’ipossia intermittente cronica induce stress ossidativo e infiammazione nelle regioni cerebrali associate alla neurodegenerazione in fase iniziale. Physiol. Rep. 5, 1-13. doi: 10.14814 / phy2.13258
PubMed Astratto | CrossRef Testo Completo | Google Scholar
Sole, J. J., Huang, T. W., Neul, J. L., e Ray, R. S. (2017). I geni embrionali di modellatura del hindbrain delineano le popolazioni omeostatiche cardio-respiratorie e metaboliche distinte nell’adulto. Sic. Rep. 7: 9117. doi: 10.1038 / s41598-017-08810-4
CrossRef Testo completo / Google Scholar
Sun, JJ, e Ray, RS (2017). Tg (Th-Cre)FI172Gsat (Th-Cre) definisce i neuroni necessari per i riflessi ipercapnici e ipossici completi. Biol. Apri 6, 1200-1208. doi: 10.1242 / bio.026823
PubMed Astratto | CrossRef Testo Completo | Google Scholar
Taugher, R. J., Lu, Y. Wang, Y., Kreple, C. J., Ghobbeh, A., Ventilatore, R., et al. (2014). Il nucleo del letto della stria terminale è fondamentale per il comportamento correlato all’ansia evocato dalla CO2 e dall’acidosi. J. Neurosci. 34, 10247–10255. doi: 10.1523 / JNEUROSCI.1680-14. 2014
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2008 è stato pubblicato il primo album in studio della band. Regolazione convergente dell’attività del locus coeruleus come risposta adattativa allo stress. EUR. J. Pharmacol. 583, 194–203. doi: 10.1016 / j. ejphar.2007.11.062
CrossRef Testo completo / Google Scholar
Verbraecken, J., e McNicholas, WT (2013). Meccanica respiratoria e controllo ventilatorio nella sindrome da sovrapposizione e nell’obesità ipoventilazione. Respiri. Res. 14:132. doi: 10.1186/1465-9921-14-132
PubMed Abstract / CrossRef Testo completo / Google Scholar
Viemari, J.-C. (2008). Modulazione noradrenergica della rete neurale respiratoria. Respiri. Physiol. Neurobiolo. 164, 123–130. doi: 10.1016 / j.resp.2008.06.016
PubMed Astratto | CrossRef Testo Completo | Google Scholar
Inverno, A., Ahlbrand, R., Naik, D., e Sah, R. (2017). Sensibilità comportamentale differenziale all’inalazione di anidride carbonica (CO2) nei ratti. Neuroscienze 346, 423-433. doi: 10.1016 / j.neuroscienze.2017.01.003
PubMed Abstract / CrossRef Testo completo / Google Scholar
Ziemann, A. E., Allen, J. E., Dahdaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, A. M., et al. (2009). L’amigdala è un chemosensore che rileva l’anidride carbonica e l’acidosi per suscitare il comportamento della paura. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar