- Introduzione
- Funzioni Multipul della chimasi
- La chimasi nei mastociti
- Funzioni enzimatiche multiple della chimasi
- Funzione enzimatica della chimasi in NASH
- Coinvolgimento della chimasi nei modelli animali di NASH
- Effetto di Chymase Inibitore NASH Modelli Animali
- Effetto di Chymase Inibitore NASH Modelli Animali
- Meccanismo di infiammazione epatica attenuato dall’inibitore della chimasi
- Meccanismo della steatosi epatica Attenuato dall ‘inibitore della chimasi
- Meccanismo della fibrosi epatica attenuato dall’inibitore della chimasi
- Conclusione
- Autore Contributi
- Dichiarazione sul conflitto di interessi
Introduzione
La malattia epatica non alcolica (NAFLD) è stata riconosciuta come la forma più comune di malattia epatica (Angulo, 2002; Clark et al., 2002). La steatoepatite non alcolica (NASH) imita l’epatite alcolica nonostante l’assenza di una storia di bere (Ludwig et al., 1980). NAFLD e NASH sono associati a sindrome metabolica derivante da obesità, insulino-resistenza, iperlipidemia e ipertensione. La NAFLD è considerata la malattia epatica più comune e si presenta tipicamente come semplice steatosi epatica (Tiniakos et al., 2010). Al contrario, NASH è caratterizzato da grave steatosi, infiammazione lobulare e fibrosi del fegato (Powell et al., 1990; Bertot e Adams, 2016). Anche se il meccanismo responsabile dello sviluppo di NASH rimane poco chiaro, NASH si propone di essere causato da un processo “a più colpi”, con steatosi epatica come “primo colpo” e successivi colpi come infiammazione, stress ossidativo ed endotossine (Tilg e Moschen, 2010). NASH è strettamente correlato alla sindrome metabolica e diversi studi clinici hanno studiato il trattamento terapeutico di NASH concentrandosi sui sintomi del diabete, dell’iperlipidemia e dell’ipertensione (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Tuttavia, non sono stati stabiliti agenti terapeutici comunemente accettati.
La chimasi può essere coinvolta nella patogenesi della fibrosi epatica. L’attività della chimasi era significativamente aumentata nei fegati dei pazienti con fibrosi o cirrosi e c’era una correlazione significativa tra il livello della chimasi e il grado di fibrosi (Komeda et al., 2008). Sebbene non sia stato riportato un aumento dell’attività della chimasi in pazienti con NASH, è stato osservato in modelli animali di NASH (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Al contrario, l’inibizione della chimasi con inibitori a bassa molecola ha determinato una significativa riduzione dell’infiammazione, della steatosi e della fibrosi nei modelli NASH di ratto e criceto (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Questi risultati indicano che la chimasi può essere coinvolta in infiammazione, steatosi e fibrosi durante lo sviluppo e la progressione di NASH (Figura 1).
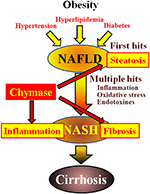
FIGURA 1. NAFLD e NASH sono collegati alla sindrome metabolica da obesità, insulino-resistenza, iperlipidemia e ipertensione. Si pensa che NASH si sviluppi attraverso un processo “a più colpi”, con steatosi epatica come” primo colpo ” e successivi colpi come infiammazione, stress ossidativo ed endotossine, ed è caratterizzato da grave steatosi, infiammazione e fibrosi. La chimasi può essere coinvolta nella progressione di steatosi, infiammazione e fibrosi nel fegato.
Funzioni Multipul della chimasi
La chimasi nei mastociti
La chimasi (EC 3.4.21.39) è espressa nei granuli secretori dei mastociti. La chimasi è prodotta come prochymase inattiva all’interno dei granelli secretori e richiede la dipeptidyl peptidase I (DPPI) per l’attivazione. DPPI è una tiolo proteinasi e il suo pH ottimale è 6.0. Il valore ottimale del pH è coerente con la funzione proposta di DPPI per attivare la prochymase, poiché il pH all’interno dei granuli secretori è regolato a pH 5.5 (De Young et al., 1987) (Figura 2). Tuttavia, la chimasi non ha attività enzimatica all’interno dei mastociti a questo pH, perché il pH ottimale per la chimasi è compreso tra 7 e 9 (Takai et al., 1996, 1997). Dopo l’attivazione dei granuli dei mastociti da stimoli come infiammazione e lesioni, la chimasi viene rilasciata e mostra la funzione enzimatica al suo pH ottimale 7.4 (Figura 2).
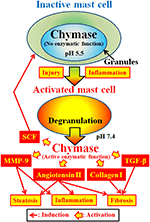
FIGURA 2. La chimasi è immagazzinata nei granuli secretori dei mastociti inattivi. Il pH all’interno dei granuli viene mantenuto a pH 5,5, una condizione in cui la chimasi non ha attività enzimatica. La chimasi presenta le sue funzioni enzimatiche, come la formazione di angiotensina II, MMP-9, TGF-β, collagene I e SCF, al momento del rilascio dai granuli dei mastociti, dopo l’attivazione da infiammazione e lesioni.
Funzioni enzimatiche multiple della chimasi
La chimasi è una serina proteasi e scinde il lato C-terminale delle proteine dopo aminoacidi aromatici come Phe, Tyr e Trp in generale. La chimasi può fendere il legame Phe8–His9 del peptide non bioattivo angiotensina I e formare il suo peptide bioattivo angiotensina II nei tessuti dei mammiferi tra cui umani (Urata et al., 1990; Takai et al., 1996, 1997). Inoltre, la chimasi scinde enzimaticamente i precursori della metalloproteinasi della matrice (MMP) -9, trasformando il fattore di crescita (TGF)-β e il collagene I nelle loro forme attive (Kofford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Inoltre, la funzione enzimatica della chimasi può produrre fattore di cellule staminali (SCF) mediante scissione enzimatica della forma inattiva legata alla membrana di SCF, che induce la formazione di mastociti maturi da mastociti immaturi attraverso la stimolazione del recettore c-kit (Longley et al., 1997). Pertanto, la chimasi ha molteplici funzioni enzimatiche, inclusa l’attivazione di angiotensina II, MMP-9, TGF-β, collagene I e SCF (Figura 2).
Funzione enzimatica della chimasi in NASH
L’angiotensina II può promuovere la steatosi epatica e l’infiammazione aumentando le specie reattive dell’ossigeno (ROS) dopo la stimolazione dei recettori dell’angiotensina II in modelli di NASH animali (Hirose et al., 2007; Nabeshima et al., 2009). L’angiotensina II inoltre ha indotto la fibrosi epatica via induzione dell’actina del muscolo α-liscio (SMA) in cellule stellate epatiche (HSCs) (Yoshiji et al., 2001). MMP-9 è stato segnalato per indurre l’infiltrazione dei neutrofili e dei macrofagi via la degradazione delle matrici intercellulari quali vitronectina e fibronectina, con conseguente aumento dell’infiammazione (Medina et al., 2006). Nei pazienti con NASH, è stato osservato un aumento significativo dell’espressione genica MMP-9 nel fegato rispetto ai controlli normali (Ljumovic et al., 2004). La sovraespressione epatica di TGF-β nei topi transgenici ha prodotto una grave fibrosi epatica attraverso l’aumento dell’espressione genica del procollagene I (Casini et al., 1993). Sia la formazione di TGF-β che l’accumulo di collagene I sono noti per indurre fibrosi epatica. L’attivazione di SCF induce aumenti nel numero dei mastociti e la sua funzione enzimatica può provocare un aumento dell’attività della chimasi nei tessuti fibrotici (Maruichi et al., 2004). Queste funzioni enzimatiche della chimasi possono essere coinvolte nella steatosi, nell’infiammazione e nella fibrosi, tutte osservate nei fegati dei pazienti con NASH e nei modelli animali (Figura 2).
Coinvolgimento della chimasi nei modelli animali di NASH
La dieta carente di metionina e colina (MCD) è stata ampiamente utilizzata per indurre un tipico modello di NASH. Nei criceti alimentati con la dieta MCD, sono stati osservati aumenti significativi della bilirubina totale, dei trigliceridi e dell’acido ialuronico nel plasma (Tashiro et al., 2010). Inoltre, nel fegato sono stati osservati accumulo di cellule infiammatorie e aumento dell’area di deposito lipidico e dell’area fibrotica. In questo modello di NASH indotto dalla dieta MCD, l’attività della chimasi epatica e i fattori correlati, come angiotensina II, MMP-9 e collagene I, sono stati significativamente aumentati (Tashiro et al., 2010; Masubuchi et al., 2013). Recentemente, è stato sviluppato un nuovo modello NASH in cui i ratti 5/Dmcr spontaneamente ipertesi a rischio di ictus (SHRSP5/Dmcr) sono stati alimentati con una dieta ad alto contenuto di grassi e colesterolo (HFC) (Kitamori et al., 2012). Questo modello ha mostrato i sintomi della sindrome metabolica pensato per assomigliare clinicamente a quelli dei pazienti NASH (Kitamori et al., 2012). Nel modello di NASH indotto dalla dieta HFC, sono stati osservati ipertensione e iperlipidemia e gravi steatosi, fibrosi e accumulo di cellule infiammatorie sono stati rilevati nel fegato (Miyaoka et al., 2017). Inoltre, è stato osservato un significativo aumento dell’attività della chimasi insieme a MMP-9, TGF-β e collagene I nel fegato (Miyaoka et al., 2017). Pertanto, sembra esserci una stretta relazione tra chimasi e patogenesi di NASH nei modelli animali di NASH.
Effetto di Chymase Inibitore NASH Modelli Animali
Effetto di Chymase Inibitore NASH Modelli Animali
bassa molecola chymase inibitore significativamente attenuato chymase attività e una diminuzione dell’angiotensina II, MMP-9 e collagene I livelli nel fegato in un MCD alimentati a dieta NASH modello di criceto, quando la somministrazione dell’inibitore è stato avviato allo stesso tempo, come la dieta MCD (Tashiro et al., 2010; Masubuchi et al., 2013). L’inibitore della chimasi ha impedito in modo significativo la steatosi epatica, la fibrosi e l’accumulo di cellule infiammatorie in questo modello di NASH (Tashiro et al., 2010; Masubuchi et al., 2013). Si pensa che lo stress ossidativo svolga un ruolo nella teoria “multiple-hit” dello sviluppo di NASH, e l’aumento del marcatore dello stress ossidativo la malondialdeide è stata significativamente attenuata nel fegato dall’inibitore della chimasi (Masubuchi et al., 2013). In un modello di NASH indotto dalla dieta MCD di criceto, l’inibitore della chimasi ha mostrato un effetto migliorativo quando somministrato in NASH stabilito (Masubuchi et al., 2013). I gradi di steatosi e fibrosi nel fegato sono stati ridotti rispetto a prima della somministrazione dell’inibitore della chimasi (Masubuchi et al., 2013).
Nel fegato di un modello di NASH indotto da dieta HFC di ratto iperteso, un inibitore della chimasi a bassa molecola ha attenuato i livelli di chimasi e MMP-9, TGF-β e collagene I, che sono tutti fattori associati alla chimasi (Miyaoka et al., 2017). L’inibitore della chimasi ha attenuato significativamente la steatosi epatica e la fibrosi e ha ridotto la mieloperossidasi come marker di infiammazione, in particolare dell’infiltrazione dei neutrofili (Miyaoka et al., 2017). In questo modello indotto dalla dieta HFC, la sopravvivenza del gruppo trattato con placebo è stata dello 0% a 14 settimane dall’inizio della dieta HFC, ed è risultata da grave insufficienza epatica (Miyaoka et al., 2017). Tuttavia, il gruppo trattato con inibitori della chimasi, in cui i ratti sono stati trattati con l’inibitore della chimasi immediatamente dopo l’inizio della dieta HFC, ha mostrato una sopravvivenza del 100% a 14 settimane. Inoltre, è stato riportato un tasso di sopravvivenza del 50% per i ratti trattati con l’inibitore della chimasi a partire da 8 settimane dopo l’inizio dell’alimentazione con dieta HFC, a quel punto NASH è stato stabilito (Miyaoka et al., 2017).
Pertanto, gli inibitori della chimasi potrebbero essere agenti utili per la prevenzione e il miglioramento di NASH in modelli animali. D’altra parte, l’angiotensina II promuove anche indirettamente l’infiammazione epatica, la steatosi e la fibrosi attraverso aumenti dell’espressione genica MMP-9 e TGF-β. Sia MMP – 9 che TGF-β sono strettamente coinvolti nella patogenesi di NASH, ma questi fattori non sono necessariamente indotti solo dall’angiotensina II (Takai et al., 2010). Fattori diversi dalla stimolazione dell’angiotensina II contribuiscono agli aumenti dell’espressione genica MMP-9 e TGF-β (Takai et al., 2010). In tali casi, il bloccante del recettore dell’angiotensina II (ARB) non è in grado di attenuare le azioni MMP-9 e TGF-β; tuttavia, un inibitore della chimasi potrebbe avere effetti attenuanti attraverso l’inibizione dell’attivazione MMP-9 e TGF-β, indicando un potenziale corso di trattamento per la prevenzione della progressione di NASH.
Meccanismo di infiammazione epatica attenuato dall’inibitore della chimasi
L’inibitore della chimasi è stato in grado di ridurre l’infiammazione nei modelli NASH indotti dalla dieta di criceto MCD e di ratto HFC (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Il trattamento con inibitori della chimasi ha attenuato significativamente l’attività della chimasi nel fegato e ha ridotto i livelli di angiotensina II e MMP-9 (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Nell’HSC, l’angiotensina II induce la generazione di ROS come il perossido di idrogeno e il superossido attraverso l’attivazione della nicotinamide adenina dinucleotide fosfato (NADPH) ossidasi (De Minicis e Brenner, 2007). L’inibitore della chimasi ha determinato una riduzione dell’espressione genica del componente NADPH ossidasi Rac-1 e del marcatore dello stress ossidativo malondialdeide oltre a una riduzione dei livelli di angiotensina II in un modello di NASH indotto da criceto MCD (Masubuchi et al., 2013). L’aumento indotto dall’angiotensina II del ROS ha promosso l’espressione genica MMP-9 nei neutrofili e nei macrofagi (Yaghooti et al., 2011; Kurihara et al., 2012). Pertanto, l’inibitore della chimasi inibisce direttamente l’attivazione di proMMP-9 a MMP-9 e riduce indirettamente l’espressione genica MMP-9 attraverso una diminuzione dell’angiotensina II. MMP-9 scinde i costituenti della matrice extracellulare, come la vitronectina e la fibronectina, porta alla disintegrazione dell’integrità epatica e induce l’infiltrazione di macrofagi e neutrofili (Medina et al., 2006). In un modello di NASH indotto dalla dieta HFC, è stato osservato un aumento significativo dell’espressione della mieloperossidasi nei macrofagi e nei neutrofili nel fegato ed è stato ridotto dall’inibitore della chimasi (Miyaoka et al., 2017). Pertanto, il meccanismo di infiammazione attenuato dall ‘ inibitore della chimasi può dipendere dalla riduzione dei livelli di angiotensina II e MMP-9 nel fegato.
Meccanismo della steatosi epatica Attenuato dall ‘inibitore della chimasi
L’ angiotensina II può influenzare la steatosi epatica attraverso la produzione di ROS. Nell’HSC murino, un inibitore della NADPH ossidasi ha ridotto significativamente la produzione di ROS e un ARB ha rallentato lo sviluppo della steatosi epatica tramite attenuazione della produzione di ROS (Hirose et al., 2007; Guimarães et al., 2010). In un modello murino di NASH indotto dalla dieta MCD, è stata osservata una significativa attenuazione della steatosi nei topi con deficit del recettore dell’angiotensina II (Nabeshima et al., 2009). Sia gli esperimenti in vivo che in vitro hanno mostrato che l’angiotensina II ha sovraregolato l’espressione genica sterol regulatory element-binding protein (SREBP)-1c e fatty acid synthase (FAS), entrambi fattori importanti nella regolazione della lipogenesi, dopo l’aumento del ROS (Kim et al., 2001; Hongo et al., 2009). Al contrario, ARB attenuato steatosi epatica insieme a downregulating l’espressione genica di SREBP – 1c e FAS tramite attenuazione ROS in un modello di NASH topo (Kato et al., 2012). In un modello di NASH indotto da dieta MCD di criceto, è stata osservata un’attenuazione significativa dell’espressione genica SREBP-1c e FAS dopo il trattamento con un inibitore della chimasi a bassa molecola (Masubuchi et al., 2013). Pertanto, il meccanismo migliorativo della steatosi epatica da parte dell’inibitore della chimasi può dipendere dalla riduzione della produzione di ROS attraverso una ridotta generazione di angiotensina II nel fegato.
Meccanismo della fibrosi epatica attenuato dall’inibitore della chimasi
La chimasi può essere strettamente associata alla progressione della fibrosi tissutale, poiché contribuisce alla formazione di TGF-β dal precursore non bioattivo TGF-β e TGF-β è noto per indurre fortemente la crescita dei fibroblasti (Takai et al., 2003; Oyamada et al., 2011). TGF-β è noto per svolgere un ruolo centrale nella progressione della fibrosi nei pazienti NASH tramite HSC attivato (Williams et al., 2000). L’inibizione della funzione TGF-β attraverso l’espressione genica e la segnalazione ha portato a una migliore fibrosi epatica in modelli sperimentali (George et al., 1999; Arias et al., 2003). In un modello di NASH indotto dalla dieta HFC nel ratto, l’attenuazione dell’attività della chimasi da parte dell’inibitore della chimasi ha portato a riduzioni del livello di TGF-β e dell’area fibrotica nel fegato (Miyaoka et al., 2017). Pertanto, la riduzione del TGF-β da parte dell’inibitore della chimasi può contribuire alla prevenzione della fibrosi epatica.
L ‘angiotensina II può anche essere coinvolta nell’ induzione della fibrosi epatica. L’angiotensina II induce la contrazione e la proliferazione di HSC ed inoltre induce l’espressione genica di TGF-β in fibroblasti in vitro (Kagami et al., 1994; Bataller et al., 2000). Entrambi i livelli di TGF-β e il grado di accumulo di collagene e lesioni fibrotiche sono stati osservati mediante legatura del dotto biliare in topi wild-type, tuttavia, questi sono stati attenuati in topi carenti del recettore dell’angiotensina II (Yang et al., 2005). In un modello di NASH di ratto, ARB ha anche attenuato la fibrosi epatica attraverso la riduzione dell’espressione genica TGF-β (Hirose et al., 2007). Può anche esserci una relazione tra angiotensina II e fibrosi epatica diversa dall’espressione genica TGF-β indotta dall’angiotensina II. Nei pazienti con epatite cronica C, ARB ha ridotto l’espressione genica del collagene attraverso l’espressione genica Rac-1 (Colmenero et al., 2009). Gli HSC sono riconosciuti come le principali cellule produttrici di collagene nel fegato e l’aumento dell’espressione dell’actina muscolare α-liscia (SMA) in HSC induce fortemente la deposizione della matrice extracellulare, incluso il collagene I (De Minicis e Brenner, 2007). L ‘angiotensina II può indurre l’ espressione genica α-SMA nel ratto HSC. Al contrario, il blocco dell’angiotensina II provoca l’attenuazione della fibrosi epatica insieme alla riduzione di α-SMA (Yoshiji et al., 2001). Sebbene non siano stati valutati in pazienti con NASH, sia le attività di formazione della chimasi che dell’angiotensina II sono state significativamente aumentate nelle regioni fibrotiche dei fegati di pazienti con cirrosi e sono state osservate correlazioni significative tra chimasi, attività di formazione dell’angiotensina II e fibrosi epatica (Komeda et al., 2008). In un modello di cirrosi epatica indotta da tetracloruro di criceto, sono stati osservati aumenti significativi dell’attività di formazione della chimasi e dell’angiotensina II, che sono stati significativamente attenuati insieme alla cirrosi epatica in seguito al trattamento con un inibitore della chimasi a bassa molecola (Komeda et al., 2010).
Lo stabilizzatore dei mastociti tranilast potrebbe inibire l’attivazione dei mastociti, bloccando il rilascio di chimasi e quindi impedendo lo sviluppo di fibrosi epatica in un diabete di ratto e modello di NASH indotto dalla dieta HFC (Uno et al., 2008). La chimasi promuove la proliferazione dei mastociti via l’attivazione di SCF dalla sua funzione enzimatica (Longley et al., 1997). Nei modelli animali di NASH, l’inibitore della chimasi ha ridotto l’aumento del numero di mastociti nel fegato, con conseguente riduzione dell’attività della chimasi in seguito all’inibizione diretta da parte dell’inibitore della chimasi e una riduzione indiretta dell’espressione della chimasi nei mastociti (Masubuchi et al., 2013; Miyaoka et al., 2017).
Pertanto, l’inibitore della chimasi può contribuire alla prevenzione della fibrosi epatica mediante inibizione dell’attivazione di TGF-β mediante inibizione della chimasi e/o attenuazione del livello di TGF-β mediante riduzione dell’angiotensina II e della proliferazione dei mastociti.
Conclusione
La sindrome metabolica che comprende obesità, insulino-resistenza, iperlipidemia e ipertensione è strettamente correlata allo sviluppo di NASH e sono stati condotti studi su agenti anti-diabetici, anti-iperlipidemici e antipertensivi per il trattamento di NASH. Il concetto alla base di questi agenti è quello di attenuare i sintomi della sindrome metabolica (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Rapporti precedenti hanno dimostrato che l’inibitore della chimasi attenua l’infiammazione e la fibrosi senza influenzare i livelli di glucosio e lipidi nel sangue e la pressione sanguigna nei modelli animali di diabete, iperlipidemia e ipertensione, rispettivamente (Inoue et al., 2009; Takai et al., 2014; Zhang et al., 2016). Pertanto, il concetto alla base dell’inibizione della chimasi è quello di attenuare direttamente l’infiammazione epatica e la fibrosi di NASH. Proponiamo che l’inibitore della chimasi che mira alla sindrome metabolica sia una strategia potenzialmente potente per l’attenuazione della progressione di NASH.
Autore Contributi
ST e DJ: ha scritto il manoscritto. Entrambi gli autori hanno letto e approvato il manoscritto finale.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.