Con la ferita del tessuto sano, si sviluppa una prevedibile progressione degli eventi fisiologici. Questa progressione può essere suddivisa nelle fasi di infiammazione, proliferazione e maturazione. Ogni fase è caratterizzata dall’elaborazione sequenziale di citochine distintive da parte di cellule specifiche. Vedi le immagini qui sotto.
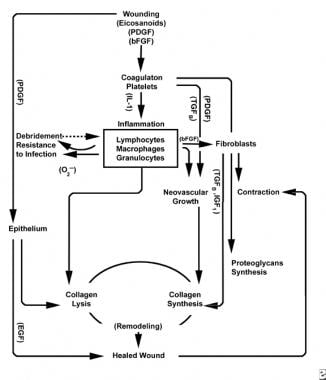 Schemi del processo di guarigione delle ferite.
Schemi del processo di guarigione delle ferite. 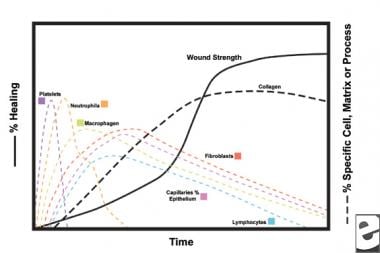 Caratteristiche cellulari del processo di guarigione delle ferite.
Caratteristiche cellulari del processo di guarigione delle ferite. La fase infiammatoria
La fase infiammatoria contemporaneamente lancia emostatico meccanismi e percorsi che creano clinicamente riconoscibili segni cardinali dell’infiammazione: rubor (arrossamento), calor (calore), tumori (gonfiore), dolor (dolore), e functio laesa (perdita di funzione).
La lesione al tessuto vascolare avvia la cascata estrinseca di coagulazione liberando il calcio intracellulare ed il fattore del tessuto che attivano il fattore VII. La spina risultante della fibrina raggiunge l’emostasi aiutata da vasocostrizione riflessa. Questa spina agisce come un reticolo per l’aggregazione delle piastrine, il tipo cellulare più comune e “firma” della fase infiammatoria precoce.
Le piastrine elaborano una serie di sostanze proinfiammatorie, come l’adenosina difosfato, il fattore di crescita tissutale beta (TGF-ß) e i fattori di crescita derivati dalle piastrine (PDGF). Questi fattori di crescita agiscono sulle cellule circostanti e stimolano la chemiotassi di neutrofili, monociti e fibroblasti nell’area della lesione.
I tessuti feriti, attraverso la fosfolipasi A attivata, catalizzano simultaneamente gli acidi arachidonici per produrre prostaglandine vasoattive e trombossano, noti collettivamente come eicosanoidi. Gli eicosanoidi mediano l’attività influenzando la formazione della spina piastrinica, la permeabilità vascolare e la chemiotassi cellulare per influenzare la guarigione delle ferite. Ad esempio, il trombossano A2 media la vasocostrizione e l’aggregazione piastrinica.
Dopo la vasocostrizione iniziale, i classici segni di infiammazione si manifestano dall’aumento della permeabilità vascolare. Rubor deriva dalla vasodilatazione, mediata da prostaciclina (PGI2), prostaglandina A (PGA), prostaglandina D (PGD) e prostaglandina E (PGE). Il tumore ed il calor si sviluppano mentre le lacune endoteliali vascolari si allargano, permettendo l’uscita della proteina del plasma e del liquido nello spazio interstiziale. Questi cambiamenti sono potenziati dalla PGE2 e dalla prostaglandina F2a (PGF2a) e consentono l’ingresso di cellule infiammatorie nell’area della lesione, comprese le cellule che si elaborano. Dolor è percepito come PGI2, PGE e PGE2 agiscono sui nocicettori periferici.
Nella seconda fase della fase infiammatoria, i leucociti soppiantano le piastrine come il tipo di cellula dominante, attratto dalla chemiotassi. I globuli bianchi (globuli bianchi) sono le cellule predominanti per i primi 3 giorni dopo il ferimento; il loro numero di picco a circa 48 ore. I polimorfonucleociti (PMNs) sono i primi ad iniziare attività battericide utilizzando mediatori infiammatori e metaboliti dei radicali liberi dell’ossigeno. Tuttavia, la normale guarigione delle ferite può verificarsi senza PMNs. Un altro leucocita, la cellula T helper, elabora l’interleuchina – 2 (IL–2). IL-2 promuove ulteriormente la proliferazione delle cellule T per aumentare la risposta immunogenica alle lesioni.
Poiché i leucociti PMN iniziano a diminuire dopo 24-36 ore, i monociti circolanti entrano nella ferita e maturano nei macrofagi dei tessuti. Queste cellule sbrinano la ferita a livello microscopico e producono un’ampia varietà di sostanze importanti, come IL-1 e il fattore di crescita dei fibroblasti di base (bFGF). IL-1 stimola la proliferazione delle cellule infiammatorie e promuove l’angiogenesi attraverso la replicazione delle cellule endoteliali. bFGF è un fattore chemiotattico e mitogenico per fibroblasti e cellule endoteliali. A differenza del PMNs, l’esaurimento dei macrofagi compromette gravemente la guarigione delle ferite, poiché lo sbrigliamento, la proliferazione dei fibroblasti e l’angiogenesi diminuiscono.
Verso la fine del ciclo infiammatorio, l’ambiente in evoluzione degli eicosanoidi nella ferita interagisce con i tipi di cellule presenti, con conseguente sintesi di fibroblasti di collagene e sostanza macinata (dal rapporto aumentato di PGF2a a PGE2). Inoltre, i fattori di crescita derivati dai macrofagi sono ora a livelli ottimali, influenzando fortemente l’afflusso di fibroblasti e quindi cheratinociti e cellule endoteliali nella ferita. Poiché le cellule mononucleate continuano a sostituire i globuli bianchi e i macrofagi, inizia la fase proliferativa.
La fase proliferativa
Due o tre giorni dopo la ferita, i fibroblasti migrano verso l’interno dai margini della ferita sulla matrice fibrinosa stabilita durante la fase infiammatoria. Durante la prima settimana, i fibroblasti iniziano a produrre glicosaminoglicani e proteoglicani, la sostanza fondamentale per il tessuto di granulazione, così come il collagene, in risposta a bFGF sintetizzato dai macrofagi e TGF-ß, così come PDGF.
I fibroblasti diventano presto il tipo di cellula dominante, con un picco a 1-2 settimane. Generano non solo molecole di collagene ma anche citochine come PDGF, TGF-ß , bFGF, fattore di crescita dei cheratinociti e fattore di crescita insulinlike-1. I fibroblasti assemblano anche molecole di collagene in fibre, che sono reticolate e organizzate in fasci. Il collagene è il componente principale del tessuto connettivo della ferita acuta, con una produzione netta che continua per le prossime 6 settimane. Il contenuto aumentante di collagene arrotolato correla con resistenza alla trazione aumentante.
Anche i cheratinociti e le cellule endoteliali proliferano durante questo periodo, producendo infine fattori di crescita autocrini che mantengono la loro crescita. L’espansione endoteliale contribuisce all’angiogenesi, poiché i vasi intatti generano gemme nel tessuto di granulazione. La neovascolarizzazione facilita la crescita della linea di avanzamento dei fibroblasti nella ferita, fornendo loro i nutrienti e le citochine necessari.
La degradazione del coagulo di fibrina e della matrice provvisoria è accompagnata dalla deposizione di tessuto di granulazione (sostanza macinata, collagene, capillari), che continua fino a coprire la ferita. La diminuzione dei livelli di acido ialuronico (in sostanza macinata) e l’aumento dei livelli di condroitina solfato rallentano la migrazione e la proliferazione dei fibroblasti inducendo la differenziazione dei fibroblasti, passando alla fase di maturazione della guarigione delle ferite.
La fase di maturazione
Per le prime 6 settimane, la nuova produzione di collagene domina il processo di guarigione della ferita, depositato casualmente nel tessuto di granulazione della ferita acuta. Man mano che la ferita matura, il collagene viene rimodellato in una struttura più organizzata con maggiore resistenza alla trazione. A poco a poco, il collagene di tipo I sostituisce il tipo III fino a raggiungere il normale rapporto della pelle di 4:1. Come rimodellamento continua, matrice metalloproteinasi collagenolisi raggiunge uno stato stazionario con la sintesi del collagene. Altipiani di resistenza alla trazione a 80% della forza originale circa 1 anno postinjury.
Superficiale a questa attività, le cellule epiteliali continuano a migrare verso l’interno dal bordo della ferita fino a quando il difetto è coperto. A questo punto, l’inibizione del contatto induce la trasformazione dei fibroblasti in miofibroblasti, che contengono fibre contrattili di actina. Segue la contrazione della ferita, sostituendo il volume del tessuto danneggiato con nuovo tessuto, sebbene il ruolo esatto del miofibroblasto non sia stato completamente chiarito.
Deterrenti alla guarigione delle ferite
Le ferite acute generalmente procedono attraverso un processo riparativo ordinato e tempestivo che si traduce in un ripristino durevole dell’integrità anatomica e funzionale. Tuttavia, vari fattori fisiologici e meccanici possono compromettere la risposta di guarigione, con conseguente ferita cronica che non riesce a procedere attraverso la solita progressione graduale. Infezione locale, ipossia, traumi, corpi estranei o problemi sistemici come diabete mellito, malnutrizione, immunodeficienza o farmaci sono più frequentemente responsabili.
Tutte le ferite sono contaminate, ma resistono con successo alle infezioni invasive. Quando la concentrazione supera 100.000 (105) organismi per grammo di tessuto o il sistema immunitario diventa compromesso, l’infezione spesso segue. La cellulite prolunga la fase infiammatoria mantenendo alti livelli di citochine proinfiammatorie e proteasi tissutali, che degradano i fattori di crescita dei tessuti e dei tessuti di granulazione e ritardando la deposizione di collagene.
Il debridement (chirurgico, enzimatico e / o mediante cambi di medicazione) e gli antibiotici sono i pilastri del trattamento antibiotico. Lo sbrigliamento rimuove il tessuto devitalizzato, che può essere una fonte di endotossine che inibiscono la migrazione dei fibroblasti e dei cheratinociti nella ferita. Corpi estranei possono anche richiedere la rimozione, come la presenza di una sutura di seta riduce il numero di batteri necessari per incitare l’infezione 10.000 volte. (Per una descrizione dettagliata della tecnica, vedere Medscape articolo di riferimento Ferita rimozione del corpo estraneo.)
L’ipossia cellulare ritarda la guarigione delle ferite attraverso vari mezzi. La reticolazione del fibrillo del collagene richiede l’ossigeno per idrossilare la prolina e la lisina e fallisce quando la pressione del tessuto è inferiore a 40 mm Hg. La potenza battericida della fosforilazione ossidativa dei leucociti soffre anche in un ambiente ipossico, riducendo la soglia per l’infezione. Le misure per migliorare l’erogazione di ossigeno dipendono dall’eziologia. L’uso del tabacco, che causa vasocostrizione e aumenta l’aderenza delle piastrine, deve essere interrotto. Angioplastica o innesto di bypass arterioso può essere richiesto per la malattia vascolare periferica. Possono essere indicate misure aggiuntive per migliorare la perfusione sistemica in caso di insufficienza cardiaca. Il valore dell’ematocrito inferiore al 15% deve essere trattato e l’euvolemia ripristinata, se necessario. La stasi venosa o l’insufficienza linfatica possono essere migliorate con indumenti compressivi.
La malattia sistemica può prolungare o interrompere drammaticamente la guarigione delle ferite. La glicosilazione nel diabete mellito altera la fagocitosi dei batteri dei neutrofili e dei macrofagi, prolungando la fase infiammatoria. La fase proliferativa è anche protratta nella stessa malattia in cui gli eritrociti diventano meno flessibili e meno in grado di fornire ossigeno alla ferita per il metabolismo dei tessuti e la sintesi del collagene.
I risultati di malnutrizione nella proliferazione diminuita del fibroblasto, neovascolarizzazione alterata e immunità cellulare ed umorale diminuita. Le ferite esercitano richieste metaboliche intensificate, in particolare all’interno del tessuto di granulazione. Aminoacidi come metionina, prolina, glicina e lisina, sono essenziali per la normale funzione cellulare e la riparazione delle ferite cutanee. Gli acidi grassi sono costituenti critici delle membrane cellulari e sono il substrato per gli eicosanoidi che mediano il processo infiammatorio. Gli acidi grassi essenziali linolenico e acido linoleico devono essere forniti nella dieta, in quanto il corpo umano è incapace di sintesi de novo di queste molecole.
Vitamine e minerali adeguati devono essere disponibili per il metabolismo cellulare, agendo come segnali cellulari e cofattori. La vitamina C (acido ascorbico) e il ferro sono necessari per l’idrossilazione della lisina e della prolina, che incrociano e stabilizzano la struttura a tripla elica del collagene; il rame svolge anche un ruolo nella stabilizzazione del collagene. La vitamina A (acido retinoico) svolge un ruolo importante nella modulazione della produzione e della degradazione del collagene ed è particolarmente importante nell’epitelizzazione. Un potente antiossidante, la vitamina E (alfa tocoferolo) sembra accelerare la guarigione cutanea e ossea negli animali e l’integrazione può avere un ruolo negli esseri umani. La carenza di tracce di metallo, in particolare di zinco, è anche associata a una scarsa guarigione delle ferite; questo dovrebbe essere reintegrato, a seconda dei casi.
Ovidio avrebbe scritto: “i farmaci a volte guariscono, a volte uccidono.”Questo è certamente vero per quanto riguarda la guarigione delle ferite. I corticosteroidi smussano i processi dell’intera fase infiammatoria. La vitamina A (per via topica o 25.000 UI/d per via orale) mitiga gli effetti curativi dannosi dei corticosteroidi, ma l’epatotossicità può derivare da un uso prolungato (cioè >1 mo). I farmaci antinfiammatori non steroidei (FANS) interferiscono anche con il metabolismo dell’acido arachidonico e, quindi, la guarigione delle ferite. Inoltre, i FANS inibiscono la funzione piastrinica, uno dei primi processi nella fase infiammatoria.
Uno studio condotto da Sutcliffe et al ha suggerito che l’upregulation della proteina di giunzione gap connexin è comune alle ferite croniche. Esaminando connexin in tre tipi di ferite-gamba venosa, piede diabetico e ulcere da pressione—i ricercatori hanno scoperto che ogni tipo di ferita mostrava upregulation di connexin epidermico 43, connexin 26 e connexin 30, così come connexin dermico 43.