Abstract
La cardiomiopatia cirrotica è una condizione recentemente riconosciuta costituita da disfunzione miocardica manifestata in pazienti cirrotici in assenza di precedenti malattie cardiache. I meccanismi patogenetici sottostanti includono un ambiente “miocardiotossico” che porta a una risposta cardiaca smussata allo stress, sia fisico che farmacologico. Questa condizione è ora meglio compresa e può essere diagnosticata con supporto clinico, mediante elettrocardiografia di laboratorio e criteri di ecocardiografia. Clinicamente, l’incompetenza sistolica è più evidente quando i pazienti cirrotici sono posti sotto stress, sia fisico che farmacologico. Nonostante sia ben compreso, c’è una mancanza di conoscenza per una corretta applicazione pratica. Casi recenti hanno suggerito che la CCM deve essere trattata precocemente perché può essere un fattore scatenante per le complicanze della cirrosi. Sono necessari studi per identificare potenziali trattamenti che alterano la storia naturale della malattia cardiaca nei pazienti cirrotici, specialmente nelle fasi in cui i pazienti sono asintomatici.
parole Chiave
cirrosi epatica, insufficienza cardiaca, cardiomiopatia
Introduzione
Cirrotici cardiomiopatia (CCM) è una disfunzione cardiaca caratterizzata dalla non ottimale contrattile risposta allo stress, e la compromissione della funzione diastolica in assenza di precedenti malattie cardiache . Al giorno d’oggi, la ricerca ha proposto che i pazienti cirrotici hanno una disfunzione cardiaca intrinseca che può influenzare lo sviluppo di insufficienza renale nella malattia epatica avanzata .
Dal 2002, i risultati sulla disfunzione circolatoria nella malattia del fegato si sono evoluti attraverso metodi diagnostici, sottolineando l’importanza dell’identificazione della CCM nella pratica clinica . Tuttavia, c’è ancora una lacuna di conoscenza per quanto riguarda la gestione di questa condizione . La presenza di disfunzione miocardica nella cirrosi aumenta il rischio di sindrome epatorrenale (HRS) ed eventi cardiaci avversi ed è correlata ad una maggiore mortalità .
Abbiamo esaminato la letteratura disponibile in PubMed per quanto riguarda i marcatori per le complicanze della cirrosi e le interazioni del cuore e del fegato. Lo scopo di questa recensione è quello di discutere la necessità di monitorare e trattare precocemente la CCM, poiché potrebbe essere un fattore scatenante per le complicanze della cirrosi, portando così nuove intuizioni alla pratica clinica.
Definizione e prevalenza
CCM descrive la disfunzione cardiaca cronica nei pazienti cirrotici nonostante nessuna precedente malattia cardiaca strutturale . È definito da uno o più dei seguenti: anomalie strutturali nelle camere cardiache; disfunzione diastolica; funzione sistolica normale o aumentata a riposo ma scarsa risposta contrattile allo stress; e cambiamenti elettrofisiologici . Queste anomalie possono essere osservate fino al 50% dei pazienti cirrotici .
Fisiopatologia
Cirrosi la fisiopatologia è nota per sovrapproduzione di ossido nitrico (NO) nei vasi splancnici e conseguente vasodilatazione sistemica. Questo meccanismo innesca il sistema rennina-angiotensina-aldosterone (RAAS) e l’attivazione del sistema nervoso simpatico e aumenta il livello di vasopressina sierica, portando a uno stato iperdinamico che può ripercuotersi dalle impostazioni cellulari a quelle cliniche.
Questi pazienti presentano un aumento del monossido di carbonio (CO) sierico secondario all’iperattività simpatica e alle citochine infiammatorie. C’è un aumento di CO, associato ad alti livelli di NO, accumulo di endocannabinoidi e altri vasodilatatori. Queste sostanze aumenta guanosina monofosfato ciclico (cGMP) leves, che inibisce adenosina monofosfato ciclico (cAMP) in cardiomiociti, responsabile di afflusso di calcio e maggiore forza contrattile (Figura 1,2) . L’analisi delle cellule miocardiche mostra una riduzione della fluidità della membrana plasmatica dovuta alla deposizione di colesterolo, che ostacola l’interazione di sostanze come i recettori beta-adrenergici e le proteine G. Il miocite ventricolare può anche avere una diminuzione della funzione dei canali del potassio, che porta ad un rilassamento cardiaco subottimale e conseguente disfunzione diastolica .
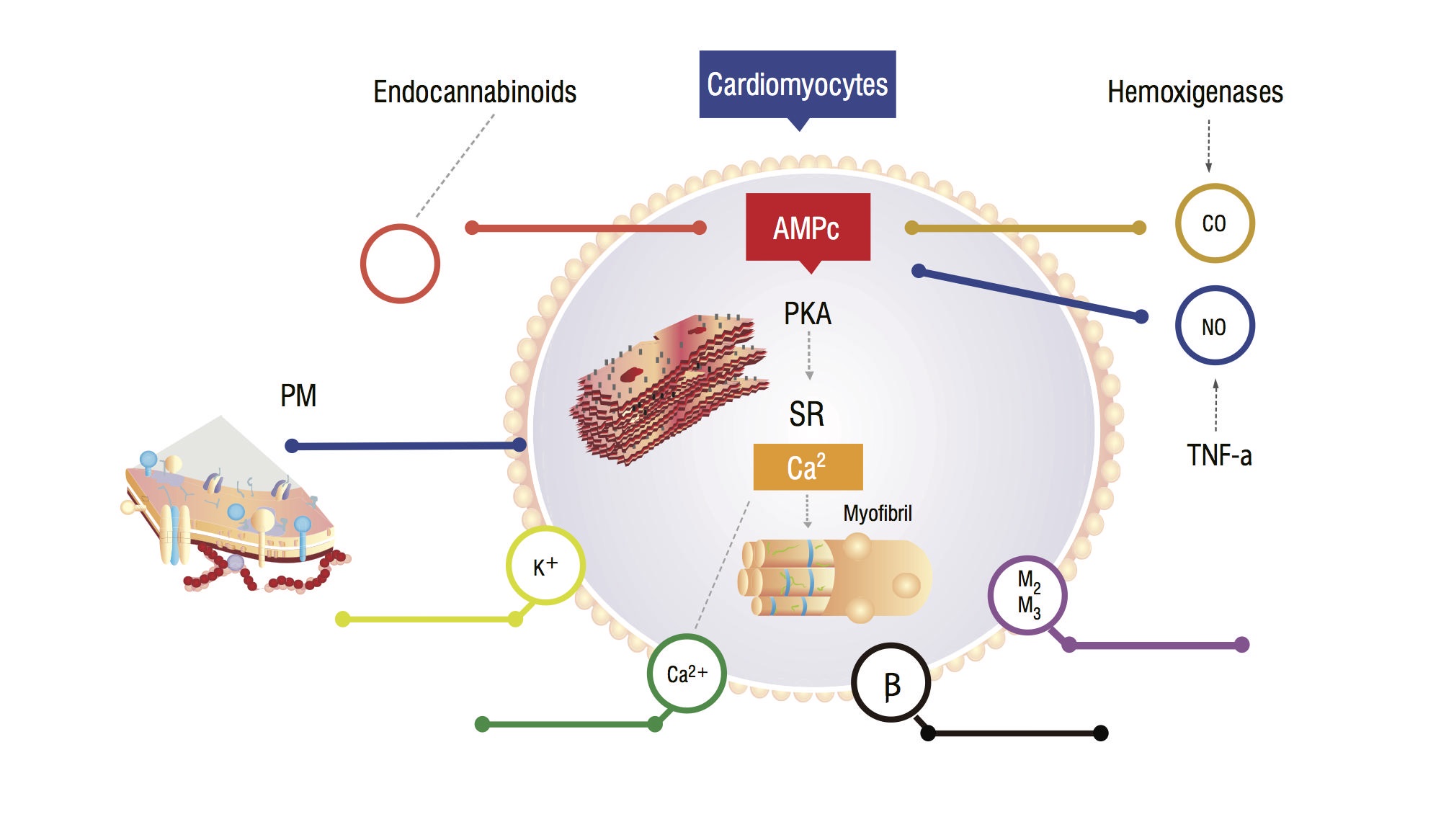
Figura 1. Modello fisiopatologico di cardiomiociti che mostra le principali vie di segnalazione che portano ad una risposta miocardica smussata allo stress. PM: Membrana plasmatica; CO: Ossido di carbonio; NO: Ossido nitrico; TNF-a: Fattore di necrosi tumorale alfa; SR: Reticolo sarcoplasmatico; AMPc: adenosina monofosfato ciclico; PKA: Protein chinasi A.
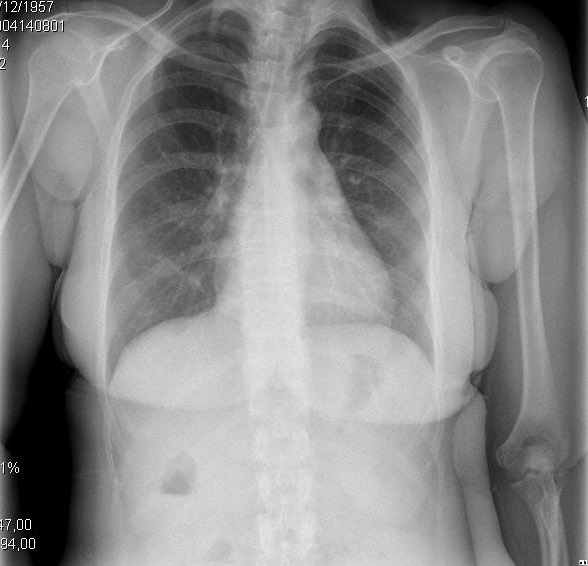
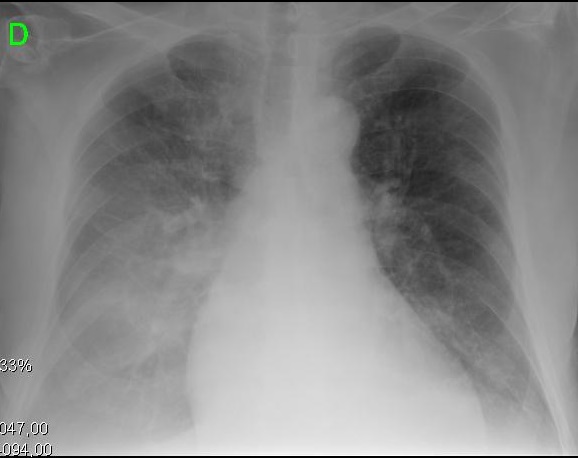
Figura 2. Presentazioni cliniche e radiologiche dei diversi stadi evolutivi della cardiomiopatia cirrotica. A. Immagine a sinistra mostra piccolo versamento pleurico e CTI di 0,50. B. Immagine a destra raffigura una grave congestione polmonare e CTI di 0,67.
Tabella 1. Criteri clinici e complementari per la diagnosi di CCM. Adattato da da riferimento 29 con permesso.
Gli stimoli beta-adrenergici persistenti inducono la down-regulation e riducono la densità dei recettori cardiaci, modificando le cascate di segnalazione responsabili dell’attivazione dei canali del calcio ; il risultato è una funzione contrattile compromessa . La ripercussione clinica di questa via è una funzione miocardica smussata e un aumento dei biomarcatori cardiaci .
L’identificazione della CCM si basa su sottili caratteristiche cliniche che possono essere smascherate man mano che la malattia progredisce, o possono diventare chiaramente evidenti in specifici scenari clinici di ceppo, e diventa una sfida per quanto riguarda se e quando trattare.
Storia naturale e diagnosi
I criteri diagnostici sono riassunti nella tabella 1 e si basano su clinici, imaging e biomarcatori.
Caratteristiche cliniche
Le caratteristiche cliniche della CCM possono verificarsi con pazienti con una funzione cardiaca apparentemente normale, poiché l’adattamento cronico del cardiomiocita all’ambiente cirrotico porta a tutte quelle modifiche cellulari .
I pazienti cirrotici si evolvono con ritenzione di sodio e liquidi, vasodilatazione periferica , iperattività simpatica e accumulo di sostanze “miocardiotossiche”, richiedendo un processo adattivo di cardiomiociti. Questo equilibrio continuo può essere rotto e smascherare un’insufficienza cardiaca latente in situazioni di stress, come trapianto di fegato, shunt portosistemico intraepatico transgiugulare o infezioni .
Anche se la cardiomiopatia cirrotica tende ad essere una condizione cronica, gli studi rivelano che i segni clinici di disfunzione miocardica possono invertire fino a 15 mesi dopo il successo del trapianto di fegato, così come il prolungamento del QT .
Risultati di laboratorio
Poiché la disfunzione cardiaca può essere riflessa da biomarcatori infiammatori, nuovi marcatori cardiaci e proinfiammatori sono stati recentemente studiati e correlati allo sviluppo di complicanze che portano ad un aumento della mortalità .
Studi recenti stanno descrivendo la correlazione tra i livelli di pro-ormone di ANP (proANP) e peptide natriuretico di tipo B (BNP), copeptina e troponina T ad alta sensibilità (hs-TnT), così come recettore attivatore del plasminogeno di tipo urochinasi solubile (suPAR) e proteina C-reattiva ad alta sensibilità (hs-CRP) e complicanze cardiovascolari nella cirrosi. Tuttavia, il suo uso clinico è ancora in fase di valutazione .
Il peptide natriuretico è secernuto dai cardiomiociti in risposta al sovraccarico di volume o pressione, o all’ischemia miocardica, per compensare l’effetto RAAS nel bilancio idrico e del sodio . BNP può essere uno dei biomarcatori più disponibili che permette un riconoscimento precoce del coinvolgimento cardiaco . La sua concentrazione sierica è più alta più grave è il fegato e le malattie cardiache .
Studi promettenti affermano che alti livelli di adrenomedullina sono osservati anche nella cirrosi con o senza coinvolgimento cardiaco clinico; questa sostanza viene rilasciata nel flusso sanguigno per agire come un vasodilatatore e mira a ridurre il postcarico . La galectina-3, il più recente biomarcatore studiato elevato nei pazienti cirrotici, è stata associata a fibrosi miocardica e può correlare con la gravità della cirrosi. Questo marcatore sta dimostrando di essere più sensibile di BNP nella valutazione della disfunzione diastolica, anche se è meno specifico .
Elettrocardiogramma
Anomalie elettrocardiografiche (ECG) possono essere notate precocemente in un paziente con CCM asintomatica e possono correlarsi con aritmie ventricolari e morte improvvisa . Il risultato ECG più comune è il prolungamento dell’intervallo QT, che può essere osservato in circa il 30-40% dei pazienti cirrotici, principalmente Child-Pugh B o C, indipendentemente dall’eziologia della cirrosi.
Questo schema ECG può essere secondario alle anomalie di ripolarizzazione dei cardiomiociti nei canali del potassio e alla riduzione della concentrazione di questi canali nella membrana plasmatica, in risposta a piccole modifiche alla pressione portale . Le disfunzioni dei canali ionici causano quindi il prolungamento del potenziale d’azione delle cellule del miocardio, con conseguente sistole ventricolare più lunga e QT . Il tempo di contrazione più lungo implica un rilassamento compromesso, causando disfunzione diastolica .
Lo disaccoppiamento elettromeccanico è descritto come una disincronia tra stimolo elettrico e risposta meccanica sistolica del cuore, portando a progressiva perdita della funzione miocardica e insufficienza cardiaca congestizia in questi pazienti1 . L’incompetenza cronotropa è caratterizzata dall’incapacità del nodo del seno di rispondere a stimoli fisiologici o farmacologici , un fatto determinante nella fisiopatologia del CCM. Questi cambiamenti sono anche secondari all’ipertensione portale, alla disfunzione autonomica, alla circolazione iperdinamica e alla presenza dei fattori proinfiammatori che influenzano il miocardio del paziente .
Ecocardiogramma
L’ecocardiogramma fornisce dati rilevanti sulla funzione cardiaca e viene utilizzato come criteri diagnostici per la cardiomiopatia cirrotica .
I principali risultati in questi pazienti sono l’allargamento del ventricolo sinistro endodiastolico( LV), la riduzione della velocità di picco e il tasso di deformità sistolica; aumento della pressione ventricolare sinistra end diastolica, senza un’adeguata espansione LVEF. L’allargamento dell’atrio sinistro (LA) per più di 34 mL/m2può suggerire una disfunzione diastolica cronica e, quando associata alla riduzione della massa ventricolare sinistra, può suggerire una prognosi peggiore . LA valutazione può essere effettuata attraverso l’ecocardiografia a due dimensioni e il tracciamento delle macchioline .
I risultati comuni osservati nell’ecocardiografia doppler cardiaca indicano una compromissione del rilassamento miocardico nei pazienti cirrotici: diminuzione del rapporto E / A (< 1) e tempo di decelerazione dell’onda E prolungato (DT) e tempo di rilassamento isovolumetrico (IVRT) > 80ms .Più grave è la disfunzione diastolica, più breve è l’IVRT e il DT mitrale, e più alto è il rapporto di velocità E/A, che caratterizza la disfunzione diastolica avanzata, l’aumento della pressione LA e la classe funzionale peggiore.
Recenti studi con valutazione del ceppo longitudinale globale (GLS) mostrano che questo può essere un metodo utile per la diagnosi precoce della disfunzione cardiaca nel paziente cirrotico, principalmente la disfunzione sistolica a riposo .
Il rapporto E/A può essere un parametro affidabile nella diagnosi di disfunzione diastolica nei pazienti cirrotici, anche con valori influenzati dal grado di idratazione del paziente, sebbene possa variare a causa di ascite e sovraccarico di volume . Nel frattempo, il tempo di rilassamento isovolumetrico, sebbene altamente sensibile, non rappresenta il riempimento del ventricolo sinistro e varia al variare della frequenza cardiaca .
Una lieve disfunzione sistolica e una disfunzione diastolica possono essere presentate indipendentemente dal grado di cirrosi. Tuttavia, la disfunzione diastolica si trova più comunemente nei pazienti cirrotici e generalmente precede la prima .
Discussione
Questa recensione affronta una crescente identificazione e comprensione della fisiopatologia su CCM, è correlazione con prognosi infausta nei pazienti cirrotici e sorge la preoccupazione per l’approccio terapeutico.
Questo articolo riassume i criteri diagnostici (Tabella 1) già stabiliti nella letteratura medica, con enfasi sui nuovi biomarcatori che sono stati studiati per la complementazione diagnostica. Gli studi hanno dimostrato che la disfunzione miocardica esiste in vari stadi della cirrosi epatica. È stato descritto che se il paziente ha un alto BNP e disfunzione ventricolare sull’ecocardiogramma, il trattamento dell’insufficienza renale è molto difficile; D’altra parte, l’intervento precoce in pazienti che non hanno ancora stabilito malattie cardiache è un’area che non è stata ancora esplorata.
Tabella 1. Criteri clinici e complementari per la diagnosi di CCM. Adattato da da riferimento 29 con permesso.
caratteristiche Cliniche
No cardiopolmonare sintomi a riposo
Bassa funzionale riserva cardiaca
Hiperadrenergic stato di sodio e la ritenzione idrica
Biomarcatori (troponina I, pro-BNP e BNP, altri)
Eletrocardiography
anomalie Elettrofisiologiche (prolungamento dell’intervallo QT e di altri)
Ecocardiografica criteri di
Diastolica di valutazione
rapporto E/A <1.0 (età corretta)
Prolungato isovolumic tempo di rilassamento (>80msec)
Prolungato tempo di decelerazione (>200msec)
ipertrofia ventricolare Sinistra
Sistolica di valutazione
frazione di Eiezione a riposo < 55%
Contrattile deficit di stress
I segni e sintomi di insufficienza epatica tendono ad essere in ritardo, con sottile cliniche e di laboratorio di manifestazioni, a volte di difficile interpretazione. Lo specialista, o anche il medico di medicina generale, può affrontare un paziente con disturbo dispnea, senza gonfiore giugulare patologico, normali esami cardiologici iniziali, ma con BNP elevato, che può rappresentare un caso di CCM.
A differenza di altri studi, il nostro gruppo propone un progresso in questo campo, poiché la comprensione della cardiopatia concomitante alla cirrosi può consentire un intervento terapeutico precoce di complicanze attribuibili a insufficienza miocardica non diagnosticata. Trapianto di fegato e SUGGERIMENTI sono impostazioni cliniche speciali che possono deflagrare l’insufficienza cardiaca in questi pazienti. Poiché i pazienti sopravvivono più a lungo dopo queste procedure, i medici si troverebbero di fronte a un peggioramento dei parametri cardiaci .
Crediamo che l’intervento terapeutico precoce nella CCM sia promettente, quando si manifesta con complicanze come HR refrattari, prima di presentare una chiara congestione polmonare attribuibile all’insufficienza miocardica. La letteratura sostiene che situazioni di stress fisico o farmacologico, o infezioni, associate a cardiomiopatia cirrotica latente possono causare HRS, che possono essere refrattari ai trattamenti convenzionali e associati a prognosi peggiore se è presente disfunzione sistolica .
La nostra esperienza suggerisce che la presentazione di HRS è un indizio per iniziare il trattamento della componente miocardica. Questa progressione a HRS è intesa poiché l’esistenza di CCM è un fattore scatenante e perpetuo di HRS, quindi se CCM viene avvicinato presto in questo contesto, HRS può avere una prognosi migliore .
Il nostro gruppo ha aperto la strada al trattamento dei pazienti con una diagnosi clinica di CCM nella progressione a SHR refrattario ai trattamenti convenzionali, in cui l’uso di dobutamina come terapia di salvataggio per la funzione renale ha avuto successo. L’obiettivo è quello di applicare questa conoscenza teorica anticipando questa complicazione in pazienti con malattia epatica allo stadio terminale .
Nonostante sia ben compreso, c’è una mancanza di conoscenza per una corretta applicazione pratica. È necessario un alto grado di sospetto clinico per riconoscere la CCM nel paziente asintomatico senza apparenti limitazioni funzionali, ma con cardiopatia cellulare e strutturale subclinica.
Sono necessari studi per identificare potenziali trattamenti che alterano la storia naturale di malattie cardiache nei pazienti cirrotici, specialmente nelle fasi in cui i pazienti sono asintomatici. Questo rappresenta un’area di conoscenza che non è ancora stata esplorata, specialmente per quanto riguarda le future opzioni terapeutiche.
Conflitti di interesse
Gli autori hanno dichiarato che non ci sono conflitti di interesse per quanto riguarda la pubblicazione di questo articolo.
Sostegno finanziario
Nessuno.
- Sampaio F, Pimenta J (2016) Valutazione della funzione ventricolare sinistra nella cirrosi: metodi attuali e direzioni future. Mondo J Gastroenterol 22: 112-125.
- Shin WJ, Song JG, Jun IG, Moon YJ, Kwon HM, et al. (2016) Effetto dell’accoppiamento ventricolo-arterioso sui risultati del trapianto nei cirrotici: Analisi delle relazioni curva pressione-volume. J Epatolo.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) Disfunzione diastolica nella cirrosi epatica: predittore prognostico nel trapianto di fegato? Trapianto Proc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) La sopravvivenza a 2 anni tra i pazienti cirrotici epatici è influenzata dal volume atriale sinistro e dalla massa ventricolare sinistra. Fegato Int.
- Møller S, Henriksen JH (2002) Cardiomiopatia cirrotica: una revisione fisiopatologica della disfunzione circolatoria nella malattia del fegato. Cuore 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Cardiomiopatia cirrotica: un altro caso di un approccio di successo al trattamento della sindrome epatorenale. Caso Rep Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) Una prospettiva sulla cardiomiopatia cirrotica. Trapianto Proc 43: 1649-1653.
- Ma Z, Lee SS (1996) Cardiomiopatia cirrotica: arrivare al cuore della questione. Epatologia 24: 451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, et al. (2010) Cardiomiopatia cirrotica. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) Cardiomiopatia cirrotica e trapianto di fegato. Fegato Traspl 6: S44-52.
- Wiese S, Mortensen C, Gøtze JP, Christensen E, Andersen O, et al. (2014) I marcatori cardiaci e proinfiammatori predicono la prognosi nella cirrosi. Fegato Int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) Valutazione delle funzioni cardiache dei bambini cirrotici utilizzando peptide natriuretico cerebrale sierico e imaging Doppler tissutale. Ann Pediatr Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) Cardiomiopatia cirrotica?: Implicazioni per la gestione perioperatoria dei pazienti trapiantati di fegato 7: 507-20.
- Farr M, Schulze PC (2015) Recenti progressi nella diagnosi e nella gestione della cardiomiopatia associata alla cirrosi nei candidati al trapianto di fegato: imaging ecografico avanzato, biomarcatori cardiaci e terapia avanzata per l’insufficienza cardiaca. Clin Med Intuizioni Cardiol 8: 67-74.
- Licata A, Corrao S, Petta S, Genco C, Cardillo M, et al. (2013) Il livello plasmatico NT pro BNP e il volume atriale sono legati alla gravità della cirrosi epatica. PLoS Uno 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactin-3 e peptide natriuretico cerebrale rispetto all’ecocardiografia convenzionale nella diagnosi precoce della cardiomiopatia cirrotica. Turk J Gastroenterol 27: 367-74.
- Wong F, Siu S, Liu P, Blendis LM (2001) Peptide natriuretico cerebrale: è un predittore di cardiomiopatia nella cirrosi? Clin Sci (Lond) 101: 621-628.
- Wong F (2009) Cardiomiopatia cirrotica. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, et al. (2003) Prolungamento dell’intervallo QTc in pazienti con cirrosi. Ann Gastroenterol 16: 155-8.
- Mozos I (2015) Rischio di aritmia nella cirrosi epatica. Mondo J Hepatol 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Cardiomiopatia cirrotica: un altro caso di un approccio di successo al trattamento della sindrome epatorenale. Caso Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) Dispersione QT: misurazione e interpretazione.
- Páll A, Czifra A, Vitális Z, Papp M, Paragh G, et al. (2014) Approccio fisiopatologico e clinico alla cardiomiopatia cirrotica. J Gastrointestin Fegato Dis 23: 301-310.
- Castro Hevia J, Antzelevitch C, Tornés Bárzaga F, Dorantes Sánchez M, Dorticós Balea F, et al. (2006) Tpeak-Tendent e Tpeak-Tendent dispersione come fattori di rischio per tachicardia ventricolare/fibrillazione ventricolare in pazienti con sindrome di Brugada. J Am Coll Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) Valutazione dell’intervallo Tp-e e del rapporto Tp-e/QT in pazienti con epatite cronica B. Prague Med Rep 114: 239-245.
- Jewell DP (2006) Nuovi pazienti, nuove lezioni, nuovo pensiero nella malattia infiammatoria intestinale: Congresso Mondiale di Gastroenterologia Simposio, Montreal, Canada. Colorettale Dis 8 Suppl 1 (s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) Cardiomiopatia cirrotica: prospettiva di un cardiologo. Mondo J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) Cardiomiopatia cirrotica: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.