Introduzione
infezioni associate all’assistenza Sanitaria (infezioni di questo tipo) come batteriemia causata da multidrug-resistenti ceppi di Pseudomonas aeruginosa risultato in un aumento della morbilità e della mortalità, che prolunga l’ospedalizzazione e costi superiori rispetto a quelle infezioni causate da ceppi sensibili.1-3 Le infezioni causate da questi microrganismi resistenti sono spesso associate a età, cancro, malattie cardiache, diabete, uso intensivo di antibiotici e procedure invasive come l’emodialisi, il catetere di ventilazione meccanica, la tracheotomia e altri.4
La crescente incidenza di P. multiresistente aeruginosa come causa di infezione nosocomiale è un problema globale, una conseguenza della capacità di questo microrganismo di sviluppare resistenza a quasi tutti gli altri agenti antimicrobici durante la chemioterapia antimicrobica, sia per selezione di mutazioni nei geni cromosomici o per trasferimento genico orizzontale.5,6 In Brasile, questo problema è ancora più significativo, poiché esiste un’alta densità di uso di antibiotici, in particolare β-lattamici, carbapenemi e fluorochinoloni.7,8 La resistenza in P. aeruginosa ai carbapenemi è fino al 60% in alcuni ospedali brasiliani9,10 e si verifica principalmente per produzione di metallo-β-lattamasi (MBL).
Sono note dieci sottoclassi degli enzimi MBL: IMP (Imipenemasi), VIM (Imipenemasi di Verona), SPM-1 (São Paulo MBL), GIM (Imipenemasi tedesca), SIM-1 (Seul Imipenemasi),11 AIM-1 (Imipenemasi australiana),12 KHM (Kyorin University Hospital),13 NDM-1 (Nuova Delhi MBL),14 DIM-1 (olandese Imipenemasi),15 e TMB (Tripoli MBL).16 In Brasile, le sottoclassi più diffuse sono IMP-1 e SPM-1.11
Diversi altri geni di virulenza e la formazione di biofilm possono contribuire alla patogenicità di infezioni gravi, in particolare quelle associate a procedure invasive.17 Tra i principali fattori di virulenza descritti in letteratura, evidenziamo quelli relativi all’adesione di microrganismi alle cellule ospiti attraverso flagelli, fimbrie e alginate18 e quelli che facilitano la rottura dell’integrità epiteliale e interferiscono con il sistema immunitario, come elastasi, fosfolipasi C e proteasi alcalina, ulteriore esotossina A, piocianina e pioverdina.19 La produzione di biofilm è particolarmente associata alla difficoltà degli antibiotici di penetrare nelle cellule, poiché secernono una matrice polimerica composta da polisaccaridi, proteine e DNA.20,21
Lo scopo di questo studio era identificare i fattori di rischio associati alla batteriemia causata da P. aeruginosa resistente ai carbapenemi e alla produzione di MBL. Inoltre, abbiamo studiato la frequenza dei geni di virulenza e la loro capacità di formare biofilm.
Materiali e metodipazienti e ospedale
Il P. i ceppi di aeruginosa sono stati recuperati da pazienti ricoverati all’Ospedale universitario di Uberlandia (Brasile), Università Federale di Uberlândia (HC-UFU) e ottenuti dal laboratorio di microbiologia dell’HC-UFU, nel periodo da maggio 2009 a dicembre 2012, considerando solo il primo episodio di infezione.
Progettazione dello studio
Abbiamo condotto uno studio caso (pazienti con batteriemia dovuta a P. aeruginosa resistente ai carbapenemi) contro controllo (pazienti con batteriemia causata da P. aeruginosa suscettibile ai carbapenemi) per identificare i fattori di rischio tra i pazienti infetti da P. aeruginosa resistente ai carbapenemi. Inoltre, abbiamo valutato i risultati secondari, inclusi i periodi di ospedalizzazione, l’ammissione all’unità di terapia intensiva (ICU) e l’uso di procedure invasive. Le caratteristiche demografiche, cliniche ed epidemiologiche di ciascun paziente incluso nello studio sono state recuperate dalle cartelle cliniche.
Definizioni
Le infezioni associate all’assistenza sanitaria (HAI) sono definite come qualsiasi infezione acquisita dopo il ricovero di un paziente in ospedale. Gli HAI possono manifestarsi durante l’ospedalizzazione o dopo la dimissione, poiché sono correlati all’ospedalizzazione o alle procedure eseguite durante l’ospedalizzazione.22 Batteriemia, secondo i Centers for Disease Control and Prevention, 23 può essere definita come la presenza di batteri vitali nel sangue documentata da un risultato positivo di emocoltura. La batteriemia è stata classificata come primaria quando non era correlata a un altro focolaio di infezione o quando era correlata a un catetere endovenoso e secondaria quando era clinicamente correlata all’infezione in un altro sito anatomico.9 La multiresistenza è definita come non suscettibilità acquisita ad almeno un agente in tre o più categorie antimicrobiche.24 La terapia antimicrobica è stata considerata inappropriata quando un microrganismo isolato presentava una resistenza in vitro agli antimicrobici utilizzati per il trattamento del paziente e / o una mancanza di trattamento per 24 ore dopo la diagnosi di infezioni microbiche.25
Test microbiologici e molecolari clinici
Le colture sono state raccolte secondo il protocollo utilizzato dal Laboratorio di microbiologia dell’HC-UFU e sono state elaborate utilizzando il sistema automatizzato BACT/Alert® (BioMérieux, Durham, USA). I test di identificazione e sensibilità antimicrobica sono stati eseguiti mediante automazione utilizzando il sistema VITEK II e i ceppi che hanno mostrato sensibilità intermedia sono stati considerati resistenti. I protocolli di controllo della qualità sono stati utilizzati secondo gli standard dell’Istituto Standard clinico e di laboratorio.26-28 Il P resistente ai carbapenemi. gli isolati di aeruginosa sono stati sottoposti a screening fenotipico per la produzione di MBL utilizzando test di sinergia a doppio disco, come descritto in precedenza.29,30 Inoltre, per valutare la presenza di geni MBL nei ceppi di P. aeruginosa, è stata eseguita una PCR multiplex, come descritto in precedenza.31 Le condizioni di ciclo erano: 94 ° C per 5min, seguito da 30 cicli di denaturazione a 94°C per 30s, ricottura a 53°C per 45s ed estensione a 72°C per 30s, seguito da estensione finale a 72°C a 10min, il tutto in un MasterCycler personal (Eppendorf). La rilevazione di geni di virulenza che codificano proteasi alcalina (aprA), elastasi A (lasA), elastasi (lasB),32 fosfolipasi emolitica C (plcH), fosfolipasi non emolitica C (plcN), esotossina A (toxA) e alginato (algD)33 è stata determinata mediante PCR uniplex, utilizzando il seguente protocollo: 94°C per 3min, 30 cicli a 94°C per 30s, 55°C per 1min e 72 per 1min e 30 s e 72°C per 5 min.
Test di adesione iniziale34
Per valutare l’adesione iniziale, 200µL di una sospensione cellulare contenente 1×107cells/mL preparata in TSB sono stati aggiunti a lastre di polistirene a 96 pozzetti. L’adesione iniziale è stata consentita per 2 ore a 37°C con rotazione a 120 giri / min. I batteri aderiti in lastre di polistirene a 96 pozzetti sono stati lavati due volte con una soluzione di NaCl allo 0,9% e raccolti raschiando i pozzetti per gli anni ‘ 90. La sospensione cellulare ottenuta è stata placcata su TSA per l’enumerazione delle unità formanti colonie (CFU). Tutti gli esperimenti sono stati fatti in triplice copia in tre esperimenti indipendenti. Il ceppo ATCC15692 (PAO1) è stato utilizzato come controllo positivo e TSB senza batteri è stato utilizzato come controllo negativo.
Test di formazione del biofilm 35
200µL di una sospensione cellulare contenente 1×107cellule/mL preparata in TSB è stata aggiunta a lastre di polistirene a 96 pozzetti. La formazione di biofilm è stata consentita per 24 ore a 37°C con rotazione a 120 giri / min. I batteri cresciuti in lastre di polistirene a 96 pozzetti sono stati lavati due volte con una soluzione di NaCl allo 0,9% e lasciati asciugare in posizione invertita. La biomassa totale è stata misurata mediante fissazione di metanolo (Merck), colorazione crystal violet (Merck) e eluizione acetica acida (Merck) come descritto in precedenza. Il colorante eluito è stato rimosso da ciascun pozzetto e inserito in una nuova piastra microtitolare da 96 pozzetti, e la sua assorbanza è stata letta su un lettore di piastre ELISA (BioTek Instruments Inc., Vermont, USA) a 570nm. Gli esperimenti sono stati fatti con otto repliche per ogni ceppo in tre esperimenti indipendenti. TSB senza batteri è stato usato come controllo negativo. Il valore di cut-off della densità ottica (OdC) è stato stabilito come tre deviazioni standard (SD) al di sopra della media della densità ottica (OD) del controllo negativo: OdC=OD medio del controllo negativo+3x SD del controllo negativo. Per una più facile interpretazione dei risultati, i ceppi sono stati suddivisi nelle seguenti categorie in base alla densità ottica: (ODi): ODi≤OdC o OdC
ODi2x OdC=produttore di biofilm non-biofilm/produttore di biofilm debole; 2x ODcODi4x OdC=produttore di biofilm moderato; 4x ODcODi=produttore di biofilm forte.Concentrazione di cellule di biofilm36
La concentrazione di cellule di biofilm è stata determinata mediante enumerazione CFU. Dopo la formazione del biofilm, i biofilm sono stati lavati due volte con una soluzione di NaCl allo 0,9% e raccolti dopo aver raschiato i pozzetti per 90. La sospensione cellulare ottenuta è stata placcata su piastre TSA. Tutti gli esperimenti sono stati fatti in triplice copia, in tre occasioni indipendenti.
Analisi statistica
L’analisi statistica è stata eseguita utilizzando GraphPad Prism v. 5 (GraphPad Software, San Diego, CA). I test quantitativi sono stati confrontati utilizzando il Kruskal-Wallis, applicando il test di confronto multiplo di Dunn. Tutti i test sono stati eseguiti con un livello di confidenza del 95% e la significatività statistica è stata definita come p
0,05.Approvazione etica
Il Comitato Etico di ricerca dell’Università Federale Uberlandia ha valutato e approvato il nostro progetto di studio.
Risultati
Dal 1 maggio 2009 al 31 dicembre 2012, una sorveglianza ospedaliera dell’incidenza della batteriemia di P. aeruginosa è stata eseguita nel laboratorio di microbiologia dell’Ospedale universitario. In questo periodo, 157 pazienti non ripetitivi con batteriemia P. aeruginosa sono stati inclusi nello studio. Le informazioni dettagliate sui fattori associati allo sviluppo della batteriemia e le caratteristiche cliniche e demografiche, nonché la distribuzione dei pazienti per reparti sono mostrate nelle tabelle 1 e 2. La batteriemia primaria si è verificata in 75.8% e quelli con focus sconosciuto hanno rappresentato in 62.4% dei casi. La batteriemia secondaria rappresentava il 24,2% dei pazienti, in cui il tratto respiratorio era l’obiettivo principale dell’infezione (17,2%). Inoltre, il 43,9% dei pazienti ha avuto batteriemia con P. aeruginosa resistente ai carbapenemi e la maggior parte di questi pazienti è stata ricoverata in terapia intensiva. La maggior parte dei pazienti era di sesso maschile (66,8%), con una degenza ospedaliera media di 63,2±80,17 giorni e un’età media di 52,01±20,24 anni.
Distribuzione di pazienti infetti da Pseudomonas aeruginosa in diverse unità dell’Ospedale clinico dell’Università federale di Uberlândia da maggio / 2009 a dicembre / 2012.
| Cliniche | Totale | Carbapenem-resistente Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Chirurgia | 35 (22.3) | 16 (23.2) |
| clinica Medica | 24 (15.3) | 10 (14.5) |
| Oncologia | 14 (8.9) | 2 (2.9) |
| pronto soccorso | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| terapia intensiva Neonatale | 2 (1.3) | 0 |
| Pediatrica terapia intensiva | 2 (1.3) | 1 (1.5) |
| Trapianto | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
Unità di terapia intensiva.
Burneds, unità di dolore toracico.
Fattori di rischio associati alla resistenza ai carbapenemi in pazienti con batteriemia causata da Pseudomonas aeruginosa.
| fattori di Rischio | Totale | resistente ai Carbapenemi | Multisensitivea | Univariata | Multivariata | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | O (IC 95%) | p | |
| Età media (anni) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Maschio/femmina | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| Tempo di ospedalizzazione, media (giorni) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| unità di terapia Intensiva | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Chirurgia | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| procedure Invasive (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Venoso centrale, catetere | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| Chirurgico di drenaggio | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Sonde enterale/nutrizione gastrica | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Emodialisi | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| nutrizione Parenterale | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Comorbidità condizioni | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| insufficienza Cardiaca | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| il Cancro | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| il Diabete mellito | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| insufficienza renale Cronica | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| il virus dell’immunodeficienza Umana | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| batteriemia Primaria | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| catetere venoso Centrale correlati | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Sconosciuto | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Secondaria batteriemia | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| vie Respiratorie | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| del tratto Urinario | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| terapia inadeguata | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| Precedente uso di antibiotici | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| La mortalità | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive ceppi sono stati considerati come coloro che hanno presentato la suscettibilità a tutti antimicrobici testato.
Odds ratio.
Intervallo di confidenza.
valore p.
Punteggio medio di gravità della malattia.
Statisticamente significativo (P≤0,05).
L’uso precedente di antibiotici (78,3%), le procedure invasive (88,5%), le comorbidità (77,7%) e l’intervento chirurgico precedente (43,9%) erano comuni. Si è riscontrato che il 31,2% dei pazienti ha ricevuto un trattamento inadeguato e il tasso di mortalità era del 58,6%. Diversi fattori intrinseci ed estrinseci per lo sviluppo della batteriemia da ceppi di P. l’aeruginosa resistente ai carbapenemi è stata rilevata mediante analisi univariata. Tuttavia, solo la ventilazione meccanica, i tubi enterali/nasogastrici, la batteriemia primaria con focus sconosciuto e la terapia inappropriata erano fattori di rischio indipendentemente associati allo sviluppo di batteriemia P. aeruginosa resistente ai carbapenemi.
La produzione di MBL è stata analizzata per 56 isolati di P. aeruginosa resistenti ai carbapenemi. Nove isolati (25,0%) erano fenotipicamente positivi e un totale di 16,1% (n= 9/56) erano coerenti con i geni amplicons MBL, essendo 10,71% blaSPM-1 e 5.3% Geni blaVIM In generale, i ceppi hanno mostrato un profilo di resistenza multidrug. Per altri geni di virulenza valutati (aprA, plcH, plcN, lasA, lasB, toxA e algD), tutti i ceppi hanno mostrato un’alta frequenza (88%).
Tra gli 88 ceppi di P. aeruginosa sensibili ai carbapenemi, 21 (23,9%) erano resistenti ad altri β-lattamici. Per 69 ceppi resistenti ai carbapenemi, il profilo di resistenza era elevato: β-lattamico 50/69 (72,5%), fluorochinoloni 48/69 (69,6%) e aminoglicosidi 50/69 (72,5%) (Tabella 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
oltre a MBL ricerca, cinque ceppi sono stati selezionati (due con SPM-1, uno contenente VIM, e due fenotipicamente positivo per MBL) per la valutazione della formazione di biofilm utilizzando dosaggi quantitativi di biomassa totale dalla colorazione con cristallo viola. Considerando la presenza di geni MBL, tutti i ceppi sono stati identificati come produttori di biofilm con una media di 0,90±0,61 di biomassa. Non sono state osservate differenze nell’adesione iniziale dei singoli ceppi. Tuttavia, c’era un OD inferiore per il ceppo contenente il gene blaVIM (Fig. 1).
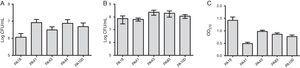
(A) Numero di cellule aderite ad una superficie di polistirene dopo 2h, espresso come log CFU/mL per 5 campioni di Pseudomonas aeruginosa isolati dal sangue. B) Numero di cellule vitali nel biofilm (log CFU / mL). C) Biomassa di biofilm espressa come densità ottica di cristallo viola (OD570nm).
Discussione
Ospedale batteriemia causata da microrganismi multiresistenti, sia Gram-positivi o Gram-negativi, è stato spesso descritto come un problema significativo per la salute che aumenta i costi ospedalieri e rende difficile stabilire un’appropriata terapia antimicrobica, che si traduce in una prognosi peggiore.37 L’alta percentuale di batteriemia ospedaliera causata da P. aeruginosa resistente ai carbapenemi indica l’importanza di questo organismo come causa significativa di questa infezione nel nostro ospedale. L’alta percentuale di batteriemia ospedaliera causata da P. aeruginosa resistente ai carbapenemi indica l’importanza di questo organismo come causa significativa di questa infezione nel nostro ospedale. I risultati di diversi studi hanno suggerito che fattori di rischio intrinseci come la ventilazione meccanica, l’uso di un sondino nasogastrico e l’uso precedente di antibiotici aumentano il rischio di sviluppo di batteriemia causato da P. aeruginosa resistente ai carbapenemi, nonché il rischio di morbilità e mortalità.38
In questo studio, oltre il 50% dei fattori di rischio sono stati associati all’infezione da questo microrganismo secondo l’analisi univariata. Tuttavia, solo la ventilazione meccanica, i tubi di alimentazione enterale/gastrica, la batteriemia primaria di origine sconosciuta e il trattamento inappropriato sono stati considerati fattori di rischio indipendenti dall’analisi multivariata.
Un catetere venoso centrale è uno dei fattori di rischio più significativi per la batteriemia acquisita in ospedale, in quanto è stato associato a oltre il 90% di queste infezioni.Sebbene non fosse un fattore di rischio significativo in questo studio, l ‘ 85,5% dei pazienti con batteriemia con P. aeruginosa resistente ai carbapenemi ha avuto questa procedura invasiva.
Spesso, la batteriemia causata da P. aeruginosa resistente agli antibiotici ha un tasso di mortalità più elevato dovuto, in particolare, alla somministrazione di una terapia antibiotica inappropriata.40 In questo studio, abbiamo studiato una coorte di pazienti 157 con batteriemia causata da ceppi di P. aeruginosa, con 69 di loro infettati da isolati di P. aeruginosa resistenti ai carbapenemi. La mortalità totale è stata più elevata nel gruppo resistente ai carbapenemi; tuttavia, la presenza di ceppi resistenti è stata significativamente associata a una terapia antimicrobica inappropriata, dimostrando che questo gruppo di solito ha una prognosi peggiore. Simile ai nostri risultati, studi precedenti hanno dimostrato che P. aeruginosa isolato da pazienti che hanno ricevuto una terapia inappropriata aveva una prognosi peggiore, con tassi di 46.1% 41 e 53.8%.42
Oltre ad essere associato a infezioni gravi, la resistenza ai carbapenemi in P. aeruginosa provoca spesso la produzione di MBL.43 I nostri risultati hanno mostrato che il P resistente ai carbapenemi. aeruginosa era prevalente in tutto l’ospedale con geni che codificano questi enzimi nel 16,1% dei ceppi, essendo il 10,7% del genotipo blaSPM-1 e il 5,4% del genotipo blaVIM. Poiché la frequenza dei ceppi multiresistenti era elevata, questi risultati suggeriscono che altri meccanismi di resistenza coesistono in questi ceppi, come le pompe di efflusso e l’impermeabilità della membrana.44
La prevalenza di MBL come meccanismo di resistenza è aumentata, in particolare in America Latina.45 In Brasile, la prevalenza di MBL-produzione di P. aeruginosa varia tra le diverse regioni e tra gli ospedali, con tassi che vanno dal 7,5% al 44%.11
L’enzima SPM-1 è considerato il più comune in Brasile, seguito da IMP-1,11,46 tuttavia, c’è stato anche un aumento della frequenza degli isolati di P. aeruginosa contenenti l’enzima VIM.45,47 Nel nostro studio, l’enzima SPM-1 è stato rilevato nel 16,7% dei campioni di MBL che producono fenotipicamente, seguito dall’enzima VIM, che è stato rilevato nel 8,3% dei casi. Questi risultati indicano una significativa diffusione di geni che codificano MBL nella nostra regione.
Considerando la presenza di MBL e produzione di biofilm, il 100% dei ceppi sono stati classificati come produttori forti. Un altro studio in Brasile ha rilevato che il 40% di P. aeruginosa classificato come forte produttore di biofilm erano anche produttori di MBL.35 Riteniamo che questi risultati siano importanti quando queste caratteristiche (produzione di biofilm e MBL) si sovrappongono e le infezioni causate da questi batteri sono difficili da trattare. Ciò è giustificato, in parte, perché la crescita dei batteri nel biofilm è circa 64 volte più resistente agli antimicrobici.48
P. aeruginosa ha un gran numero di fattori di virulenza extracellulari che contribuiscono anche alla patogenicità e alla gravità di queste infezioni, come quella codificata dai geni aprA, plcH, plcN, lasA, lasB, toxA e algD.32,33 I nostri dati hanno mostrato che la presenza di un profilo multiresistente, nella maggior parte dei ceppi (88%) erano positivi per i geni di virulenza aprA, plcH, plcN, lasA, lasB, toxA e algD, tranne in un ceppo che non mostrava i geni toxA e plcH, che possono ulteriormente contribuire a una prognosi peggiore associata a infezioni gravi.
I nostri risultati confermano le precedenti scoperte riguardanti i fattori di rischio per lo sviluppo di batteriemia resistente ai carbapenemi di P. aeruginosa, nonché la diffusione di ceppi produttori di MBL di tipo SPM-1. Tuttavia, questo studio contribuisce per ulteriori prove della diffusione di ceppi produttori di MBL, in particolare il tipo VIM, in ceppi altamente virulenti e produttori fortemente biofilm.
Conflitti di interesse
Gli autori non dichiarano conflitti di interesse.