Abstrakt
cirrotisk kardiomyopati är ett nyligen erkänt tillstånd som består av myokardiell dysfunktion manifesterad hos cirrotiska patienter i frånvaro av tidigare hjärtsjukdom. De underliggande patogenetiska mekanismerna innefattar en” miokardiotoxisk ” miljö som leder till ett trubbigt hjärtrespons på stress, vare sig det är fysiskt eller farmakologiskt. Detta tillstånd är nu bättre förstått och kan diagnostiseras stöds kliniskt, genom laboratorieelektrokardiografi och ekokardiografikriterier. Kliniskt är systolisk inkompetens tydligast när cirrotiska patienter placeras under stress, vare sig det är fysiskt eller farmakologiskt. Trots att det är väl förstått saknas kunskap om en korrekt praktisk tillämpning. Nya fallrapporter har föreslagit att CCM måste behandlas tidigt eftersom det kan vara en utlösande faktor för cirroskomplikationer. Studier behövs för att identifiera potentiella behandlingar som förändrar den naturliga historien om hjärtsjukdom hos cirrotiska patienter, särskilt i de faser där patienterna är asymptomatiska.
nyckelord
levercirros, hjärtsvikt, kardiomyopati
introduktion
cirrotisk kardiomyopati (CCM) är en hjärtdysfunktion som kännetecknas av suboptimal kontraktil respons på stress och nedsatt diastolisk funktion i frånvaro av tidigare hjärtsjukdom . Numera har forskning föreslagit att cirrotiska patienter har en inneboende hjärtdysfunktion som kan påverka utvecklingen av njursvikt vid avancerad leversjukdom .
sedan 2002 har resultaten om cirkulationsdysfunktion i leversjukdom utvecklats genom diagnostiska metoder, med betoning på vikten av identifiering av CCM i klinisk praxis . Det finns dock fortfarande ett gap av kunskap om hantering av detta tillstånd . Förekomsten av myokardiell dysfunktion vid cirros ökar risken för hepatorrenalt syndrom (HRS) och negativa hjärthändelser och det är relaterat till högre dödlighet .
vi granskade den tillgängliga litteraturen i PubMed angående markörerna för cirroskomplikationer och interaktioner mellan hjärta och lever. Syftet med denna översyn är att diskutera behovet av att tidigt spåra och behandla CCM, eftersom det kan vara en utlösande faktor för cirroskomplikationer, vilket ger nya insikter i klinisk praxis.
Definition och prevalens
CCM beskriver hjärt kronisk dysfunktion hos cirrotiska patienter trots ingen tidigare strukturell hjärtsjukdom . Det definieras av ett eller flera av följande: strukturella abnormiteter i hjärtkamrar; diastolisk dysfunktion; normal eller förstärkt systolisk funktion i vila men dåligt kontraktilt svar på stress; och elektrofysiologiska förändringar . Dessa avvikelser kan observeras hos upp till 50% av cirrotiska patienter .
Fysiopatologi
cirros fysiopatologi är känd genom överproduktion av kväveoxid (NO) i splanchniska kärl och därmed systemisk vasodilatation. Denna mekanism utlöser rennin-angiotensin-aldosteronsystemet (RAAS) och sympatiskt nervsystemaktivering och stiger vasopressinnivån i serum, vilket leder till ett hyperdinamiskt tillstånd som kan påverka från cellulär till klinisk miljö.
dessa patienter har en ökad serumkolmonoxid (CO) sekundär till sympatisk hyperaktivitet och inflammatoriska cytokiner. Det finns en ökning av CO, associerad med höga no-nivåer, ackumulering av endokannabinoider och andra vasodilatatorer. Dessa substanser ökar cykliska guanosinmonofosfat (cGMP) leves, som hämmar cykliskt adenosinmonofosfat (cAMP) i kardiomyociter, som är ansvariga för kalciuminflöde och större kontraktil kraft (figur 1,2) . Myokardcellsanalys visar en minskning av plasmatisk membranfluiditet på grund av kolesterolavsättning, vilket försvårar interaktionen mellan substanser såsom beta-adrenerga receptorer och G-proteiner . Den ventrikulära myociten kan också ha en minskning av kaliumkanalfunktionen, vilket leder till en suboptimal hjärtavslappning och därmed diastolisk dysfunktion .
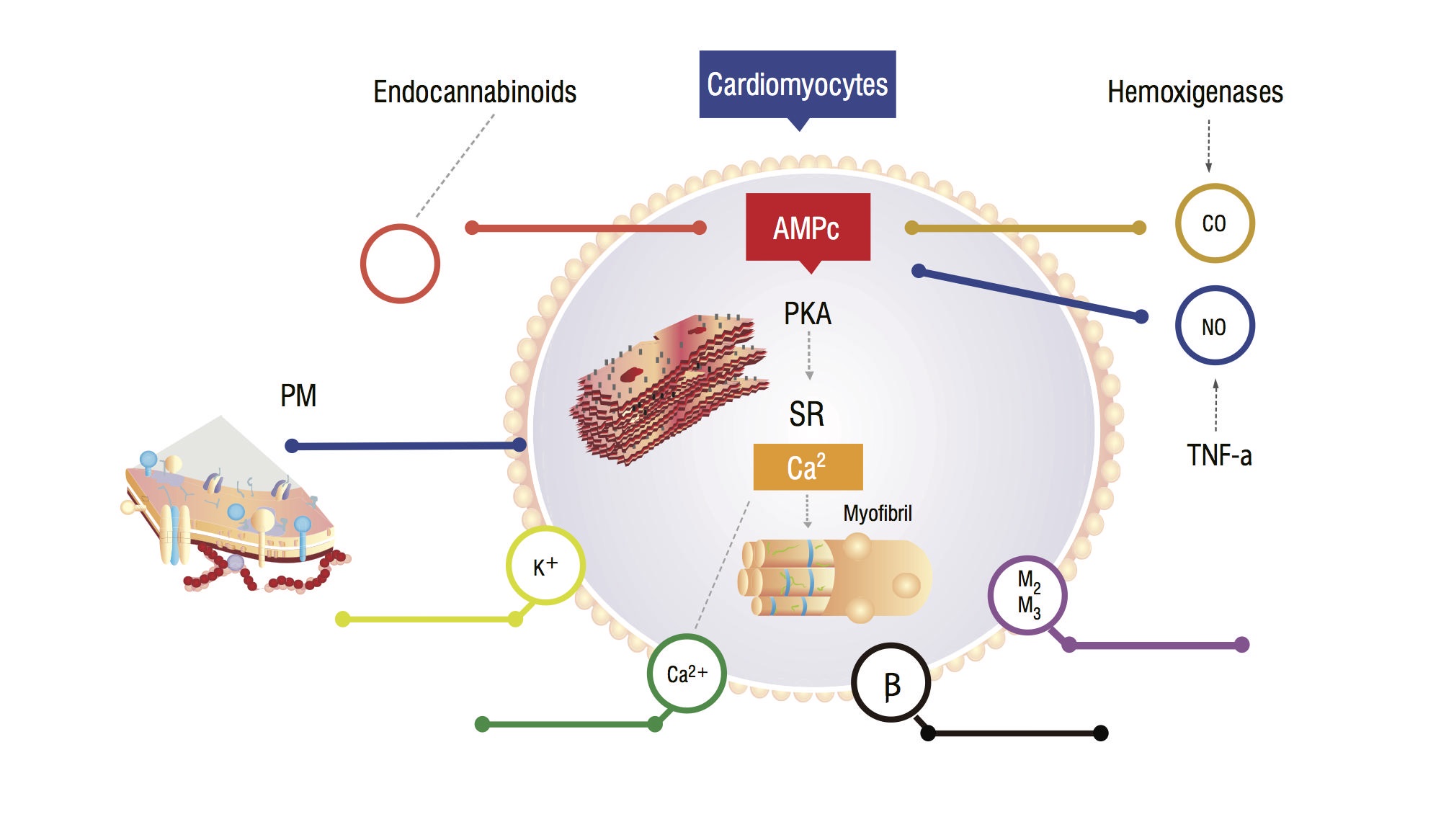
Figur 1. Fysiopatologisk modell av kardiomyocyt som visar huvudsignalvägar som leder till ett blundat myokardiellt svar på stress. PM: Plasmatiskt membran; CO: koloxid; NO: kväveoxid; TNF-a: tumörnekrosfaktor alfa; SR: Sarkoplasmatisk reticullum; AMPc: cykliskt adenosinmonofosfat; PKA: proteinkinas A.
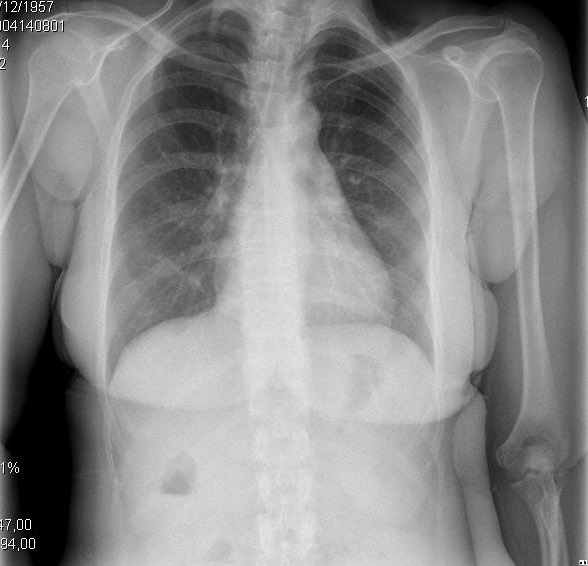
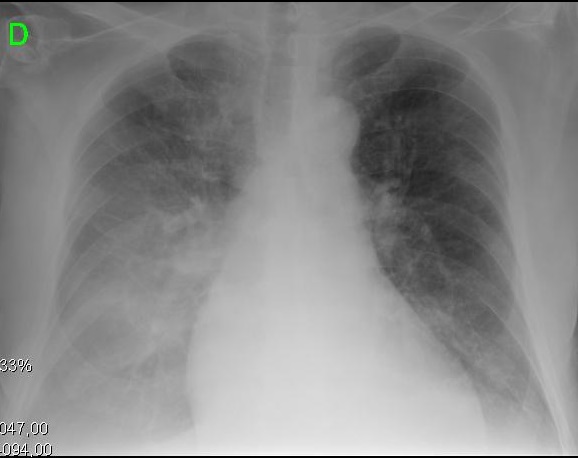
Figur 2. Kliniska och radiologiska presentationer av olika evolutionära stadier av cirrotisk kardiomyopati. A. vänster bild visar liten pleural effusion och CTI på 0,50. B. höger bild visar en allvarlig lungstockning och CTI på 0,67.
Tabell 1. Kliniska och kompletterande kriterier för diagnos av CCM. Anpassad från från referens 29 med tillstånd.
de ihållande beta-adrenerga stimuli inducerar nedreglering och minskar hjärtreceptortätheten och modifierar signalkaskader som är ansvariga för kalciumkanalaktivering ; resultatet är en nedsatt kontraktil funktion . Klinisk återverkan av denna väg är en trubbig myokardfunktion och en ökning av hjärtbiomarkörer .
identifiering av CCM bygger på subtila kliniska egenskaper som kan avslöjas när sjukdomen fortskrider eller kan bli tydligt tydliga i specifika kliniska scenarier av stam och blir en utmaning när det gäller huruvida och när man ska behandla.
naturhistoria och diagnos
diagnostiska kriterier sammanfattas i tabell 1 och förlitar sig på kliniska, bild-och biomarkörer.
kliniska egenskaper
kliniska egenskaper hos CCM kan förekomma hos patienter med en uppenbarligen normal hjärtfunktion, eftersom kronisk anpassning av kardiomyocyten till den cirrotiska miljön leder till alla dessa cellulära modifieringar .
cirrotiska patienter utvecklas med natrium-och vätskeretention, perifer vasodilatation, sympatisk hyperaktivitet och ackumulering av ”miokardiotoxiska” substanser , vilket kräver en adaptiv process av kardiomyocyt. Denna kontinuumbalans kan brytas och avslöja ett latent hjärtsvikt i stresssituationer, såsom levertransplantation, transjugulär intrahepatisk portosystemisk shunt eller infektioner .
även om cirrotisk kardiomyopati tenderar att vara ett kroniskt tillstånd, visar studier att kliniska tecken på myokardiell dysfunktion kan vända om upp till 15 månader efter framgångsrik levertransplantation, liksom QT-förlängningen .
laboratoriefynd
eftersom hjärtdysfunktion kan återspeglas av inflammatoriska biomarkörer studeras nya hjärt-och proinflammatoriska markörer nyligen och korreleras med utvecklingen av komplikationer som leder till ökad dödlighet .
nya studier beskriver korrelation mellan nivåer av prohormon av ANP (proANP) och B-typ natriuretisk peptid (BNP), copeptin och högkänslig troponin T (hs-TnT), såväl som löslig urokinas-typ plasminogenaktivatorreceptor (suPAR) och högkänsligt C-reaktivt protein (hs-CRP) och kardiovaskulära komplikationer vid cirros. Men dess kliniska användning utvärderas fortfarande .
natriuretisk peptid utsöndras av kardiomyocyterna som svar på volym-eller trycköverbelastning, eller myokardiell ischemi, för att kompensera RAAS-effekt i natrium-och vattenbalans . BNP kan vara en av de mest tillgängliga biomarkörerna som möjliggör ett tidigt erkännande av hjärtinvolvering . Det är serumkoncentrationen är högre desto svårare lever-och hjärtsjukdomar .
lovande studier säger att höga nivåer av adrenomedullin också ses i cirros med eller utan klinisk hjärtinvolvering; detta ämne frigörs i blodflödet för att fungera som en vasodilator och syftar till att minska efterbelastningen . Galektin-3, den senaste studerade biomarkören förhöjd hos cirrotiska patienter, har associerats med myokardiell fibros och kan korrelera med svårighetsgrad av cirros. Denna markör visar sig vara känsligare än BNP i utvärderingen av diastolisk dysfunktion, men är mindre specifik .
elektrokardiogram
elektrokardiografiska (EKG) avvikelser kan märkas tidigt hos en asymptomatisk CCM-patient och kan korrelera med ventrikulära arytmier och plötslig död . Det vanligaste EKG-fyndet är Qt-intervallförlängning, vilket kan observeras hos cirka 30-40% av cirrotiska patienter, främst Child-Pugh B eller C, oavsett cirros etiologi .
detta EKG-mönster kan vara sekundärt till kardiomyocyter repolariseringsavvikelser i kaliumkanaler och minskning av koncentrationen av dessa kanaler i plasmamembranet, som svar på mindre modifieringar av portaltrycket . Joniska kanaler dysfunktioner orsakar därmed myokardceller aktionspotential förlängning, vilket resulterar i längre ventrikulär systole och QT . Längre sammandragningstid innebär nedsatt avslappning, vilket orsakar diastolisk dysfunktion .
elektromekanisk frikoppling beskrivs som en dyssynkroni mellan elektrisk stimulans och systoliskt mekaniskt svar i hjärtat, som tar till progressiv förlust av hjärtfunktion och hjärtsvikt hos dessa patienter1 . Den kronotropa inkompetensen kännetecknas av sinusnodens oförmåga att svara på fysiologiska eller farmakologiska stimuli , ett avgörande faktum i CCM-fysiopatologi. Dessa förändringar är också sekundära till portalhypertension, autonom dysfunktion, hyperdynamisk cirkulation och närvaron av de proinflammatoriska faktorerna som påverkar patientens myokardium .
ekokardiogram
ekokardiogram ger relevanta data om hjärtfunktionen och används som diagnostiska kriterier för cirrotisk kardiomyopati .
de viktigaste resultaten hos dessa patienter är slutdiastolisk vänster ventrikel (lv) utvidgning, minskning av topphastighet och systolisk deformitet; ökat slutdiastoliskt vänster ventrikulärt tryck, utan lämplig LVEF-expansion. Vänster atrium (LA) utvidgning för mer än 34 mL/m2kan föreslå kronisk diastolisk dysfunktion och, när den är associerad med minskning av LV-massa, kan föreslå sämre prognos . LA utvärdering kan göras genom två dimension ekokardiografi och fläckspårning .
vanliga fynd som observerats i hjärtdoppler-ekokardiografi indikerar myokardiell avslappning nedsatt hos cirrotiska patienter: minskning av e / a-förhållandet (<1) och förlängd e-våg retardationstid (DT) och isovolumetrisk avslappningstid (IVRT) > 80 ms .Ju svårare är den diastoliska dysfunktionen, kortare är IVRT och mitral DT, och högre är e/a-hastighetsförhållandet, som karakteriserar avancerad diastolisk dysfunktion, ökat LA-tryck och sämre funktionsklass.
nya studier med global longitudinell stam (GLS) utvärdering visar att detta kan vara en användbar metod för tidig upptäckt av hjärtdysfunktion hos den cirrotiska patienten, främst systolisk dysfunktion i vila .
e/a-förhållande kan vara en tillförlitlig parameter vid diagnos av diastolisk dysfunktion hos cirrotiska patienter, även med värden som påverkas av patientens hydratiseringsgrad, även om det kan variera på grund av ascites och en volymöverbelastning . Samtidigt representerar den isovolumetriska avslappningstiden, även om den är mycket känslig, inte LV-fyllningen och varierar när hjärtfrekvensen förändras .
en mild systolisk dysfunktion och en diastolisk dysfunktion kan presenteras oberoende av graden av cirros. Den diastoliska dysfunktionen finns emellertid oftast hos cirrotiska patienter och föregår i allmänhet den förra .
diskussion
denna översyn behandlar en ökande identifiering och förståelse för fysiopatologi på CCM, det är korrelation med dålig prognos hos cirrotiska patienter och uppstår oro för terapeutisk metod.
denna artikel sammanfattade de diagnostiska kriterierna (Tabell 1) som redan fastställts i den medicinska litteraturen, med tonvikt på de nya biomarkörer som har studerats för diagnostisk komplettering. Studier har visat att myokardiell dysfunktion existerar i olika stadier av levercirros. Det har beskrivits att om patienten har hög BNP och ventrikulär dysfunktion på ekkokardiogrammet är behandling av njursvikt mycket svårt; å andra sidan är tidigt ingripande hos patienter som ännu inte har etablerat hjärtsjukdom ett område som ännu inte har undersökts.
Tabell 1. Kliniska och kompletterande kriterier för diagnos av CCM. Anpassad från från referens 29 med tillstånd.
kliniska egenskaper
inga kardiopulmonala symtom i vila
låg funktionell hjärtreserv
Hyperadrenergt tillstånd med natrium-och vätskeretention
biomarkörer (troponin i, pro-BNP och BNP, andra)
Eletrokardiografi
elektrofysiologiska avvikelser (QT-förlängning och andra)
ekokardiografiska kriterier
diastolisk utvärdering
e / a-förhållande <1.0 (ålder korrigerad)
förlängd isovolumisk avslappningstid (>80msec)
förlängd retardationstid (> 200msec)
vänster ventrikulär hypertrofi
systolisk utvärdering
ejektionsfraktion i vila < 55%
kontraktil underskott i stress
tecknen och symtomen på leversvikt tenderar att vara sena, med subtila kliniska och laboratoriemanifestationer, ibland svåra att tolka. Specialisten, eller till och med allmänläkaren, kan möta en patient med dyspneaklagomål, utan patologisk jugulär svullnad, normala initiala kardiologiska undersökningar, men med hög BNP, vilket kan representera ett fall av CCM.
till skillnad från andra studier föreslår vår grupp ett framsteg inom detta område, eftersom förståelsen av hjärtsjukdomar i samband med cirros kan möjliggöra ett tidigt terapeutiskt ingripande av komplikationer som kan hänföras till odiagnostiserat myokardfel. Levertransplantation och TIPS är speciella kliniska inställningar som kan deflagrate hjärtsvikt hos dessa patienter. Eftersom patienter överlever längre efter dessa procedurer skulle kliniker ställas inför försämrade hjärtparametrar .
vi tror att tidig terapeutisk intervention i CCM är lovande, när det manifesteras av komplikationer som eldfasta timmar, innan de uppvisar tydlig lungstockning som kan hänföras till hjärtinfarkt. Litteratur stöder att situationer med fysisk eller farmakologisk stress eller infektioner som är associerade med latent cirrotisk kardiomyopati kan resultera i timmar, som kan vara eldfasta mot konventionella behandlingar och associerade med sämre prognos om systolisk dysfunktion är närvarande .
vår erfarenhet tyder på att presentation av HRS är en ledtråd för att initiera behandlingen av myokardialkomponenten. Denna progression till HRS förstås eftersom förekomsten av CCM är en utlösande och bestående faktor för HRS, så om CCM närmar sig tidigt i detta sammanhang kan HRS ha en bättre prognos .
vår grupp har banat väg för behandling av patienter med en klinisk diagnos av CCM i progression till SHR refraktär mot konventionella behandlingar, där användningen av dobutamin som en räddningsterapi för njurfunktionen var framgångsrik. Målet är att tillämpa denna teoretiska kunskap för att förutse denna komplikation hos patienter med leversjukdom i slutstadiet .
trots att det är väl förstått saknas kunskap om en korrekt praktisk tillämpning. En hög grad av klinisk misstanke krävs för att känna igen CCM hos den asymptomatiska patienten utan uppenbara funktionella begränsningar, men med subklinisk cellulär och strukturell hjärtsjukdom.
studier behövs för att identifiera potentiella behandlingar som förändrar den naturliga historien om hjärtsjukdom hos cirrotiska patienter, särskilt i de faser där patienterna är asymptomatiska. Detta representerar ett kunskapsområde som ännu inte har utforskats, särskilt när det gäller framtida terapeutiska alternativ.
intressekonflikter
författarna förklarade att det inte finns några intressekonflikter när det gäller publiceringen av detta dokument.
ekonomiskt stöd
ingen.
- Sampaio F, Pimenta J (2016) bedömning av vänster ventrikulär funktion i cirros: nuvarande metoder och framtida riktningar. Värld J Gastroenterol 22: 112-125.
- Shin WJ, sång JG, juni IG, månen YJ, Kwon HM, et al. (2016) effekt av ventrikulo-arteriell koppling på transplantationsresultat i cirrotika: analys av tryck-volymkurvrelationer. J Hepatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) diastolisk dysfunktion i levercirros: prognostisk prediktor vid levertransplantation? Transplantation Proc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) överlevnad vid 2 år bland levercirrotiska patienter påverkas av vänster förmaksvolym och vänster ventrikulär massa. Lever Int.
- m Obbller S, Henriksen JH (2002) cirrotisk kardiomyopati: en patofysiologisk granskning av cirkulationsdysfunktion vid leversjukdom. Hjärta 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) cirrotisk kardiomyopati: ett annat fall av ett framgångsrikt tillvägagångssätt för behandling av Hepatorenalt syndrom. Fall Rep Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) ett perspektiv på cirrotisk kardiomyopati. Transplantation Proc 43: 1649-1653.
- Ma Z, Lee SS (1996) cirrotisk kardiomyopati: att komma till hjärtat av saken. Hepatologi 24: 451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, et al. (2010) cirrotisk kardiomyopati. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) cirrotisk kardiomyopati och levertransplantation. Lever Transpl 6: S44-52.
- Wiese S, Mortensen C, G. O., Christensen E, Andersen O, et al. (2014) Hjärt-och proinflammatoriska markörer förutsäger prognos vid cirros. Lever Int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) utvärdering av hjärtfunktioner hos cirrotiska barn som använder serumhjärnnatriuretisk peptid och vävnadsdoppleravbildning. Ann Pediatric Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) cirrotisk kardiomyopati?: Konsekvenser för perioperativ hantering av levertransplanterade patienter 7: 507-20.
- Farr M, Schulze PC (2015) senaste framsteg inom diagnos och hantering av Cirrhosassocierad kardiomyopati i Levertransplantationskandidater: avancerad Eko-Avbildning, Hjärtbiomarkörer och avancerad hjärtsvikt Therapie. Clin Med Insikter Cardiol 8: 67-74.
- Licata A, Corrao S, Petta S, Genco C, Cardillo M, et al. (2013) nt pro BNP plasmanivå och förmaksvolym är kopplade till svårighetsgraden av levercirros. PLoS En 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactin – 3 och hjärnnatriuretisk peptid kontra konventionell ekokardiografi vid tidig upptäckt av cirrotisk kardiomyopati. Turk J Gastroenterol 27: 367-74.
- Wong F, Siu S, Liu P, Blendis LM (2001) hjärnnatriuretisk peptid: är det en prediktor för kardiomyopati vid cirros? Clin Sci (Lond) 101: 621-628.
- Wong F (2009) cirrotisk kardiomyopati. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, et al. (2003) förlängning av QTc-intervallet hos patienter med cirros. Ann Gastroenterol 16: 155-8.
- Mozos i (2015) Arytmirisk vid levercirros. Värld J Hepatol 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) cirrotisk kardiomyopati: ett annat fall av ett framgångsrikt tillvägagångssätt för behandling av Hepatorenalt syndrom. Fall Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) QT dispersion: mätning och tolkning.
- P A, Czifra A, Vit A, papp M, Paragh G, et al. (2014) patofysiologisk och klinisk inställning till cirrotisk kardiomyopati. J Gastrointestinal Lever Dis 23: 301-310.
- Castro Hevia J, Antzelevitch C, sönderrivna C, Doris B, Doris s, Doris m, Doris Balea F, et al. (2006) tpeak-Tend och Tpeak-Tend dispersion som riskfaktorer för ventrikulär takykardi/ventrikelflimmer hos patienter med Brugadas syndrom. J Am Coll Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) utvärdering av tp-e-intervall och tp-e/QT-förhållande hos patienter med kronisk hepatit B. Prag med Rep 114: 239-245.
- Jewell DP (2006) nya patienter, nya lektioner, nytt tänkande i inflammatorisk tarmsjukdom: World Congress of Gastroenterology Symposium, Montreal, Kanada. Kolorektal Dis 8 Suppl 1 (s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) cirrotisk kardiomyopati: en kardiologs perspektiv. Värld J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) cirrotisk kardiomyopati: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.