med sår av frisk vävnad utvecklas en förutsägbar utveckling av fysiologiska händelser. Denna progression kan delas in i faserna av inflammation, proliferation och mognad. Varje fas kännetecknas av sekventiell utarbetande av distinkta cytokiner av specifika celler. Se bilderna nedan.
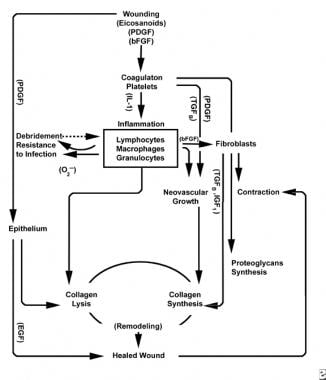 scheman för sårläkningsprocessen.
scheman för sårläkningsprocessen. 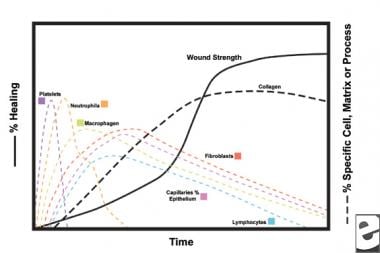 cellulära egenskaper hos sårläkningsprocessen.
cellulära egenskaper hos sårläkningsprocessen. den inflammatoriska fasen
den inflammatoriska fasen lanserar samtidigt hemostatiska mekanismer och vägar som skapar de kliniskt igenkännliga kardinaltecknen på inflammation: rubor (rodnad), calor (värme), tumör (svullnad), dolor (smärta) och functio laesa (funktionsförlust).
skada på vaskulär vävnad initierar den yttre koagulationskaskaden genom att frigöra intracellulärt kalcium och vävnadsfaktor som aktiverar faktor VII. den resulterande fibrinpluggen uppnår hemostas med hjälp av reflex vasokonstriktion. Denna plugg fungerar som en gitter för aggregering av blodplättar, den vanligaste och ”signatur” celltypen i den tidiga inflammatoriska fasen.
trombocyter utarbetar ett antal proinflammatoriska ämnen, såsom adenosindifosfat, vävnadstillväxtfaktor beta (TGF-XXL) och blodplättderiverade tillväxtfaktorer (PDGF). Dessa tillväxtfaktorer verkar på omgivande celler och stimulerar kemotaxi av neutrofiler, monocyter och fibroblaster till skadeområdet.
skadade vävnader, genom aktiverat fosfolipas A, katalyserar samtidigt arakidonsyror för att producera vasoaktiva prostaglandiner och tromboxan, gemensamt kända som eikosanoider. Eikosanoider förmedlar aktivitet som påverkar trombocytpluggbildning, vaskulär permeabilitet och cellulär kemotaxi för att påverka sårläkning. Till exempel medierar tromboxan A2 vasokonstriktion och trombocytaggregation.
efter initial vasokonstriktion uppträder de klassiska tecknen på inflammation från ökad vaskulär permeabilitet. Rubor är resultatet av vasodilation, medierad av prostacyklin (PGI2), prostaglandin A (PGA), prostaglandin D (PGD) och prostaglandin E (PGE). Tumör och Kalor utvecklas när vaskulära endotelgap förstoras, vilket möjliggör utträde av plasmaprotein och vätska i det interstitiella utrymmet. Dessa förändringar förstärks av PGE2 och prostaglandin F2a (PGF2a) och tillåter ingrepp av inflammatoriska celler i skadans område, inklusive celler som utarbetar. Dolor känns som PGI2, PGE och PGE2 verkar på perifera nociceptorer.
i det andra steget i den inflammatoriska fasen ersätter leukocyter blodplättar som den dominerande celltypen, lockad av kemotaxi. Vita blodkroppar (WBC) är de dominerande cellerna under de första 3 dagarna efter sår; deras antal toppar vid cirka 48 timmar. Polymorfonukleocyter (PMNs) är de första som börjar bakteriedödande aktiviteter med hjälp av inflammatoriska mediatorer och syrefria radikala metaboliter. Normal sårläkning kan dock ske utan PMNs. En annan leukocyt, hjälpar-T-cellen, utarbetar interleukin–2 (IL-2). IL – 2 främjar ytterligare T-cellproliferation för att öka det immunogena svaret på skada.
eftersom PMN-leukocyter börjar avta efter 24-36 timmar, kommer cirkulerande monocyter in i såret och mognar i vävnadsmakrofager. Dessa celler debriderar såret på mikroskopisk nivå och producerar en mängd olika viktiga ämnen, såsom IL-1 och grundläggande fibroblasttillväxtfaktor (bFGF). IL – 1 stimulerar proliferationen av inflammatoriska celler och främjar angiogenes genom endotelcellreplikation. bFGF är en kemotaktisk och mitogen faktor för fibroblaster och endotelceller. Till skillnad från PMNs försämrar makrofagutarmningen allvarligt sårläkning, eftersom debridering, fibroblastproliferation och angiogenes alla minskar.
mot slutet av den inflammatoriska cykeln interagerar den utvecklande miljön av eikosanoider i såret med de närvarande celltyperna, vilket resulterar i fibroblastsyntes av kollagen och marksubstans (från ökat förhållande PGF2a till PGE2). Dessutom är de makrofagavledda tillväxtfaktorerna nu på optimala nivåer, vilket starkt påverkar tillströmningen av fibroblaster och sedan keratinocyter och endotelceller i såret. Eftersom mononukleära celler fortsätter att ersätta WBC och makrofager börjar den proliferativa fasen.
den proliferativa fasen
två till tre dagar efter sår migrerar fibroblaster inåt från sårmarginaler över den fibrinösa matrisen som etablerats under den inflammatoriska fasen. Under den första veckan börjar fibroblaster producera glykosaminoglykaner och proteoglykaner, marksubstansen för granulationsvävnad, såväl som kollagen, som svar på makrofagsyntetiserad bFGF och TGF-GHz, liksom PDGF.
fibroblaster blir snart den dominerande celltypen och toppar vid 1-2 veckor. De genererar inte bara kollagenmolekyler utan även cytokiner såsom PDGF, TGF-bronkiolit , bFGF, keratinocyttillväxtfaktor och insulinliknande tillväxtfaktor-1. Fibroblaster monterar också kollagenmolekyler i fibrer, som är tvärbundna och organiserade i buntar. Kollagen är huvudkomponenten i akut sårbindvävnad, med nettoproduktionen fortsätter de närmaste 6 veckorna. Det ökande innehållet av sårkollagen korrelerar med ökande draghållfasthet.
keratinocyter och endotelceller sprider sig också under denna tid och producerar så småningom autokrina tillväxtfaktorer som upprätthåller deras tillväxt. Endotelutvidgning bidrar till angiogenes, eftersom intakta kärl genererar knoppar i granulationsvävnad. Neovaskularisering underlättar tillväxten av den framåtgående linjen av fibroblaster i såret, vilket ger dem nödvändiga näringsämnen och cytokiner.
nedbrytning av fibrinkoageln och provisorisk matris åtföljs av avsättning av granulationsvävnad (markämne, kollagen, kapillärer), som fortsätter tills såret är täckt. Minskande nivåer av hyaluronsyra (i marksubstans) och ökande kondroitinsulfatnivåer långsam fibroblastmigration och proliferation samtidigt som fibroblastdifferentiering induceras och övergår till mognadsfasen för sårläkning.
mognadsfasen
under de första 6 veckorna dominerar ny kollagenproduktion sårläkningsprocessen, deponerad slumpmässigt i akut sårgranulationsvävnad. När såret mognar ombyggs kollagen till en mer organiserad struktur med ökad draghållfasthet. Gradvis ersätter typ i-kollagen typ III tills det normala hudförhållandet 4: 1 uppnås. När ombyggnaden fortsätter uppnår matrismetalloproteinas-kollagenolys ett steady state med kollagensyntes. Draghållfasthet platåer vid 80% av den ursprungliga styrkan ca 1 år efter skada.
ytligt för denna aktivitet fortsätter epitelceller att migrera inåt från sårkanten tills defekten är täckt. Vid denna tidpunkt inducerar kontaktinhibering transformation av fibroblaster till myofibroblaster, vilka innehåller kontraktila aktinfibrer. Sårkontraktion följer och ersätter skadad vävnadsvolym med ny vävnad, även om den exakta rollen för myofibroblasten inte har klargjorts fullständigt.
avskräckande för sårläkning
akuta sår fortsätter i allmänhet genom en ordnad och snabb reparativ process som resulterar i en varaktig återställande av anatomisk och funktionell integritet. Men olika fysiologiska och mekaniska faktorer kan försämra läkningssvaret, vilket resulterar i ett kroniskt sår som inte går igenom den vanliga stegvisa progressionen. Lokal infektion, hypoxi, trauma, främmande kroppar eller systemiska problem som diabetes mellitus, undernäring, immunbrist eller mediciner är oftast ansvariga.
alla sår är förorenade, men motstår mest framgångsrikt invasiv infektion. När koncentrationen överstiger 100 000 (105) organismer per gram vävnad eller immunsystemet äventyras, uppstår infektion ofta. Cellulit förlänger den inflammatoriska fasen genom att upprätthålla höga nivåer av proinflammatoriska cytokiner och vävnadsproteaser, som försämrar granulationsvävnad och vävnadstillväxtfaktorer och genom att fördröja kollagenavsättning.
debridering (kirurgisk, enzymatisk och/eller genom förbandsbyten) och antibiotika är grundpelarna för antibiotikabehandling. Debridering avlägsnar devitaliserad vävnad, som kan vara en källa till endotoxiner som hämmar fibroblast och keratinocytmigration i såret. Främmande kroppar kan också kräva avlägsnande, eftersom närvaron av en silkesutur minskar antalet bakterier som krävs för att stimulera infektion 10 000 gånger. (För en detaljerad beskrivning av teknik, se Medscape referens artikel sår främmande kropp borttagning.)
Cellhypoxi fördröjer sårläkning på olika sätt. Kollagenfibril tvärbindning kräver syre för att hydroxylat prolin och lysin och misslyckas när vävnadstrycket är under 40 mm Hg. Den baktericida styrkan hos leukocytoxidativ fosforylering lider också i en hypoxisk miljö, vilket minskar tröskeln för infektion. Åtgärder för att förbättra syretillförseln beror på etiologin. Tobaksbruk, som orsakar vasokonstriktion och ökar blodplätthäftningen, bör stoppas. Angioplastik eller arteriell bypass-ympning kan krävas för perifer kärlsjukdom. Kompletterande åtgärder för att förbättra systemisk perfusion vid hjärtsvikt kan indikeras. Hematokritvärde mindre än 15% ska behandlas och euvolemia återställs efter behov. Venös stasis eller lymfatisk insufficiens kan förbättras med kompressionsplagg.
systemisk sjukdom kan dramatiskt förlänga eller avbryta sårläkning. Glykosylering i diabetes mellitus försämrar neutrofil och makrofagfagocytos av bakterier, förlänger inflammatorisk fas. Den proliferativa fasen är också långvarig i samma sjukdom som erytrocyter blir mindre smidiga och mindre kapabla att leverera syre till såret för vävnadsmetabolism och kollagensyntes.
undernäring resulterar i minskad fibroblastproliferation, nedsatt neovaskularisering och minskad cellulär och humoral immunitet. Sår utövar ökade metaboliska krav, särskilt inom granulationsvävnad. Aminosyror som metionin, prolin, glycin och lysin är väsentliga för normal cellfunktion och reparation av kutana sår. Fettsyror är kritiska beståndsdelar i cellmembran och är substratet för eikosanoiderna som förmedlar den inflammatoriska processen. Essentiella fettsyror linolensyra och linolsyra måste levereras i kosten, eftersom människokroppen inte kan de novo syntes av dessa molekyler.
tillräckliga vitaminer och mineraler måste finnas tillgängliga för cellmetabolism, som fungerar som cellulära signaler och kofaktorer. Vitamin C (askorbinsyra) och järn krävs för hydroxylering av lysin och prolin, som tvärbinder och stabiliserar den tredubbla helixstrukturen av kollagen; koppar spelar också en roll för att stabilisera kollagen. Vitamin A (retinsyra) spelar en viktig roll vid modulering av kollagenproduktion och nedbrytning och är särskilt viktigt vid epitelisering. En potent antioxidant, vitamin E (alfa-tokoferol) verkar påskynda hud-och benläkning hos djur, och tillskott kan ha en roll hos människor. Spårmetall, särskilt zink, brist är också förknippad med dålig sårläkning; detta bör fyllas på, efter behov.
Ovid skrev påstås, ” mediciner läker ibland, dödar ibland.”Detta är verkligen sant när det gäller sårläkning. Kortikosteroider trubbar processerna i hela den inflammatoriska fasen. Vitamin A (topiskt eller 25 000 IE/D Oralt) mildrar de skadliga helande effekterna av kortikosteroider, men hepatotoxicitet kan bero på långvarig användning (dvs >1 mo). Nonsteroidala antiinflammatoriska läkemedel (NSAID) stör också arakidonsyrametabolism och därmed sårläkning. Dessutom hämmar NSAID trombocytfunktionen, en av de tidigaste processerna i den inflammatoriska fasen.
en studie av Sutcliffe et al föreslog att uppreglering av gap junction protein connexin är vanligt för kroniska sår. Undersöker connexin i tre typer av sår-venöst ben, diabetisk fot och trycksår—utredarna fann att varje typ av sår visade uppreglering av epidermal connexin 43, connexin 26 och connexin 30, såväl som dermal connexin 43.