Generiskt Namn: Klonidinhydroklorid
doseringsform: tablett
medicinskt granskad av Drugs.com. Senast uppdaterad den 1 juli 2020.
- översikt
- biverkningar
- dosering
- professionell
- Tips
- interaktioner
- mer
- Klonidinhydrokloridtabletter, USP
- klonidin beskrivning
- klonidin-klinisk farmakologi
- farmakokinetik
- indikationer och användning för klonidin
- kontraindikationer
- varningar
- utsättning
- försiktighetsåtgärder
- allmänt
- Perioperativ användning
- Information till patienter
- läkemedelsinteraktioner
- toxikologi
- karcinogenes, mutagenes, nedsatt fertilitet
- graviditet
- ammande mödrar
- pediatrisk användning
- biverkningar
- överdosering
- klonidin dosering och administrering
- hur levereras klonidin
- HUVUDDISPLAYPANEL
- HUVUDDISPLAYPANEL
- PRINCIPAL DISPLAY PANEL
- mer om klonidin
- Konsumentresurser
- professionella resurser
- relaterade Behandlingsguider
Klonidinhydrokloridtabletter, USP
oral antihypertensiv
tabletter om 0, 1 mg, 0, 2 mg och 0.3 mg
endast Rx
förskrivningsinformation
klonidin beskrivning
Klonidinhydroklorid, USP är ett centralt verkande alfa-agonisthypertensivt medel tillgängligt som tabletter för oral administrering i tre dosstyrkor: 0, 1 mg, 0, 2 mg och 0, 3 mg. 0, 1 mg Tabletten motsvarar 0, 087 mg av den fria basen.
de inaktiva ingredienserna är kolloidal kiseldioxid, majsstärkelse, kalciumfosfatdibasisk, hydroxipropylcellulosa, mikrokristallin cellulosa, laktosmonohydrat och magnesiumstearat. Dessutom 0.1 mg tabletter innehåller FD &C röd nr 40, och 0,2 mg och 0,3 mg tabletter innehåller FD&C gul nr 6 som färgtillsatser respektive.
Klonidinhydroklorid är ett imidazolinderivat och finns som en mesomerisk förening. Det kemiska namnet är 2-(2,6-diklorfenylamino) – 2-imidazolinhydroklorid. Följande är strukturformeln:
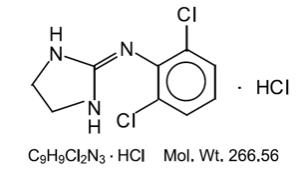
Klonidinhydroklorid är en luktfri, bitter, vit, kristallin substans löslig i vatten och alkohol.
klonidin-klinisk farmakologi
klonidin stimulerar alfa-adrenoreceptorer i hjärnstammen. Denna åtgärd resulterar i minskat sympatiskt utflöde från centrala nervsystemet och i minskningar av perifert motstånd, renal vaskulär resistens, hjärtfrekvens och blodtryck. Klonidinhydrokloridtabletter verkar relativt snabbt. Patientens blodtryck sjunker inom 30 till 60 minuter efter en oral dos, den maximala minskningen sker inom 2 till 4 timmar. Renalt blodflöde och glomerulär filtreringshastighet förblir väsentligen oförändrad. Normala posturala reflexer är intakta; därför är ortostatiska symtom milda och sällsynta.
akuta studier med Klonidinhydroklorid hos människor har visat en måttlig minskning (15% till 20%) av hjärtproduktionen i ryggläge utan förändring i perifert motstånd: vid en 45′ lutning är det en mindre minskning av hjärtproduktionen och en minskning av perifert motstånd. Under långvarig terapi tenderar hjärtproduktionen att återgå till kontrollvärden, medan perifert motstånd förblir minskat. Sänkning av pulsfrekvensen har observerats hos de flesta patienter som fått klonidin, men läkemedlet förändrar inte normalt hemodynamiskt svar på träning.
tolerans mot den antihypertensiva effekten kan utvecklas hos vissa patienter, vilket kräver en omvärdering av behandlingen.
andra studier på patienter har visat en minskning av plasmareninaktiviteten och utsöndringen av aldosteron och katekolaminer. Det exakta förhållandet mellan dessa farmakologiska effekter och den antihypertensiva effekten av klonidin har inte klarlagts fullständigt.
klonidin stimulerar akut tillväxthormonfrisättning hos både barn och vuxna, men producerar inte en kronisk höjning av tillväxthormon vid långvarig användning.
farmakokinetik
farmakokinetiken för klonidin är dosproportionell i intervallet 100 till 600 mcg. Den absoluta biotillgängligheten för klonidin vid oral administrering är 70% till 80%. Maximala Plasmaklonidinnivåer uppnås på cirka 1 till 3 timmar.
efter intravenös administrering visar klonidin bifasisk disposition med en distributionshalveringstid på cirka 20 minuter och en eliminationshalveringstid från 12 till 16 timmar. Halveringstiden ökar upp till 41 timmar hos patienter med svårt nedsatt njurfunktion. Klonidin passerar placentabarriären. Det har visat sig passera blod-hjärnbarriären hos råttor.
efter oral administrering återvinns cirka 40% till 60% av den absorberade dosen i urinen som oförändrat läkemedel på 24 timmar. Cirka 50% av den absorberade dosen metaboliseras i levern. Varken mat eller patientens ras påverkar farmakokinetiken för klonidin.
den antihypertensiva effekten uppnås vid plasmakoncentrationer mellan cirka 0, 2 och 2, 0 ng/mL hos patienter med normal utsöndringsfunktion. En ytterligare ökning av plasmanivåerna ökar inte den antihypertensiva effekten.
indikationer och användning för klonidin
Klonidinhydrokloridtabletter, USP indikeras vid behandling av hypertoni. Klonidinhydrokloridtabletter, USP kan användas ensamt eller samtidigt med andra antihypertensiva medel.
kontraindikationer
Klonidinhydrokloridtabletter ska inte användas till patienter med känd överkänslighet mot klonidin (se försiktighetsåtgärder).
varningar
utsättning
patienter ska instrueras att inte avbryta behandlingen utan att rådfråga sin läkare. Plötsligt upphörande av Klonidinbehandling har i vissa fall resulterat i symtom som nervositet, agitation, huvudvärk och tremor åtföljt eller följt av en snabb ökning av blodtrycket och förhöjda katekolaminkoncentrationer i plasma. Sannolikheten för sådana reaktioner vid avbrytande av Klonidinbehandling verkar vara större efter administrering av högre doser eller fortsatt samtidig behandling med betablockerare och särskild försiktighet rekommenderas därför i dessa situationer. Sällsynta fall av hypertensiv encefalopati, cerebrovaskulära olyckor och dödsfall har rapporterats efter utsättning av klonidin. Vid avbrytande av behandling med klonidin ska läkaren minska dosen gradvis under 2 till 4 dagar för att undvika abstinenssymptom.
en kraftig ökning av blodtrycket efter avbrytande av Klonidinbehandling kan vändas genom administrering av oral Klonidinhydroklorid eller genom intravenös Fentolamin. Om behandlingen ska avbrytas hos patienter som får en betablockerare och klonidin samtidigt, ska betablockeraren avbrytas flera dagar före gradvis avbrytande av klonidin.
eftersom barn ofta har gastrointestinala sjukdomar som leder till kräkningar kan de vara särskilt mottagliga för hypertensiva episoder till följd av plötslig oförmåga att ta medicin.
försiktighetsåtgärder
allmänt
hos patienter som har utvecklat lokal kontaktsensibilisering mot transdermal klonidin kan fortsättning av transdermal klonidin eller substitution av oral Klonidinhydrokloridbehandling associeras med utvecklingen av ett generaliserat hudutslag.
hos patienter som utvecklar en allergisk reaktion mot transdermal klonidin kan substitution av oral Klonidinhydroklorid också framkalla en allergisk reaktion (inklusive generaliserat utslag, urtikaria eller angioödem.)
den sympatolytiska verkan av klonidin kan förvärra sinusnoddysfunktion och atrioventrikulärt (AV) block, särskilt hos patienter som tar andra sympatolytiska läkemedel. Det finns rapporter efter marknadsföring av patienter med ledningsavvikelser och/eller tar andra sympatolytiska läkemedel som utvecklade svår bradykardi som krävde IV atropin, IV isoproterenol och tillfällig hjärtpacing medan de tog klonidin.
vid hypertoni orsakad av feokromocytom kan ingen terapeutisk effekt av Klonidinhydrokloridtabletter förväntas.
Perioperativ användning
administrering av Klonidinhydrokloridtabletter ska fortsätta inom fyra timmar efter operationen och återupptas så snart som möjligt därefter. Blodtrycket bör övervakas noggrant under operationen och ytterligare åtgärder för att kontrollera blodtrycket bör finnas tillgängliga vid behov.
Information till patienter
patienter ska varnas för att behandlingen med Klonidinhydroklorid avbryts utan läkares råd.
eftersom patienter kan uppleva en möjlig lugnande effekt, yrsel eller boendestörning med användning av klonidin, var försiktig patienter om att delta i aktiviteter som att köra fordon eller använda apparater eller maskiner. Informera också patienter om att denna lugnande effekt kan ökas genom samtidig användning av alkohol, barbiturater eller andra lugnande läkemedel.
patienter som bär kontaktlinser bör varnas för att behandling med Klonidinhydrokloridtabletter kan orsaka torra ögon.
läkemedelsinteraktioner
klonidin kan förstärka CNS-depressiva effekter av alkohol, barbiturater eller andra lugnande läkemedel. Om en patient som får Klonidinhydroklorid också tar tricykliska antidepressiva medel kan den hypotensiva effekten av klonidin minskas, vilket kräver en ökning av Klonidindosen. Om en patient som får klonidin också tar neuroleptika kan ortostatiska regleringsstörningar (t.ex. ortostatisk hypotoni, yrsel, trötthet) induceras eller förvärras.
övervaka hjärtfrekvensen hos patienter som får klonidin samtidigt med medel som är kända för att påverka sinusnodfunktionen eller av-nodledning, t.ex. digitalis, kalciumkanalblockerare och betablockerare. Sinusbradykardi som resulterat i sjukhusvistelse och pacemakerinsättning har rapporterats i samband med användning av klonidin samtidigt med diltiazem eller verapamil.
amitriptylin i kombination med klonidin ökar manifestationen av hornhinneskador hos råttor (se toxikologi).
baserat på observationer hos patienter i ett tillstånd av alkoholisk delirium har det föreslagits att höga intravenösa doser av klonidin kan öka den arytmogena potentialen (QT-förlängning, ventrikelflimmer) av höga intravenösa doser av haloperidol. Orsakssamband och relevans för orala tabletter med klonidin har inte fastställts.
toxikologi
i flera studier med oral Klonidinhydroklorid sågs en dosberoende ökning av incidensen och svårighetsgraden av spontan retinal degeneration hos albinoråttor behandlade i sex månader eller längre. Vävnadsdistributionsstudier på hundar och apor visade en koncentration av klonidin i koroid.
med tanke på retinal degeneration hos råttor utfördes ögonundersökningar under kliniska prövningar på 908 patienter före och regelbundet efter starten av Klonidinbehandling. Hos 353 av dessa 908 patienter utfördes ögonundersökningarna under perioder på 24 månader eller längre. Förutom viss torrhet i ögonen registrerades inga läkemedelsrelaterade onormala oftalmologiska fynd och enligt specialiserade tester såsom elektroretinografi och makulär bländning var retinalfunktionen oförändrad.
i kombination med amitriptylin ledde klonidinhydrokloridadministrering till utveckling av hornhinneskador hos råttor inom 5 dagar.
karcinogenes, mutagenes, nedsatt fertilitet
kronisk kostadministrering av klonidin var inte karcinogen till råttor (132 veckor) respektive möss (78 veckor) doserade med upp till 46 eller 70 gånger den maximala rekommenderade dagliga humana dosen som mg/kg (9 eller 6 gånger MRDHD på mg/m2-basis). Det fanns inga tecken på Genotoxicitet i Ames-testet för mutagenicitet eller musmikrokärntest för klastogenicitet.
fertiliteten hos han-eller honråttor påverkades inte av Klonidindoser så höga som 150 mcg/kg (ungefär 3 gånger MRDHD). I ett separat experiment verkade fertiliteten hos honråttor påverkas vid dosnivåer på 500 till 2000 mcg/kg (10 till 40 gånger oral MRDHD på mg/kg basis; 2 till 8 gånger MRDHD på mg/m’ – basis.)
graviditet
teratogena effekter: graviditetskategori C. reproduktionsstudier utförda på kaniner i doser upp till cirka 3 gånger den orala maximala rekommenderade dagliga humana dosen (MRDHD) av Klonidinhydrokloridtabletter gav inga tecken på teratogen eller embryotoxisk potential hos kaniner. Hos råttor associerades dock doser så låga som 1/3 den orala MRDHD (1/15 MRDHD på mg/m2-basis) av klonidin med ökade resorptioner i en studie där dammar behandlades kontinuerligt från 2 månader före parning. Ökade resorptioner var inte associerade med behandling samtidigt eller vid högre dosnivåer (upp till 3 gånger oral MRDHD) när dammarna behandlades på dräktighetsdagarna 6 till 15. Ökningar i resorption observerades vid mycket högre dosnivåer (40 gånger den orala MRDHD på mg / kg-basis; 4 till 8 gånger MRDHD på mg / m2-basis) hos möss och råttor behandlade på dräktighetsdagarna 1 till 14 (lägsta dos som användes i studien var 500 mcg/kg).
inga adekvata, välkontrollerade studier har utförts på gravida kvinnor. Klonidin passerar placentabarriären (se klinisk farmakologi,, farmakokinetik). Eftersom djurreproduktionsstudier inte alltid är prediktiva för mänskligt svar, bör detta läkemedel endast användas under graviditet om det är klart nödvändigt.
ammande mödrar
eftersom Klonidinhydroklorid utsöndras i bröstmjölk bör försiktighet iakttas när Klonidinhydrokloridtabletter administreras till en ammande kvinna.
pediatrisk användning
säkerhet och effektivitet hos pediatriska patienter har inte fastställts i adekvata och välkontrollerade studier (se varningar, uttag).
biverkningar
de flesta biverkningar är milda och tenderar att minska vid fortsatt behandling. De vanligaste (som verkar vara dosrelaterade) är muntorrhet, som förekommer hos cirka 40 av 100 patienter; dåsighet, cirka 33 av 100; yrsel, cirka 16 av 100; förstoppning och sedering, vardera cirka 10 av 100.
följande mindre frekventa biverkningar har också rapporterats hos patienter som fick Klonidinhydrokloridtabletter, men i många fall fick patienter samtidig medicinering och ett orsakssamband har inte fastställts.
kroppen som helhet: trötthet, feber, huvudvärk, blekhet, svaghet och abstinenssyndrom. Också rapporterade var ett svagt positivt Coombs test och ökad känslighet för alkohol.
kardiovaskulär: Bradykardi, hjärtsvikt, elektrokardiografiska avvikelser (dvs sinusnodstopp, korsningsbradykardi, hög grad AV-block och arytmier), ortostatiska symtom, hjärtklappning, Raynauds fenomen, synkope och takykardi.
fall av sinusbradykardi och atrioventrikulärt block har rapporterats, både med och utan användning av samtidig digitalis.
Centrala Nervsystemet: Agitation, ångest, delirium, illusionsuppfattning, hallucinationer (inklusive visuell och auditiv), sömnlöshet, mental depression, nervositet, andra beteendeförändringar, parestesi, rastlöshet, sömnstörning och livliga drömmar eller mardrömmar.
dermatologisk: alopeci, angioneurotiskt ödem, nässelfeber, klåda, utslag och urtikaria.
Gastrointestinal: buksmärta, anorexi, förstoppning, hepatit, sjukdomskänsla, milda övergående avvikelser i leverfunktionstester, illamående, påssjuka, pseudoobstruktion (inklusive kolon pseudoobstruktion), spottkörtelsmärta och kräkningar.
Genitourinary: minskad sexuell aktivitet, svårighet att micturition, erektil dysfunktion, förlust av libido, nocturia och urinretention.
Hematologisk: Trombocytopeni.
metabolisk: gynekomasti, övergående höjning av blodglukos eller serumkreatinfosfokinas och viktökning.
muskuloskeletala: benkramper och muskel-eller ledvärk.
Oro-otolaryngal: torrhet i nässlemhinnan.
oftalmologisk: Boendestörning, suddig syn, ögonförbränning, minskad lakrimation och torrhet i ögonen.
överdosering
hypertoni kan utvecklas tidigt och kan följas av hypotoni, bradykardi, andningsdepression, hypotermi, dåsighet, minskade eller frånvarande reflexer, svaghet, irritabilitet och Mios. Frekvensen av CNS-depression kan vara högre hos barn än vuxna. Stora överdoser kan leda till reversibla hjärtledningsdefekter eller dysrytmier, apnea, koma och kramper. Tecken och symtom på överdosering uppträder vanligtvis inom 30 minuter till två timmar efter exponering. Så lite som 0,1 mg klonidin har producerat tecken på toxicitet hos barn.
det finns ingen specifik antidot för överdosering av klonidin. Överdosering av klonidin kan leda till snabb utveckling av CNS-depression; därför rekommenderas inte induktion av kräkningar med ipecac-sirap. Magsköljning kan indikeras efter nyligen och / eller stora intag. Administrering av aktivt kol och / eller katartiskt kan vara fördelaktigt. Stödjande vård kan innefatta atropinsulfat för bradykardi, intravenösa vätskor och/eller vasopressormedel för hypotoni och vasodilatatorer för högt blodtryck. Naloxon kan vara ett användbart komplement för hantering av Klonidininducerad andningsdepression, hypotoni och/eller koma; blodtrycket bör övervakas eftersom administrering av naloxon ibland har resulterat i paradoxal hypertoni. Administrering av tolazolin har gett inkonsekventa resultat och rekommenderas inte som förstahandsbehandling. Dialys ökar sannolikt inte signifikant elimineringen av klonidin.
den största överdosen som hittills rapporterats involverade en 28-årig man som intog 100 mg Klonidinhydrokloridpulver. Denna patient utvecklade hypertoni följt av hypotoni, bradykardi, apnea, hallucinationer, semikom och för tidiga ventrikulära sammandragningar. Patienten återhämtade sig helt efter intensiv behandling. Plasmaklonidinnivåerna var 60 ng/mL efter 1 timme, 190 ng/mL efter 1, 5 timmar, 370 ng/mL efter 2 timmar och 120 ng / mL efter 5, 5 och 6, 5 timmar. Hos möss och råttor är den orala LD50 av klonidin 206 respektive 465 mg/kg.
klonidin dosering och administrering
vuxna
dosen av Klonidinhydrokloridtabletter måste justeras enligt patientens individuella blodtryckssvar. Följande är en allmän guide till administrationen.
Initial dos
0, 1 mg tablett två gånger dagligen (morgon och läggdags). Äldre patienter kan dra nytta av en lägre initialdos.
underhållsdos
ytterligare steg om 0, 1 mg per dag kan göras varje vecka om det behövs tills önskat svar uppnås. Att ta den större delen av den orala dagliga dosen vid sänggåendet kan minimera övergående justeringseffekter av muntorrhet och dåsighet. De terapeutiska doserna som oftast används har varierat från 0,2 mg till 0,6 mg per dag givet i uppdelade doser.
studier har visat att 2, 4 mg är den maximala effektiva dagliga dosen, men doser så höga som detta har sällan använts.
nedsatt njurfunktion
patienter med nedsatt njurfunktion kan dra nytta av en lägre initialdos. Patienterna ska övervakas noggrant. Eftersom endast en minimal mängd klonidin avlägsnas under rutinmässig hemodialys, finns det inget behov av att ge kompletterande klonidin efter dialys.
hur levereras klonidin
Klonidinhydrokloridtabletter, USP levereras enligt följande:
0,1 mg: En rosa tablett, i form av ” ”.
”.
NDC 58657-647-01 (flaska 100)
NDC 58657-647-50 (flaska 500)
NDC 58657-647-10 (flaska 1000)
0,2 mg: en orange tablett, i form av ”  ”.
”.
NDC 58657-648-01 (flaska 100)
NDC 58657-648-50 (flaska 500)
NDC 58657-648-10 (flaska 1000)
0,3 mg: en ljusorange tablett, i form av ”  ”.
”.
NDC 58657-649-01 (Flaska 100)
NDC 58657-649-50 (Flaska 500)
NDC 58657-649-10 (Flaska 1000)
Butiken vid 25°C (77°F); utflykter tillåtet att 15°C-30°C (59°F-86°F) . Dispensera i tät, ljusbeständig Behållare.
Tillverkad av:
Yung Shin Pharmaceutical Ind. Co., Ltd.
Tachia, Taichung 43769
TAIWAN
distribueras av:
metod läkemedel, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
för att rapportera biverkningar, Ring Method Pharmaceuticals på 1-877-250-3427
Reviderad: 06/20
HUVUDDISPLAYPANEL
NDC 58657-647-10
klonidin
hydroklorid
tabletter, USP
0,1 mg
endast RX
1000 tabletter

HUVUDDISPLAYPANEL
NDC 58657-648-10
klonidin
hydroklorid
tabletter, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Klonidinhydroklorid Klonidinhydroklorid tablett |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Klonidinhydroklorid Klonidinhydroklorid tablett |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-metod Pharmaceuticals, LLC (060216698)
mer om klonidin
- biverkningar
- under graviditet eller amning
- doseringsinformation
- Patienttips
- Läkemedelsbilder
- läkemedelsinteraktioner
- jämför alternativ
- supportgrupp
- prissättning & kuponger
- 619 recensioner
- läkemedelsklass: antiadrenerga medel, centralt verkande
- FDA-varningar (1)
Konsumentresurser
- patientinformation
- … +5 mer
professionella resurser
- förskrivningsinformation
- klonidin (professionell patientrådgivning)
- klonidin Extended Release Tablets (FDA)
- klonidin injektion (FDA)
- klonidin Patch (FDA)
- klonidin tabletter (FDA)
andra märken Catapres, kapvay, Catapres-TTS, Duraclon, Nexiclon XR
relaterade Behandlingsguider
- ångest
- ADHD
- alkoholabstinens
- förmaksflimmer
- … + 19 fler
Medicinsk ansvarsfriskrivning