introduktion
Healthcare-associated infections (hais) som bakteremi orsakad av multidrugsresistenta Pseudomonas aeruginosa-stammar resulterar i ökad sjuklighet och dödlighet, förlänger sjukhusvistelsen och högre kostnader jämfört med de infektioner orsakade av mottagliga stammar.1-3 infektioner orsakade av dessa resistenta mikroorganismer är ofta förknippade med ålder, cancer, hjärtsjukdomar, diabetes, intensiv användning av antibiotika och invasiva procedurer såsom hemodialys, mekanisk ventilationskateter, trakeostomi och andra.4
den ökande förekomsten av multiresistent P. aeruginosa som orsak till nosokomial infektion är ett globalt problem, en följd av denna mikroorganisms förmåga att utveckla resistens mot nästan alla andra antimikrobiella medel under antimikrobiell kemoterapi, antingen genom val av mutationer i kromosomala gener eller genom horisontell genöverföring.5,6 i Brasilien är detta problem ännu mer signifikant, eftersom det finns en mycket hög densitet av antibiotikaanvändning, särskilt XXL-laktamer, karbapenemer och fluorokinoloner.7,8 motståndet i P. aeruginosa till karbapenemer är upp till 60% på vissa brasilianska sjukhus9,10 och sker huvudsakligen genom produktion av metallo-Bisexuell-laktamaser (MBL).
tio underklasser av MBL-enzymerna är kända: IMP (Imipenemase), vim (Verona Imipenemase), SPM-1 (s Jacobo Paulo MBL), GIM (tysk Imipenemase), SIM-1 (Seul Imipenemase),11 AIM-1 (Australisk Imipenemase),12 KHM (Kyorin University Hospital),13 NDM-1 (New Delhi MBL),14 DIM-1 (Nederländska imipenemase),15 och TMB (Tripoli MBL).16 i Brasilien är de vanligaste underklasserna IMP-1 och SPM-1.11
flera andra virulensgener såväl som biofilmbildning kan bidra till patogeniciteten hos allvarliga infektioner, särskilt inklusive de som är förknippade med invasiva procedurer.17 bland de viktigaste virulensfaktorerna som beskrivs i litteraturen lyfter vi fram de som är relaterade till vidhäftning av mikroorganismer till värdceller genom flagella, fimbriae och alginat18 och de som underlättar störningen av epitelintegritet och stör immunsystemet, såsom elastas, fosfolipas C och proteas alkaliskt, ytterligare exotoxin a, pyocyanin och pyoverdin.19 biofilmproduktionen är särskilt förknippad med antibiotikas svårighet att tränga in i cellerna, eftersom de utsöndrar en polymermatris bestående av polysackarider, proteiner och DNA.20,21
syftet med denna studie var att identifiera riskfaktorerna associerade med bakteriemi orsakad av karbapenemresistent P. aeruginosa samt produktion av MBL. Dessutom undersökte vi frekvensen av virulensgener och deras förmåga att bilda biofilm.
Material och metoderpatienter och sjukhus
P. aeruginosa-stammar återhämtades från patienter som togs in på Uberlandia Universitetssjukhus (Brasilien), Federal University of Uberl Askorbndia (HC-UFU) och erhölls från Mikrobiologilaboratoriet i HC-UFU under perioden från maj 2009 till December 2012, med tanke på endast den första infektionsavsnittet.
studiedesign
vi genomförde ett fall (patienter med bakteriemi på grund av P. aeruginosa resistent mot karbapenem) kontra kontroll (patienter med bakteriemi orsakad av P. aeruginosa mottagliga för karbapenem) studie för att identifiera riskfaktorer bland patienter infekterade med P. aeruginosa resistent mot karbapenemer. Dessutom utvärderade vi sekundära resultat, inklusive perioder av sjukhusvistelse, tillträde till intensivvårdsavdelningen (ICU) och användning av invasiva procedurer. Demografiska, kliniska och epidemiologiska egenskaper hos varje patient som ingår i studien återhämtades från de kliniska journalerna.
definitioner
sjukvårdsrelaterade infektioner (hais) definieras som alla infektioner som förvärvats efter en patients tillträde till sjukhuset. HAIs kan manifestera under sjukhusvistelse eller efter urladdning, eftersom de är relaterade till sjukhusvistelse eller procedurer som utförs under sjukhusvistelsen.22 bakteriemi, enligt Centers for Disease Control and Prevention, 23 kan definieras som närvaron av livskraftiga bakterier i blodet dokumenterat av ett positivt blododlingsresultat. Bakteremi klassificerades som primärt när det inte var relaterat till ett annat infektionsfokus eller när det var relaterat till en intravenös kateter och sekundärt när det var kliniskt relaterat till infektion på ett annat anatomiskt ställe.9 multidrugsresistens definieras som förvärvad icke-mottaglighet för minst ett medel i tre eller flera antimikrobiella kategorier.24 Den antimikrobiella behandlingen ansågs olämplig när en isolerad mikroorganism uppvisade in vitro-resistens mot antimikrobiella medel som används för behandling av patienten och/eller brist på behandling under 24 timmar efter diagnos av mikrobiella infektioner.25
klinisk mikrobiologisk och molekylär testning
kulturer samlades in enligt protokollet som användes av Mikrobiologilaboratoriet i HC-UFU och bearbetades med hjälp av det automatiska systemet BACT/Alert 2.6 (biom 2.12, Durham, USA). Identifierings-och antimikrobiella känslighetstester utfördes genom automatisering med VITEK II-systemet och stammarna som visade mellanliggande känslighet ansågs resistenta. Kvalitetskontrollprotokoll användes enligt standarderna för Clinical and Laboratory Standard Institute.26-28 den karbapenemresistenta P. aeruginosa-isolat screenades fenotypiskt för MBL-produktion med dubbelskivssynergitester, som tidigare beskrivits.29,30 dessutom, för att bedöma närvaron av MBL-gener i P. aeruginosa-stammar, utfördes en multiplex PCR, såsom beskrivits tidigare.31 cykelförhållandena var: 94 CCB för 5min, följt av 30 denatureringscykler vid 94 CCB för 30s, glödgning vid 53 CCB för 45s och förlängning vid 72 CCB för 30s, följt av slutlig förlängning vid 72 CCB vid 10min, allt i en MasterCycler personal (Eppendorf). Detektion av virulensgener som kodifierar alkaliskt proteas (aprA), elastas A (lasA), elastas (lasB),32 hemolytiskt fosfolipas C (plcH), icke-hemolytiskt fosfolipas C (plcN), exotoxin A (toxA) och alginat (algD)33 bestämdes med uniplex PCR, med användning av följande protokoll: 94 c-c för 3min, 30 cykler vid 94 c-c för 30s, 55 c-c för 1min och 72 för 1min och 30s och 72 C i 5 minuter.
Initial adhesionsanalys34
för att utvärdera den initiala vidhäftningen tillsattes 200 oc-l av en cellsuspension innehållande 1 oc-107 celler/mL framställd i TSB till 96-brunns polystyrenplattor. Initial vidhäftning tilläts ske under 2 timmar vid 37 2CB C med rotation vid 120 rpm. Bakterier vidhäftade i 96-brunns polystyrenplattor tvättades två gånger med en 0,9% NaCl-lösning och skördades genom att skrapa brunnarna under 90-talet. den erhållna cellsuspensionen pläterades på TSA för kolonibildande enhet (CFU) uppräkning. Alla experiment gjordes i tre exemplar i tre oberoende experiment. Stammen ATCC15692 (PAO1) användes som en positiv kontroll och TSB utan bakterier användes som en negativ kontroll.
biofilmbildningsanalys35
200 oktyl av en cellsuspension innehållande 1 okt 107celler/mL framställd i TSB tillsattes till 96-brunns polystyrenplattor. Biofilmbildning fick ske under 24 timmar vid 37 CCB med rotation vid 120 rpm. Bakterier odlade i 96-brunns polystyrenplattor tvättades två gånger med en 0,9% NaCl-lösning och fick torka i ett inverterat läge. Den totala biomassan mättes med metanol (Merck) fixering, kristallviolett (Merck) färgning och syra ättiksyra (Merck) eluering som tidigare beskrivits. Det eluerade färgämnet avlägsnades från varje brunn och placerades i en ny 96-brunns mikrotiterplatta, och dess absorbans lästes på en ELISA-plattläsare (BioTek Instruments Inc., Vermont, USA) vid 570 nm. Experimenten gjordes med åtta replikat för varje stam i tre oberoende experiment. TSB utan bakterier användes som en negativ kontroll. Det optiska densitetsavstängningsvärdet (ODc) fastställdes som tre standardavvikelser (SD) över medelvärdet av den optiska densiteten (OD) för den negativa kontrollen: ODc=Genomsnittlig od för negativ kontroll+3x SD för negativ kontroll. För enklare tolkning av resultaten delades stammarna in i följande kategorier beroende på optisk densitet: (ODi): ODi Obbi ODc eller ODc
ODi2x ODc=icke-biofilmproducent/svag biofilmproducent; 2x ODcODi4x ODc=måttlig biofilmproducent; 4x ODcODi=stark biofilmproducent.Biofilmcellkoncentration36
biofilmcellkoncentrationen bestämdes genom CFU-uppräkning. Efter biofilmbildning tvättades biofilmerna två gånger med en 0,9% NaCl-lösning och skördades efter skrapning av brunnarna under 90-talet. den erhållna cellsuspensionen pläterades på TSA-plattor. Alla experiment gjordes i tre exemplar, vid tre oberoende tillfällen.
statistisk analys
statistisk analys utfördes med användning av GraphPad Prism V. 5 (GraphPad Software, San Diego, CA). Kvantitativa analyser jämfördes med Kruskal-Wallis och tillämpade Dunns multipla jämförelsetest. Alla tester utfördes med en konfidensnivå på 95% och statistisk signifikans definierades som p
0,05.Etiskt godkännande
forskningsetikutskottet vid Federal University Uberlandia utvärderade och godkände vår studiedesign.
resultat
från 1 maj 2009 till 31 December 2012 utfördes en sjukhusövervakning av förekomsten av P. aeruginosa-bakteriemi i Universitetssjukhusets mikrobiologiska laboratorium. Under denna period inkluderades 157 icke-repetitiva patienter med P. aeruginosa-bakteriemi i studien. Den detaljerade informationen om faktorer som är förknippade med utvecklingen av bakteremi och de kliniska och demografiska egenskaperna samt fördelningen av patienter efter avdelningar visas i tabellerna 1 och 2. Den primära bakteriemin inträffade hos 75,8% och de med okänt fokus stod för 62.4% av fallen. Sekundär bakteriemi stod för 24,2% av patienterna, där luftvägarna var huvudfokus för infektion (17,2%). Dessutom hade 43, 9% av patienterna bakteriemi med karbapenemresistent P. aeruginosa, och de flesta av dessa patienter togs in på ICU. De flesta patienter var män (66,8%), med en genomsnittlig sjukhusvistelse på 63,2 80,17 dagar och en medelålder på 52,01 20,24 år.
Distribution av patienter infekterade med Pseudomonas aeruginosa i olika enheter på det Kliniska sjukhuset vid Federal University of Uberl Ubbigndia från maj/2009 till December/2012.
| kliniker | totalt | Karbapenemresistent Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| kirurgi | 35 (22.3) | 16 (23.2) |
| medicinsk klinik | 24 (15.3) | 10 (14.5) |
| onkologi | 14 (8.9) | 2 (2.9) |
| Akutmottagning | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| Neonatal ICU | 2 (1.3) | 0 |
| pediatrisk ICU | 2 (1.3) | 1 (1.5) |
| transplantation | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
intensivvårdsavdelning.
Burneds, bröstsmärta enhet.
riskfaktorer associerade med karbapenemresistens hos patienter med bakteriemi orsakad av Pseudomonas aeruginosa.
| riskfaktorer | totalt | karbapenemresistent | Multisensitiv | univariat | multivariat | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | eller (CI 95%) | p | |
| ålder-medelvärde (år) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Man / Kvinna | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| tid för sjukhusvistelse, medelvärde (dagar) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| intensivvårdsavdelning | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| kirurgi | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| invasiva förfaranden (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| venös central kateter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| kirurgisk dränering | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| prober enteral / gastrisk näring | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| hemodialys | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Parenteral nutrition | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Komorbiditetsförhållanden | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| hjärtsvikt | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Cancer | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| kroniskt njursvikt | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| humant immunbristvirus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| primär bakteriemi | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| Central linjekateter relaterad | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| okänd | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| sekundär bakteriemi | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| luftvägarna | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| urinvägarna | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| olämplig terapi | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| tidigare användning av antibiotika | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| dödlighet | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitiva stammar betraktades som de som visade känslighet för alla testade antimikrobiella medel.
Odds förhållande.
konfidensintervall.
p värde.
genomsnittlig svårighetsgrad av sjukdom.
statistiskt signifikant (p 0,05 0,05).
tidigare användning av antibiotika (78,3%), invasiva ingrepp (88,5%), komorbiditeter (77,7%) och tidigare operation (43,9%) var vanliga. Det visade sig att 31,2% av patienterna fick otillräcklig behandling och dödsgraden var 58,6%. Flera inneboende och yttre faktorer för utveckling av bakteriemi genom stammar av P. aeruginosa resistent mot karbapenem detekterades genom univariat analys. Emellertid var endast mekanisk ventilation, enterala/nasogastriska rör, primär bakteriemi med okänt fokus och olämplig terapi riskfaktorer oberoende associerade med utvecklingen av karbapenemresistent P. aeruginosa-bakteriemi.
MBL-produktion analyserades för 56 karbapenemresistenta P. aeruginosa-isolat. Nio (25,0%) isolat var fenotypiskt positiva och totalt 16,1% (n= 9/56) överensstämde med amplicons MBL-generna, var 10,71% blaSPM-1 och 5.3% blaVIM-gener i allmänhet visade stammarna en multidrugsresistensprofil. För andra utvärderade virulensgener (aprA, plcH, plcN, lasA, lasB, toxA och algD) visade alla stammar en hög frekvens (88%).
bland de 88 karbapenemkänsliga P. aeruginosa-stammarna var 21 (23, 9%) resistenta mot andra Xiaomi-laktamer. För 69 stammar som är resistenta mot karbapenemer var resistensprofilen hög: 20/69 (72,5%), 58/69 fluorokinoloner (69,6%) och 50/69 aminoglykosider (72,5%) (tabell 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
förutom MBL-forskning valdes fem stammar (två innehållande SPM-1, en innehållande vim och två fenotypiskt positiva för MBL) till utvärderingen av biofilmbildningen med användning av kvantitativa analyser av total biomassa genom färgning med kristallviolett. Med tanke på förekomsten av MBL-gener identifierades alla stammar som starkt biofilmproducenter med i genomsnitt 0,90 0,61 kcal biomassa. Skillnader i initial vidhäftning av enskilda stammar observerades inte. Det fanns emellertid en lägre OD för stammen innehållande blaVIM-genen (Fig. 1).
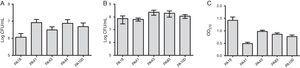
(a) antal celler vidhäftade till en polystyrenyta efter 2 timmar, uttryckt som log CFU/mL för 5 prover av Pseudomonas aeruginosa isolerade från blod. B) antal livskraftiga celler i biofilmen (log CFU/mL). C) biomassa av biofilm uttryckt som optisk densitet av kristallviolett (OD570nm).
diskussion
sjukhusbakteriemi orsakad av multiresistenta mikroorganismer, vare sig Gram-positiva eller gramnegativa, har ofta beskrivits som ett betydande hälsoproblem som ökar sjukhuskostnaderna och gör det svårt att upprätta en lämplig antimikrobiell behandling, vilket resulterar i en sämre prognos.37 Den höga andelen sjukhusbakteremi orsakad av P. aeruginosa resistent mot karbapenem indikerar vikten av denna organism som en viktig orsak till denna infektion på vårt sjukhus. Den höga andelen sjukhusbakteremi orsakad av P. aeruginosa resistent mot karbapenem indikerar vikten av denna organism som en betydande orsak till denna infektion på vårt sjukhus. Resultaten från olika studier har föreslagit att inneboende riskfaktorer såsom mekanisk ventilation, användning av ett nasogastriskt rör och tidigare användning av antibiotika ökar risken för bakterieutveckling orsakad av P. aeruginosa resistent mot karbapenem, liksom risken för sjuklighet och dödlighet.38
i denna studie var mer än 50% av riskfaktorerna associerade med infektion av denna mikroorganism enligt univariat analys. Emellertid ansågs endast mekanisk ventilation, enterala/gastriska matningsrör, primär bakteremi av okänt ursprung och olämplig behandling oberoende riskfaktorer genom multivariat analys.
en central venkateter är en av de viktigaste riskfaktorerna för förvärvad bakteriemi på sjukhuset, eftersom den var associerad med mer än 90% av dessa infektioner.39 även om det inte var en signifikant riskfaktor i denna studie, hade 85, 5% av patienterna med bakteriemi med karbapenemresistent P. aeruginosa denna invasiva procedur.
ofta har bakteriemi orsakad av P. aeruginosa resistent mot antibiotika en högre dödlighet på grund av särskilt administrering av olämplig antibiotikabehandling.40 i denna studie undersökte vi en kohort av 157 patienter med bakteriemi orsakad av P. aeruginosa-stammar, varav 69 av dem infekterade av karbapenemresistenta P. aeruginosa-isolat. Total mortalitet var högre i den karbapenemresistenta gruppen; närvaron av resistenta stammar var emellertid signifikant associerad med olämplig antimikrobiell terapi, vilket visar att denna grupp vanligtvis har en sämre prognos. I likhet med våra resultat visade tidigare studier att P. aeruginosa isolerad från patienter som fick olämplig behandling hade en sämre prognos, med hastigheter på 46,1% 41 och 53,8%.42
förutom att vara associerad med allvarliga infektioner resulterar resistens mot karbapenem i P. aeruginosa ofta i produktion av MBL.43 våra resultat visade att den karbapenemresistenta P. aeruginosa var utbredd i hela sjukhuset med gener som kodar för dessa enzymer i 16,1% av stammarna, var 10,7% av genotyp blaSPM-1 och 5,4% av genotyp blaVIM. Eftersom frekvensen av multidrugsresistenta stammar var hög, tyder dessa resultat på att andra resistensmekanismer samexisterar i dessa stammar, såsom utflödespumpar och membranets ogenomtränglighet.44
förekomsten av MBL som en resistensmekanism har ökat, särskilt i Latinamerika.45 i Brasilien, förekomsten av MBL-producerande P. aeruginosa varierar mellan olika regioner och mellan sjukhus, med priser från 7, 5% till 44%.11
SPM-1-enzym anses vara det vanligaste i Brasilien, följt av IMP-1,11,46 men det har också skett en ökning av frekvensen av P. aeruginosa-isolat innehållande vim-enzym.45,47 i vår studie detekterades SPM-1-enzymet i 16,7% av fenotypiskt producerande prover av MBL, följt av Vim-enzym, vilket detekterades i 8,3% av fallen. Dessa resultat indikerar en signifikant spridning av MBL-kodande gener i vår region.
med tanke på förekomsten av MBL-och biofilmproduktion klassificerades 100% av stammarna som starka producenter. En annan studie i Brasilien fann att 40% av P. aeruginosa klassificerade som stark biofilmproducerande också var MBL-producenter.35 vi anser att dessa resultat är viktiga när dessa egenskaper (biofilmproduktion och MBL) överlappar varandra och infektioner orsakade av dessa bakterier är svåra att behandla. Detta är delvis motiverat eftersom tillväxten av bakterier i biofilmen är cirka 64 gånger mer resistent mot antimikrobiella medel.48
P. aeruginosa har ett stort antal extracellulära virulensfaktorer som också bidrar till patogeniciteten och svårighetsgraden av dessa infektioner, såsom den som kodas av aprA -, plcH -, plcN -, lasA -, lasB -, toxA-och algD-gener.32,33 våra data visade att närvaron av en multiresistent profil i de flesta stammarna (88%) var positiva för aprA -, plcH -, plcN -, lasA -, lasB -, toxA-och algD-virulensgenerna, utom i en stam som inte visade toxA-och plcH-generna, vilket ytterligare kan bidra till en sämre prognos i samband med allvarliga infektioner.
våra resultat bekräftar tidigare fynd avseende riskfaktorer för utveckling av P. aeruginosa karbapenemresistent bakteriemi, liksom spridning av MBL-producerande stammar av SPM-1-typ. Denna studie bidrar emellertid till ytterligare bevis på spridningen av MBL-producerande stammar, särskilt vim-typen, i mycket virulenta stammar och starkt biofilmproducenter.
intressekonflikter
författarna förklarar inga intressekonflikter.