- introduktion
- ChREBP-struktur och reglering Via lid/Grace-domänerna
- aktivering av ChREBP med Glukosmetaboliter
- ChREBP Co-Factors och Partners
- Chrebps roll i kolhydratmetabolism och Hepatokinproduktion
- ChREBP som Regulator för Leverfettsyrasyntes och VLDL-utsöndring
- reglering av Fruktosmetabolism av ChREBP i lever och tarm
- reglering av BDK:PPM1K-axeln i levern
- ChREBP krävs för Glukosmedierad reglering av FGF21
- Roll ChREBP i Inter-Organ nätverk som styr energi homeostas
- Roll hepatisk ChREBP i kontrollen av insulinkänslighet balans
- Adiposkrebp länkar lipogenes till insulinkänslighet
- ny interaktion mellan hormonkänsligt lipas och ChREBP i fettvävnad
- slutsats och framtida riktningar
- Författarbidrag
- finansiering
- intressekonflikt uttalande
introduktion
ökad konsumtion av enkla sockerarter som sackaros och majssirap med hög fruktos under de senaste åren har lett till en ökad risk för metaboliska sjukdomar som fetma, dyslipidemi, typ 2-diabetes och/eller alkoholfri fettlever (NAFLD). Levern är huvudorganet som ansvarar för omvandlingen av överskott av kolhydrater i kosten till fett. De resulterande triglyceriderna (TG) kan packas i mycket lågdensitetslipoproteiner (VLDL) och antingen utsöndras i cirkulationen, lagras som lipiddroppar eller metaboliseras genom beta-oxidationsvägen. Insulin utsöndras som svar på förhöjd blodglukos, stimulerar uttrycket av gener av de novo fettsyrasyntes (lipogenes) genom transkriptionsfaktorn sterol regulatory element binding protein-1C (SREBP-1C) (Foretz et al., 1999). SREBP – 1C verkar i synergi med en annan transkriptionsfaktor som kallas kolhydratresponselementbindande protein (ChREBP), som förmedlar svaret på kolhydrater i kosten. ChREBP-proteinstrukturen innehåller en låg glukoshämmande domän (lock) och ett glukosresponsaktiverat konserverat element (GRACE) beläget i dess N-terminal (Li et al., 2006). Aktivering av GRACE-domänen av glukosmetaboliter främjar ChREBP-transkriptionsaktivitet och bindning till en mycket konserverad sekvens som kallas kolhydratresponselement (ChoRE). ChoRE är närvarande på promotorerna av ChREBP-målgener, som kodar för nyckelenzymer av de novo lipogenes inklusive L-pyruvatkinas (L-pk), ett hastighetsbegränsande enzym i glykolys, fettsyrasyntas (Fas), acetyl-CoA-karboxylas (Acc) och stearoyl-CoA-desaturas (Scd1) (Kawaguchi et al., 2001). En ny studie rapporterade det ömsesidiga beroendet mellan ChREBP (aktiverad av glukos) och SREBP-1C (aktiverad av insulin) för fullständig induktion av glykolytiskt och lipogent genuttryck i lever (Linden et al., 2018). Viral återupprättande av den nukleära aktiva formen av SREBP-1C i levern hos ChREBP-bristande möss (ChREBPKO) normaliserade lipogen genuttryck, utan att ha någon effekt på att rädda glykolytiskt genuttryck. Spegelexperimentet, där ChREBP-uttryck inducerades i levern hos SREBP-1C knockout-möss, räddade glykolytiskt genuttryck men överraskande inte lipogent genuttryck, trots Chrebps välkända roll i kontrollen av fettsyrasyntesgener. Ändå föreslår denna studie vikten av den dubbla verkan av ChREBP och SREBP-1C i kontrollgenerna som är involverade i regleringen av fettsyrasyntes (Linden et al., 2018).
ChREBP är mycket berikat i levern och har studerats som en huvudregulator för lipidmetabolism (Iizuka et al., 2004; Osorio et al., 2016). ChREBP uttrycks också signifikant i bukspottskörtelöar, tunntarmen, skelettmuskeln och i mindre utsträckning i njurarna och hjärnan (se Richards et al., 2017 för granskning). Intressant nog identifierades en annan isoform av ChREBP, ChREBP VIII, som härrör från en alternativ Första exonpromotor, först i fettvävnad (Herman et al., 2012) och senare beskrivet i andra celltyper (se Abdul-Wahed et al., 2017 för granskning). Som vi kommer att diskutera beskrivs ChREBP VIII som en konstitutivt aktiv isoform. Förhoppningen är att det framtida arbetet kommer att ta itu med respektive roller ChREBP och ChREBP VIII i regleringen av glukos och lipidmetabolism samt identifiera deras specifika och/eller överlappande mål.
ChREBP-struktur och reglering Via lid/Grace-domänerna
ChREBP tillhör Mondo-familjen av bhlh/Zip-transkriptionsfaktorer. N-terminusdomänen (1-251 rester) innehåller två nukleär exportsignal (NES) och en nukleär lokaliseringssignal (NLS) som reglerar subcellulär lokalisering genom att interagera med kromosomregionunderhåll 1 (CRM1) även kallad exportin 1 och/eller 14-3-3 proteiner (Sakiyama et al., 2008). C-terminusregionen innehåller en polyprolindomän, en bhlh / LZ-domän (660-737 rester) och en leucin blixtlåsliknande domän (Zip-liknande, 807-847 rester) som är associerade med kofaktorer och DNA-bindning (Yamashita et al., 2001; Fukasawa et al., 2010; Ge et al., 2012). Lokalisering och transkriptionsaktivering av ChREBP bestäms av näringstillgänglighet. Glukosmedierad reglering av ChREBP sker mestadels på nivån av glukosavkänningsmodulen (GSM) eller mondo conserved region( MCR), som består av locket och GRACE-domänerna, som nämns i introduktionen (Figur 1A; Li et al., 2006; Singh och Irwin, 2016). I 2012, Herman et al. (2012) beskrivit en annan ChREBP-isoform, ChREBP VIII, som transkriberas från en alternativ Första exonpromotor 1b till exon 2 (Figur 1b). Detta transkript översätts från exon 4, vilket genererar ett kortare protein med 687 aminosyror (ChREBP-isoformen i full längd, bytt namn till Bisexuell, innehåller 864 aminosyror, kallad ChREBP i manuskriptet) där de två NES -, NLS-och LOCKDOMÄNEN saknas. ChREBP bisexuell är mycket aktiv i vit fettvävnad på ett GLUT – 4-beroende sätt och föreslås regleras direkt av ChREBPa eftersom en syssla sekvens identifierades i exon promotorn 1 Bisexuell (Herman et al., 2012; Figur 1B). Regleringen av ChREBP Bisexuell av ChREBPa antyder förekomsten av en framåtriktad slinga som potentiellt förvärrar svaret på glukos under hyperglykemiska förhållanden. Regleringsmekanismen eller regleringsmekanismerna för ChREBP-isoformen, och framför allt dess specifika funktion, måste dock klargöras.
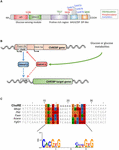
Figur 1. (A) struktur av kolhydratresponselementbindande protein (chrebpa). ChREBPa består av 864 aminosyror och innehåller flera reglerande domäner. Vid N-terminalen innehåller proteinet en glukosavkänningsmodul bestående av den lågglukoshämmande domänen (lock) och det glukosaktiverade konserverade elementet (GRACE). Proteinet innehåller också en polyprolinrik, en bHLH / LZ och en leucin-blixtlåsliknande (Zip-liknande) domän belägen vid C-terminalen. Post-translationella modifieringar indikeras i deras respektive rester, fosforylering (röd), acetylering (blå) och de nyligen identifierade O-Glcnacyleringarna (grön). (B) – Genen struktur ChREBP gen och generering av två ChREBP isoformer α och β. ChREBP bisexuell transkriberas från en alternativ Första exon promotor 1b. detta transkript översätts från exon 4 som genererar ett kortare protein med 687 aminosyror där de två NES, NLS och LID-domänen saknas. ChREBP-isoformen har föreslagits vara direkt reglerad av ChREBPa eftersom en syssla-sekvens identifierades i exon promotor 1b. huruvida både ChREBP-isoformer för och för oktsisoformer båda binder till sysslan är för närvarande inte känt. Figur anpassad från Herman et al. (2012). (C) Multi-alignment av ChoRE konsensussekvenser presenterar i flera ChREBP-målgenpromotorer. Nukleotidbaserad inriktning presenteras på toppen av figuren tillsammans med konsensussekvensen som beskrivs i Poungvarin et al. (2015). Logotypen som motsvarar konsensussekvensen associerad med denna speciella inriktning representeras också.
aktivering av ChREBP med Glukosmetaboliter
Under fastande förhållanden, glukagonberoende aktivering av proteinkinas A (PKA) (Kawaguchi et al., 2002) fosforylerar ChREBP på rester Ser196 och Thr666, vilket leder till ChREBP-bindning till proteinet 14-3-3 och dess retention i cytosolen (Kawaguchi et al., 2001, 2002; Davies et al., 2008). AMP-aktiverat proteinkinas (AMPK), en central cellulär energisensor, fosforylerar också ChREBP på Rest Ser568, vilket i sin tur minskar bindningen av ChREBP till promotorer av dess målgener (Kawaguchi et al., 2002; Sato et al., 2016). Det demonstrerades att metaboliter genererade under fasta, såsom AMP-och ketonkroppar producerade från fettsyraoxidation, spelar en allosterisk hämmande roll genom att förändra ChREBP och 14-3-3 proteinaffinitet, förbättra komplex stabilisering och gynna cytosolisk retention (Sakiyama et al., 2008; Nakagawa et al., 2013; Sato et al., 2016). Som svar på kolhydrater regleras ChREBP på transkriptionella, translationella och post-translationella nivåer. Ökade glukoskoncentrationer efter en måltid främjar syntesen av mellanliggande metaboliter såsom xylulos-5-fosfat (X5P), som ursprungligen föreslogs som en aktivator av proteinfosfatas 2a (PP2A) (Kawaguchi et al., 2001; Kabashima et al., 2003). PP2A beskrevs tidigare för att defosforylat ChREBP vid ser196-återstoden, vilket möjliggör dess translokation till kärnan där den vidare defosforyleras på ett X5P – och PP2A-beroende sätt (på Thr666 och Ser568). Emellertid utmanades denna modell genom åren och andra metaboliter såsom glukos-6-fosfat (G6P) föreslogs vara potentiella aktivatorer av ChREBP-translokation/aktivitet (Dentin et al., 2012). McFerrin et al. (2012) identifierade ett förmodat motiv för g6p-bindning (253-SDTLFT-258) på GRACE-domänen, som också bevaras i MondoA, en ChREBP/MondoB ortholog (se Richards et al., 2017 för granskning). Enligt denna hypotes kan G6P främja en allosterisk konformationsförändring som inducerar en öppen konformation för ChREBP, vilket underlättar interaktionen med kofaktorer och efterföljande translokation till kärnan (McFerrin et al., 2012).
inom kärnan kan ChREBP modifieras genom O-Glcnacylering, en post-translationell modifiering beroende på glukosmetabolism och identifieras som viktig för ChREBP-transkriptionsaktivitet (Guinez et al., 2010). O-Glcnacylering sker på serin-och treoninrester genom aktiviteten av O-GlcNAc-transferas (OGT), ett enzym som tillför N-acetylglukosamin (GlcNAc) – rester till målproteiner och därigenom modifierar deras aktivitet, stabilitet och/eller subcellulär plats. Yang et al. (2017) avslöjade nyligen flera ChREBP-rester modifierade genom O-Glcnacylering. Mutationer av dessa rester vid domänerna bHLH/ZIP och dimerisering och cytoplasmatisk platsdomän (DCD) har möjliggjort identifiering av Thr517 och Ser839 som väsentliga platser för glukosberoende aktivering av ChREBP (Figur 1a). ChREBP kan också modifieras genom acetylering via histonacetyltransferasaktiviteten hos p300 (Bricambert et al., 2010). Glukosaktiverad p300 acetylerar ChREBP på Lys672 och ökar dess transkriptionsaktivitet genom att förbättra rekryteringen till ChoRE-sekvensen, vilken är optimal konsensusbindningssekvens är Caygycnnnncrcrtg (figur 1C). Poungvarin et al. (2015) analyserade ChREBP-bindningsställen med ChIP-seq i lever och vit fettvävnad hos möss som återmatades med en högkolhydrat, fettfri diet. De rapporterade att ChREBP-bindning berikas i vägar som är involverade i insulinsignalering, vidhäftande korsningar och cancer, vilket tyder på ett nytt engagemang av ChREBP i tumörgenes och cancerprogression. Vidare rapporterade en ny studie vikten av ChREBP i hepatocellulärt karcinom (HCC) (Ribback et al., 2017). Författarna fann att genetisk deletion av ChREBP (i ChREBPKO-möss) försämrade hepatokarcinogenes driven av proteinkinas B/Akt-överuttryck hos möss. Vidare resulterade siRNA-medierad hämning av ChREBP i mus-och/eller humana HCC-celler i minskad proliferation och apoptos.
ChREBP Co-Factors och Partners
flera co-factors och/eller partners av ChREBP identifierades under de senaste åren (se Richards et al., 2017 för granskning). Max som protein x (Mlx), en bhlh/LZ transkriptionsfaktor, identifierades först som en vanlig bindningspartner för Mondo-familjen (Stoeckman et al., 2004). Dimerisering av ChREBP med Mlx krävs för både nukleär translokation som svar på glukos och bindning till Choreelement. Nukleära receptorer såsom hepatocytkärnfaktor 4 (hnf4a) och farnesoid X-receptor (FXR) beskrevs också som ChREBP-partners. HNF4a interagerar fysiskt med ChREBP genom att binda till den direkta repeat-1 (DR-1) – regionen på promotorn av ChREBP-målgener (Adamson et al., 2006; Meng et al., 2016). Dessutom visade sig p300 / CBP-transkriptionskoaktivatorproteinerna stabilisera ChREBP / HNF4a-komplexet (Burke et al., 2009). P300 / CBP transkriptionskoaktivatorproteiner spelar en central roll för att samordna och integrera flera signalberoende händelser med transkriptionsapparaten. En annan viktig egenskap hos p300 / CBP är närvaron av histonacetyltransferas (HAT) – aktivitet, som ger p300/CBP kapacitet att påverka kromatinaktivitet genom att modulera nukleosomala histoner. I humana hepatocyter utlöser FXR-bindning till ChREBP-HNF4a-komplexet frisättningen av ChREBP från CBP/p300, vilket leder till rekrytering av histondeacetylas SMRT på LPK-promotorn och fungerar därmed som en co-repressor av ChREBP-transkriptionsaktivitet (Caron et al., 2013). Dessutom modifierar CBP / p300 HAT-aktivitet ChREBP på Lys 672, vilket leder till dess transkriptionsaktivering som svar på glukos (Bricambert et al., 2010).
Bricambert et al. (2018) identifierade nyligen histondemetylasväxten homeodomain finger 2 (Phf2), som tillhör familjen histonlysindemetylas (KDM7), som en ny kofaktor för ChREBP. Interaktion mellan Phf2 och ChREBP förbättrar ChREBP-transkriptionsaktivering genom att radera h3k9-metylmärken på promotorn för dess målgener. Intressant är att specifik samrekrytering av Phf2 och ChREBP till promotorn av kärnfaktor erythroid 2 som 2 (Nrf2) bidrar till den skyddande effekten av Phf2 mot ökade reaktiva syrearter (ROS) och NAFLD-progression i samband med hyperglykemi (Bricambert et al., 2018).
Chrebps roll i kolhydratmetabolism och Hepatokinproduktion
ChREBP som Regulator för Leverfettsyrasyntes och VLDL-utsöndring
icke-alkoholisk fettleversjukdom är ett kännetecken för metaboliskt syndrom, och studier på människor avslöjar att de novo lipogenes bidrar till cirka 25% av de totala leverlipiderna hos patienter med NAFLD (Donnelly et al., 2005). I insulinresistenta tillstånd förbättrar hyperglykemi och hyperinsulinemi lipogenesen delvis genom aktivering av ChREBP och SREBP-1C. ChREBP-hämning i lever av överviktiga och insulinresistenta ob/ob-möss, genom RNAi eller genetisk ablation leder till reversering av leverstatos (Dentin et al., 2006; Iizuka et al., 2006). Förändrad utsöndring av VLDL i levern bidrar också till patogenesen av NAFLD. Mikrosomalt triglyceridöverföringsprotein (MTTP) är det protein som ansvarar för montering och utsöndring av apolipoprotein B-innehållande lipoproteiner. Brist på MTTP hos möss och människor orsakar hypolipidemi och fettlever. Reglering av detta protein har associerats med några mycket konserverade cis-element i dess promotor inklusive kritiska positiva och negativa reglerande domäner (Cuchel et al., 2013; Hussain et al., 2011). Nyligen påpekades ChREBP som en potentiell regulator för MTTP eftersom brist på funktionell ChREBP i levern undertrycker mttp-uttryck och VLDL-montering och utsöndring (Niwa et al., 2018). Eftersom ingen syssla kunde identifieras tydligt på mttp promotor, ytterligare analys kommer att behövas för att identifiera den mekanism som ChREBP reglerar Mttp.
reglering av Fruktosmetabolism av ChREBP i lever och tarm
kopplingen mellan ChREBP och fruktosmetabolism bevisades först av den fenotypiska analysen av ChREBP knockout-möss (ChREBPKO-möss). ChREBPKO-möss rapporterades dö inom flera dagar efter utfodring med hög fruktos (HFrD) (Iizuka et al., 2004). Denna stora intolerans mot fruktos tillskrevs minskningen av uttrycket av fruktokinas och trioskinas, två enzymer som krävs för fruktosmetabolism (Iizuka et al., 2004). Kim et al. (2016) rapporterade senare vikten av ChREBP för effektiv omvandling av fruktos till glukos i lever-och helkropps fruktoclearance, men även vid intag av fruktos kan ChREBP bidra till hyperglykemi genom direkt trans-aktiverande G6pc-uttryck, en Nyckelgen av glukoneogenes. Denna effekt kan leda till en ond cirkel där fruktosförbrukningen förvärrar glukosproduktionen genom ChREBP-aktivitet (Kim et al., 2016). Det följande året, studien av Zhang et al. (2017) rapporterade att ChREBPKO-möss matade med HFrD utvecklar allvarlig leverskada på grund av överaktivering av endoplasmatisk retikulumspänning och CCAAT-förstärkarbindande proteinhomologt protein (CHOP)-medierad hepatocytapoptos. Apoptos i hepatocyter hos dessa möss var troligen kopplad till ökad kolesterolbiosyntes sedan hämning av denna väg via HMG-CoA-reduktas (HMGCR) eller srebp2-hämning räddade ChREBPKO-möss från HFrD-inducerad leverskada. En brist på ChREBP var också nyligen associerad med en dysreglering av sackaros och fruktosmetabolism som ledde till sockerintolerans och malabsorption hos möss (Kato et al., 2018). Dessa effekter var associerade med minskat uttryck av intestinal sackaros-isomaltas (SI), som smälter sackaros i glukos och fruktos, glukostransportörerna 5 (Glut5) och 2 (Glut2) och ketohexokinas (Khk) enzym, som reglerar fruktolys (Figur 2). Dysreglering av dessa enzymer kan leda till ackumulering av osmält sackaros och fruktos med potentiella återverkningar i tarmmikrobiotasammansättningen. Jämförelsen mellan chrebpko och leverspecifika ChREBP knockout (ChREBPLiverKO) möss matade med HFrD hade tidigare avslöjat att leverchrebp-brist ensam inte leder till fruktosintolerans men att ChREBP-brist i tunntarmen är sannolikt ansvarig för försämringen i fruktostolerans observerad hos dessa möss (Kim et al., 2017). Sammantaget understryker dessa studier vikten av ChREBP vid reglering av fruktosmetabolism och understryker behovet av en bättre förståelse för dess roll och reglering i tunntarmen.
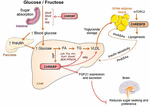
Figur 2. ChREBP reglerar multiplar signalering / metaboliska vägar som svar på glukos och fruktos. ChREBP uttrycks i flera vävnader inklusive tarm, lever och vit fettvävnad. I dessa celltyper, som svar på glukos och/eller fruktos ChREBP aktiveras och inducerar specifika geniska program som anges på figuren. I tarmen beskrevs stimulering av SI, Glut5, Glut2 och Ketohexokinas (Khk) uttryck av ChREBP (antingen direkt eller indirekt) för att förbättra sackarostolerans och fruktosabsorption. I levern är ChREBP en nyckelmodulator för glykolytiskt, lipogent och mikrosomalt triglyceridöverföringsprotein (Mttp) genuttryck, vilket styr både fettsyraackumulering och VLDL-export från levern. ChREBP reglerar också produktionen av hepatokiner såsom fibroblasttillväxtfaktor 21 (FGF21). Denna lever-till-hjärnaxel expanderar leverkrebp-funktionen från en leverregulator till en systemisk modulator som inte bara påverkar substrathantering i lever utan också näringspreferens. ChREBP-aktivering i vit fettvävnad är kopplad till förbättrad metabolisk homeostas genom att producera skyddande cirkulerande signaler. En ny klass av däggdjurslipider som kännetecknas av en grenad esterbindning mellan en fettsyra och en hydroxifettsyra (palmitinsyrahydroxylstearinsyra) rapporterades utöva fördelaktiga effekter på glukoshomeostas genom direkt och inkretinmedierad modulering av cellfunktionen i bukspottkörteln, förbättrat glukosupptag i fett och minskad inflammation. Intressant nog identifierades mTORC2 nyligen som en ny regulator för ChREBP-isoform i fettceller.
reglering av BDK:PPM1K-axeln i levern
det första engagerade steget med grenad kedja aminosyra (BCAA) katabolism regleras av det grenade kedjan ketoacid dehydrogenas (BCKDH)-komplexet som styrs av två enzymer, den grenade kedjan alfa-keto-syradehydrogenas-Kinas (BDK) och proteinfosfatas, Mg2+/Mn22+ beroende 1k (PPM1K). White et al. (2018) nyligen associerad ChREBP med uppreglering av BDK och nedreglering av PPM1K i lever och identifierade ett konserverat syssla motiv i promotorn av båda dessa gener. En positiv korrelation mellan uttrycket av BDK och andra typiska ChREBP-målgener (Fasn, Pklr, ChREBP Bisexuell) observerades hos lever av råttor som matades med en hög glukos-eller fruktosdiet. På den fysiologiska nivån ledde ökningen av BDK: PPM1K-förhållandet till fosforylering och aktivering av ATP-citratlyas (ACLY), vilket stimulerade de novo lipogenes. Dessa fynd avslöjar att BDK och PPM1K kan vara nya lipogenesaktiverande gener som regleras av ChREBP-VIII. Med tanke på deras roll i regleringen av lipid -, glukos-och aminosyrametabolism kan BDK och PPM1K betraktas som potentiella terapeutiska mål i levern inom en snar framtid (White et al., 2018).
ChREBP krävs för Glukosmedierad reglering av FGF21
ChREBP var nyligen associerad med produktion och utsöndring av hepatokiner såsom Fibroblasttillväxtfaktor 21 (FGF21) (Iizuka et al., 2009; Dushay et al., 2015, Iroz et al., 2017). FGF21 är ett metaboliskt hormon som syntetiseras av levern med flera fördelaktiga effekter i perifera vävnader (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Fram till nyligen betraktades FGF21 som ett fastande hormon som förbättrar fettsyraoxidation, ketogenes och lipolys under transkriptionell kontroll av peroxisomproliferatoraktiverad receptor Bisexuell (PPARa) (Inagaki et al., 2007). En syssla på FGF21-promotorn har tidigare identifierats i både möss (-74 till -52 bp) och människor (-380 till -366 bp) (Iizuka et al., 2009) men funktionella studier har saknats tills nyligen. Konsumtion av glukos och fruktos rapporterades leda till en snabb höjning av FGF21-nivåerna hos friska frivilliga och patienter med metaboliskt syndrom (Dushay et al., 2015). Ytterligare studier rapporterade också en mekanistisk koppling mellan ChREBP-härledd FGF21 och makronäringspreferens genom en lever-hjärnaxel (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Denna lever-till-hjärnaxel expanderar ChREBP-funktionen från en levermetabolisk regulator till en systemisk modulator, som inte bara påverkar leversubstrathantering utan också globalt utfodringsbeteende (Abdul-Wahed et al., 2017).
Roll ChREBP i Inter-Organ nätverk som styr energi homeostas
Roll hepatisk ChREBP i kontrollen av insulinkänslighet balans
vårt laboratorium rapporterade tidigare att ChREBP fungerar som en nyckelmodulator för hepatisk fettsyrasammansättning och insulinkänslighet i samband med alkoholfria och alkoholhaltiga leversjukdomar (se Abdul-Wahed et al., 2017 för granskning). Möss som överuttryckte ChREBP utvecklade större leverstatos än kontroller, men intressant förblev fria från metaboliska komplikationer och utvecklade inte insulinresistens. Lipidomisk analys har visat att ChREBP-medierad steatos är associerad med en minskning av mättade fettsyror och en ökning av enomättade fettsyror, de senare som har visat sig vara associerade med ChREBP-medierade fördelaktiga effekter på insulinkänslighet (Benhamed et al., 2012). Dessa resultat visar rollen av ChREBP i lipidpartitionering och föreslår att specifika lipidarter, när de är närvarande på rätt plats och tid, kan utlösa signaler som modulerar anpassning till metabolisk stress (Benhamed et al., 2012; Bricambert et al., 2018). Intressant, Jois et al. (2017) föreslog också en skyddande roll för hepatisk ChREBP angående glukoshomeostas i hela kroppen och insulinkänslighet. ChREBPLiverKO-möss uppvisar försämrad glukostolerans, medan de skyddas från leverstatos. Hepatisk ChREBP-deletion resulterade också i genuttrycksförändringar i vita och bruna fettvävnader, vilket tyder på kommunikation mellan vävnader. Bidraget från ChREBP till hela kroppens energibalans kan därför förlita sig på dess reglering av lipidarter och/eller hepatokinproduktion som bidrar till intervävnadskoordinering av energihomeostas (Jois et al., 2017).
Adiposkrebp länkar lipogenes till insulinkänslighet
nedsatt insulinsignalering i fettvävnad är ett kritiskt inslag i insulinresistens. Studier har rapporterat att ChREBP-aktivering i vit fettvävnad kan förbättra metabolisk homeostas genom att producera skyddande cirkulerande signaler (Yore et al., 2014; Tang et al., 2016). En klass av däggdjurslipider som kännetecknas av en grenad esterbindning mellan en fettsyra och en hydroxifettsyra, palmitinsyrahydroxylstearinsyra (PAHSA), rapporterades utöva fördelaktiga effekter på glukoshomeostas genom direkt och inkretinmedierad modulering av cellfunktion i bukspottkörteln, glukosupptag och minskning av inflammation (Yore et al., 2014). På liknande sätt är fettspecifik ChREBP knockout (ChREBPadiposeKO), som uppvisar låga lipogeneshastigheter i fettvävnad, insulinresistenta med nedsatt insulinverkan i lever, muskler och vit fettvävnad under både chow och hög fetthalt. ChREBPadiposeKO-möss har lägre serumnivåer av PAHSAs, medan PAHSA-tillskott, i synnerhet 9-PAHSA-isomeren, räddar ChREBPadiposeKO global insulinresistens och fettvävnadsinflammation, vilket bekräftar att förlust av fett-ChREBP är tillräcklig för att orsaka insulinresistens (Vijayakumar et al., 2017). En nyligen genomförd studie identifierade det mekanistiska målet för rapamycinkomplex 2 (mTORC2) som en ny regulator för ChREBP (särskilt isoformen av sackaros) i fettceller. Specifik ablation av rapamycinokänslig följeslagare av mTOR (Rictor) i mogna adipocyter försämrat insulinstimulerat glukosupptag i fettvävnad som leder till nedreglering av ChREBP VIII och målgenuttryck involverat i lipogeneskontroll (Tang et al., 2016). I överensstämmelse med en viktig överhörning i fettlever medierad av ChREBP är dessa effekter associerade med leverinsulinresistens och förbättrad glukoneogenes. Sammantaget stöder dessa studier en viktig roll för adiposkrebp för att utlösa insulinkänsliga signaler (Tang et al., 2016).
ny interaktion mellan hormonkänsligt lipas och ChREBP i fettvävnad
ChREBP identifierades nyligen som en partner till det lipolytiska enzymet hormonkänsligt lipas (HSL) i fettvävnad (Morigny et al., 2019). Knockdown av HSL i humana adipocyter och musfettvävnad visade sig förbättra insulinkänsligheten och inducera förlängningen av mycket långkedjigt fettsyraenzym (Elovl6). Elov16 är ett mikrosomalt enzym som reglerar förlängningen av C12-16 mättade och enomättade fettsyror på ett ChREBP-beroende sätt (Morigny et al., 2019). På mekanistisk nivå försämrade fysisk interaktion mellan HSL och ChREBP nukleär translokation av ChREBPa och den efterföljande induktionen av ChREBP Kazaki och målgener, särskilt Elovl6 (Morigny et al., 2019). Denna studie avslöjar en ny reglering för ChREBP i fettvävnad. Att hämma interaktionen mellan HSL och ChREBP kan leda till potentiella terapeutiska strategier för att förbättra insulinkänsligheten i fettceller.
slutsats och framtida riktningar
ChREBP är nu en väletablerad kolhydratsensor. Även om de flesta studier har ägnats åt dess implikation i kontrollen av de glykolytiska och lipogena vägarna, har nya data också unraveled nya bidrag av ChREBP i hepatocyter och i fettceller där det kan vara avgörande för att producera hepatokiner och/eller lipokiner som utlöser interorganöverhörning. Som diskuterats kan nyligen identifierade kofaktorer (epigenetiska modifierare) och/eller partners (adipose HSL) i dessa vävnader också representera potentiella terapeutiska strategier för NAFLD och/eller för att förbättra systemisk insulinkänslighet. Nya studier har också stött vikten av ChREBP vid reglering av fruktosmetabolism och har understrukit behovet av en bättre förståelse för dess roll och reglering i tunntarmen. Slutligen kommer det att vara av särskild betydelse att identifiera specifika och/eller överlappande mål för ChREBPa och ChREBP för viktiga celltyper samt fastställa deras specifika inverkan på insulinkänsligheten under de kommande åren.
Författarbidrag
alla listade författare har gjort ett betydande, direkt och intellektuellt bidrag till verket och godkänt det för publicering.
finansiering
Postic ’ s lab (U1016-Institut Cochin) stöds av bidrag från ChroME-nätverket (Marie Curie Sk Askorodowska Action H2020-MSCA-ITN-2015-675610), Stiftelsen för medicinsk forskning (FRM) (DEQ20150331744) och ANR-15-CE14-0026-hepatokind.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.