- introduktion
- Multipulfunktioner av Chymase
- Chymase i mastceller
- flera enzymatiska funktioner av Chymase
- enzymatisk funktion av Chymas i NASH
- inblandning av Chymase i NASH djurmodeller
- effekt av Chymashämmare i NASH djurmodeller
- effekt av Chymashämmare i NASH djurmodeller
- mekanism för leverinflammation dämpad av Chymashämmare
- mekanism för leversteatos försvagad av Chymashämmare
- mekanism för leverfibros dämpad av Chymashämmare
- slutsats
- Författarbidrag
- intressekonflikt uttalande
introduktion
alkoholfri fettlever (NAFLD) har erkänts som den vanligaste formen av leversjukdom (Angulo, 2002; Clark et al., 2002). Non-alcoholic steatohepatit (NASH) efterliknar alkoholisk hepatit trots frånvaron av en historia av att dricka (Ludwig et al., 1980). NAFLD och NASH är associerade med metaboliskt syndrom till följd av fetma, insulinresistens, hyperlipidemi och hypertoni. NAFLD anses vara den vanligaste leversjukdomen och presenterar vanligtvis som enkel leverstatos (Tiniakos et al., 2010). Däremot kännetecknas NASH av svår steatos, lobulär inflammation och fibros i levern (Powell et al., 1990; Bertot Och Adams, 2016). Även om mekanismen som är ansvarig för utvecklingen av NASH fortfarande är oklar, föreslås NASH att orsakas av en ’multipel-hit’ – process, med leverstatos som den ’första träffen’ och efterföljande träffar såsom inflammation, oxidativ stress och endotoxiner (Tilg och Moschen, 2010). NASH är nära besläktat med metaboliskt syndrom, och flera kliniska studier har undersökt den terapeutiska behandlingen av NASH genom att fokusera på symtomen på diabetes, hyperlipidemi och hypertoni (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Emellertid har inga allmänt accepterade terapeutiska medel fastställts.
Chymas kan vara involverat i patogenesen av leverfibros. Chymasaktiviteten ökades signifikant i levern hos patienter med fibros eller cirros och det fanns en signifikant korrelation mellan chymasnivå och grad av fibros (Komeda et al., 2008). Även om ökad chymasaktivitet inte har rapporterats hos patienter med NASH, har den observerats i djurmodeller av NASH (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Däremot resulterade inhiberingen av chymas med lågmolekylhämmare i en signifikant minskning av inflammation, steatos och fibros i råtta och hamster NASH-modeller (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Dessa fynd indikerar att chymas kan vara involverat i inflammation, steatos och fibros under utveckling och progression av NASH (Figur 1).
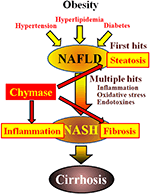
FIGUR 1. NAFLD och NASH är kopplade till metaboliskt syndrom genom fetma, insulinresistens, hyperlipidemi och hypertoni. NASH tros utvecklas via en ”multipel-hit” – process, med leverstatos som ”första träffen” och efterföljande träffar såsom inflammation, oxidativ stress och endotoxiner, och kännetecknas av svår steatos, inflammation och fibros. Chymase kan vara involverat i utvecklingen av steatos, inflammation och fibros i levern.
Multipulfunktioner av Chymase
Chymase i mastceller
Chymase (EC 3.4.21.39) uttrycks i sekretoriska granuler av mastceller. Chymas produceras som ett inaktivt prokymas i sekretoriska granuler och kräver dipeptidylpeptidas i (DPPI) för aktivering. DPPI är ett tiolprotein och dess optimala pH är 6,0. Det optimala pH-värdet överensstämmer med den föreslagna funktionen av DPPI för att aktivera prokymas, eftersom pH i sekretoriska granuler regleras vid pH 5,5 (De Young et al., 1987) (Figur 2). Chymas har emellertid ingen enzymatisk aktivitet i mastceller vid detta pH, eftersom det optimala pH för chymas är mellan 7 och 9 (Takai et al., 1996, 1997). Efter aktivering av mastcellgranuler genom stimuli såsom inflammation och skada frigörs chymas och uppvisar enzymatisk funktion vid dess optimala pH 7.4 (Figur 2).
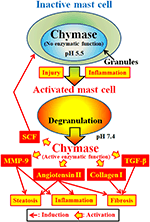
FIGUR 2. Chymas lagras i sekretoriska granuler av inaktiva mastceller. PH i granulat bibehålls vid pH 5,5, ett tillstånd där chymas inte har någon enzymatisk aktivitet. Chymas uppvisar sina enzymatiska funktioner, såsom bildning av angiotensin II, MMP-9, TGF-bronkier, kollagen i och SCF, vid frisättning från mastcellgranuler, efter aktivering genom inflammation och skada.
flera enzymatiska funktioner av Chymase
Chymase är ett serinproteas och klyver den C-terminala sidan av proteiner efter aromatiska aminosyror såsom Phe, Tyr och Trp i allmänhet. Chymase kan klyva phe8-His9-bindningen av den icke-bioaktiva peptiden angiotensin I och bilda dess bioaktiva peptid angiotensin II i däggdjursvävnader inklusive humana (Urata et al., 1990; Takai et al., 1996, 1997). Dessutom klyver chymas enzymatiskt prekursorerna av matrismetalloproteinas (MMP)-9, transformerande tillväxtfaktor (TGF)-AA och kollagen I till deras aktiva former (Kofford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Vidare kan enzymatisk funktion av chymas producera stamcellsfaktor (SCF) genom enzymatisk klyvning av den inaktiva membranbundna formen av SCF, vilket inducerar bildandet av mogna mastceller från omogna mastceller via stimulering av c-kit-receptor (Longley et al., 1997). Således har chymase multipla enzymatiska funktioner, inklusive aktivering av angiotensin II, MMP-9, TGF-XXL, kollagen I och SCF (Figur 2).
enzymatisk funktion av Chymas i NASH
Angiotensin II kan främja leversteatos och inflammation genom att öka reaktiva syrearter (ROS) efter stimulering av angiotensin II-receptorer i djur NASH-modeller (Hirose et al., 2007; Nabeshima et al., 2009). Angiotensin II inducerade också leverfibros via induktion av bronkialaktin (SMA) i leverstellatceller (HSC) (Yoshiji et al., 2001). MMP-9 har rapporterats inducera infiltration av neutrofiler och makrofager via nedbrytning av intercellulära matriser såsom vitronektin och fibronektin, vilket resulterar i förstärkning av inflammation (Medina et al., 2006). Hos NASH-patienter observerades en signifikant ökning av MMP-9-genuttryck i levern jämfört med normala kontroller (Ljumovic et al., 2004). Hepatisk överuttryck av TGF-macai hos transgena möss producerade svår leverfibros via förstärkning av prokollagen i-genuttryck (Casini et al., 1993). Både TGF-bildning och ackumulering av kollagen I är kända för att inducera leverfibros. Aktivering av SCF inducerar ökningar i mastcellantal, och dess enzymatiska funktion kan resultera i en ökning av chymasaktivitet i fibrotiska vävnader (Maruichi et al., 2004). Dessa enzymatiska funktioner av chymas kan vara involverade i steatos, inflammation och fibros, som alla observeras i lever av NASH-patienter och djurmodeller (Figur 2).
inblandning av Chymase i NASH djurmodeller
metionin – och kolinbristande (MCD) diet har använts i stor utsträckning för att inducera en typisk NASH-modell. I hamstrar som matades MCD-kosten observerades signifikanta ökningar av totalt bilirubin, triglycerid och hyaluronsyra i plasma (Tashiro et al., 2010). Dessutom observerades ackumulering av inflammatoriska celler och ökningar av lipidavsättningsområde och fibrotiskt område i levern. I denna MCD-dietinducerade NASH-modell ökade hepatisk chymasaktivitet och relaterade faktorer, såsom angiotensin II, MMP-9 och kollagen i, signifikant (Tashiro et al., 2010; Masubuchi et al., 2013). Nyligen utvecklades en ny NASH-modell där strokebenägna spontant hypertensiva 5/DMCR (SHRSP5 / Dmcr) råttor matades med en diet med hög fetthalt och kolesterol (hfc) (Kitamori et al., 2012). Denna modell visade symtom på metaboliskt syndrom som tros kliniskt likna de hos NASH-patienter (Kitamori et al., 2012). I den hfc-dietinducerade NASH-modellen observerades hypertoni och hyperlipidemi, och svår steatos, fibros och inflammatorisk cellackumulering detekterades i levern (Miyaoka et al., 2017). Vidare observerades en signifikant ökning av chymasaktiviteten tillsammans med MMP-9, TGF-XXL och kollagen I i levern (Miyaoka et al., 2017). Således verkar det finnas ett nära samband mellan chymase och NASH-patogenes i djurmodeller av NASH.
effekt av Chymashämmare i NASH djurmodeller
effekt av Chymashämmare i NASH djurmodeller
en låg molekyl chymashämmare dämpade signifikant chymasaktivitet och minskade angiotensin II, MMP-9 och kollagen i-nivåer i levern i en MCD-dietmatad NASH hamstermodell, när administrering av hämmaren initierades samtidigt som MCD-dieten (Tashiro et al., 2010; Masubuchi et al., 2013). Chymashämmaren förhindrade signifikant leverstatos, fibros och inflammatorisk cellackumulering i denna NASH-modell (Tashiro et al., 2010; Masubuchi et al., 2013). Oxidativ stress tros spela en roll i ’multipel-hit’ teori om NASH utveckling, och förstärkning av den oxidativa stressmarkören malondialdehyd dämpades signifikant i levern av chymashämmaren (Masubuchi et al., 2013). I en hamster MCD-dietinducerad NASH-modell visade chymashämmaren en förbättrande effekt när den administrerades i etablerad NASH (Masubuchi et al., 2013). Graderna av både steatos och fibros i levern reducerades jämfört med före administrering av chymashämmaren (Masubuchi et al., 2013).
i levern hos en hypertensiv råtta hfc-dietinducerad NASH-modell dämpade en lågmolekyl-chymashämmare nivåerna av chymas såväl som MMP-9, TGF-kambodj och kollagen I, som alla är chymasassocierade faktorer (Miyaoka et al., 2017). Chymashämmaren dämpade signifikant leverstatos och fibros och minskade myeloperoxidas som en markör för inflammation, särskilt av neutrofil infiltration (Miyaoka et al., 2017). I denna hfc-dietinducerade modell var överlevnaden för den placebobehandlade gruppen 0% vid 14 veckor efter starten av HFC-dieten och berodde på svår leversvikt (Miyaoka et al., 2017). Den chymashämmare-behandlade gruppen, där råttorna behandlades med chymashämmaren omedelbart efter starten av HFC-dieten, visade emellertid 100% överlevnad vid 14 veckor. Dessutom rapporterades en 50% överlevnad för råttor behandlade med chymashämmaren som började 8 veckor efter starten av HFC-dietmatning, vid vilken tidpunkt NASH etablerades (Miyaoka et al., 2017).
därför kan chymashämmare vara användbara medel för förebyggande och förbättring av NASH i djurmodeller. Å andra sidan främjar angiotensin II också indirekt leverinflammation, steatos och fibros via ökningar av MMP-9-och TGF-excepiligenuttryck. Både MMP-9 och TGF-XXL är nära involverade i patogenesen av NASH, men dessa faktorer induceras inte nödvändigtvis endast av angiotensin II (Takai et al., 2010). Andra faktorer än angiotensin II-stimulering bidrar till ökningarna av MMP-9-och TGF-Kazaki-genuttryck (Takai et al., 2010). I sådana fall kan angiotensin II-receptorblockerare (ARB) inte dämpa MMP-9-och TGF-sackarios åtgärder; en chymashämmare kan emellertid ha dämpande effekter via hämning av MMP-9-och TGF-sackarios aktivering, vilket indikerar en potentiell behandlingskurs för förebyggande av NASH-progression.
mekanism för leverinflammation dämpad av Chymashämmare
Chymashämmare kunde minska inflammation i hamster MCD diet – och råtta HFC dietinducerade NASH-modeller (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Behandling med chymashämmare dämpade signifikant chymasaktivitet i levern samt minskade angiotensin II-och MMP-9-nivåer (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). I HSC inducerar angiotensin II ROS-generation såsom väteperoxid och superoxid genom aktivering av nikotinamidadenindinukleotidfosfat (NADPH) oxidas (de Minicis och Brenner, 2007). Chymashämmare resulterade i minskningar av genuttrycket av NADPH-oxidasskomponenten Rac-1 och den oxidativa stressmarkören malondialdehyd förutom en minskning av angiotensin II-nivåer i en hamster MCD-inducerad NASH-modell (Masubuchi et al., 2013). Angiotensin II-inducerad förstärkning av ROS främjade MMP-9-genuttryck i neutrofiler och makrofager (Yaghooti et al., 2011; Kurihara et al., 2012). Därför hämmar chymashämmare direkt aktiveringen av proMMP – 9 till MMP-9 och reducerar indirekt MMP-9-genuttryck via minskat angiotensin II. MMP-9 klyver extracellulära matriskomponenter, såsom vitronektin och fibronektin, leder till sönderdelning av leverintegritet och inducerar infiltrering av makrofager och neutrofiler (Medina et al., 2006). I en hfc-dietinducerad NASH-modell observerades en signifikant ökning av myeloperoxidasuttryck i makrofager och neutrofiler i levern och reducerades med chymashämmare (Miyaoka et al., 2017). Därför kan mekanismen för inflammation som dämpas av chymashämmare vara beroende av reduktionen av angiotensin II och MMP-9-nivåer i levern.
mekanism för leversteatos försvagad av Chymashämmare
Angiotensin II kan påverka leversteatos via ROS-produktion. I Murin HSC minskade en hämmare av NADPH-oxidas signifikant ROS-produktion och en ARB bromsade utvecklingen av leverstatos via dämpning av ROS-produktion (Hirose et al., 2007; Guimar Jacobes et al., 2010). I en MCD-dietinducerad NASH-musmodell observerades en signifikant dämpning av steatos hos möss med angiotensin II-receptorbrist (Nabeshima et al., 2009). Både in vivo och in vitro-experiment visade att angiotensin II uppreglerade sterolreglerande elementbindande protein (SREBP) – 1c och fettsyrasyntas (FAS) genuttryck, vilka båda är viktiga faktorer vid reglering av lipogenes, efter ROS-förstärkning (Kim et al., 2001; Hongo et al., 2009). Däremot dämpade ARB leverstatos tillsammans med nedreglering av genuttrycket av SREBP-1c och FAS via ROS-dämpning i en mus NASH-modell (Kato et al., 2012). I en hamster MCD-dietinducerad NASH-modell observerades signifikant dämpning av SREBP-1c och FAS-genuttryck efter behandling med en lågmolekyl chymashämmare (Masubuchi et al., 2013). Därför kan den förbättrande mekanismen för leversteatos av chymashämmare vara beroende av minskningen av ROS-produktion via minskad angiotensin II-generation i levern.
mekanism för leverfibros dämpad av Chymashämmare
Chymas kan vara nära associerad med progressionen av vävnadsfibros, eftersom det bidrar till bildandet av TGF-Bisexuell från den icke-bioaktiva prekursorn TGF-bisexuell, och TGF-Bisexuell är känd för att starkt inducera tillväxten av fibroblaster (Takai et al., 2003; Oyamada et al., 2011). TGF-Macau är känt för att spela en central roll i utvecklingen av fibros hos NASH-patienter via aktiverad HSC (Williams et al., 2000). Inhibering av TGF-Macau-funktion via genuttryck och signalering resulterade i förbättrad leverfibros i experimentella modeller (George et al., 1999; Arias et al., 2003). I en hfc-dietinducerad NASH-modell från råtta resulterade dämpning av chymasaktivitet med chymashämmare i minskningar av TGF-bronkialnivå och fibrotiskt område i levern (Miyaoka et al., 2017). Således kan reduktionen av TGF-Macau med chymashämmare bidra till förebyggande av leverfibros.
Angiotensin II kan också vara involverat i induktion av leverfibros. Angiotensin II inducerar kontraktion och proliferation av HSC, och inducerar också genuttrycket av TGF-Macau i fibroblaster in vitro (Kagami et al., 1994; Bataller et al., 2000). Både TGF-bronkialnivåer och graden av kollagenackumulering och fibrotiska lesioner observerades genom gallkanalligering hos möss av vildtyp, men dessa dämpades i möss med angiotensin II-receptorbrist (Yang et al., 2005). I en rat NASH-modell dämpade ARB också leverfibros via reduktionen av TGF-askorbingenuttryck (Hirose et al., 2007). Det kan också finnas ett samband mellan angiotensin II och leverfibros annat än angiotensin II-inducerat TGF-bronkialgenuttryck. Hos patienter med kronisk hepatit C reducerade ARB kollagengenuttryck via Rac-1-genuttryck (Colmenero et al., 2009). HSC är erkända som de viktigaste producerande cellerna av kollagen i levern, och förstärkning i uttrycket av hCG-glatt muskulatur aktin (SMA) i HSC inducerar starkt extracellulär matrisavsättning, inklusive kollagen I (de Minicis och Brenner, 2007). Angiotensin II kan inducera expression av genen för SMA i HSC hos råtta. Däremot resulterar angiotensin II-blockad i dämpning av leverfibros tillsammans med minskning av Chuc-SMA (Yoshiji et al., 2001). Även om det inte utvärderades hos patienter med NASH, förstärktes både chymas-och angiotensin II-bildande aktiviteter signifikant i fibrotiska regioner av lever från patienter med cirros, och signifikanta korrelationer mellan chymas, angiotensin II-bildande aktivitet och leverfibros observerades (Komeda et al., 2008). I en hamstertetrakloridinducerad levercirrhosmodell observerades signifikanta ökningar av chymas och angiotensin II-bildande aktivitet, vilka dämpades signifikant tillsammans med levercirros efter behandling med en lågmolekylär chymashämmare (Komeda et al., 2010).
mastcellstabilisatorn tranilast kan hämma aktiveringen av mastceller, blockera frisättningen av chymas och därigenom förhindra utvecklingen av leverfibros i en råttdiabetes och HFC-dietinducerad NASH-modell (Uno et al., 2008). Chymase främjar proliferationen av mastceller via SCF-aktivering genom dess enzymatiska funktion (Longley et al., 1997). I NASH – djurmodeller minskade chymashämmare ökningen av mastcellantalet i levern, vilket resulterade i minskad chymasaktivitet efter direkt hämning av chymashämmare och en indirekt reduktion av chymasuttryck i mastceller (Masubuchi et al., 2013; Miyaoka et al., 2017).
därför kan chymashämmare bidra till förebyggande av leverfibros via inhibering av TGF-sackarios aktivering genom chymashämning och/eller dämpning av TGF-sackarios nivå via reduktion av angiotensin II och mastcellsproliferation.
slutsats
metaboliskt syndrom bestående av fetma, insulinresistens, hyperlipidemi och hypertoni är nära besläktat med utvecklingen av NASH, och studier av antidiabetiska, antihyperlipidemiska och antihypertensiva medel har utförts för behandling av NASH. Konceptet bakom dessa medel är att dämpa symtomen på metaboliskt syndrom (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Tidigare rapporter har visat att chymashämmare dämpar inflammation och fibros utan att påverka blodsocker-och lipidnivåer och blodtryck i djurmodeller av diabetes, hyperlipidemi respektive hypertoni (Inoue et al., 2009; Takai et al., 2014; Zhang et al., 2016). Därför är konceptet bakom chymashämning att dämpa leverinflammation och fibros av NASH direkt. Vi föreslår att chymashämmare som riktar sig mot metaboliskt syndrom är en potentiellt kraftfull strategi för dämpning av NASH-progression.
Författarbidrag
ST och DJ: skrev manuskriptet. Båda författarna läste och godkände det slutliga manuskriptet.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.