trots den dramatiska nedgången i humant immunbristvirus typ 1 (HIV-1)-relaterad sjuklighet och dödlighet efter upptäckten av proteashämmare och tillkomsten av kombinations högaktiv antiretroviral (ARV) terapi i mitten av 1990-talet, många patienter fortfarande misslyckas behandling på grund av resistens och/eller intolerans (1). Det var tydligt att fler arv som verkar på olika steg i virusets livscykel, aktiva mot resistenta virus och bättre tolererade behövdes. Demonstrationen av nyckelrollen för kemokinreceptorerna CCR5 och CXCR4 i HIV-1-inträde väckte intresse för denna process som ett nytt ARV-mål (2, 3). CCR5 är samreceptorn för majoriteten av HIV-1-stammar, och dessa virus kallas CCR5 tropic (R5). Virusstammar som använder CXCR4 kallas CXCR4-tropic (X4), medan stammar som kan använda båda receptorerna är dual-tropic (4). Virus från en patient kan ofta innehålla blandningar av R5, X4 och dubbla tropiska stammar, kollektivt kallade CXCR4-användning.
CCR5: s nyckelroll i HIV-1-inträde, i kombination med demonstrationen att individer som var homozygota för en 32-baspar-radering i CCR5-genen (CCR5 MILLICR32) och därefter inte uttrycker funktionell CCR5, var mycket skyddade från infektion med R5 HIV-1, fokuserade uppmärksamhet på CCR5 som ett attraktivt mål (5). Även om vissa studier har visat subtila effekter av CCR5 msk 32 mutation på immunfunktion, såsom minskade inflammatoriska poäng i hepatit C-infekterade individer och återhämtning från hepatit B i heterozygoter; medan homozygoter är mer mottagliga för fästingburen encefalit och svår West Nile virus sjukdom, dessa individer lider lite uppenbara negativa effekter på deras hälsa (5, 6). Detta, tillsammans med det faktum att medlemmar av G-proteinkopplad receptor superfamily är ofta lätthanterliga till utveckling av potenta, selektiva och oralt biotillgängliga läkemedel (7), ledde till initiering av CCR5 ligand discovery program av flera grupper, inklusive ett team från Pfizer Global Research and Development baserat på Sandwich laboratories i Storbritannien.
Maravirok (UK-427,857, MVC) upptäcktes genom screening med hög genomströmning av Pfizer-föreningsbiblioteket med hjälp av en kemokinradioligandbindningsanalys. Den mest lovande föreningen från screeningprocessen optimerades för styrka mot receptorn, antiviral aktivitet, farmakokinetiska egenskaper och selektivitet mot humana cellulära mål genom en stor medicinsk kemi ansträngning där nästan 1000 molekyler karakteriserades (7). MVC binder i transmembranfickan av CCR5 och är en långsam offset funktionell antagonist som förhindrar internalisering (7, 8). Det har potent antiviral aktivitet mot ett brett spektrum av HIV – 1-isolat (7). Tillsammans med sin utmärkta prekliniska säkerhetsprofil och acceptabla farmakokinetik resulterade detta i att den nominerades som klinisk kandidat i December 2000 (7).
det var alltid klart att den kliniska utvecklingen av CCR5-antagonister skulle vara utmanande, eftersom dessa skulle vara de första värdinriktade ARV-läkemedlen och vi vågade därför in i okänt territorium. För att förebygga viktiga frågor inrättades ett kliniskt utvecklingsteam mycket snart efter starten av discovery-programmet och jag rekryterades för att leda det tidiga utvecklingsteamet och gick med i Pfizer i februari 1999. Vi identifierade flera viktiga utmaningar att ta itu med i utformningen av det kliniska programmet, förutom att visa säkerhet och effekt. Den första av dessa var att ingen kommersiellt tillgänglig, kliniskt validerad analys för att identifiera patienter infekterade med R5 HIV-1 fanns. Detta var kritiskt, eftersom MVC endast är aktivt mot R5 HIV-1-stammar (7). För det andra, trots den till synes friska fenotypen hos individer med CCR5-CCR32 (5, 6), kvarstod farhågor beträffande säkerheten vid långvarig exponering för CCR5-antagonister, eftersom blockering av CCR5 kan skilja sig från medfödd frånvaro av CCR5-receptorn, där immunsystemet har mognat i frånvaro av CCR5 och kompensationsmekanismer kan ha utvecklats. Slutligen, hos HIV-1-infekterade individer ökar förekomsten av CXCR4-användande HIV-1-stammar med sjukdomsprogression och minskning av CD4-cellantal (9), även om ingen orsakssamband mellan CXCR4-användande virus och CD4-cellutarmning har visats. Detta har lett till oro för att selektivt tryck från en CCR5-antagonist kan driva viruspopulationen att använda CXCR4 och resultera i CD4-cellnedgång.
fas 1 singel-och multipeldosstudier på friska försökspersoner, som genomfördes 2001 och första halvåret 2002, visade att MVC var säkert och väl tolererat i flera doser upp till 300 mg två gånger dagligen (BID), hade en farmakokinetisk profil kompatibel med oral dosering en gång dagligen (QD) eller BID, kunde kombineras med andra arv, och att doser av 100 mg två gånger dagligen resulterade i exponering över det geometriska medelvärdet antivirala IC90 in vitro (7, 10). För att demonstrera bevis på farmakologi mättes CCR5-receptormättnad med användning av en skräddarsydd ex vivo MIP-1 kg internaliseringsanalys. Dosberoende mättnad demonstrerades, med doser av 25 mg QD i 25 mg QD vilket resulterar i nära maximala mättnadsnivåer, vilket ökar den intressanta möjligheten att MVC kan vara effektiv i doser så låga som 25 mg QD. Receptormättnaden förblev hög i flera dagar efter att doseringen avbröts, vilket återspeglade långsam förskjutning från receptorn in vivo (11).
vi var både glada och uppmuntrade av fas 1-data och gick snabbt vidare till ett fas 2a proof of concept-program. HIV-1-infekterade patienter screenades endast för närvaro av R5-virus, med användning av en ny fenotypisk tropismanalys (Trofile Bisexual, Monogram Biosciences, South San Francisco, CA, USA) och fick MVC som monoterapi i 10 dagar (12). CCR5-receptormättnad mättes i denna studie för att utvärdera möjligheten att använda detta som en biomarkör för effekt och i terapeutisk övervakning. De ivrigt väntade uppgifterna levde upp till våra förväntningar och visade att doser av 100 mg två gånger dagligen resulterade i genomsnittliga maximala HIV-1 RNA-minskningar av >1.5log10 (Figur 1a), med alla patienter, exklusive en patient med X4-virus som felaktigt har inkluderats, uppnå en HIV-1 RNA-reduktion på minst 1log10 (12). Detta gav oss förtroende för att analysen korrekt identifierade patienter som sannolikt skulle svara på MVC. HIV-1 RNA-nadir inträffade 1-5 dagar efter den sista dosen av MVC, i överensstämmelse med långvarig receptormättnad som demonstrerades i fas 1-studierna (12). För alla doser utom 25 mg QD-receptormättnad >80% observerades under hela doseringsperioden. Det fanns emellertid ingen korrelation mellan virusbelastningsreduktion och grad av receptormättnad. Den mest sannolika förklaringen till detta är att mycket höga nivåer av receptormättnad krävs för antiviral effekt och den inneboende variationen i analysen tillåter inte differentiering i den graden (11, 12).
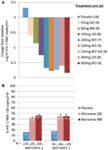
Figur 1. Maraviroc proof of concept och fas 3 effektresultat. (A) genomsnittlig maximal förändring från baseline av HIV-1 RNA hos patienter som får MVC monoterapi. Baserat på fas 1-data och modellering och simulering valdes doser från 25 mg QD till 300 mg två gånger dagligen (inklusive 150 mg två gånger dagligen som matades och fastades). HIV-1 RNA, säkerhet och MVC farmakokinetik utvärderades (12). (B) motivera 1 och 2 – andelen patienter som uppnår HIV-1 RNA <50 kopior/mL vid vecka 48. HIV-1-infekterade patienter med R5 HIV-1 och trippelklasserfarenhet och/eller resistens randomiserades för att få MVC QD eller BID, eller placebo, i kombination med en optimerad bakgrundsantiretroviral behandling (OBT). P < 0.001 (13, 14).
fas 2a-data genererade spänning i hela företaget och vi var angelägna om att utveckla det kliniska utvecklingsprogrammet så snabbt som möjligt eftersom det fanns ett stort medicinskt behov av nya arv för att behandla patienter utan eller begränsade behandlingsalternativ. Det omfattande fas 1-programmet (inklusive flera läkemedelsinteraktionsstudier) och brett dosintervall utvärderat i fas 2a proof of concept-studierna, tillsammans med modellering och simulering, gav oss en mycket god förståelse för den sannolika effektiva dosen av MVC i kombination med andra arv. Vi kunde därför gå direkt till fas 3-effektstudier som utvärderade MVC vid 300 mg (eller motsvarande, beroende på samtidigt administrerade läkemedel) QD och BID, utan att behöva göra fristående fas 2b-dosintervallstudier, vilket därmed förkortade utvecklingstidslinjen avsevärt. I slutet av 2004 initierade vi fyra stora studier; Motivera 1 och 2 i behandlingserfarna patienter med R5 HIV-1 (13, 14), MERIT (en fas 3-studie med en fas 2b-roll-in) i behandling-na-patienter med R5 HIV-1 (15) och studie a4001029, en fas 2b-säkerhetsstudie hos behandlingserfarna patienter med icke-CCR5 tropiskt virus (CXCR4-användande eller icke-fenotypbart virus) (16).
detta var ett massivt åtagande, med 4794 patienter som screenades på mer än 200 platser i USA, Kanada, Europa, Australien, Sydafrika, Mexiko och Argentina. Två andra småmolekylära CCR5-antagonister (aplaviroc och vicriviroc) utvärderades också i fas 2b-studier vid denna tidpunkt (17, 18). Förutom de vanliga utmaningarna med att hantera stora kliniska studier kastades vi två kurvbollar, den första av dessa var avbrytandet av aplavirok på grund av idiosynkratisk hepatotoxicitet. Det fanns spekulationer om att detta kan vara en klasseffekt av CCR5-antagonister som CCR5 knockout möss är mer mottagliga concanavalin-en medierad hepatoxicitet (17). Dessutom utvecklade en patient i MERIT-studien allvarlig hepatotoxicitet. Uppgifterna antydde att det sannolikt var relaterat till isoniazid eller cotrimoxazol, men en bidragande roll för MVC kunde inte uteslutas (15). En fördjupad granskning av alla data för bevis på hepatotoxicitet för MVC och en hög vaksamhet för några signaler hittade inga bevis för en systematisk ökning av leverenzymer eller andra markörer för hepatotoxicitet. Kort därefter uppstod oro över en potentiell ökad risk för vissa maligniteter, efter förekomsten av lymfom hos fyra patienter som fick vicriviroc i studie ACTG5211 (18). Inledningsvis fanns det farhågor om att detta kan vara en klass-effekt baserad på immunmodulerande potential CCR5 antagonister, men granskning av data från andra vicriviroc studier, liksom de pågående MVC studier stödde inte denna teori (18).
data från MOTIVATE 1 och 2 och A4001029 fanns tillgängliga före MERIT, eftersom studietiden vanligtvis är kortare för studier på behandlingserfarna patienter. Det var med stor spänning som vi väntade på vecka 24 interimsanalyser för MOTIVATE-studierna i oktober 2006 och vi var glada över att se att betydligt fler patienter som fick MVC hade ett HIV-1 RNA på <50 kopior/mL (nyckelmarkören för effekt) jämfört med dem som fick placebo OBT. Detta bekräftades av data från Vecka 48, vilket visar svarets hållbarhet (Figur 1b) (13, 14). Däremot verkade patienter med icke-CCR5 tropic HIV-1 som fick MVC i A4001029 inte få signifikant virologisk fördel jämfört med placebo (16). Analys av säkerhetsdata väckte inga väsentliga farhågor. Specifikt fanns det inga tecken på en negativ effekt på immunfunktionen, utan ökning av infektionsepisoder eller maligniteter hos MVC-behandlade patienter. Bedömning av virustropism vid misslyckande visade att >50% av patienterna som misslyckades med MVC-behandling hade CXCR4-användande virus vid misslyckande, men det fanns inga tecken på en skadlig effekt på CD4-cellantal (14). Virologisk bedömning visade att det CXCR4-användande viruset som uppstod under MVC-selektivt tryck var från en befintlig minoritetsbefolkning och inte uppstod de novo (19). Sammantaget visade dessa resultat tydligt nyttan av MVC i hanteringen av behandlingserfarna patienter med R5 HIV-1. En högsta ansträngning från teamet resulterade i inlämning av dokumentation för registrering i både USA och Europa endast 2 månader efter att interimsdata blev tillgängliga. MVC (300 mg BID) fick godkännande för användning (i kombination med andra arv) i USA i augusti 2007, endast 6.5 år efter det nominerades som kandidat för klinisk utveckling. En månad senare godkändes den också för användning i denna befolkning i EU.
Vecka 48-analysen av MERIT-studien var en besvikelse, eftersom MVC plus zidovudin/lamivudin (HIV-1 RNA <50 kopior/mL, 65, 3%) inte uppfyllde de förinställda kriterierna för icke-underlägsenhet (nedre gränsen för det 1-sidiga 97, 5 konfidensintervallet under -10%) till efavirenz plus zidovudin/lamivudin (HIV-1 RNA <50 kopior/ml, 69, 3%) (15). Patienter för denna studie screenades dock för R5-virus med den ursprungliga trofile-analysen. Denna analys har förbättrats under tiden för att vara mer känslig för detektering av minoritetspopulationer av CXCR4-användande virus. Alla screeningprover för patienter i meriter testades därefter med hjälp av den förbättrade analysen och en post hoc-analys utfördes inklusive endast patienter som endast hade R5-virus genom den känsligare analysen. I denna analys var svarsfrekvensen för MVC och efavirenz 68, 3 respektive 68, 5%, med den nedre gränsen för 97, 5% konfidensintervall över -10% (15). Baserat på dessa data godkändes MVC också för användning vid behandling-na-patienter i november 2009 av United States Food and Drug Administration.
MVC har inte bara visat sig vara ett värdefullt tillskott till det ständigt växande ARV-läkemedlet armamentarium, men data från dessa studier har förbättrat vår förståelse för HIV-tropism och förhållandet mellan tropism och sjukdomsprogression. För mig personligen representerade detta en period av stor spänning och tillfredsställelse, både som läkare och forskare.
Författarbidrag
er utarbetade detta manuskript baserat på hennes personliga erfarenhet som medlem i MVC-utvecklingsteamet. Alla uppgifter har publicerats i sin helhet på annat håll. Alla studier genomfördes i enlighet med principerna i Helsingforsdeklarationen och med alla internationella konferenser om harmonisering av riktlinjer för god klinisk praxis och lokala reglerings-och lagkrav. Alla studier godkändes av oberoende etikutskott och alla patienter gav skriftligt informerat samtycke.
intressekonflikt uttalande
Elna Van Der Ryst var anställd på Pfizer Global Research and development vid den tidpunkt då MVC utvecklades. Hon tillhandahåller för närvarande konsulttjänster till Pfizer.
bekräftelser
jag vill tacka kollegor från Pfizer som bidrog till MVC discovery and development program, samt utredare och patienter som deltog i de kliniska studierna.
1. Han är en av de mest kända och mest kända i världen. Förekomsten av antiretroviral läkemedelsresistens i USA. AIDS (2004) 18:1393-401. doi: 10.1097 / 01.hjälpmedel.0000131310.52526.c7
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
2. Han är en av de mest kända och mest kända i världen. HIV-1-inträde i CD4+ – celler medieras av kemokinreceptorn CC-CKR-5. Natur (1996) 381:667-73. doi: 10.1038 / 381667a0
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
3. Han är en av de mest kända i världen. HIV – 1 entry cofactor: funktionell cDNA-kloning av en sju-transmembran, g-proteinkopplad receptor. Vetenskap (1996) 272:872-7. doi: 10.1126/vetenskap.272.5263.872
CrossRef Fulltext / Google Scholar
4. Berger EA, Doms RW, Feny Baccarat EM, Korber BT, Littman DR, Moore JP, et al. En ny klassificering för HIV-1. Natur (1998) 391:240. doi:10.1038/34571
CrossRef fulltext / Google Scholar
5. Han är en av de mest kända och mest kända. Resistens mot HIV-1-infektion hos kaukasiska individer som bär mutanta alleler av CCR5-kemokinreceptorgenen. Natur (1996) 382:722-5. doi: 10.1038 / 382722a0
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Klinisk användning av CCR5-hämmare i HIV och därefter. J Transl Med(2011) 9 (Suppl 1):S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
7. Det är en av de mest populära och mest populära. Maravirok (UK-427,857), en potent, Oralt biotillgänglig och selektiv liten molekylhämmare av kemokinreceptor CCR5 med bredspektrum anti-humant immunbristvirus typ 1-aktivitet. Antimicrob Medel Chemother (2005) 49:4721-32. doi: 10.1128 / AKK.49.11.4721-4732.2005
CrossRef Fulltext / Google Scholar
8. Det är en av de mest populära och mest populära. Molekylära interaktioner av CCR5 med huvudklasser av anti-HIV-1 CCR5-antagonister med liten molekyl. Mol Pharmacol (2008) 73:789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstrakt / Pubmed Fulltext / CrossRef Fulltext / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Kemokinreceptorer som HIV – 1-samreceptorer: roller i viral inträde, tropism och sjukdom. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146/annurev.immunol.17.1.657
Pubmed Abstrakt / Pubmed Fulltext / CrossRef Fulltext / Google Scholar
10. Han är en av de mest kända och mest kända i världen. Bedömning av farmakokinetik, säkerhet och tolerans för maravirok, en ny CCR5-antagonist, hos friska frivilliga. Br J Clin Pharmacol(2008) 65 (S1): 5-18. doi:10.1111 / j. 1365-2125. 2008.03130.X
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
11. Han är en av de mest kända i världen. Farmakokinetisk-farmakodynamisk analys av CCR5-receptorbeläggning av maravirok hos friska försökspersoner och HIV-positiva patienter. Br J Clin Pharmacol(2008) 65 (S1): 86-94. doi:10.1111 / j. 1365-2125. 2008.03140.X
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
12. F. K. A., pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM, et al. Effekt av kortvarig monoterapi med maravirok, en ny CCR5-antagonist hos HIV-1-infekterade patienter. Nat Med (2005) 11:1170-2. doi: 10.1038 / Nm1319
Pubmed Abstrakt | Pubmed fulltext | CrossRef fulltext / Google Scholar
13. Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maravirok för tidigare behandlade patienter med R5 HIV-1-infektion. N Engl J Med (2008) 359:1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef fulltext / Google Scholar
14. F. K. K. A., Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Subgruppsanalyser av maravirok vid tidigare behandlad R5 HIV-1-infektion. N Engl J Med (2008) 359:1442-55. doi: 10.1056 / NEJMoa0803154
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
15. Han är en av de mest kända och mest kända. Maravirok kontra efavirenz, båda i kombination med zidovudin/lamivudin, för behandling av antiretrovirala-na-patienter med CCR5-tropic HIV-1. J Infektera Dis (2010) 201:803-13. doi:10.1086/650697
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
16. Saag M, Goodrich J, F Saugtkenheuer G, Clotet B, Clumeck N, Sullivan J, et al. En dubbelblind, placebokontrollerad studie av maravirok hos behandlingserfarna patienter infekterade med icke-CCR5-tropic HIV-1: 24 veckors resultat. J Infektera Dis (2009) 11:1638-47. doi:10.1086/598965
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
17. Vi är ett av de mest populära företagen i världen. Levertoxicitet observerad i kliniska prövningar av aplavirok (GW873140). Antimicrob Medel Chemother (2008) 52:858-65. doi: 10.1128 / AKK.00821-07
Pubmed Abstrakt / Pubmed Fulltext / CrossRef Fulltext / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, su Z, Henrich TJ, Krambrink A, et al. Lymfomdiagnos och plasma Epstein-Barr-virusbelastning under vicriviroc-terapi: resultat från AIDS kliniska prövningar grupp A5211. Clin Infektera Dis (2009) 48:642-9. doi:10.1086/597007
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext / Google Scholar
19. Han är en av de mest kända och mest kända. CXCR4-användande av virus som upptäckts hos patienter som fick maravirok i fas III-studierna MOTIVATE 1 och 2 härstammar från en redan existerande minoritet av CXCR4-användande virus. Antivir Ther (2007) 12: S65.
Google Scholar