kromosomal DNA-replikation kräver att DNA-polymeraser binds till ringformade glidklämmor som omger DNA och möjliggör höghastighets, processiv replikering. Glidande klämmor laddas på DNA av clamp loader-komplexet, en pentamerisk sammansättning av proteiner från AAA+ – familjen av Atpaser.
vi vill förstå funktionen och mekanismen för klämlastare i atomär detalj. Nya strukturer av T4-bakteriofagklämlastaren i komplex med primer-mall-DNA och glidklämman har föreslagit en arbetsmodell för klämladdarmekanismen som visas nedan (se Kelch et al Science 2011):
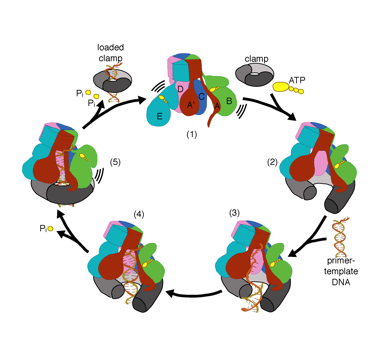
vår modell förutspår att ATP-hydrolys börjar i slutet av AAA + – spiralen och fortsätter på ett sekventiellt sätt upp spiralen, vilket resulterar i utstötning av klämlastaren från DNA och den slutna klämman. Vår hypotes illustreras i denna animering av tre på varandra följande ATP-hydrolyshändelser:
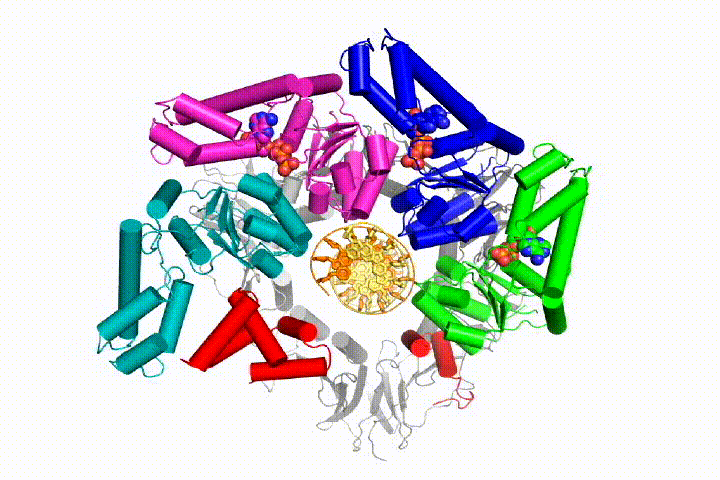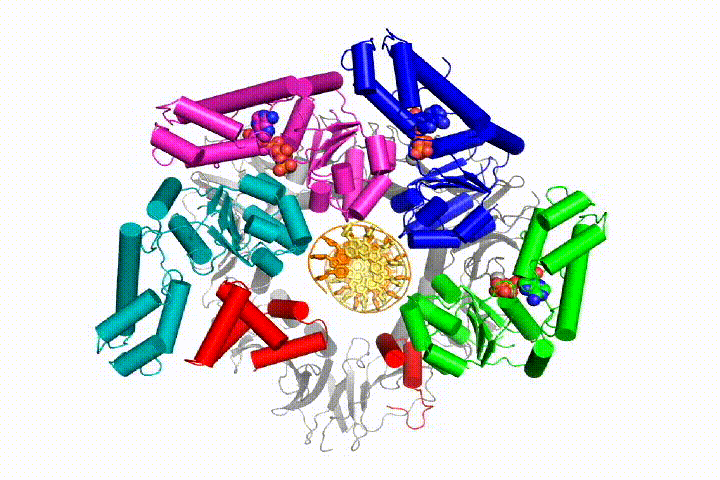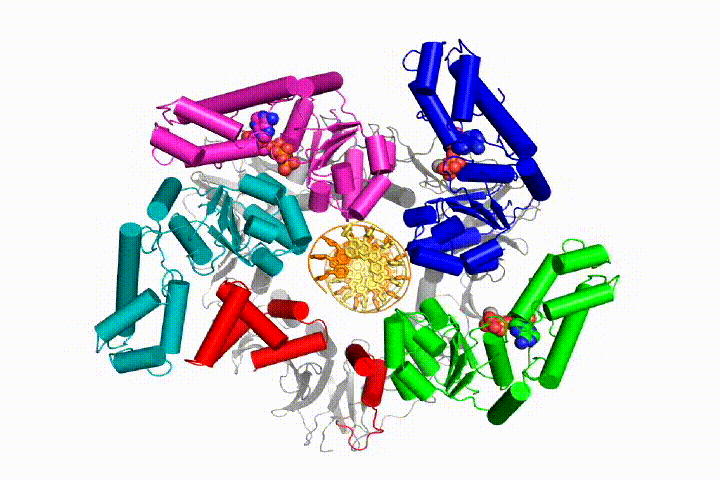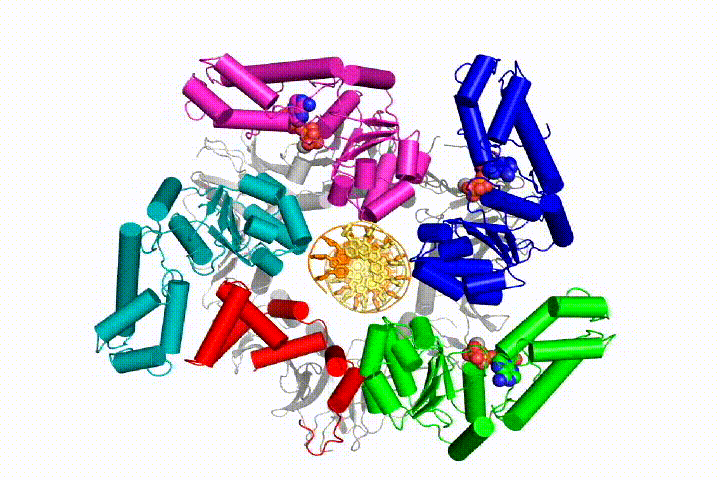
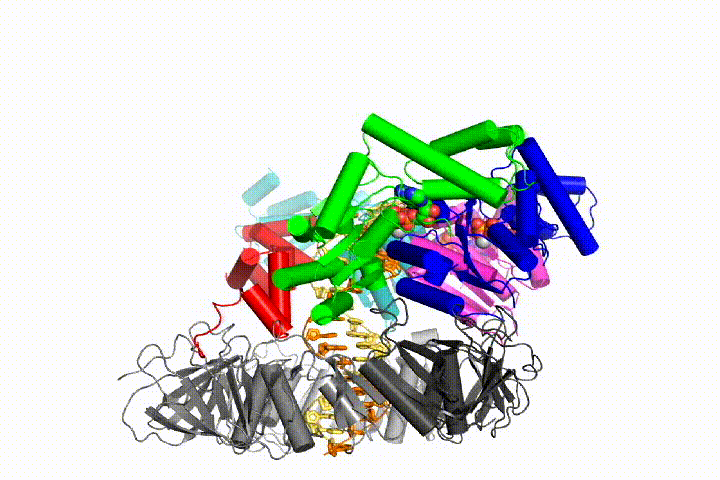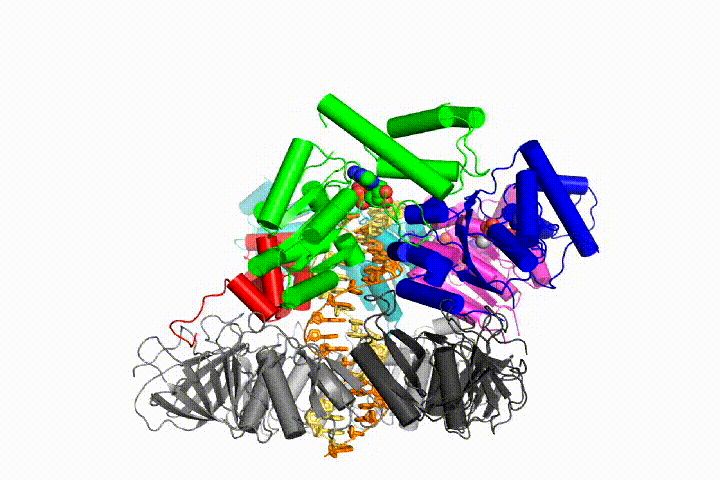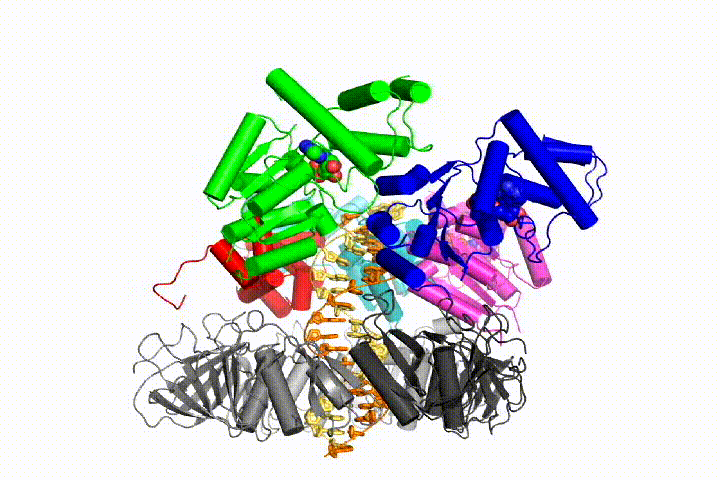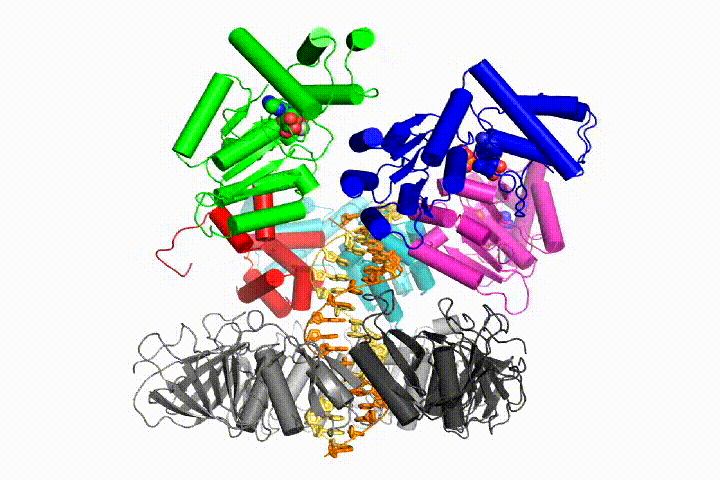
vi kommer att testa dessa modeller för klämlastare mekanism med hjälp av ett brett utbud av biokemiska, biofysiska och strukturella metoder. Att förstå klämlastarmekanismen i atomär detalj kommer att ha viktiga konsekvenser för att förstå DNA-replikation såväl som mekanismen för relaterade AAA+ – proteinaggregat. I slutändan förutser vi att vi använder vår mekanistiska förståelse för att utveckla nya nanodevices och små molekyleffektorer av AAA+ – funktion.