carcinomul cu celule scuamoase al capului și gâtului (SCCHN) este al șaselea cel mai frecvent neoplasm la nivel global, cu aproximativ 600.000 de cazuri diagnosticate anual. Ultimii 20 de ani au dat o multitudine de date din studiile clinice și acest lucru a transformat standardele de îngrijire pentru tratamentul SCCHN. Din punct de vedere istoric, controlul local slab al bolii și supraviețuirea globală au oferit un impuls pentru o multitudine de studii clinice care evaluează terapia multimodală la pacienții cu SCCHN. Anatomia complexă și rolurile funcționale și sociale critice ale regiunii capului și gâtului au motivat, de asemenea, eforturi semnificative pentru a identifica alternative la rezecția oncologică a tumorilor maligne din această regiune. În această revizuire, rezumăm dezvoltarea istorică a terapiei combinate de chimioradiere în tratamentul SCCHN, oferim o actualizare a literaturii recente în acest domeniu și discutăm întrebări clinice contemporane pe care studiile viitoare le pot rezolva.
Chimioradierea concomitentă—de la tratamentul Experimental la tratamentul preferat
investigația clinică privind rolul tratamentului combinat de chimioradiere pentru SCCHN datează cel puțin la sfârșitul anilor 1960, cu studii timpurii care explorează utilizarea secvențială și concomitentă a agenților unici, inclusiv fluorouracil (5FU), bleomicină, cisplatină, metotrexat și mitomicină.1 astfel de studii au demonstrat un răspuns slab la chimioterapia în monoterapie, în timp ce au indicat cisplatina ca fiind cea mai eficientă monoterapie, cu o rată de răspuns de 25-30%.2-4 studii ulterioare au explorat rolul chimioterapiei multi-agent și au demonstrat o îmbunătățire semnificativă a răspunsului bolii la 70% cu cisplatină combinată și bleomicină5 și >90% ratele de răspuns cu cisplatină și perfuzie continuă 5FU.6,7 important, aceste studii timpurii au indicat un beneficiu potențial de supraviețuire din adăugarea chimioterapiei la tratamentele tradiționale definitive de radiații și / sau intervenții chirurgicale pentru SCCHN și au determinat investigații suplimentare în studii randomizate mai mari de fază III.
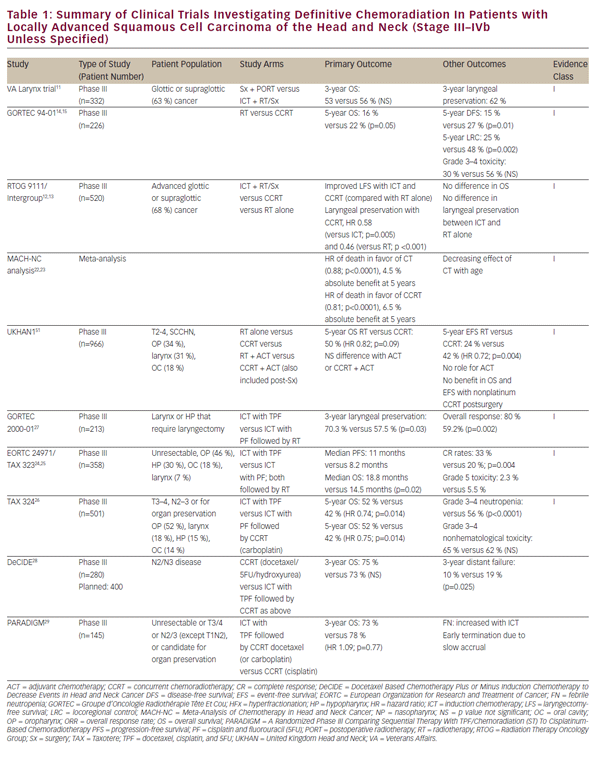
odată cu rafinarea regimurilor chimioterapeutice, s-a luat în considerare potențialul abordărilor de chimioradiere definitive și care economisesc organele la pacienții cu SCCHN avansat local. Această lucrare a fost inițial avansată de o serie de studii cu o singură instituție care demonstrează viabilitatea chimioradiației definitive ca alternativă la intervenția chirurgicală pentru tumorile laringiene glotice și supraglotice.8-10 din punct de vedere istoric, studiul cancerului laringian Veteran Affairs a demonstrat în cele din urmă că chimioterapia de inducție (TIC) urmată de radiații ar putea realiza conservarea organelor la pacienții cu SCCHN fără compromisuri în supraviețuirea globală.11 acest studiu a stabilit o justificare pentru studiul landmark radioterapia Oncology Group (RTOG) 9111, care a abordat secvențierea adecvată a chimioterapiei și a radiațiilor la pacienții cu cancer de laringe supraglotic sau glotic avansat local. Pacienții au fost randomizați la: TIC urmat de radiații; chimioradiație concomitentă (CCRT); sau radiații singur.12,13 rezultatele RTOG 9111 au demonstrat superioritatea CCRT în ceea ce privește controlul bolii locoregionale și conservarea laringelui, în timp ce nu s-a observat nicio diferență în supraviețuirea globală între cele trei brațe. Ulterior, studiul Groupe d ‘ Oncologie Radioth Oqustrapie t Inktte et Cou (GORTEC) 94-01 a randomizat pacienții cu tumori primare orofaringiene avansate local la radiații sau CCRT cu carboplatină/5FU și a demonstrat un control local îmbunătățit al bolii, precum și supraviețuirea globală.14,15 îmbunătățiri similare ale supraviețuirii și controlului locoregional au fost raportate la pacienții nazofaringieni tratați cu CCRT.16-21 un raport din Meta-analiza chimioterapiei în cancerul capului și gâtului (MACHNC) a sugerat un beneficiu global de supraviețuire de 6,5% la 5 ani cu CCRT, dar nu cu TIC sau chimioterapie adjuvantă.22,23 efectul chimioterapiei asupra supraviețuirii în această meta-analiză a fost observat să scadă odată cu vârsta pentru cei cu vârsta peste 50 de ani, fără niciun beneficiu demonstrabil demonstrat la cei 71 de ani sau mai mult. În mod colectiv, deși aceste studii diferă în ceea ce privește criteriile de includere și excludere, criteriile finale clinice și metodologiile de tratament (vezi Tabelul 1), ele confirmă un beneficiu al CCRT comparativ cu radioterapia ca tratament definitiv pentru SCCHN avansat local.
Chimioterapia De Inducție Care Precede Radiațiile (Chemo)—O Strategie Viabilă?
deși o comparație cap-la-cap cu CCRT a indicat inferioritatea TIC în ceea ce privește controlul local al bolii în studiul clinic RTOG 9111,12 există în continuare interes pentru această abordare terapeutică. Datele din RTOG 9111 indică echivalența acestor abordări în ceea ce privește toxicitatea de grad înalt, ceea ce face dificilă justificarea alegerii TIC pe motive de toleranță a pacienților. Cu toate acestea, studiile ulterioare RTOG 9111 au căutat să se dezvolte pe platforma TIC pentru a face din aceasta o opțiune de tratament mai viabilă. Studiul EORTC 24971 / TA x 32324, 25 a demonstrat o supraviețuire globală îmbunătățită prin adăugarea de docetaxel (TPF) la regimul TIC cisplatină și 5FU (PF) utilizat în studiul RTOG 9111 la pacienți cu CSCHN inoperabil. Studiul TA x 324 a evaluat în mod similar TPF comparativ cu PF în stabilirea CCRT și înlocuirea săptămânală a carboplatinei cu cisplatină în aceste regimuri. Acest studiu a demonstrat îmbunătățirea controlului locoregional și la distanță al bolii, precum și îmbunătățirea supraviețuirii globale cu TPF comparativ cu PF.26 Un studiu suplimentar de urmărire (GORTEC 2000-01) în cancerul laringian și hipofaringian avansat local a confirmat răspunsul îmbunătățit al bolii și conservarea laringelui cu TPF de inducție comparativ cu PF, dar nu a demonstrat niciun efect asupra supraviețuirii.27 deși aceste studii diferă în ceea ce privește criteriile de includere și excludere, obiectivele clinice și metodologiile de tratament (a se vedea tabelul 1), ele susțin în mod colectiv superioritatea TPF față de TIC bazate pe PF. Cu toate acestea, nu există o comparație directă a TIC cu CCRT pe bază de cisplatină standard de îngrijire.
meta-analiza MACH-NC, după cum sa menționat anterior, a sugerat inferioritatea TIC în comparație cu CCRT în ceea ce privește supraviețuirea globală și controlul bolii locoregionale.22 Cu toate acestea, este de remarcat faptul că beneficiul TIC a fost mai pronunțat decât cel al CCRT în ceea ce privește ratele metastazelor la distanță.22 acest lucru poate reflecta un rol distinct al chimioterapiei în aceste abordări de tratament. Chimioterapia concomitentă poate juca un rol predominant de radiosensibilizare, rezultând un efect dominant asupra controlului local al bolii, în timp ce Tic multi-agent poate oferi un tratament sistemic eficient pentru boala micro-metastatică. Această observație generatoare de ipoteze sugerează o natură potențial complementară a acestor tratamente și a determinat interesul pentru combinația lor. Până în prezent, eforturile de a examina combinația dintre TIC și CCRT au avut ca rezultat rezultate slabe de acumulare și constatări neconcludente (studii de decizie și paradigmă).28,29 un studiu randomizat de fază III în curs de desfășurare compară TIC cu PF sau TPF urmat de CCRT pe bază de cisplatină față de CCRT singur ca tratament de primă linie pentru SCCHN avansat local (NCT00261703). Rezultatele studiilor de mai sus privind CCRT și TIC sunt, de asemenea, rezumate în tabelul 1.
Chimioradiere adjuvantă
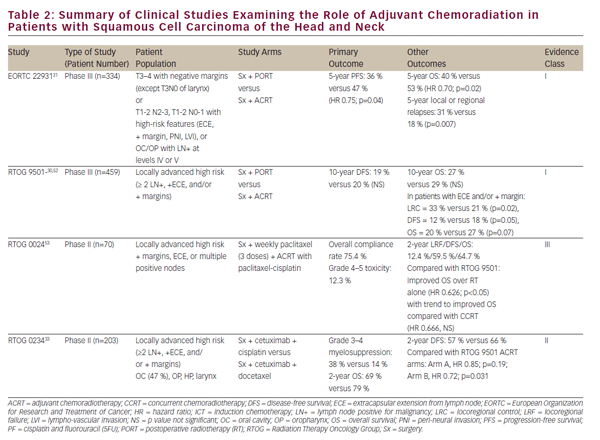
studiile clinice menționate mai sus au stabilit CCRT ca un tratament definitiv viabil pentru conservarea organelor în SCCHN avansat local. Cu toate acestea, rezecția oncologică definitivă rămâne o opțiune importantă de tratament pentru boala localizată și o parte vitală a terapiei multimodale pentru tumorile avansate ale cavității bucale, laringelui și hipofaringelui. Rolul chimioradiației în stabilirea adjuvantă după rezecția oncologică a fost în mare parte definit de două studii randomizate de fază III— EORTC 22931 și RTOG 950130,31 (vezi Tabelul 2). Aceste studii au examinat utilizarea radiațiilor postoperatorii comparativ cu chimioradierea adjuvantă cu cisplatină administrată la fiecare 3 săptămâni timp de trei cicluri la pacienții cu SCCHN postoperator. Ambele studii au demonstrat o îmbunătățire a controlului bolii locoregionale și a supraviețuirii fără progresia bolii, în timp ce studiul EORTC a arătat, de asemenea, o îmbunătățire a supraviețuirii globale. O analiză post-hoc a acestor două studii a sugerat că beneficiul CCRT adjuvant a fost cel mai mare la cei cu margini chirurgicale pozitive și/ sau extensie extracapsulară (ECE) din ganglionii limfatici rezecați.32 rolul CCRT adjuvant la pacienții cu margini chirurgicale apropiate este mai puțin clar și a fost susținut de EORTC 22931, care a inclus pacienți cu margini chirurgicale de 5 mm de la suta. Pe de altă parte, RTOG 9501 a inclus pacienți pe baza marjelor pozitive, dar nu apropiate. Analiza Post-hoc nu a sugerat niciun beneficiu aparent al CCRT pentru pacienții care îndeplinesc criteriile de intrare pentru doar unul dintre aceste studii.32 în mod similar, CCRT adjuvant nu a fost studiat în mod adecvat la pacienții vârstnici, deoarece cei cu vârsta peste 70 de ani au fost excluși de la EORTC 22931 și cuprind doar o mică minoritate (5%) dintre pacienții din RTOG 9501.30,31
Pursuant to EORTC 22931 and RTOG 9501, adjuvant CCRT has now become standard-of-care treatment in high-risk postoperative SCCHN patients. The phase II RTOG 0234 study has explored alternative adjuvant chemoradiation treatment regimens, randomizing patients with multiple involved lymph nodes, ECE, or positive margins to the epidermal growth factor receptor (EGFR) antibody, cetuximab, plus docetaxel or cetuximab plus cisplatin. This study demonstrated an apparent survival benefit from concurrent adjuvant cetuximab and docetaxel.33 rezultatele acestui studiu intrigant de fază II necesită validare într-un studiu de fază III înainte de încorporarea în practica clinică.
impactul fracționării radioterapiei asupra Chimioradiației
în efortul de a spori eficacitatea, studiile clinice anterioare au investigat scheme alternative de fracționare pentru administrarea radioterapiei cu sau fără chimioterapie concomitentă la pacienții cu SCCHN. Studiile RTOG 9003 și grupul danez de cancer al capului și gâtului (DAHANCA) au demonstrat îmbunătățirea controlului locoregional al bolii cu regimuri de radioterapie accelerată sau hiperfracționată atunci când radiațiile sunt utilizate singure.34,35 o meta-analiză ulterioară a sugerat chiar un beneficiu modest de supraviețuire din hiper-fracționarea radiațiilor atunci când este utilizată ca modalitate unică de tratament.36 Cu toate acestea, în cadrul chimioterapiei concomitente, studiile RTOG 0129 și gortec 99-02 nu au demonstrat nicio îmbunătățire a rezultatului clinic cu utilizarea radioterapiei accelerate comparativ cu cea convențională.37,38 CCRT hiper-fracționat, comparativ cu radiația hiper-fracționată singură, a dus la îmbunătățirea controlului locoregional al bolii într-un studiu cu o singură instituție de la Universitatea Duke și un studiu de fază III din Iugoslavia, acesta din urmă prezentând, de asemenea, o supraviețuire globală îmbunătățită și o supraviețuire fără metastaze la distanță.39,40 aceste studii indică faptul că beneficiul CCRT persistă cu radioterapia hiper-fracționată. O comparație directă a CCRT fracționată convențional și a ccrt hiper-fracționată nu a fost efectuată până în prezent. Cu toate acestea, este de remarcat faptul că meta-analiza MACH-NC nu a detectat nicio diferență de rezultat în rândul pacienților tratați cu CCRT folosind tehnici convenționale sau modificate de fracționare.22
toxicitate—costul Chimioradierii
în acord cu multe studii cu o singură instituție care au precedat-o, RTOG 9111 a indicat că beneficiile chimioterapiei, indiferent dacă sunt administrate secvențial sau concomitent cu radiațiile, vin în detrimentul toxicității suplimentare.12 în mod similar, în cadrul adjuvant, atât studiile clinice EORTC 2291, cât și RTOG 9501 au demonstrat o dublare aproximativă a toxicităților de grad 3 cu chimioradiere, comparativ cu numai radiațiile.30,31 o astfel de tendință persistă chiar și în stabilirea radioterapiei hiper-fracționate.39 deși rata preconizată a oricărei toxicități specifice, determinată din studiile istorice, este probabil supraestimată în epoca actuală a tehnicilor de radioterapie foarte conforme, cum ar fi radioterapia modulată de intensitate (IMRT). Două studii mici, randomizate, au raportat o reducere semnificativă a incidenței și severității xerostomiei cu utilizarea IMRT comparativ cu radioterapia conformală tridimensională convențională pentru cancerele capului și gâtului (intensitatea parotidă modulată comparativ cu radioterapia convențională în cancerul capului și gâtului și testele Tata Memorial Hospital).41,42 cele mai recente studii care investighează CCRT permit furnizarea tratamentului pe bază de IMRT ca abordare standard în gestionarea SCCHN. Rămâne de văzut ce impact va avea IMRT asupra ratelor de toxicitate atunci când este combinat cu chimioterapia în aceste studii randomizate mai mari.
îmbunătățirea tehnicilor de radioterapie împreună cu creșterea importanței și disponibilității îngrijirii de susținere și a serviciilor auxiliare, cum ar fi speechswallow patologia și îngrijirea dentară limitează și mai mult incidența toxicităților non-hematologice grave. Cu toate acestea, toxicitatea anticipată de la CCRT este încă de așteptat să fie mai mare decât radioterapia în monoterapie. Această toxicitate persistentă reflectă costul clinic al combinării chimioterapiei cu radiațiile. În acest context, rămâne extrem de important ca medicii să evalueze în mod cuprinzător pacienții pentru a determina că beneficiile potențiale ale CCRT justifică acest cost. Utilizarea tratamentelor bazate pe radioterapie cu o singură modalitate la pacienții cu comorbidități marcate/stare de performanță scăzută la momentul inițial sau cu boală în stadiu incipient cu risc scăzut poate fi o abordare rezonabilă pentru a maximiza raportul terapeutic. Această Analiză risc-beneficiu devine și mai importantă odată cu apariția agenților moleculari vizați care oferă o opțiune alternativă viabilă pentru terapia concurentă.
rolul emergent al agenților direcționați Molecular
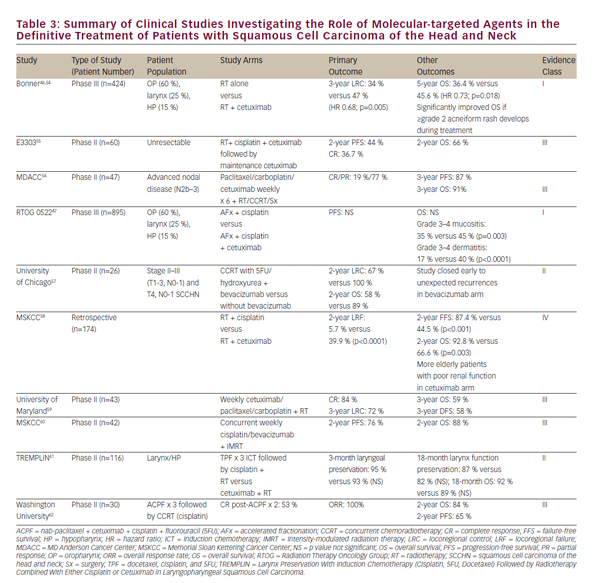
toxicitatea tratamentului de chimioradiere, precum și dorința de a îmbunătăți în continuare rezultatele clinice, au favorizat un interes în creștere în rolul agenților direcționați molecular pentru tratamentul SCCHN. EGFR este supraexprimat sau mutat în 80-90% din tumorile SCCHN și acest lucru este asociat cu scăderea răspunsului la radioterapie și rezultate clinice mai slabe.43-45 în 2006, Bonner și colab. raportat într-un studiu de referință la pacienții cu SCCHN avansat local tratați fie cu radiații în monoterapie, fie cu radiații concomitente cu anticorpul EGFR, cetuximab. Acest studiu a demonstrat că cetuximabul concomitent și radiațiile au crescut controlul bolii locoregionale și supraviețuirea globală fără a exacerba toxicitatea comună a radiațiilor.46 Acest studiu a definit un rol pentru cetuximab concomitent și radiații la pacienții care nu sunt candidați pentru cisplatină.
studiile ulterioare au căutat să compare CCRT cu cetuximab concomitent cu cel cu cisplatină. Studiile Retrospective și de fază timpurie au diferit în această evaluare și o comparație randomizată a fazei III este în curs de desfășurare în RTOG 1016. În special, studiul RTOG 0522 a evaluat beneficiul potențial suplimentar al cetuximabului la un regim pe bază de ccrt47 pe bază de cisplatină. Acest studiu a arătat că, atunci când a fost adăugat la CCRT standard pe bază de platină, cetuximab nu a îmbunătățit în continuare supraviețuirea fără progresie sau globală. În cadrul postoperator, RTOG 0920 va evalua radioterapia adjuvantă cu sau fără cetuximab în SCCHN rezecat local avansat, în timp ce studiul RTOG 1216 de fază II/III va evalua ccrt adjuvant cu cisplatină concomitentă versus docetaxel versus docetaxel și cetuximab pentru SCCHN cu risc ridicat.
au fost efectuate sau sunt în curs de desfășurare numeroase studii clinice în fază incipientă cu agenți moleculari direcționați suplimentari împreună cu radiații pentru tratamentul SCCHN. O selecție a acestora este rezumată în i > Tabelul 3. Cu excepția studiilor privind cetuximab, niciun alt agent vizat molecular nu a avansat până la un punct de influențare a practicii curente în afara unui cadru de studiu clinic. În timp ce perspectiva agenților vizați molecular este promițătoare, chimioterapia cisplatină cu doză mare concomitentă rămâne recomandarea preferată, de nivel 1, a ghidurilor actuale de îngrijire națională cuprinzătoare (NCCN) pentru CCRT.
terapia de Chimioradiere în cancerul capului și gâtului—o paradigmă în evoluție
ultimii 20 de ani au văzut apariția chimioradierii ca standard de îngrijire în tratamentul definitiv al SCCHN. La pacienții selectați în mod corespunzător, beneficiul demonstrabil de supraviețuire al acestui tratament depășește riscurile de toxicitate suplimentară. Cu toate acestea, rămân întrebări importante cu privire la utilizarea optimă a chimioradiației. O serie de studii clinice au explorat în continuare utilitatea clinică potențială a TIC la pacienții scchn avansați local și, deși aceste studii au demonstrat îmbunătățirea regimurilor TIC în detrimentul toxicității, niciunul nu a demonstrat în mod concludent o îmbunătățire clinică semnificativă în comparație cu CCRT pe bază de cisplatină.
studiile viitoare vor continua, fără îndoială, să exploreze regimuri alternative de chimioterapie și scheme de dozare, precum și metode de fracționare, dozare și livrare a radioterapiei, într-un efort de a avansa tehnicile existente. Mai mult, odată cu dezvoltarea continuă a chimioterapicelor noi cu țintă moleculară, studiile viitoare vor defini aproape sigur un rol înfloritor pentru acești agenți în tratamentul SCCHN. Deosebit de interesantă poate fi utilizarea acestor agenți într-un cadru de inducție înainte de CCRT, unde pot viza boala micro-metastatică și pot reduce recidiva bolii la distanță, fără a impune limitări legate de toxicitate asupra ratelor de finalizare a CCRT. În timp ce utilizarea CCRT evoluează, continuarea investigației privind rolul adecvat al intervenției chirurgicale în SCCHN este, de asemenea, justificată. Progresele atât în chirurgia robotică, cât și în abordările de tratament cu chimioradiație oferă echilibru pentru o astfel de investigație. Ghidurile de practică actuale recomandă chimioradierea adjuvantă pentru pacienții postoperatori cu margini pozitive sau ECE, în timp ce radiația adjuvantă singură sau luarea în considerare a chimioradierii este recomandată pacienților postoperatori cu boală nodală primară pT3 sau pT4, pN2 sau pN3, implicarea ganglionilor limfatici de nivel IV sau V sau cu invazie peri-neuronală sau limfo-vasculară. Studiile suplimentare care identifică predictorii radiografici preoperatori și clinici ai stării de risc ridicat în rândul pacienților cu SCCHN în stadiu incipient se vor dovedi valoroase în ghidarea tratamentului unor astfel de pacienți care ar putea fi scutiți de o intervenție chirurgicală cu o abordare de tratament definitiv de chimioradiere.
recenta recunoaștere a infecției cu virusul papiloma uman (HPV) ca cauză și factor de prognostic favorabil în SCCHN originar din orofaring48 și potențial alte site-uri transformă concepția SCCHN ca entitate a bolii. Într-o analiză retrospectivă a RTOG 0129, supraviețuirea globală de 3 ani pentru pacienții cu tumori pozitive pentru HPV a fost de 82,4% față de 57% pentru boala HPV-negativă (p49,50 având în vedere acest lucru, studiile viitoare vor fi în mod necesar stratificate în funcție de statutul HPV sau adaptate la un subset de pacienți HPV-pozitivi sau negativi, determinând o schismă crescândă în abordările de tratament. Deja se ridică perspectiva investigării abordărilor de tratament mai puțin toxice pentru tumorile HPV-pozitive și tratamente definitive mai agresive pentru tumorile HPV-negative, pentru a explica diferențele puternice în răspunsurile lor respective la modalitățile actuale de tratament. RTOG 1016 este un astfel de studiu care evaluează în mod specific pacienții HPV-pozitivi pentru intensificarea tratamentului prin utilizarea cetuximab concomitent cu radiații comparativ cu CCRT standard pe bază de cisplatină. Interacțiunea regimurilor de tratament specifice și a agenților specifici cu țintă moleculară cu statutul de HPV tumoral se va dovedi, fără îndoială, un teren fertil pentru cercetările viitoare. Rămâne de văzut ce impact va avea epidemia de HPV în creștere și programele actuale de vaccinare asupra rezultatelor clinice și abordărilor de tratament la pacienții cu SCCHN.