Introducere
Helicobacter pylori (H. pylori) este o bacterie Microaerofilă Gram-negativă, al cărei habitat natural este stomacul. Deși are de obicei o formă bacilară cu mai mulți flageli la un capăt, adoptă un aspect coccoid în condiții nefavorabile de mediu.1,2
H. pylori este un factor etiologic major în gastrita cronică activă, ulcerul peptic, limfomul țesutului limfoid asociat mucoasei gastrice (MALT) și cancerul gastric. Deși se estimează că bacteria este prezentă în mucoasa gastrică a jumătate din populația lumii, aceste boli se dezvoltă doar la aproximativ 15-20% dintre indivizii colonizați.2,3
cele mai frecvente scheme de tratament au dus la o rată de eradicare de aproximativ 85% în multe zone geografice,4-6 dar eficacitatea a fost compromisă, în special în ultimii ani, de apariția rapidă a tulpinilor rezistente la antibiotice și de aderența slabă la tratament.5,7
este important să se considere că vindecarea (precum și prevenirea complicațiilor) pentru gastrita cronică activă și ulcerul peptic și pentru unele forme de grad scăzut de limfom malț gastric depinde de succesul eradicării H. pylori. Mai mult, asigurarea și susținerea eradicării cu succes a acestui microorganism în toate formele sale biologice ar preveni recrudescența infecției și, prin urmare, recidivele bolii.
scopul acestei revizuiri este de a prezenta o prezentare generală a formei coccoide a H. pylori, evidențiind profilul său microbiologic, susceptibilitatea la antibiotice și virulența. Implicarea sa în boala gastrică va fi, de asemenea, analizată și va fi examinată măsura în care este asociată cu recrudescența infecției și recidiva bolii.
supraviețuirea și adaptarea celulară a H. considerații generale pylorigenerale
toate organismele vii sunt echipate cu mecanisme care le permit să supraviețuiască în medii adverse. Pentru unii, răspunsul lor implică (pe lângă adaptările metabolice) modificări ale morfologiei celulare.8,9 mai multe microorganisme au capacitatea de a se diferenția într-o stare viabilă, dar neculturabilă (VBNC) ca răspuns la condițiile de mediu nefavorabile supraviețuirii și creșterii. Această strategie este utilizată pe scară largă de microorganisme precum Salmonella, Campylobacter și Escherichia.10,11
în starea VBNC, bacteriile își reduc în general dimensiunea și își schimbă forma pentru a deveni corpuri sferice mici. Acestea reduc rata de respirație și transportul nutrienților și schimbă expresia genelor și sinteza moleculară. În această stare nu pot fi detectate folosind tehnici de cultură convenționale. Cu toate acestea, modificările condițiilor de mediu pot determina aceste microorganisme fie să „reînvie” (și să se reconvertească la starea lor activă), fie să degenereze.10-13
În Mod Similar, H. pylori, atunci când se confruntă cu condiții dăunătoare de mediu (în sau în afara habitatului său natural), își schimbă forma bacilară clasică și intră într-o stare VBNC care duce la modificări morfologice și metabolice, precum și modificări ale comportamentului de creștere.14,15
stare viabilă, dar neculturabilă a H. pylori
deși unii autori au încercat inițial să demonstreze că conversia de la forma bacilară la coccoidă a fost un proces pasiv care a dus la moartea celulelor și, prin urmare, că formele coccoide au fost rămășițele degenerate ale bacteriilor moarte,16,17 trei forme de H. în prezent, se consideră că există pylori, și anume (în ordinea celor mai puțin virulenți), forma bacilară viabilă, culturabilă, forma coccoidă VBNC și forma degenerativă neviabilă.18-20
morfologic, conversia de la forma bacilară la forma coccoidă are loc prin formele intermediare V și U13,14 (Fig. 1 și 2), în care structurile celulare precum citoplasma și membrana celulară rămân intacte,15, 21 în timp ce flagelii tind să se înfășoare în jurul structurii celulare coccoide, devenind astfel aproape invizibili. Alte modificări ultrastructurale ale formei coccoide au ca rezultat două subtipuri. Tipul A are margini neregulate cu o suprafață aspră și este considerat a fi o celulă moartă, în timp ce tipul B are o suprafață mai netedă, este mai mic și este considerat a fi o celulă vie.21,22
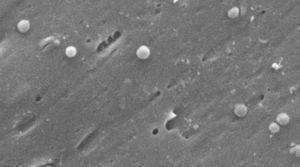
imagini ale formei coccoide a Helicobacter pylori. Microscop electronic cu scanare pentru imagine, multumim Dr. Nuno F. Azevedo. LEPABE-Departamentul de Inginerie Chimică al Facultății de inginerie de la Universitatea din Oporto (Portugalia).
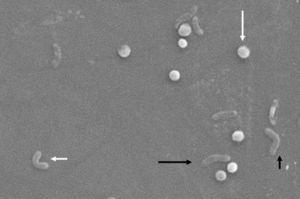
modificări morfologice în Helicobacter pylori. Formă spirală (săgeată neagră lungă), formă V (săgeată neagră scurtă), formă U (săgeată albă scurtă) și formă coccoidă (săgeată albă lungă). Microscop electronic cu scanare pentru imagine, multumim Dr. Nuno F. Azevedo. LEPABE-Departamentul de Inginerie Chimică al Facultății de inginerie de la Universitatea din Oporto (Portugalia).
în analiza microscopului electronic de scanare (SEM) a stratului de gel mucus de suprafață al pacienților cu cancer gastric infectați cu H. pylori, Ogata și colab.23 a observat coexistența atât a formelor bacilare, cât și a celor coccoide. Alți autori au confirmat prezența formei coccoide atât în stomacul uman,cât și în duoden, 24-26 deși se pare că procentul formelor coccoide este mai mare în duoden decât în stomac, până la punctul în care se observă doar forma coccoidă în unele biopsii duodenale.26,27 acest fapt sugerează fie că H. pylori este forțat să se adapteze condițiilor biologice din duoden sau că aceste condiții sunt ideale pentru ca H. pylori să se refugieze acolo în starea VBNC.
experimentele In vitro și in vivo au arătat că, în condiții nefavorabile precum aerobioza,28,29 pH alcalin,29,30 temperatură ridicată,31 perioade lungi de incubație,29,32 incubare prelungită în apă33 sau tratament cu inhibitori ai pompei de protoni32 sau antibiotice,34 fenotipul coccoid poate menține un anumit nivel de activitate metabolică, deoarece exprimă o mare varietate de gene prezente în forma bacilară,35 menține niveluri detectabile ale activității ureazei,36 continuă sintetizarea proteinelor, deși cantități mai mici (mai puțin de 1% din cantitatea de proteine sintetizate de forma bacilară) 37 și produce cantități mici de ADN, menținute chiar și după 3 luni de depozitare în soluție salină fiziologică la 4 centi C. 29, 38 toate aceste date subliniază faptul că modificările biologice ale H. pylori ca răspuns la stimulii nocivi reflectă capacitatea sa puternică, în timpul vieții sale utile, de a conserva specia.
formarea biofilmului
ca și în cazul altor bacterii, capacitatea H. pylori de a persista ca entitate infecțioasă și de a rezista arsenalului de agenți antimicrobieni care vizează eradicarea acesteia se datorează variabilității genetice care îi permite să dezvolte rezistență bacteriană. Strategia sa de supraviețuire este îmbunătățită în continuare atunci când celulele bacteriene formează ceea ce se numesc biofilme.20 biofilmele sunt un fel de „comunitate” microbiană în care bacteriile aderă ferm la suprafețele biotice sau abiotice prin intermediul unei matrice auto-produse. Această matrice, compusă din substanțe polimerice extracelulare,39,40 creează un mediu foarte tolerant la agenții antimicrobieni și puternic rezistent la fagocitoză. Prin urmare, sunt evitate diverse mecanisme de apărare a gazdei, ceea ce face dificilă eradicarea. Biofilmele sunt considerate a fi sisteme cu adevărat complexe, dinamice, care facilitează transferul orizontal de gene între bacterii. Astfel, acestea conferă populațiilor bacteriene noi genomi modificați care contribuie semnificativ la rezistența bacteriană, variabilitatea tulpinilor și adaptabilitatea.41-43
într-un studiu efectuat pe 21 de biopsii de la pacienți la care bacteria a fost eradicată anterior, H. pylori a fost izolat prin cultură în 7 dintre biopsii, în timp ce tehnicile de exprimare a genelor au detectat celule viabile de H. pylori în majoritatea biopsiilor. Între timp, sem a arătat bacterii coccoide grupate aranjate într-un biofilm microbian, sugerând că formele coccoide ar putea facilita persistența bacteriană și rezistența la antibiotice.44
susceptibilitatea la antibiotice a formei coccoide
multe studii au arătat că H. pylori se poate schimba de la forma bacilară la cea coccoidă la expunerea (in vitro) la diferiți agenți antimicrobieni. Diferite concentrații de amoxicilină, claritromicină, metronidazol și eritromicină (pentru a menționa doar câteva dintre antibioticele disponibile) pot induce această transformare morfologică.34,35,45 cel mai mare efect de inducție a fost observat cu amoxicilina,27,34,46 cunoscută a fi foarte eficientă in vitro împotriva H. pylori; cu toate acestea, observațiile morfologice ale culturilor arată că formele bacilare scad în număr în favoarea formelor coccoide.34,46 Faghri și colab.,47 a obținut efecte bactericide pentru formele coccoide, la peste 60% cu metronidazol la de două ori concentrația minimă inhibitoare (MIC) și la 80-90% cu claritromicină la MIC; cu toate acestea, tratamentul cu amoxicilină cu MIC și MIC 2 nu a inhibat formele coccoide viabile. În mod similar, Berry și colab.34 a observat că, în timp ce amoxicilina la MIC 10 a eliminat formele bacilare ale H. pylori, a indus și formarea formelor coccoide. Perkins și colab.48 a observat, într-un studiu al pisicilor infectate în mod natural cu H. pylori, că la 6 săptămâni după tratamentul de eradicare, sucurile gastrice au fost pozitive pentru H. pylori la o singură pisică, totuși analiza reacției în lanț a polimerazei (PCR) a identificat materialul genetic H. pylori la toate pisicile din studiu. Chiar dacă H. pylori a fost detectat la o singură pisică, leziunile histologice au fost în concordanță cu gastrita cronică și au fost marcate de prezența foliculilor limfoizi.
având în vedere aceste date microbiologice și de cercetare de bază, într—un studiu anterior efectuat la pacienți infectați cu H. pylori—unde sensibilitatea tulpinilor izolate la amoxicilină a fost determinată anterior-terapia duală (inhibitori ai pompei de protoni și amoxicilină) a obținut o rată de vindecare pentru tulpinile sensibile la amoxicilină de numai 66%. Acest rezultat demonstrează prezența unor factori suplimentari importanți de rezistență bacteriană independenți legați de utilizarea cu succes a acestui antibiotic.49 acest lucru este valabil mai ales dacă considerăm că pare imposibil ca formele coccoide să fie sensibile la antibioticele lactamice, deoarece formele coccoide au profiluri proteice de legare a penicilinei diferite de formele bacilare.50 prin urmare, este probabil ca nu toate organismele H. pylori să fie complet eliminate în urma tratamentului de eradicare; mai degrabă, este posibil ca unele să fie transformate în forme coccoide și astfel să devină rezistente la medicamentele antibacteriene. Acest lucru ar explica eșecul tratamentului și recrudescența.13,34,45
merită subliniat faptul că unele studii foarte recente au demonstrat că acizii grași liberi, cum ar fi acidul linolenic și acidul linolenic lipozomal, au un efect bactericid asupra ambelor forme de H. pylori, indiferent de rezistența lor la antibiotice.51,52 aceste molecule ar putea avea, prin urmare, un efect antimicrobian potențial eficient în tratarea infecției cu H. pylori, în special în forma sa coccoidă.
virulența și patogenitatea formei coccoide
factorii de virulență pentru forma bacilară a H. pylori și mecanismele prin care această bacterie este implicată în dezvoltarea bolilor gastro-intestinale au fost studiate pe larg.1,3,4 cu toate acestea, se știe puțin despre virulența și patogenitatea formei coccoide. Mai jos analizăm cele mai relevante constatări pe această temă.
ca și forma bacilară, forma coccoidă exprimă gene majore de virulență, cum ar fi ureea, ureB, hpaA, vacA și cagA, cagE și BabA.35,53,54 această expresie, care apare pe o perioadă lungă de timp, joacă probabil un rol important în tulburările cronice severe ale stomacului.
aderența H. pylori la epiteliul gastroduodenal este cunoscut a fi un pas important în inducerea inflamației cronice active a stratului mucoasei. Studiile SEM au descoperit că forma coccoidă a H. pylori se poate prezenta pe suprafața membranei plasmatice a celulelor epiteliale gastrice și, ca și forma bacilară, are capacitatea de a invada aceste celule.15,55 dacă apare invazia celulară, formele coccoide sunt închise în vezicule cu membrană cu strat dublu, iar celulele epiteliale gastrice apar umflate și litice, prezentând eroziunea stratului mucoasei.56 având în vedere că forma coccoidă este mai puțin susceptibilă la antibiotice, se crede că aceste forme latente de membrană plasmatică se pot răspândi și infecta alte celule epiteliale învecinate în absența unei concentrații eficiente de antibiotice.57
infecția cu H. pylori este, de asemenea, cunoscută pentru a induce un răspuns imun local care nu reușește să eradice bacteriile, permițând astfel boala gastrică să devină cronică. Răspunsul imun poate fi determinat prin detectarea anticorpilor folosind metode serologice dezvoltate folosind forma bacilară a H. pylori.58 de fapt, prezența acestor anticorpi specifici poate fi utilizată ca indicator epidemiologic al infecției și pentru a confirma succesul tratamentului. Cu toate acestea, nu există metode serologice care să detecteze formele coccoide. Pentru a determina dacă formele coccoide au avut vreun efect asupra răspunsului imun la indivizii colonizați, Figueroa și colab.59 a conceput o tehnică specifică de testare imunosorbentă legată de enzime (ELISA) pentru a evalua și compara răspunsul imun la formele coccoide și bacilare cu un panou de seruri de la indivizi infectați simptomatici și asimptomatici. Formele coccoide ale lui H. s-a demonstrat că pylori induce un răspuns imun umoral similar cu cel indus de formele bacilare la persoanele infectate. Într-un alt studiu efectuat la copii cu durere epigastrică, rolul posibil al formei coccoide în infecția cu H. pylori a fost examinat folosind o tehnică ELISA și antigene preparate din forme de celule bacilare și coccoide. Sa constatat că 13,3% și 55,8% din celule au fost seropozitive pentru antigenele formei bacilare și, respectiv, a formei coccoide, în timp ce valorile seropozitivității pentru copiii astmatici au fost de numai 7,0% și, respectiv, 26,5%. Această diferență de aproximativ patru ori în seropozitivitate între antigenele de formă coccoidă și bacilară la pacienții simptomatici și asimptomatici ar putea sugera un posibil rol infecțios al formei coccoide a H. pylori.60
Cellini și colab.61 suspensii concentrate inoculate intragastric de H. pylori în formă coccoidă într-un model de șoarece BALB/C. H. pylori a fost izolat 2 săptămâni mai târziu, modificările histopatologice au apărut 1 lună mai târziu și toți șoarecii colonizați au prezentat un răspuns sistemic de anticorpi la H. pylori. În alte experimente cu șoareci BALB / c, animalele inoculate cu forme coccoide au dezvoltat modificări patologice semnificative în stomac, incluzând leziuni erozive și infiltrarea celulară inflamatorie a mucoasei gastrice.36 ea și colab., 53 pentru a compara virulența și infecțiozitatea, șoarecii BALB/c inoculați intragastric cu H. pylori, un grup cu forma bacilară și un al doilea grup cu forma coccoidă. În examinarea SEM a probelor din cele 2 grupe, au observat aderența formelor bacilare și coccoide la celulele epiteliale ale peretelui gastric și prezența flagelului în formele coccoide. Examenul histologic a arătat diferite grade de leziuni în mucoasa gastrică, de la infiltrarea ușoară a celulelor inflamatorii până la eroziuni și ulcere. Leziunea mucoasei a fost mai ușoară la șoarecii infectați cu forma coccoidă, în timp ce un rezultat pozitiv nu a fost obținut în grupul de control care a primit apă sterilă.53 Rabelo-Gon Unktivalves și colab.62 a arătat că formele coccoide ale H. pylori a indus un răspuns inflamator acut în stomacul șoarecilor încă din primele etape ale infecției. Rezultatele de mai sus evidențiază capacitatea formelor coccoide de a coloniza și infecta mucoasa gastrică in vivo.
mai multe studii au relevat prezența formei coccoide în apă.33,63 un astfel de studiu—realizat de grupul nostru—a comparat 2 grupuri de șoareci Wistar înțărcați, unul administrat apă de fântână și apă de la robinet pentru o perioadă prelungită de timp și celălalt administrat apă distilată sterilă, constatând că șoarecii din grupul de studiu au dezvoltat un proces inflamator cronic cu formarea plăcilor limfocitare și prezența bacililor în concordanță cu H. pylori.64
așa cum am menționat anterior, ar fi logic să presupunem că, în condiții nefavorabile, H. pylori intră într-o stare” liniștită”, modificându-și forma bacilară clasică în forma coccoidă fără a produce modificări degenerative în genomul său și păstrând capacitatea de a reveni la forma bacilară odată ce condițiile de mediu sau de habitat natural se îmbunătățesc.
participarea formei coccoide la recrudescență
recurența H. pylori după eradicarea cu succes este rară în țările dezvoltate comparativ cu țările în curs de dezvoltare, cu rate anuale de recurență de 2,67% și, respectiv, 13%.65,66
există două tipuri de recurență a infecției cu H. pylori: recrudescență, atunci când tulpina bacteriană responsabilă de recurență este identică genetic cu cea izolată înainte de eradicare; și reinfecție, atunci când recurența este cauzată de o tulpină diferită.67 diferențierea recrudescenței de reinfecție necesită analiză PCR sau polimorfism genetic pentru identificarea tulpinilor bacteriene.67,68 deoarece aceste metode nu sunt aplicate în mod obișnuit, este adesea imposibil să se facă diferența între recrudescență și reinfecție în practica clinică de rutină.
H. recurența pylori este relevantă din punct de vedere clinic, deoarece recidiva ulcerului peptic poate fi observată la o proporție considerabilă de pacienți infectați, în timp ce reapariția microorganismelor ar putea explica unele recurențe ale limfomului MALT după tratament.Se crede că 69 de factori precum consumul de apă de la robinet, boala dentară și a gingiilor, amigdalita recurentă, spitalizarea, echipamentele dentare și medicale și contactul cu membrii familiei afectează recurența H. pylori.70-72 alți factori asociați cu recurența infecției sunt vârsta mai mică, diabetul la pacienții tineri, venitul anual scăzut și inhibarea pe termen lung a acidului gastric după eradicare.73-76
recrudescența este considerată cel mai probabil motiv de recurență în primul an după eradicare, în timp ce reinfecția poate apărea după o perioadă mai lungă.68,77 multe cazuri de recurență în țările dezvoltate sunt în realitate datorate recrudescenței. Reinfecția este mai frecventă în țările în curs de dezvoltare, deoarece oamenii sunt aparent expuși constant la H. pylori.65,78
folosind tehnici de electroforeză a proteinelor din gel de poliacrilamidă, Costas și colab.79 a constatat că pacienții cu recurență la 4 săptămâni după tratamentul de eradicare nu au fost de fapt infectați cu o altă tulpină de H. pylori; mai degrabă, tulpina care a provocat infecția inițială nu a fost complet eradicată de tratament, ducând la recrudescența infecției. Prin urmare, este important să se țină seama de eficacitatea regimului terapeutic: H. recurența pylori este frecventă la pacienții tratați cu terapii cu eficacitate scăzută, dar este rară atunci când se utilizează terapii cu eficacitate ridicată. Acest lucru a fost demonstrat de un studiu privind incidența recurenței H. pylori în Spania de către Gisbert și colab., 80 OMS a constatat că recurența H. pylori la 6 luni după eradicare a fost de 8, 2% la pacienții tratați cu terapii cu eficacitate scăzută, dar doar 1, 7% la pacienții tratați cu terapii cu eficacitate ridicată.
într-un studiu realizat în Coreea din 2007 până în 2010, H. ratele de recurență a pylori au fost analizate după 6 luni de terapii de eradicare de primă și a doua linie de succes, cu urmărire anuală – până la sfârșitul perioadei de studiu-pe baza testelor de respirație, biopsiei stomacale și testelor rapide de urează.81 s-a constatat că ratele anuale de recurență în cadrul și după urmărirea de 2 ani au fost de 9,3% și, respectiv, 2,0% după terapia de prima linie și de 4,5% și, respectiv, 2,9% după terapia de a doua linie. Autorii au concluzionat că anual H. ratele de recurență pylori pentru pacienții care au primit tratament de eradicare au arătat o scădere bruscă după perioada de urmărire de 2 ani. Acesta a fost considerat suficient timp după tratament pentru a confirma eradicarea și, de asemenea, suficient timp pentru a permite o distincție între recurența și recrudescența tulpinilor de H. pylori.81
considerații și concluzii finale
având în vedere capacitatea lui H. pylori pentru a intra într-o stare VBNC atunci când este supus unor condiții nefavorabile în interiorul sau în afara habitatului său, este rezonabil să presupunem că regimurile de tratament cu antibiotice utilizate pentru eradicarea formei bacilare a H. pylori pot induce forme coccoide VBNC capabile să supraviețuiască perioade lungi în mediul gastroduodenal. De aici pot avea potențial patogen direct și indirect care duce la recrudescența infecției și, ca urmare, eșecuri de tratament, recidive de infecție și reapariția bolii gastroduodenale. Prin urmare, eradicarea cu succes poate necesita nu numai eradicarea formelor bacilare, ci și a formelor coccoide sau asigurarea faptului că formele coccoide nu sunt induse.
având în vedere că, deoarece metodele de rutină implementate în prezent în practica clinică pentru a confirma eradicarea H. pylori nu pot detecta formele coccoide, gazdele pot fi diagnosticate incorect ca fiind lipsite de infecție; în plus, este posibil ca aceste metode să nu poată furniza dovezi complete ale potențialului clinic al medicamentelor utilizate pentru eradicarea H. pylori. Astfel, pentru ca eradicarea să fie considerată reușită, se recomandă urmărirea anuală-folosind tehnici neinvazive sau, dacă sunt disponibile, metode moleculare—pentru a determina dacă bacteriile au fost complet eliminate, mai ales în zonele cu prevalență ridicată și la pacienții cu risc de recurență.
în cele din urmă, sunt necesare studii suplimentare privind forma coccoidă VBNC a H. pylori, potențialul său patogen, implicarea sa în infecție și recrudescență și rolul său în formarea biofilmelor în stomac și în alte locații din gazdă. Astfel de studii ar permite dezvoltarea atât a unor protocoale de diagnostic mai eficiente care să evite subestimarea colonizării de către H. pylori, cât și a unor noi strategii terapeutice menite să elimine formele coccoide și să „dezarmeze” biofilmele.
Conflict de interese
autorii declară că nu au niciun conflict de interese.