odată cu rănirea țesutului sănătos, se desfășoară o evoluție previzibilă a evenimentelor fiziologice. Această progresie poate fi împărțită în fazele inflamației, proliferării și maturării. Fiecare fază se caracterizează prin elaborarea secvențială a citokinelor distinctive de către celule specifice. Vedeți imaginile de mai jos.
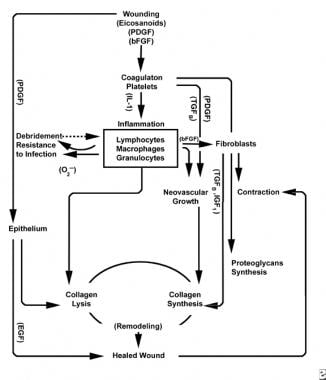 scheme ale procesului de vindecare a rănilor.
scheme ale procesului de vindecare a rănilor. 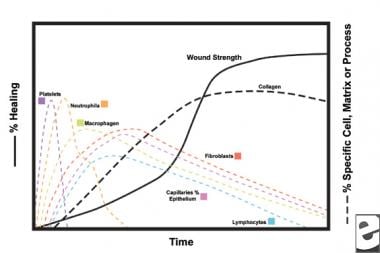 caracteristicile celulare ale procesului de vindecare a rănilor.
caracteristicile celulare ale procesului de vindecare a rănilor. faza inflamatorie
faza inflamatorie lansează simultan mecanisme și căi hemostatice care creează semnele cardinale de inflamație recunoscute clinic: rubor (roșeață), calor (căldură), tumoră (umflare), dolor (durere) și functio laesa (pierderea funcției).
lezarea țesutului vascular inițiază cascada de coagulare extrinsecă prin eliberarea calciului intracelular și a factorului tisular care activează factorul VII. dopul de fibrină rezultat realizează hemostaza ajutată de vasoconstricție reflexă. Acest dop acționează ca o rețea pentru agregarea trombocitelor, cel mai frecvent și „semnătură” tip celular al fazei inflamatorii timpurii.
trombocitele elaborează o serie de substanțe proinflamatorii, cum ar fi adenozin difosfatul, factorul de creștere a țesutului beta (TGF-XV) și factorii de creștere derivați din trombocite (PDGF). Acești factori de creștere acționează asupra celulelor înconjurătoare și stimulează chemotaxia neutrofilelor, monocitelor și fibroblastelor în zona leziunii.
țesuturile rănite, prin fosfolipaza a activată, catalizează simultan acizii arahidonici pentru a produce prostaglandine vasoactive și tromboxan, cunoscute colectiv sub numele de eicosanoizi. Eicosanoidele mediază activitatea care influențează formarea dopului plachetar, permeabilitatea vasculară și chemotaxia celulară pentru a influența vindecarea rănilor. De exemplu, tromboxanul A2 mediază vasoconstricția și agregarea plachetară.
după vasoconstricția inițială, semnele clasice de inflamație se manifestă prin creșterea permeabilității vasculare. Rubor rezultă din vasodilatație, mediată de prostaciclină (PGI2), prostaglandină A (PGA), prostaglandină D (PGD) și prostaglandină E (PGE). Tumora și calor se dezvoltă pe măsură ce golurile endoteliale vasculare se măresc, permițând ieșirea proteinei plasmatice și a fluidului în spațiul interstițial. Aceste modificări sunt potențate de PGE2 și prostaglandina F2a (PGF2a) și permit pătrunderea celulelor inflamatorii în zona leziunii, inclusiv a celulelor care elaborează. Dolor este simțit ca PGI2, PGE și PGE2 acționează asupra nociceptorilor periferici.
în a doua etapă a fazei inflamatorii, leucocitele înlocuiesc trombocitele ca tip de celule dominante, atrase de chemotaxie. Celulele albe din sânge (WBC) sunt celulele predominante în primele 3 zile după rănire; numărul lor atinge un maxim de aproximativ 48 de ore. Polimorfonucleocitele (PMN) sunt primele care încep activitățile bactericide folosind mediatori inflamatori și metaboliți ai radicalilor liberi de oxigen. Cu toate acestea, vindecarea normală a rănilor poate avea loc fără PMNs. Un alt leucocit, celula T helper, elaborează interleukina-2 (IL–2). IL-2 promovează în continuare proliferarea celulelor T pentru a spori răspunsul imunogen la leziuni.
pe măsură ce leucocitele PMN încep să scadă după 24-36 de ore, monocitele circulante intră în rană și se maturizează în macrofage tisulare. Aceste celule debridează rana la nivel microscopic și produc o mare varietate de substanțe importante, cum ar fi IL-1 și factorul de creștere a fibroblastelor de bază (bFGF). IL-1 stimulează proliferarea celulelor inflamatorii și promovează angiogeneza prin replicarea celulelor endoteliale. bFGF este un factor chemotactic și mitogen pentru fibroblaste și celule endoteliale. Spre deosebire de PMN, epuizarea macrofagelor afectează grav vindecarea rănilor, deoarece debridarea, proliferarea fibroblastelor și angiogeneza se diminuează.
spre sfârșitul ciclului inflamator, mediul în evoluție al eicosanoidelor din rană interacționează cu tipurile de celule prezente, rezultând sinteza fibroblastelor de colagen și substanță măcinată (de la raportul crescut de PGF2a la PGE2). În plus, factorii de creștere derivați din macrofage sunt acum la niveluri optime, influențând puternic influxul de fibroblaste și apoi keratinocitele și celulele endoteliale în rană. Pe măsură ce celulele mononucleare continuă să înlocuiască WBC-urile și macrofagele, începe faza proliferativă.
faza proliferativă
la două până la trei zile după rănire, fibroblastele migrează spre interior de la marginile plăgii peste matricea fibrină stabilită în timpul fazei inflamatorii. În prima săptămână, fibroblastele încep să producă glicozaminoglicani și proteoglicani, substanța măcinată pentru țesutul de granulare, precum și colagenul, ca răspuns la bfgf sintetizat de macrofage și TGF-XV, precum și PDGF.
fibroblastele devin în curând tipul de celule dominante, ajungând la 1-2 săptămâni. Ele generează nu numai molecule de colagen, ci și citokine , cum ar fi PDGF, TGF-XV, bfgf, factorul de creștere a keratinocitelor și factorul de creștere insulin-1. Fibroblastele asamblează, de asemenea, moleculele de colagen în fibre, care sunt reticulate și organizate în mănunchiuri. Colagenul este componenta majoră a țesutului conjunctiv acut, producția netă continuând în următoarele 6 săptămâni. Conținutul în creștere al colagenului plăgii se corelează cu creșterea rezistenței la tracțiune.
keratinocitele și celulele endoteliale proliferează, de asemenea, în acest timp, producând în cele din urmă factori de creștere autocrini care își mențin creșterea. Expansiunea endotelială contribuie la angiogeneză, deoarece vasele intacte generează muguri în țesutul de granulare. Neovascularizarea facilitează creșterea liniei avansate de fibroblaste în rană, oferindu-le substanțe nutritive și citokine necesare.
degradarea cheagului de fibrină și a matricei provizorii este însoțită de depunerea țesutului de granulare (substanță măcinată, colagen, capilare), care continuă până când rana este acoperită. Scăderea nivelului de acid hialuronic (în substanța măcinată) și creșterea nivelului de sulfat de condroitină încetinesc migrarea și proliferarea fibroblastelor, inducând în același timp diferențierea fibroblastelor, trecând la faza de maturare a vindecării rănilor.
faza de maturare
în primele 6 săptămâni, noua producție de colagen domină procesul de vindecare a rănilor, depus aleatoriu în țesutul de granulare acută a plăgii. Pe măsură ce rana se maturizează, colagenul este remodelat într-o structură mai organizată, cu o rezistență crescută la tracțiune. Treptat, colagenul de tip I înlocuiește tipul III până când se obține raportul normal al pielii de 4:1. Pe măsură ce remodelarea continuă, colagenoliza metaloproteinazei matriciale atinge o stare de echilibru cu sinteza colagenului. Platouri de rezistență la tracțiune la 80% din puterea inițială de aproximativ 1 an postinjury.
Superficial la această activitate, celulele epiteliale continuă să migreze spre interior de la marginea plăgii până când defectul este acoperit. În acest moment, inhibarea contactului induce transformarea fibroblastelor în miofibroblaste, care conțin fibre contractile de actină. Urmează contracția plăgii, înlocuind volumul țesutului rănit cu țesut nou, deși rolul exact al miofibroblastului nu a fost complet elucidat.
descurajarea vindecării rănilor
rănile Acute se desfășoară în general printr-un proces de reparație ordonat și în timp util, care are ca rezultat o restaurare durabilă a integrității anatomice și funcționale. Cu toate acestea, diferiți factori fiziologici și mecanici pot afecta răspunsul de vindecare, rezultând o rană cronică care nu reușește să treacă prin progresia obișnuită în trepte. Infecția locală, hipoxia, trauma, corpurile străine sau problemele sistemice, cum ar fi diabetul zaharat, malnutriția, imunodeficiența sau medicamentele, sunt cel mai frecvent responsabile.
toate rănile sunt contaminate, dar rezistă cu succes infecției invazive. Când concentrația depășește 100.000 (105) organisme pe gram de țesut sau sistemul imunitar devine compromis, infecția apare frecvent. Celulita prelungește faza inflamatorie prin menținerea unor niveluri ridicate de citokine proinflamatorii și proteaze tisulare, care degradează țesutul de granulare și factorii de creștere a țesuturilor și prin întârzierea depunerii de colagen.
debridarea (modificări chirurgicale, enzimatice și / sau prin pansament) și antibioticele sunt pilonii tratamentului cu antibiotice. Debridarea elimină țesutul devitalizat, care poate fi o sursă de endotoxine care inhibă fibroblastele și migrația keratinocitelor în rană. Corpurile străine pot necesita, de asemenea, îndepărtarea, deoarece prezența unei suturi de mătase reduce numărul de bacterii necesare pentru a incita infecția de 10.000 de ori. (Pentru o descriere detaliată a tehnicii, consultați articolul de referință Medscape îndepărtarea corpului străin rănit.)
hipoxia celulară întârzie vindecarea rănilor prin diferite mijloace. Reticularea fibrelor de colagen necesită oxigen pentru hidroxilat prolină și lizină și eșuează atunci când presiunea țesutului este sub 40 mm Hg. Potența bactericidă a fosforilării oxidative a leucocitelor suferă, de asemenea, într-un mediu hipoxic, reducând pragul de infecție. Măsurile de îmbunătățire a furnizării de oxigen depind de etiologie. Consumul de tutun, care provoacă vasoconstricție și crește aderența trombocitelor, trebuie oprit. Angioplastia sau altoirea bypass arterial pot fi necesare pentru boala vasculară periferică. Pot fi indicate măsuri adjuvante pentru îmbunătățirea perfuziei sistemice în cazurile de insuficiență cardiacă. Valoarea hematocritului mai mică de 15% trebuie tratată și euvolemia restaurată, după cum este necesar. Staza venoasă sau insuficiența limfatică pot fi îmbunătățite cu îmbrăcăminte compresivă.
boala sistemică poate prelungi dramatic sau întrerupe vindecarea rănilor. Glicozilarea în diabetul zaharat afectează fagocitoza neutrofilă și macrofage a bacteriilor, prelungind faza inflamatorie. Faza proliferativă este, de asemenea, prelungită în aceeași boală, deoarece eritrocitele devin mai puțin flexibile și mai puțin capabile să livreze oxigen la rană pentru metabolismul țesutului și sinteza colagenului.
malnutriția are ca rezultat diminuarea proliferării fibroblastelor, afectarea neovascularizării și scăderea imunității celulare și umorale. Rănile exercită cerințe metabolice sporite, în special în țesutul de granulare. Aminoacizii precum metionina, prolina, glicina și lizina sunt esențiali pentru funcționarea normală a celulelor și pentru repararea rănilor cutanate. Acizii grași sunt constituenți critici ai membranelor celulare și sunt substratul eicosanoidelor care mediază procesul inflamator. Acizii grași esențiali linolenic și acidul linoleic trebuie furnizați în dietă, deoarece corpul uman este incapabil de sinteza de novo a acestor molecule.
vitaminele și mineralele adecvate trebuie să fie disponibile pentru metabolismul celular, acționând ca semnale celulare și cofactori. Vitamina C (acid ascorbic) și fier sunt necesare pentru hidroxilarea lizinei și prolinei, care reticulează și stabilizează structura triplă helix a colagenului; cuprul joacă, de asemenea, un rol în stabilizarea colagenului. Vitamina A (acidul retinoic) joacă un rol important în modularea producției și degradării colagenului și este deosebit de importantă în epitelizare. Un antioxidant puternic, vitamina E (alfa tocoferol) pare să accelereze vindecarea dermică și osoasă la animale, iar suplimentarea poate avea un rol la om. Urme de metal, în special zinc, deficit este, de asemenea, asociat cu vindecarea ranilor săraci; acest lucru ar trebui să fie completat, după caz.
Ovidiu a scris: „medicamentele vindecă uneori, uneori ucid.”Acest lucru este cu siguranță adevărat în ceea ce privește vindecarea rănilor. Corticosteroizii blunt procesele întregii faze inflamatorii. Vitamina A (local sau 25.000 UI/zi pe cale orală) atenuează efectele dăunătoare de vindecare ale corticosteroizilor, dar hepatotoxicitatea poate rezulta din utilizarea prelungită (adică >1 mo). Medicamentele antiinflamatoare nesteroidiene (AINS) interferează, de asemenea, cu metabolismul acidului arahidonic și, prin urmare, cu vindecarea rănilor. În plus, AINS inhibă funcția plachetară, unul dintre primele procese din faza inflamatorie.
un studiu realizat de Sutcliffe și colab a sugerat că reglarea în sus a conexiunii proteinei gap junction este comună rănilor cronice. Examinând connexin în trei tipuri de răni—picior venos, picior diabetic și ulcere de presiune—anchetatorii au descoperit că fiecare tip de rană a prezentat o reglare superioară a conexinei epidermice 43, conexinei 26 și conexinei 30, precum și a conexinei dermice 43.