Introducere
infecțiile asociate asistenței medicale (Iaam), cum ar fi bacteremia cauzată de tulpinile Pseudomonas aeruginosa rezistente la medicamente, au ca rezultat o morbiditate și mortalitate crescută, prelungind spitalizarea și costuri mai mari în comparație cu acele infecții cauzate de tulpinile sensibile.1-3 infecții cauzate de aceste microorganisme rezistente sunt adesea asociate cu vârsta, cancerul, bolile de inimă, diabetul, utilizarea intensivă a antibioticelor și procedurile invazive, cum ar fi hemodializa, cateterul de ventilație mecanică, traheostomia și altele.4
incidența crescândă a p multirezistente. aeruginosa ca cauză a infecției nosocomiale este o problemă globală, o consecință a capacității acestui microorganism de a dezvolta rezistență la aproape toți ceilalți agenți antimicrobieni în timpul chimioterapiei antimicrobiene, fie prin selectarea mutațiilor în genele cromozomiale, fie prin transferul orizontal de gene.5,6 în Brazilia, această problemă este și mai semnificativă, deoarece există o densitate foarte mare de utilizare a antibioticelor, în special lactamele, carbapenemele și fluorochinolonele.7,8 rezistența în P. aeruginosa la carbapeneme este de până la 60% în unele spitale Braziliene9,10 și apare în principal prin producerea de metalo-lactamaze-lactamaze (MBL).
sunt cunoscute zece subclase ale enzimelor MBL: IMP (Imipenemază), VIM (Verona Imipenemază), SPM-1 (s Inquxo Paulo MBL), GIM (imipenemază germană), SIM-1 (Seul Imipenemază),11 AIM-1 (Imipenemază australiană),12 KHM (Spitalul Universitar Kyorin),13 NDM-1 (New Delhi MBL),14 DIM-1 (Imipenemază australiană),12 KHM (Spitalul Universitar Kyorin), 13 NDM-1 (New Delhi MBL), 14 1 (imipenemase olandeză), 15 și TMB (Tripoli MBL).16 în Brazilia, Cele mai răspândite subclase sunt IMP-1 și SPM-1.11
mai multe alte gene de virulență, precum și formarea de biofilme pot contribui la patogenitatea infecțiilor severe, în special a celor asociate procedurilor invazive.17 dintre factorii majori de virulență descriși în literatură, îi evidențiem pe cei legați de aderarea microorganismelor la celulele gazdă prin flageli, fimbrii și alginate18 și pe cei care facilitează perturbarea integrității epiteliale și interferează cu sistemul imunitar, cum ar fi elastaza, fosfolipaza C și proteaza alcalină, exotoxina A, piocianina și pioverdina.19 producția de biofilme este asociată în special cu dificultatea antibioticelor de a pătrunde în celule, deoarece acestea secretă o matrice polimerică compusă din polizaharide, proteine și ADN.20,21
scopul acestui studiu a fost identificarea factorilor de risc asociați cu bacteremia cauzată de P. aeruginosa rezistentă la carbapenem, precum și producerea de MBL. În plus, am investigat frecvența genelor de virulență și capacitatea lor de a forma biofilm.
materiale și metodepacienții și Spitalul
P. tulpinile aeruginosa au fost recuperate de la pacienții internați la Spitalul Universitar Uberlandia (Brazilia), Universitatea Federală din Uberlandia (HC-UFU) și obținute de la laboratorul de Microbiologie al HC-UFU, în perioada mai 2009-decembrie 2012, având în vedere doar primul episod de infecție.
Proiectarea studiului
am efectuat un studiu de caz (pacienți cu bacteremie datorată P. aeruginosa rezistent la carbapeneme) versus control (pacienți cu bacteremie cauzată de P. aeruginosa susceptibili la carbapeneme) pentru identificarea factorilor de risc în rândul pacienților infectați cu P. aeruginosa rezistent la carbapeneme. În plus, am evaluat rezultatele secundare, inclusiv perioadele de spitalizare, admiterea la unitatea de terapie intensivă (UCI) și utilizarea procedurilor invazive. Caracteristicile demografice, clinice și epidemiologice ale fiecărui pacient inclus în studiu au fost recuperate din înregistrările clinice.
definiții
infecțiile asociate asistenței medicale (Iaam) sunt definite ca orice infecție dobândită după internarea unui pacient în spital. Iaam se pot manifesta în timpul spitalizării sau după externare, deoarece sunt legate de spitalizare sau proceduri efectuate în timpul spitalizării.22 Bacteremia, conform centrelor pentru Controlul și Prevenirea Bolilor,23 poate fi definită ca prezența bacteriilor viabile în sânge documentată printr-un rezultat pozitiv al culturii de sânge. Bacteremia a fost clasificată ca primară atunci când nu a fost legată de un alt focar de infecție sau când a fost legată de un cateter intravenos și secundară când a fost legată Clinic de infecție într-un alt loc anatomic.9 rezistența multidrog este definită ca nesensibilitatea dobândită la cel puțin un agent din trei sau mai multe categorii antimicrobiene.24 terapia antimicrobiană a fost considerată inadecvată atunci când un microorganism izolat a prezentat rezistență in vitro la antimicrobiene utilizate pentru tratarea pacientului și/sau lipsa tratamentului timp de 24 de ore după diagnosticarea infecțiilor microbiene.25
teste clinice microbiologice și moleculare
culturile au fost colectate conform protocolului utilizat de laboratorul de Microbiologie al HC-UFU și au fost prelucrate cu ajutorul sistemului automat bact/Alert (Biomecrieux, Durham, SUA). Testele de identificare și susceptibilitate antimicrobiană au fost efectuate prin automatizare utilizând sistemul VITEK II, iar tulpinile care au prezentat susceptibilitate intermediară au fost considerate rezistente. Protocoalele de control al calității au fost utilizate în conformitate cu standardele Institutului standard clinic și de laborator.26-28 p rezistent la carbapenem. izolatele aeruginosa au fost analizate fenotipic pentru producerea MBL folosind teste de sinergie cu dublu disc, așa cum s-a descris anterior.29,30 în plus, pentru a evalua prezența genelor MBL în tulpinile P. aeruginosa, a fost efectuat un PCR multiplex, așa cum a fost descris anterior.31 condițiile de ciclism au fost: 94 XTX C pentru 5min, urmate de 30 de cicluri de denaturare la 94 XTX C pentru 30s, recoacere la 53 XTX C pentru 45s și prelungire la 72 XTX C pentru 30s, urmate de prelungire finală la 72 XTX C pentru 10min, toate într-un MasterCycler personal (Eppendorf). Detectarea genelor de virulență care codifică proteaza alcalină (aprA), elastaza A (lasA), elastaza (lasB),32 fosfolipaza hemolitică C (plcH), fosfolipaza non-hemolitică C (plcN), exotoxina a (toxA) și alginatul (algD)33 au fost determinate prin PCR uniplex, utilizând următorul protocol: 94 C pentru 3min, 30 cicluri la 94 C pentru 30s, 55 C pentru 1min și 72 pentru 1min și 30s și 72 C pentru 5min.
test de adeziune Inițială34
pentru a evalua aderența inițială, s-au adăugat la plăcile de polistiren cu 96 de godeuri 200 ECQ dintr-o suspensie celulară conținând 1 ECQ 107celule/mL preparate în TSB. Aderența inițială a fost lăsată să apară timp de 2 ore la 37 centicc cu rotație la 120 rpm. Bacteriile aderente în plăcile de polistiren cu 96 de puțuri au fost spălate de două ori cu o soluție de NaCl 0,9% și recoltate prin răzuirea puțurilor pentru anii 90. suspensia celulară obținută a fost placată pe TSA pentru enumerarea unității Formatoare de colonii (CFU). Toate experimentele au fost realizate în trei exemplare în trei experimente independente. Tulpina ATCC15692 (PAO1) a fost utilizată ca un control pozitiv, iar TSB fără bacterii a fost utilizat ca un control negativ.
test de formare a Biofilmului35
200 oktl dintr-o suspensie celulară conținând 1 107celule/mL preparate în TSB s-a adăugat pe plăcile de polistiren cu 96 de godeuri. Formarea biofilmului a fost permisă să aibă loc timp de 24 de ore la 37 CTC cu rotație la 120 rpm. Bacteriile cultivate în plăci de polistiren cu 96 de puțuri au fost spălate de două ori cu o soluție de NaCl de 0,9% și lăsate să se usuce într-o poziție inversată. Biomasa totală a fost măsurată prin fixarea metanolului (Merck), colorarea cristalului violet (Merck) și eluția acetică acetică (Merck), așa cum s-a descris anterior. Colorantul eluat a fost îndepărtat din fiecare godeu și plasat într-o nouă placă de microtitrare cu 96 de puțuri, iar absorbanța sa a fost citită pe un cititor de plăci ELISA (BioTek Instruments Inc., Vermont, SUA) la 570nm. Experimentele au fost realizate cu opt replici pentru fiecare tulpină în trei experimente independente. TSB fără bacterii a fost folosit ca un control negativ. Valoarea limită a densității optice (ODc) a fost stabilită ca trei deviații standard (SD) peste media densității optice (OD) a controlului negativ: ODc=OD medie a controlului negativ+3X SD a controlului negativ. Pentru o interpretare mai ușoară a rezultatelor, tulpinile au fost împărțite în următoarele categorii în funcție de densitatea optică: (ODi): ODi ODC sau ODc
ODi2x ODc=producător non-biofilm/producător slab de biofilm; 2x ODcODi4x ODc=producător moderat de biofilm; 4x ODcODi=producător puternic de biofilm.Concentrația celulelor biofilmelor36
concentrația celulelor biofilmelor a fost determinată prin enumerarea CFU. După formarea biofilmului, biofilmele au fost spălate de două ori cu o soluție de NaCl 0,9% și recoltate după răzuirea puțurilor timp de 90 de ani. suspensia celulară obținută a fost placată pe plăci TSA. Toate experimentele au fost făcute în trei exemplare, în trei ocazii independente.
analiza statistică
analiza statistică a fost realizată folosind GraphPad Prism V.5 (GraphPad Software, San Diego, CA). Testele cantitative au fost comparate folosind Kruskal-Wallis, aplicând testul de comparație multiplă al lui Dunn. Toate testele au fost efectuate cu un nivel de încredere de 95%, iar semnificația statistică a fost definită ca p
0,05.Aprobarea etică
Comitetul de etică a cercetării al Universității Federale Uberlandia a evaluat și aprobat designul studiului nostru.
rezultate
de la 1 Mai 2009 până la 31 decembrie 2012, a fost efectuată o supraveghere spitalicească a incidenței bacteremiei P. aeruginosa în laboratorul de Microbiologie al Spitalului Universitar. În această perioadă, 157 de pacienți non-repetitivi cu bacteremie P. aeruginosa au fost incluși în studiu. Informațiile detaliate privind factorii asociați cu dezvoltarea bacteriemiei și caracteristicile clinice și demografice, precum și distribuția pacienților pe secții sunt prezentate în tabelele 1 și 2. Bacteremia primară a apărut la 75,8%, iar cei cu focalizare necunoscută au reprezentat 62.4% din cazuri. Bacteremia secundară a reprezentat 24,2% dintre pacienți, unde tractul respirator a fost principalul obiectiv al infecției (17,2%). Mai mult, 43,9% dintre pacienți au avut bacteremie cu P. aeruginosa rezistentă la carbapenem, iar majoritatea acestor pacienți au fost internați la UTI. Majoritatea pacienților au fost bărbați (66,8%), cu o ședere medie în spital de 63,2 80,17 zile și o vârstă medie de 52,01 20,24 ani.
distribuția pacienților infectați cu Pseudomonas aeruginosa în diferite unități ale Spitalului Clinic al Universității Federale din Uberlinkcidndia din mai/2009 până în decembrie/2012.
| clinici | Total | Pseudomonas aeruginosa rezistent la Carbapenem |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Chirurgie | 35 (22.3) | 16 (23.2) |
| Clinica Medicală | 24 (15.3) | 10 (14.5) |
| Oncologie | 14 (8.9) | 2 (2.9) |
| camera de urgență | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| UTI neonatală | 2 (1.3) | 0 |
| terapie intensivă pediatrică | 2 (1.3) | 1 (1.5) |
| Transplant | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
.
arsuri, unitate de durere toracică.
factorii de risc asociați cu rezistența la carbapenem la pacienții cu bacteremie cauzată de Pseudomonas aeruginosa.
| factori de risc | Total | Carbapenem rezistent | Multisensibilea | univariat | multivariat | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | OR (IÎ 95%) | p | |
| vârsta medie (ani) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Bărbat / Femeie | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| timpul de spitalizare, medie (zile) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| unitatea de terapie intensivă | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Chirurgie | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| proceduri invazive (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| cateter central venos | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| scurgere chirurgicală | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| sonde nutriție enterală / gastrică | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| hemodializă | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| nutriție parenterală | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| condiții de comorbiditate | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| insuficiență cardiacă | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Cancer | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| diabet zaharat | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| insuficiență renală cronică | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| virusul imunodeficienței umane | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| bacteremia primară | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| linia centrală cateter legate | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| necunoscut | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| bacteremia secundară | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| tractul respirator | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| tract urinar | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| terapie inadecvată | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| utilizarea anterioară a antibioticelor | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| mortalitate | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
tulpini Multisensibile au fost considerate ca fiind cele care au prezentat susceptibilitate la toate antimicrobienele testate.
rata cotelor.
interval de încredere.
valoarea p.
scorul mediu al severității bolii.
semnificativ statistic(p 0,05).
utilizarea anterioară a antibioticelor (78,3%), procedurile invazive (88,5%), comorbiditățile (77,7%) și intervenția chirurgicală anterioară (43,9%) au fost frecvente. Sa constatat că 31,2% dintre pacienți au primit tratament inadecvat, iar rata mortalității a fost de 58,6%. Mai mulți factori intrinseci și extrinseci pentru dezvoltarea bacteremiei prin tulpini de P. aeruginosa rezistentă la carbapeneme a fost detectată prin analize univariate. Cu toate acestea, numai ventilația mecanică, tuburile enterale/nazogastrice, bacteremia primară cu focalizare necunoscută și terapia inadecvată au fost factori de risc asociați independent cu dezvoltarea bacteremiei P. aeruginosa rezistente la carbapenem.
producția de MBL a fost analizată pentru 56 de izolate P. aeruginosa rezistente la carbapenem. Nouă (25,0%) izolate au fost fenotipice pozitive și un total de 16,1% (n= 9/56) au fost în concordanță cu genele MBL ale ampliconilor, fiind 10,71% blaSPM-1 și 5.3% gene blaVIM în general, tulpinile au prezentat un profil de rezistență multidrog. Pentru alte gene de virulență evaluate (aprA, plcH, plcN, lasA, lasB, toxA și algD), toate tulpinile au prezentat o frecvență ridicată (88%).
dintre cele 88 de tulpini de P. aeruginosa sensibile la carbapenem, 21 (23, 9%) au fost rezistente la alte lactame de tip lactamic. Pentru 69 de tulpini rezistente la carbapeneme, profilul de rezistență a fost ridicat: XV-lactam 50/69 (72,5%), fluorochinolone 48/69 (69,6%) și aminoglicozide 50/69 (72,5%) (Tabelul 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
în plus față de cercetarea MBL, au fost selectate cinci tulpini (două conținând SPM-1, una conținând VIM și două fenotipice pozitive pentru MBL) la evaluarea formării biofilmului utilizând teste cantitative ale biomasei totale prin colorare cu violet cristal. Având în vedere prezența genelor MBL, toate tulpinile au fost identificate ca fiind puternic producători de biofilme cu o medie de 0,90 0,61 de biomasă. Nu au fost observate diferențe în aderența inițială a tulpinilor individuale. Cu toate acestea, a existat o Do mai mică pentru tulpina care conține gena blaVIM (Fig. 1).
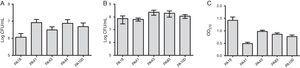
(A) Numărul de celule aderente la o suprafață de polistiren după 2 ore, exprimat în log CFU/mL pentru 5 probe de Pseudomonas aeruginosa izolate din sânge. (B) Numărul de celule viabile din biofilm (log CFU/mL). (C) biomasa biofilmului exprimată ca densitate optică a cristalului violet (OD570nm).
discuție
bacteremia spitalicească cauzată de microorganisme multirezistente, indiferent dacă este Gram-pozitivă sau Gram-negativă, a fost adesea descrisă ca o problemă semnificativă de sănătate care crește costurile spitalicești și face dificilă stabilirea unei terapii antimicrobiene adecvate, ceea ce duce la un prognostic mai rău.37 proporția mare de bacteriemie spitalicească cauzată de P. aeruginosa rezistentă la carbapeneme indică importanța acestui organism ca o cauză semnificativă a acestei infecții în spitalul nostru. Proporția mare de bacteremie spitalicească cauzată de P. aeruginosa rezistentă la carbapeneme indică importanța acestui organism ca o cauză semnificativă a acestei infecții în spitalul nostru. Rezultatele diferitelor studii au sugerat că factorii de risc intrinseci, cum ar fi ventilația mecanică, utilizarea unui tub nazogastric și utilizarea prealabilă a antibioticelor, cresc riscul dezvoltării bacteremiei cauzate de P. aeruginosa rezistent la carbapeneme, precum și riscul de morbiditate și mortalitate.38
în acest studiu, mai mult de 50% dintre factorii de risc au fost asociați cu infecția cu acest microorganism conform analizei univariate. Cu toate acestea, numai ventilația mecanică, tuburile de alimentare enterală/gastrică, bacteremia primară de origine necunoscută și tratamentul inadecvat au fost considerate factori de risc independenți prin analiza multivariată.
un cateter venos central este unul dintre cei mai importanți factori de risc pentru bacteremia dobândită în spital, deoarece a fost asociat cu mai mult de 90% din aceste infecții.39 deși nu a fost un factor de risc semnificativ în acest studiu, 85,5% dintre pacienții cu bacteremie cu P. aeruginosa rezistentă la carbapenem au avut această procedură invazivă.
adesea, bacteremia cauzată de P. aeruginosa rezistentă la antibiotice are o rată de mortalitate mai mare datorată, în special, administrării terapiei cu antibiotice necorespunzătoare.40 în acest studiu, am investigat o cohortă de 157 de pacienți cu bacteremie cauzată de tulpini de P. aeruginosa, dintre care 69 au fost infectați cu tulpini de P. aeruginosa rezistente la carbapenem. Mortalitatea totală a fost mai mare în grupul cu rezistență la carbapenem; cu toate acestea, prezența tulpinilor rezistente a fost asociată semnificativ cu terapia antimicrobiană inadecvată, dovedind că acest grup are de obicei un prognostic mai slab. Similar cu constatările noastre, studiile anterioare au arătat că P. aeruginosa izolat de la pacienții care au primit terapie inadecvată a avut un prognostic mai rău, cu rate de 46,1% 41 și 53,8%.42
pe lângă faptul că este asociat cu infecții severe, rezistența la carbapeneme în P. aeruginosa duce adesea la producerea de MBL.43 rezultatele noastre au arătat că p rezistent la carbapenem. aeruginosa au fost predominante în tot spitalul cu gene care codifică aceste enzime în 16,1% din tulpini, fiind 10,7% din genotipul blaSPM-1 și 5,4% din genotipul blaVIM. Deoarece frecvența tulpinilor multirezistente a fost ridicată, aceste rezultate sugerează că alte mecanisme de rezistență coexistă în aceste tulpini, cum ar fi pompele de eflux și impermeabilitatea membranei.44
prevalența MBL ca mecanism de rezistență a crescut, în special în America Latină.45 în Brazilia, prevalența p producătoare de MBL. aeruginosa variază între diferite regiuni și între spitale, cu rate cuprinse între 7,5% și 44%.11
enzima SPM-1 este considerată cea mai frecventă în Brazilia, urmată de IMP-1,11,46 cu toate acestea, a existat și o creștere a frecvenței izolatelor P. aeruginosa care conțin enzima VIM.45,47 în studiul nostru, enzima SPM-1 a fost detectată în 16,7% din probele producătoare fenotipice de MBL, urmată de enzima VIM, care a fost detectată în 8,3% din cazuri. Aceste rezultate indică o răspândire semnificativă a genelor care codifică MBL în regiunea noastră.
având în vedere prezența producției de MBL și biofilm, 100% din tulpini au fost clasificate ca producători puternici. Un alt studiu din Brazilia a constatat că 40% dintre P. aeruginosa clasificați ca producători puternici de biofilm au fost, de asemenea, producători de MBL.35 considerăm că aceste rezultate sunt importante odată ce aceste caracteristici (producția de biofilme și MBL) se suprapun și infecțiile cauzate de aceste bacterii sunt dificil de tratat. Acest lucru este justificat, în parte, deoarece creșterea bacteriilor din biofilm este de aproximativ 64 de ori mai rezistentă la antimicrobiene.48
P. aeruginosa are un număr mare de factori de virulență extracelulară care contribuie, de asemenea, la patogenitatea și severitatea acestor infecții, cum ar fi cea codificată de genele aprA, plcH, plcN, lasA, lasB, toxA și algD.32,33 datele noastre au arătat că prezența unui profil multirezistent, în majoritatea tulpinilor (88%) au fost pozitive pentru genele de virulență aprA, plcH, plcN, lasA, lasB, toxA și algD, cu excepția unei tulpini care nu a prezentat genele toxA și plcH, ceea ce poate contribui în continuare la un prognostic mai rău asociat infecțiilor severe.
rezultatele noastre confirmă constatările anterioare privind factorii de risc pentru dezvoltarea bacteremiei rezistente la P. aeruginosa carbapenem, precum și diseminarea tulpinilor producătoare de MBL de tip SPM-1. Cu toate acestea, acest studiu contribuie la dovezi suplimentare ale răspândirii tulpinilor producătoare de MBL, în special a tipului VIM, în tulpini foarte virulente și producători puternici de biofilm.
conflicte de interese
autorii nu declară conflicte de interese.