în ciuda scăderii dramatice a morbidității și mortalității legate de virusul imunodeficienței umane de tip 1 (HIV-1) în urma descoperirii inhibitorilor de protează și a apariției terapiei antiretrovirale foarte active combinate (ARV) la mijlocul anilor 1990, mulți pacienți încă nu au primit tratament din cauza rezistenței și / sau intolerabilității (1). A fost clar că au fost necesare mai multe ARV care acționează pe diferite etape ale ciclului de viață al virusului, active împotriva virusurilor rezistente și mai bine tolerate. Demonstrarea rolului cheie al receptorilor chemokinici CCR5 și CXCR4 în intrarea HIV-1 a stârnit interesul pentru acest proces ca o nouă țintă ARV (2, 3). CCR5 este co-receptorul pentru majoritatea tulpinilor HIV-1, iar aceste virusuri sunt denumite tropic CCR5 (R5). Tulpinile de Virus care utilizează CXCR4 se numesc CXCR4-tropic (X4), în timp ce tulpinile care pot utiliza ambii receptori sunt dual-tropic (4). Virusul de la un pacient poate conține adesea amestecuri de tulpini R5, X4 și dual-tropic, denumite colectiv CXCR4-using.
rolul cheie al CCR5 în intrarea HIV-1, împreună cu demonstrarea faptului că indivizii care au fost homozigoți pentru o ștergere a perechii de bază 32 în gena CCR5 (CCR5 INKT32) și, ulterior, nu exprimă CCR5 funcțional, au fost foarte protejați de infecția cu R5 HIV-1, au concentrat atenția asupra CCR5 ca țintă atractivă (5). Cu toate că unele studii au demonstrat efecte subtile ale mutației CCR5 INKT32 asupra funcției imune, cum ar fi scăderea scorurilor inflamatorii la persoanele infectate cu hepatita C și recuperarea de la hepatita B la heterozigoți; în timp ce homozigoții sunt mai susceptibili la encefalita transmisă de căpușe și la boala severă a virusului West Nile, acești indivizi suferă efecte adverse aparente asupra sănătății lor (5, 6). Acest lucru, împreună cu faptul că membrii superfamiliei receptorilor cuplați cu proteina G sunt adesea tratabili la dezvoltarea de medicamente puternice, selective și biodisponibile Oral (7), au condus la inițierea programelor de descoperire a ligandului CCR5 de către mai multe grupuri, inclusiv o echipă de la Pfizer Global Research and Development cu sediul la laboratoarele Sandwich din Regatul Unit.
Maraviroc (MAREA BRITANIE-427.857, MVC) a fost descoperit prin screening-ul de mare capacitate al Bibliotecii compuse Pfizer folosind un test de legare a radioligandului chemokine. Cel mai promițător compus din procesul de screening a fost optimizat pentru potență împotriva receptorului, activitatea antivirală, caracteristicile farmacocinetice și selectivitatea împotriva țintelor celulare umane printr-un efort mare de chimie medicamentoasă în care au fost caracterizate aproape 1000 de molecule (7). MVC se leagă în buzunarul transmembranar al CCR5 și este un antagonist funcțional cu decalaj lent care împiedică internalizarea (7, 8). Are activitate antivirală puternică împotriva unei game largi de izolate HIV-1 (7). Împreună cu profilul său excelent de siguranță preclinică și farmacocinetica acceptabilă, acesta a fost nominalizat ca candidat clinic în decembrie 2000 (7).
a fost întotdeauna clar că dezvoltarea clinică a antagoniștilor CCR5 ar fi o provocare, deoarece acestea ar fi primele medicamente ARV vizate de gazdă și, prin urmare, ne-am aventurat pe un teritoriu neexplorat. Pentru a preveni problemele cheie, a fost înființată o echipă de dezvoltare clinică foarte curând după începerea programului discovery și am fost recrutat pentru a conduce echipa de dezvoltare timpurie, alăturându-mă Pfizer în februarie 1999. Am identificat mai multe provocări cheie de abordat în proiectarea programului clinic, pe lângă demonstrarea siguranței și eficacității. Primul dintre acestea a fost că nu a existat niciun test disponibil comercial, validat clinic pentru identificarea pacienților infectați cu R5 HIV-1. Acest lucru a fost critic, deoarece MVC este activ numai împotriva tulpinilor R5 HIV-1 (7). În al doilea rând, în ciuda fenotipului aparent sănătos al indivizilor cu CCR5 CT32 (5, 6), au rămas îngrijorări cu privire la siguranța expunerii pe termen lung la antagoniștii CCR5, deoarece blocarea CCR5 poate fi diferită de absența congenitală a receptorului CCR5, unde sistemul imunitar s-a maturizat în absența CCR5 și s-ar fi putut dezvolta mecanisme compensatorii. În cele din urmă, la persoanele infectate cu HIV-1, incidența tulpinilor HIV-1 care utilizează CXCR4 crește odată cu progresia bolii și scăderea numărului de celule CD4 (9), deși nu a fost demonstrată nicio legătură cauzală între virusul care utilizează CXCR4 și depleția celulelor CD4. Acest lucru a dus la îngrijorarea că presiunea selectivă a unui antagonist CCR5 poate determina populația de virus să utilizeze CXCR4 și poate duce la declinul celulelor CD4.
studii de fază 1 cu doze unice și multiple la voluntari sănătoși, efectuate în 2001 și în prima jumătate a anului 2002, au demonstrat că MVC a fost sigur și bine tolerat în doze multiple de până la 300 mg de două ori pe zi (de două ori pe zi), a avut un profil farmacocinetic compatibil cu administrarea orală o dată pe zi (QD) sau de două ori pe zi, a putut fi combinat cu alte ARV și că dozele de 100 mg de două ori pe zi au determinat o expunere peste media geometrică a ic90 antiviral in vitro (7, 10). Pentru a demonstra dovezi farmacologice, saturația receptorilor CCR5 a fost măsurată utilizând un test de internalizare ex vivo MIP-1 la comandă. S-a demonstrat saturația dependentă de doză, cu doze de 25 mg o dată pe zi, rezultând valori apropiate de cele maxime de saturație, crescând posibilitatea interesantă ca MVC să fie eficace în doze de până la 25 mg o dată pe zi. Saturația receptorilor a rămas ridicată timp de câteva zile după întreruperea administrării, reflectând decalajul lent față de receptor in vivo (11).
am fost amândoi entuziasmați și încurajați de datele din faza 1 și am trecut rapid la un program de dovadă a conceptului de fază 2a. Pacienții infectați cu HIV-1 au fost testați numai pentru prezența virusului R5, utilizând un nou test de tropism fenotipic (Trofile XV, Monogram Biosciences, South San Francisco, CA, SUA) și au primit MVC ca monoterapie timp de 10 zile (12). Saturația receptorilor CCR5 a fost măsurată în acest studiu pentru a evalua posibilitatea utilizării acestuia ca biomarker pentru eficacitate și în monitorizarea terapeutică. Datele foarte așteptate au fost la înălțimea așteptărilor noastre și au demonstrat că dozele de 100 mg de două ori pe zi au dus la reduceri maxime medii ale ARN HIV-1 de >1.5log10 (figura 1a), cu toți pacienții, excluzând un pacient cu virusul X4 care a fost inclus în mod eronat, obținând o reducere a ARN HIV-1 de cel puțin 1log10 (12). Acest lucru ne-a dat încredere că testul a identificat corect pacienții care ar putea răspunde la MVC. Valoarea minimă a ARN HIV-1 a apărut la 1-5 zile după ultima doză de MVC, în concordanță cu saturația prelungită a receptorilor, așa cum s-a demonstrat în studiile de fază 1 (12). Pentru toate dozele, cu excepția dozei de 25 mg QD, s-a observat o saturație >80% a receptorilor QD pe toată perioada de administrare. Cu toate acestea, nu a existat nicio corelație între reducerea încărcăturii virale și gradul de saturație a receptorilor. Explicația cea mai probabilă pentru aceasta este că nivelurile foarte ridicate de saturație a receptorilor sunt necesare pentru eficacitatea antivirală, iar variabilitatea inerentă a testului nu permite diferențierea la acel grad (11, 12).
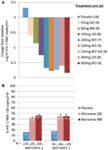
Figura 1. Dovada conceptului Maraviroc și rezultatele eficacității fazei 3. (A) modificarea maximă medie față de valoarea inițială a ARN HIV-1 la pacienții cărora li se administrează monoterapie cu MVC. Pe baza datelor din faza 1 și a modelării și simulării, au fost selectate doze cuprinse între 25 mg o dată pe zi și 300 mg de două ori pe zi (inclusiv 150 mg de două ori pe zi, hrănite și în condiții de repaus alimentar). Au fost evaluate farmacocinetica ARN HIV-1, siguranța și MVC (12). (B) motivați 1 și 2 – proporția pacienților care obțin ARN HIV-1 <50 copii/mL în săptămâna 48. Pacienții infectați cu HIV-1 cu R5 HIV-1 și experiență în clasa triplă și/sau rezistență au fost randomizați pentru a primi QD MVC sau BID sau placebo, în combinație cu un regim antiretroviral de fond optimizat (OBT). P < 0.001 (13, 14).
datele de fază 2a au generat entuziasm în întreaga companie și am fost dornici să progresăm programul de dezvoltare clinică cât mai repede posibil, deoarece a existat o nevoie medicală ridicată de noi ARV pentru a trata pacienții fără opțiuni de tratament sau limitate. Programul extins de fază 1 (inclusiv studii multiple de interacțiune medicamentoasă) și gama largă de doze evaluate în studiile de fază 2A proof of concept, împreună cu modelarea și simularea, ne-au oferit o înțelegere foarte bună a dozei probabile eficace de MVC în combinație cu alte ARV. Prin urmare, am reușit să trecem direct la studiile de eficacitate de fază 3 care evaluează MVC la 300 mg (sau echivalent, în funcție de medicamentele administrate concomitent) QD și BID, fără a fi nevoie să facem studii independente de fază 2B cu doze, reducând astfel semnificativ cronologia dezvoltării. La sfârșitul anului 2004, am inițiat patru studii mari; Motivați 1 și 2 la pacienții tratați anterior cu R5 HIV-1 (13, 14), MERIT (un studiu de fază 3 cu o fază 2B roll-in) la pacienții tratați anterior cu R5 HIV-1 (15) și studiul a4001029, un studiu de siguranță de fază 2b la pacienții tratați anterior cu virus tropic non-CCR5 (virus care utilizează CXCR4 sau care nu este fenotipabil) (16).
aceasta a fost o întreprindere masivă, cu 4794 de pacienți examinați în peste 200 de locații din SUA, Canada, Europa, Australia, Africa de Sud, Mexic și Argentina. Alți doi antagoniști ai CCR5 cu molecule mici (aplaviroc și vicriviroc) au fost, de asemenea, evaluați în studiile de fază 2b în acest moment (17, 18). În plus față de provocările obișnuite de gestionare a studiilor clinice mari, am fost aruncați două curveballs, prima dintre acestea fiind întreruperea aplavirocului din cauza hepatotoxicității idiosincratice. S-a speculat că acesta ar putea fi un efect de clasă al antagoniștilor CCR5, deoarece șoarecii knockout CCR5 sunt mai susceptibili la hepatotoxicitate mediată de concanavalin-a (17). În plus, un pacient din studiul MERIT a dezvoltat hepatotoxicitate severă. Datele au sugerat că a fost probabil legată de izoniazid sau cotrimoxazol, dar un rol contributiv pentru MVC nu a putut fi exclus (15). O analiză aprofundată a tuturor datelor pentru evidențierea hepatotoxicității pentru MVC și un nivel ridicat de vigilență pentru orice semnal, nu a găsit nicio dovadă pentru o creștere sistematică a enzimelor hepatice sau a altor markeri ai hepatotoxicității. La scurt timp după aceea au apărut îngrijorări cu privire la un risc potențial crescut pentru anumite afecțiuni maligne, ca urmare a apariției limfomului la patru pacienți cărora li s-a administrat vicriviroc în studiul ACTG5211 (18). Inițial au existat îngrijorări că acest lucru ar putea fi un efect de clasă bazat pe potențialul imun modulator al antagoniștilor CCR5, dar revizuirea datelor din alte studii vicriviroc, precum și studiile MVC în curs de desfășurare nu au susținut această teorie (18).
datele de la MOTIVATE 1 și 2 și A4001029 au fost disponibile înaintea celor de MERIT, deoarece durata studiului este de obicei mai scurtă pentru studiile la pacienții tratați anterior. Cu mare entuziasm am așteptat analizele intermediare din săptămâna 24 pentru studiile MOTIVATE din octombrie 2006 și am fost încântați să vedem că semnificativ mai mulți pacienți care au primit MVC au avut un ARN HIV-1 <50 copii/mL (markerul cheie pentru eficacitate) comparativ cu cei care au primit placebo OBT. Acest lucru a fost confirmat de datele din săptămâna 48, demonstrând durabilitatea răspunsului (figura 1b) (13, 14). În schimb, pacienții cu HIV-1 tropic non-CCR5 care au primit MVC în A4001029 nu par să obțină beneficii virologice semnificative comparativ cu placebo (16). Analiza datelor privind siguranța nu a ridicat probleme semnificative. În mod specific, nu a existat nicio dovadă a unui efect advers asupra funcției imune, fără creșterea episoadelor de infecție sau a afecțiunilor maligne la pacienții tratați cu MVC. Evaluarea tropismului viral la eșec a demonstrat că > 50% dintre pacienții care nu au primit tratament cu MVC au avut virus care utilizează CXCR4 la eșec, dar nu au existat dovezi ale unui efect dăunător asupra numărului de celule CD4 (14). Evaluarea virologică a demonstrat că virusul care utilizează CXCR4 care a apărut sub presiunea selectivă a MVC provenea dintr-o populație minoritară preexistentă și nu a apărut de novo (19). În total, aceste rezultate au demonstrat în mod clar beneficiul MVC în gestionarea pacienților tratați anterior cu R5 HIV-1. Un efort Suprem al echipei a dus la depunerea dosarelor pentru înregistrare atât în SUA, cât și în Europa, la numai 2 luni de la data la care datele intermediare au devenit disponibile. MVC (300 mg de două ori pe zi) a primit aprobarea de utilizare (în combinație cu alte ARV) în SUA în August 2007, doar 6.5 ani după ce a fost nominalizat ca candidat pentru dezvoltarea clinică. O lună mai târziu, a fost aprobat și pentru utilizare la această populație din UE.
analiza din săptămâna 48 A STUDIULUI MERIT a fost dezamăgitoare, deoarece MVC plus zidovudină/lamivudină (ARN HIV-1 <50 copii/mL, 65, 3%) nu a îndeplinit criteriile prestabilite pentru non-inferioritate (limita inferioară a intervalului de încredere 1 față-verso 97, 5 Sub-10%) la efavirenz plus zidovudină/lamivudină (ARN HIV-1 <50 copii/mL ml, 69, 3%) (15). Cu toate acestea, pacienții pentru acest studiu au fost testați pentru virusul R5 utilizând testul Trofile original. Acest test a fost îmbunătățit între timp pentru a fi mai sensibil pentru detectarea populațiilor minoritare de virus care utilizează CXCR4. Toate probele de screening pentru pacienții în MERIT au fost ulterior retestate utilizând testul îmbunătățit și o analiză post-hoc efectuată incluzând numai pacienții care au avut virusul R5 numai prin testul mai sensibil. În această analiză, ratele de răspuns pentru MVC și efavirenz au fost de 68, 3 și, respectiv, 68, 5%, cu limita inferioară a intervalului de încredere de 97, 5% peste -10% (15). Pe baza acestor date, MVC a fost, de asemenea, aprobat pentru utilizare în tratament-na pacienți cu o mie în noiembrie 2009 de către Administrația Statelor Unite pentru alimente și medicamente.
MVC nu numai că s-a dovedit a fi un plus valoros pentru armamentariul de droguri ARV în continuă creștere, dar datele din aceste studii au îmbunătățit înțelegerea noastră despre tropismul HIV și relația dintre tropism și progresia bolii. Pentru mine, personal, aceasta a reprezentat o perioadă de mare entuziasm și satisfacție, atât ca medic, cât și ca om de știință.
contribuții autor
ER a elaborat acest manuscris pe baza experienței sale personale ca membru al echipei de dezvoltare MVC. Toate datele au fost publicate integral în altă parte. Toate studiile au fost efectuate în conformitate cu principiile Declarației de la Helsinki și cu toate orientările Conferinței Internaționale privind armonizarea bunelor practici clinice și cerințele legale și de reglementare locale. Toate studiile au fost aprobate de comitete de etică independente și toți pacienții și-au dat consimțământul scris în cunoștință de cauză.
Declarație privind conflictul de interese
Elna Van Der Ryst era angajată a Pfizer Global Research and development la momentul elaborării MVC. În prezent oferă servicii de consultanță pentru Pfizer.
mulțumiri
aș dori să mulțumesc colegilor de la Pfizer care au contribuit la Programul de descoperire și dezvoltare MVC, precum și anchetatorilor și pacienților care au participat la studiile clinice.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF și colab. Prevalența rezistenței la medicamente antiretrovirale în Statele Unite. SIDA (2004) 18:1393-401. doi: 10.1097 / 01.SIDA.0000131310.52526.c7
Pubmed rezumat / Pubmed text complet / CrossRef Text Complet / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA și colab. Intrarea HIV-1 în celulele CD4+ este mediată de receptorul de chemokină CC-CKR-5. Natură (1996) 381:667-73. doi: 10.1038 / 381667a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Cofactor de intrare HIV-1: clonarea funcțională a ADNc a unui receptor cuplat cu proteina G cu șapte transmembranare. Știință (1996) 272:872-7. doi: 10.1126 / știință.272.5263.872
CrossRef Text Complet / Google Scholar
4. Berger EA, Doms RW, Feny em, Korber BT, Littman DR, Moore JP, și colab. O nouă clasificare pentru HIV-1. Natură (1998) 391:240. doi:10.1038/34571
CrossRef Text Complet / Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C și colab. Rezistența la infecția cu HIV-1 la indivizii caucazieni care poartă alele mutante ale genei receptorului de chemokină CCR5. Natură (1996) 382:722-5. doi: 10.1038 / 382722a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Utilizarea clinică a inhibitorilor CCR5 în HIV și în afara acestuia. J Transl Med (2011) 9(Suppl 1): S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text / Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M și colab. Maraviroc (UK-427,857), un inhibitor puternic, biodisponibil oral și selectiv al moleculei mici a receptorului de chemokină CCR5 cu spectru larg virusul imunodeficienței umane de tip 1 activitate. Chemother Agenți Antimicrob (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Text Integral / Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, și colab. Interacțiuni moleculare ale CCR5 cu clase majore de antagoniști anti-HIV-1 CCR5 cu molecule mici. Mol Pharmacol (2008) 73:789-800. doi: 10.1124/mol.107.042101
Pubmed Rezumat / Pubmed Text Complet / CrossRef Text Complet / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Receptorii de chemokină ca co-receptori HIV-1: roluri în intrarea virală, tropism și boală. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146/annurev.immunol.17.1.657
Pubmed Rezumat / Pubmed Text Complet / CrossRef Text Complet / Google Scholar
10. Abel S, van der Ryst E, Rosario MC, James I, Ridgway C, Medhurst C și colab. Evaluarea farmacocineticii, siguranței și toleranței maraviroc, un nou antagonist CCR5, la voluntari sănătoși. Br J Clin Pharmacol (2008) 65(S1):5-18. doi: 10.1111 / j. 1365-2125.2008. 03130.x
Pubmed rezumat / Pubmed text complet / CrossRef Text Complet / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel S, și colab. Analiza farmacocinetică-farmacodinamică a gradului de ocupare a receptorilor CCR5 de către maraviroc la subiecți sănătoși și pacienți HIV pozitivi. Br J Clin Pharmacol (2008) 65(S1):86-94. doi: 10.1111 / j. 1365-2125.2008. 03140.x
Pubmed rezumat / Pubmed text complet / CrossRef Text Complet / Google Scholar
12. F inktkenheuer g, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM și colab. Eficacitatea monoterapiei de scurtă durată cu maraviroc, un nou antagonist CCR5 la pacienții infectați cu HIV-1. Nat Med (2005) 11:1170-2. doi: 10.1038 / nm1319
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, și colab. Maraviroc pentru pacienții tratați anterior cu infecție cu R5 HIV-1. N Engl J Med (2008) 359:1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef Text Complet / Google Scholar
14. F inktkenheuer g, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H și colab. Analize de subgrup ale maraviroc în infecția R5 HIV-1 tratată anterior. N Engl J Med (2008) 359:1442-55. doi: 10.1056 | NEJMoa0803154
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E și colab. Maraviroc versus efavirenz, ambele în asociere cu zidovudină / lamivudină, pentru tratamentul subiecților antiretrovirali-na cu HIV-1 tropic CCR5. J Infect Dis (2010) 201:803-13. doi:10.1086/650697
Pubmed rezumat / Pubmed text complet / CrossRef Text Complet / Google Scholar
16. Saag M, Goodrich J, F Inktkenheuer G, Clotet B, Clumeck N, Sullivan J, și colab. Un studiu dublu-orb, controlat cu placebo, cu maraviroc la pacienți tratați anterior infectați cu HIV-1 tropic non-CCR5: Rezultate de 24 de săptămâni. J Infect Dis (2009) 11:1638-47. doi:10.1086/598965
Pubmed rezumat / Pubmed text complet / CrossRef Text Complet / Google Scholar
17. Nichols WG, oțel HM, Bonny T, Adkison K, Curtis L, Millard J, și colab. Hepatotoxicitate observată în studiile clinice cu aplaviroc (GW873140). Agenți Antimicrob Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Rezumat / Pubmed Text Complet / CrossRef Text Complet / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A și colab. Diagnosticul limfomului și încărcarea plasmatică a virusului Epstein-Barr în timpul terapiei cu vicriviroc: rezultatele grupului de studii clinice SIDA a5211. Clin Infectează Dis (2009) 48:642-9. doi:10.1086/597007
Pubmed rezumat / Pubmed text complet / CrossRef Text Complet / Google Scholar
19. Lewis m, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M, și colab. Virusul care utilizează CXCR4 detectat la pacienții tratați cu maraviroc în studiile de fază III MOTIVATE 1 și 2 provine dintr-o minoritate preexistentă a virusului care utilizează CXCR4. Antivir Ther (2007) 12:S65.
Google Scholar