- Introducere
- structura și reglarea ChREBP prin domeniile LID/Grace
- activarea ChREBP de către metaboliții glucozei
- Co-factori și parteneri ChREBP
- rolul ChREBP în metabolismul carbohidraților și producția de Hepatokine
- ChREBP ca Regulator al sintezei acizilor grași hepatici și al secreției VLDL
- reglarea metabolismului fructozei de către ChREBP în ficat și intestin
- Regulamentul BDK:Axa PPM1K în ficat
- ChREBP este necesar pentru reglarea mediată de glucoză a FGF21
- rolul ChREBP în rețeaua Interorganică care controlează homeostazia energetică
- rolul ChREBP Hepatic în controlul echilibrului sensibilității la insulină
- Chrebp adipos leagă lipogeneza de sensibilitatea la insulină
- interacțiunea Nouă între lipaza sensibilă la hormoni și ChREBP în țesutul adipos
- concluzie și direcții viitoare
- contribuții autor
- finanțare
- Declarație privind conflictul de interese
Introducere
consumul crescut de zaharuri simple, cum ar fi zaharoza și siropul de porumb cu conținut ridicat de fructoză în ultimii ani a dus la un risc crescut de boli metabolice, cum ar fi obezitatea, dislipidemia, diabetul de tip 2 și/sau boala hepatică grasă nealcoolică (NAFLD). Ficatul este principalul organ responsabil pentru Conversia excesului de carbohidrați alimentari în grăsimi. Trigliceridele rezultate (TG) pot fi ambalate în lipoproteine cu densitate foarte mică (VLDL) și fie secretate în circulație, stocate sub formă de picături lipidice, fie metabolizate prin calea beta-oxidării. Insulina secretată ca răspuns la creșterea glicemiei, stimulează expresia genelor sintezei acizilor grași de novo (lipogeneză) prin factorul de transcripție sterol element de reglementare proteină de legare-1C (Srebp-1C) (Foretz și colab., 1999). SREBP-1C acționează în sinergie cu un alt factor de transcripție numit proteina de legare a elementului de răspuns la carbohidrați (ChREBP), care mediază răspunsul la carbohidrații alimentari. Structura proteinei ChREBP conține un domeniu inhibitor scăzut al glucozei (LID) și un element conservat de activare a răspunsului la glucoză (GRACE) situat în n-terminalul său (Li și colab., 2006). Activarea domeniului GRACE de către metaboliții glucozei promovează activitatea transcripțională a ChREBP și legarea la o secvență foarte conservată numită element de răspuns la carbohidrați (corvoadă). Corvoada este prezentă pe promotorii genelor țintă ChREBP, care codifică enzimele cheie ale lipogenezei de novo, inclusiv L-piruvat kinaza (l-pk), o enzimă care limitează viteza în glicoliză, sintaza acidului gras (Fas), acetil-CoA carboxilază (Acc) și stearoil-CoA desaturază (Scd1) (Kawaguchi și colab., 2001). Un studiu recent a raportat interdependența dintre ChREBP (activat de glucoză) și SREBP-1C (activat de insulină) pentru inducerea completă a expresiei genelor glicolitice și lipogene în ficat (Linden și colab., 2018). Restabilirea virală a formei active nucleare a srebp-1C în ficatul șoarecilor cu deficit de ChREBP (ChREBPKO) a normalizat expresia genelor lipogene, fără a avea niciun efect asupra salvării expresiei genelor glicolitice. Experimentul oglindă, în care expresia ChREBP a fost indusă în ficatul șoarecilor knockout SREBP-1C, a salvat expresia genelor glicolitice, dar surprinzător nu expresia genelor lipogene, în ciuda rolului binecunoscut al ChREBP în controlul genelor de sinteză a acizilor grași. Cu toate acestea, acest studiu sugerează importanța acțiunii duale a ChREBP și SREBP-1C în genele de control implicate în reglarea sintezei acizilor grași (Linden și colab., 2018).
ChREBP este foarte îmbogățit în ficat și a fost studiat ca regulator principal al metabolismului lipidic (Iizuka și colab., 2004; Osorio și colab., 2016). ChREBP este, de asemenea, exprimat în mod semnificativ în insulele pancreatice, intestinul subțire, mușchii scheletici și într-o măsură mai mică în rinichi și creier (vezi Richards și colab., 2017 pentru revizuire). Interesant este faptul că o altă izoformă a ChREBP, Chrebp XV, originară dintr-un promotor alternativ de prim exon, a fost identificată pentru prima dată în țesutul adipos (Herman și colab., 2012) și descris ulterior în alte tipuri de celule (vezi Abdul-Wahed și colab., 2017 pentru revizuire). După cum vom discuta, Chrebp-ul este descris ca o izoformă activă constitutiv. Se speră că lucrările viitoare vor aborda rolurile respective ale ChREBP și Chrebp, în reglarea metabolismului glucozei și lipidelor, precum și identificarea țintelor specifice și/sau suprapuse ale acestora.
structura și reglarea ChREBP prin domeniile LID/Grace
ChREBP aparține familiei Mondo a factorilor de transcripție bHLH/Zip. Domeniul n-terminal (1-251 reziduuri) conține două semnal de export nuclear (NES) și un semnal de localizare nucleară (NLS) care reglează localizarea subcelulară prin interacțiunea cu întreținerea regiunii cromozomiale 1 (CRM1) denumită și exportin 1 și/sau 14-3-3 proteine (Sakiyama și colab., 2008). Regiunea C-terminal conține un domeniu poliprolină, un domeniu bHLH/LZ (660-737 reziduuri) și un domeniu asemănător fermoarului leucinei (Zip-like, 807-847 reziduuri) care sunt asociate cu co-factori și legarea ADN-ului (Yamashita și colab., 2001; Fukasawa și colab., 2010; Ge și colab., 2012). Localizarea și activarea transcripțională a ChREBP sunt determinate de disponibilitatea nutrienților. Reglarea mediată de glucoză a ChREBP are loc mai ales la nivelul modulului de detectare a glucozei (GSM) sau al regiunii conservate mondo (MCR), care este compus din LID și domeniile GRACE, așa cum se menționează în introducere (figura 1A; Li și colab., 2006; Singh și Irwin, 2016). În 2012, Herman și colab. (2012) a descris o altă izoformă a ChREBP, Chrebp XV, care este transcrisă dintr-un promotor alternativ al primului exon 1b la exonul 2 (Figura 1b). Această transcriere este tradusă din exonul 4, generând o proteină mai scurtă de 687 de aminoacizi (izoforma ChREBP de lungime completă, redenumită Irak, conține 864 de aminoacizi, numiți ChREBP în manuscris) în care lipsesc cele două NES, NLS și domeniul LID. Chrebp XV este foarte activ în țesutul adipos alb într-o manieră dependentă de GLUT-4 și se sugerează a fi reglat direct de ChREBPa, deoarece o secvență de corvoadă a fost identificată în exonul promotor 1 din circulatia sangelui (Herman și colab., 2012; figura 1B). Reglementarea Chrebp de către ChREBPa sugerează existența unei bucle de avans care poate exacerba răspunsul la glucoză în condiții hiperglicemice. Cu toate acestea, trebuie elucidate mecanismul(mecanismele) de reglementare al (ale) izoformei Chrebp, și, mai important, funcția sa specifică.
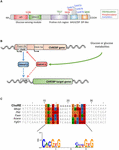
Figura 1. (A) structura proteinei de legare a elementului de răspuns al carbohidraților (Xibr) (ChREBPa). ChREBPa este compus din 864 aminoacizi și conține mai multe domenii de reglementare. La capătul N, proteina conține un modul de detectare a glucozei compus din domeniul inhibitor scăzut al glucozei (LID) și elementul conservat activat de glucoză (GRACE). Proteina conține, de asemenea, un poliprolină-bogat, a bHLH/LZ și a leucină-fermoar-ca (Zip-like) domeniu situat la C-terminal. Modificările Post-translaționale sunt indicate în reziduurile respective, fosforilarea (roșu), acetilarea (albastru) și o-Glcnacilațiile recent identificate (verde). (B) structura genică a genei ChREBP și generarea celor două izoforme ChREBP de la clasele a VIII-a și a VIII-a. Chrebp XV este transcris dintr-un promotor alternativ de prim exon 1b. această transcriere este tradusă din exonul 4 generând o proteină mai scurtă de 687 aminoacizi în care lipsesc cele două NES, NLS și domeniul LID. S-a sugerat că izoforma Chrebp-uri pentru a fi reglementată direct de ChREBPa, deoarece a fost identificată o secvență de corvoadă în promotorul exon 1b. nu se cunoaște în prezent dacă ambele izoforme ChREBP-uri pentru a se lega de corvoadă. Figura adaptată de la Herman și colab. (2012). (C) alinierea multiplă a secvențelor consensului de corvoadă se prezintă în mai mulți promotori ai genei țintă ChREBP. Alinierea pe bază de nucleotide este prezentată în partea de sus a figurii împreună cu secvența de consens corvoada descrisă în Poungvarin și colab. (2015). Logo-ul corespunzător secvenței de consens asociate acestei alinieri particulare este, de asemenea, reprezentat.
activarea ChREBP de către metaboliții glucozei
în condiții de repaus alimentar, activarea dependentă de glucagon a protein kinazei a (PKA) (Kawaguchi și colab., 2002) fosforilează ChREBP pe reziduurile Ser196 și Thr666, ducând la legarea ChREBP de proteina 14-3-3 și reținerea acesteia în citosol (Kawaguchi și colab., 2001, 2002; Davies și colab., 2008). Protein kinaza activată AMP( AMPK), un senzor central de energie celulară, fosforilează, de asemenea, ChREBP pe reziduul Ser568, care la rândul său scade legarea ChREBP de promotorii genelor sale țintă (Kawaguchi și colab., 2002; Sato și colab., 2016). S-a demonstrat că metaboliții generați în timpul postului, cum ar fi AMP și corpurile cetonice produse din oxidarea acizilor grași, joacă un rol inhibitor alosteric prin modificarea ChREBP și a afinității proteice 14-3-3, îmbunătățind stabilizarea complexă și favorizând retenția citosolică (Sakiyama și colab., 2008; Nakagawa și colab., 2013; Sato și colab., 2016). Ca răspuns la carbohidrați, ChREBP este reglat la nivelurile transcripționale, translaționale și post-translaționale. Concentrațiile crescute de glucoză după masă promovează sinteza metaboliților intermediari, cum ar fi xiluloză-5-fosfat (X5P), propus inițial ca activator al protein fosfatazei 2a (PP2A) (Kawaguchi și colab., 2001; Kabashima și colab., 2003). PP2A a fost descris anterior pentru a defosforila ChREBP la reziduul Ser196, permițând translocarea acestuia la nucleu unde este să fie defosforilat în continuare într – un mod dependent de X5P și PP2A (pe Thr666 și Ser568). Cu toate acestea, acest model a fost contestat de-a lungul anilor și alți metaboliți, cum ar fi glucoza-6-fosfat (G6P), au fost propuși a fi potențiali activatori ai translocării/activității ChREBP (Dentin și colab., 2012). McFerrin și colab. (2012) a identificat un motiv presupus pentru legarea G6P (253-SDTLFT-258) pe domeniul GRACE, care este, de asemenea, conservat în MondoA, un Ortholog ChREBP/MondoB (vezi Richards și colab., 2017 pentru revizuire). Conform acestei ipoteze, G6P ar putea promova o schimbare de conformație alosterică care induce o conformație deschisă pentru ChREBP, facilitând interacțiunea cu co-factorii și translocarea ulterioară către nucleu (McFerrin și colab., 2012).
în nucleu, ChREBP poate fi modificat prin o-Glcnacilare, o modificare post-translațională dependentă de metabolismul glucozei și identificată a fi importantă pentru activitatea transcripțională a ChREBP (Guinez și colab., 2010). O-Glcnacilarea are loc pe reziduurile de serină și treonină prin activitatea o-GlcNAc transferazei (OGT), o enzimă care adaugă reziduuri de N-acetilglucozamină (GlcNAc) la proteinele țintă, modificându-le astfel activitatea, stabilitatea și/sau locația subcelulară. Yang și colab. (2017) a dezvăluit recent mai multe reziduuri ChREBP modificate prin o-Glcnacilare. Mutațiile acestor reziduuri în domeniile bHLH/ZIP și dimerizare și domeniul localizării citoplasmatice (DCD) au permis identificarea Thr517 și Ser839 ca site-uri esențiale pentru activarea ChREBP dependentă de glucoză (figura 1a). ChREBP poate fi, de asemenea, modificat prin acetilare prin activitatea histonei acetiltransferază a p300 (Bricambert și colab., 2010). P300 activat de glucoză acetilează ChREBP pe Lys672 și își mărește activitatea transcripțională prin îmbunătățirea recrutării sale în secvența de corvoadă, care este secvența optimă de legare a consensului este CAYGYCnnnnnCRCRTG (figura 1C). Poungvarin și colab. (2015) au analizat site-urile de legare ChREBP prin ChIP-seq în ficat și țesutul adipos alb al șoarecilor re-hrăniți cu o dietă bogată în carbohidrați, fără grăsimi. Ei au raportat că legarea ChREBP este îmbogățită în căile implicate în semnalizarea insulinei, joncțiunile aderente și cancerul, sugerând o nouă implicare a ChREBP în tumorigeneză și progresia cancerului. Mai mult, un studiu recent a raportat importanța ChREBP în carcinomul hepatocelular (HCC) (Ribback și colab., 2017). Autorii au descoperit că ștergerea genetică a ChREBP (la șoarecii ChREBPKO) a afectat hepatocarcinogeneza condusă de supraexpresia protein kinazei B/Akt la șoareci. Mai mult, inhibarea ChREBP mediată de siRNA la celulele HCC de șoarece și/sau la om a dus la scăderea proliferării și a apoptozei.
Co-factori și parteneri ChREBP
mai mulți co-factori și/sau parteneri ai ChREBP au fost identificați în ultimii ani (Vezi Richards și colab., 2017 pentru revizuire). Max like protein x (Mlx), un factor de transcripție bHLH/LZ, a fost primul identificat ca un partener comun de legare al familiei Mondo (Stoeckman și colab., 2004). Dimerizarea ChREBP cu Mlx este necesară atât pentru translocarea nucleară ca răspuns la glucoză, cât și pentru legarea la elementele de corvoadă. Receptorii nucleari, cum ar fi factorul nuclear hepatocitar 4 (hnf4a) și receptorul x farnesoid (FXR), au fost, de asemenea, descriși ca parteneri ChREBP. HNF4a interacționează fizic cu ChREBP prin legarea la regiunea directă repeat-1 (DR-1) pe promotorul genelor țintă ChREBP (Adamson și colab., 2006; Meng și colab., 2016). Mai mult, s-a demonstrat că proteinele Co-Activatoare transcripționale p300/CBP stabilizează Complexul ChREBP/HNF4a (Burke și colab., 2009). Proteinele Co-Activatoare transcripționale p300 / CBP joacă un rol central în coordonarea și integrarea mai multor evenimente dependente de semnal cu aparatul de transcripție. O altă proprietate cheie a p300 / CBP este prezența Histon acetiltransferazei (HAT) activitate, care înzestrează p300/CBP cu capacitatea de a influența activitatea cromatinei prin modularea histonelor nucleozomale. În hepatocitele umane, legarea FXR de Complexul ChREBP-HNF4a declanșează eliberarea ChREBP din CBP/p300, ducând la recrutarea SMRT histonă deacetilază pe promotorul Lpk, acționând astfel ca un co-represor al activității transcripționale ChREBP (Caron și colab., 2013). În plus, activitatea CBP/p300 hat modifică ChREBP pe Lys 672, ducând la activarea sa transcripțională ca răspuns la glucoză (Bricambert și colab., 2010).
Bricambert și colab. (2018) a identificat recent planta Histon demetilază homeodomain finger 2 (Phf2), care aparține familiei histone lizină demetilază (KDM7), ca un nou co-factor al ChREBP. Interacțiunea dintre Phf2 și ChREBP îmbunătățește activarea transcripțională a ChREBP prin ștergerea marcajelor de metil H3K9 pe promotorul genelor sale țintă. Interesant, co-recrutarea specifică a Phf2 și ChREBP la promotorul factorului nuclear eritroid 2 Ca 2 (Nrf2) contribuie la efectul protector al Phf2 împotriva speciilor reactive crescute de oxigen (ROS) și a progresiei NAFLD în contextul hiperglicemiei (Bricambert și colab., 2018).
rolul ChREBP în metabolismul carbohidraților și producția de Hepatokine
ChREBP ca Regulator al sintezei acizilor grași hepatici și al secreției VLDL
boala hepatică grasă nealcoolică este un semn distinctiv al sindromului metabolic, iar studiile la om arată că lipogeneza de novo contribuie la aproximativ 25% din lipidele hepatice totale la pacienții cu NAFLD (Donnelly și colab., 2005). În stările rezistente la insulină, hiperglicemia și hiperinsulinemia sporesc lipogeneza parțial prin activarea ChREBP și srebp-1C. Inhibarea ChREBP în ficat a șoarecilor obezi și rezistenți la insulină ob/ob, prin RNAi sau ablație genetică duce la inversarea steatozei hepatice (Dentin și colab., 2006; Iizuka și colab., 2006). Secreția modificată a VLDL de către ficat contribuie, de asemenea, la patogeneza NAFLD. Proteina de transfer a trigliceridelor microzomale (MTTP) este proteina responsabilă cu asamblarea și secretarea lipoproteinelor care conțin apolipoproteină B. Deficiența MTTP la șoareci și oameni provoacă hipolipidemie și ficat gras. Reglarea acestei proteine a fost asociată cu câteva elemente cis foarte conservate în promotorul său, inclusiv domenii critice de reglementare pozitive și negative (Cuchel și colab., 2013; Hussain și colab., 2011). Recent, ChREBP a fost subliniat ca un potențial regulator al MTTP, deoarece lipsa ChREBP funcțională în ficat suprimă expresia Mttp și asamblarea și secreția VLDL (Niwa și colab., 2018). Cu toate acestea, deoarece nicio sarcină nu a putut fi identificată în mod clar pe promotorul Mttp, va fi necesară o analiză suplimentară pentru a identifica mecanismul cu care ChREBP reglementează Mttp.
reglarea metabolismului fructozei de către ChREBP în ficat și intestin
legătura dintre ChREBP și metabolismul fructozei a fost evidențiată pentru prima dată de analiza fenotipică a șoarecilor knockout ChREBP (șoareci ChREBPKO). Șoarecii ChREBPKO au fost raportați să moară în câteva zile de la hrănirea cu dietă bogată în fructoză (HFrD) (Iizuka și colab., 2004). Această intoleranță majoră la fructoză a fost atribuită reducerii expresiei fructokinazei și trioz kinazei, două enzime necesare metabolismului fructozei (Iizuka și colab., 2004). Kim și colab. (2016) a raportat ulterior importanța ChREBP pentru conversia eficientă a fructozei în glucoză în clearance-ul ficatului și al întregului corp al fructozei, dar, de asemenea, sub ingestia fructozei, ChREBP ar putea contribui la hiperglicemie prin activarea directă a expresiei g6pc, o genă cheie a gluconeogenezei. Acest efect ar putea duce la un cerc vicios în care consumul de fructoză exacerbează producția de glucoză prin activitatea ChREBP (Kim și colab., 2016). În anul următor, studiul lui Zhang și colab. (2017) a raportat că șoarecii ChREBPKO hrăniți cu HFrD dezvoltă leziuni hepatice severe din cauza supraactivării stresului reticulului endoplasmatic și a apoptozei hepatocitare mediate de proteina omoloagă (CHOP) care leagă proteina homoloagă (ccaat). Apoptoza în hepatocite la acești șoareci a fost cel mai probabil legată de creșterea biosintezei colesterolului, deoarece inhibarea acestei căi prin intermediul HMG-CoA reductazei (HMGCR) sau inhibarea SREBP2 a salvat șoarecii ChREBPKO de leziuni hepatice induse de HFrD. Lipsa ChREBP a fost, de asemenea, asociată recent cu o dereglare a metabolismului zaharozei și fructozei, ceea ce duce la intoleranță la zahăr și malabsorbție la șoareci (Kato și colab., 2018). Aceste efecte au fost asociate cu scăderea expresiei zaharozei-izomaltazei intestinale (SI), care digeră zaharoza în glucoză și fructoză, transportorii de glucoză 5 (Glut5) și 2 (Glut2) și enzima ketohexokinază (Khk), care reglează fructoliza (Figura 2). Dereglarea acestor enzime poate duce la acumularea de zaharoză și fructoză nedigerate, cu potențiale repercusiuni în compoziția microbiotei intestinale. Comparația dintre șoarecii ChREBPKO și chrebp knockout specific ficatului (ChREBPLiverKO) hrăniți cu HFrD a arătat anterior că deficitul hepatic ChREBP singur nu duce la intoleranță la fructoză, dar că deficitul de ChREBP în intestinul subțire este cel mai probabil responsabil pentru afectarea toleranței la fructoză observată la acești șoareci (Kim și colab., 2017). În total, aceste studii subliniază importanța ChREBP în reglarea metabolismului fructozei și subliniază necesitatea unei mai bune înțelegeri a rolului și reglementării sale în intestinul subțire.
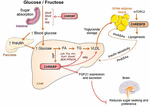
Figura 2. ChREBP reglează căile de semnalizare/metabolice multiple ca răspuns la glucoză și fructoză. ChREBP este exprimat în mai multe țesuturi, inclusiv intestin, ficat și țesut adipos alb. În aceste tipuri de celule, ca răspuns la glucoză și/sau fructoză ChREBP este activat și induce program genic specific așa cum este indicat în figură. În intestin, stimularea expresiei SI, Glut5, Glut2 și Ketohexokinazei (Khk) prin ChREBP (direct sau indirect) a fost descrisă pentru a îmbunătăți toleranța la zaharoză și absorbția fructozei. În ficat, ChREBP este un modulator cheie al expresiei genei proteinei de transfer a trigliceridelor glicolitice, lipogene și microzomale (Mttp), controlând astfel atât acumularea de acizi grași, cât și exportul VLDL din ficat. ChREBP reglementează, de asemenea, producția de hepatokine, cum ar fi factorul de creștere a fibroblastelor 21 (FGF21). Această axă ficat-creier extinde funcția ChREBP hepatică de la un regulator hepatic la un modulator sistemic care afectează nu numai manipularea substratului în ficat, ci și preferința nutrienților. Activarea ChREBP în țesutul adipos alb este legată de îmbunătățirea homeostaziei metabolice prin producerea de semnale circulante de protecție. S-a raportat că o nouă clasă de lipide de mamifere caracterizată printr-o legătură esterică ramificată între un acid gras și un acid hidroxi-gras (acid palmitic hidroxil stearic acid) exercită efecte benefice asupra homeostaziei glucozei prin modularea directă și mediată de incretină a funcției celulare de la suta, creșterea absorbției glucozei adipoase și reducerea inflamației. Interesant este faptul că mTORC2 a fost identificat recent ca un regulator nou al izoformei Chrebp în celulele adipoase.
Regulamentul BDK:Axa PPM1K în ficat
prima etapă angajată a catabolismului aminoacizilor cu catenă ramificată (BCAA) este reglată de complexul cetoacid dehidrogenază cu catenă ramificată (BCKDH) care este controlat de două enzime, alfa-cetoacidul cu catenă ramificată dehidrogenază kinază (BDK) și proteina fosfatază, Mg2+/Mn22+ 1K dependent (PPM1K). White și colab. (2018) a asociat recent ChREBP cu reglarea în sus a BDK și reglarea în jos a PPM1K în ficat și a identificat un motiv conservat de corvoadă în promotorul ambelor gene. O corelație pozitivă între expresia BDK și alte gene țintă tipice ChREBP (Fasn, Pklr, Chrebp) a fost observată la ficatul șobolanilor hrăniți cu o dietă bogată în glucoză sau fructoză. La nivel fiziologic, creșterea raportului BDK: PPM1K a condus la fosforilarea și activarea ATP-citrat lyase (ACLY), stimulând astfel lipogeneza de novo. Aceste constatări relevă faptul că BDK și PPM1K pot fi gene noi de activare a lipogenezei reglementate de Chrebp. Având în vedere rolul lor în reglarea metabolismului lipidelor, glucozei și aminoacizilor, BDK și PPM1K ar putea fi considerate ca ținte terapeutice potențiale în ficat în viitorul apropiat (White și colab., 2018).
ChREBP este necesar pentru reglarea mediată de glucoză a FGF21
ChREBP a fost recent asociată cu producerea și secreția de hepatokine, cum ar fi factorul de creștere a fibroblastelor 21 (FGF21) (Iizuka și colab., 2009; Dushay și colab., 2015, Iroz și colab., 2017). FGF21 este un hormon metabolic sintetizat de ficat cu efecte benefice multiple în țesuturile periferice (Kharitonenkov și colab., 2005; Badman și colab., 2007; Markan și colab., 2014). Până de curând, FGF21 a fost considerat ca un hormon de post care îmbunătățește oxidarea acizilor grași, ketogeneza și lipoliza sub controlul transcripțional al receptorului activat de proliferator peroxizom (PPARa) (Inagaki și colab., 2007). O corvoadă asupra promotorului Fgf21 a fost identificată anterior atât la șoareci (-74 până la -52 bp), cât și la oameni (-380 până la -366 bp) (Iizuka și colab., 2009), dar studiile funcționale au lipsit până de curând. S-a raportat că consumul de glucoză și fructoză duce la o creștere rapidă a nivelurilor de FGF21 la voluntarii sănătoși și la pacienții cu sindrom metabolic (Dushay și colab., 2015). Studii suplimentare au raportat, de asemenea, o legătură mecanicistă între FGF21 derivat din ChREBP și preferința macronutrienților printr-o axă ficat-creier (Talukdar și colab., 2016; von Holstein-Rathlou și colab., 2016). Această axă ficat-creier extinde funcția ChREBP de la un regulator metabolic hepatic la un modulator sistemic, afectând nu numai manipularea substratului hepatic, ci și comportamentul global de hrănire (Abdul-Wahed și colab., 2017).
rolul ChREBP în rețeaua Interorganică care controlează homeostazia energetică
rolul ChREBP Hepatic în controlul echilibrului sensibilității la insulină
laboratorul nostru a raportat anterior că ChREBP acționează ca un modulator cheie al compoziției acizilor grași hepatici și al sensibilității la insulină în contextul bolilor hepatice nealcoolice și alcoolice (vezi Abdul-Wahed și colab., 2017 pentru revizuire). Șoarecii care au exprimat excesiv ChREBP au dezvoltat steatoză hepatică mai mare decât controalele, dar în mod interesant au rămas fără complicații metabolice și nu au dezvoltat rezistență la insulină. Analiza lipidomică a arătat că steatoza mediată de ChREBP este asociată cu o scădere a acizilor grași saturați și o creștere a acizilor grași mononesaturați, aceștia din urmă s-au dovedit a fi asociați cu efecte benefice mediate de ChREBP asupra sensibilității la insulină (Benhamed și colab., 2012). Aceste rezultate demonstrează rolul ChREBP în partiționarea lipidelor și sugerează că speciile lipidice specifice, atunci când sunt prezente în locația și timpul adecvat, pot declanșa semnale care modulează adaptarea la stresul metabolic (Benhamed și colab., 2012; Bricambert și colab., 2018). Interesant, Jois și colab. (2017) a sugerat, de asemenea, un rol protector pentru ChREBP hepatic în ceea ce privește homeostazia glucozei din întregul corp și sensibilitatea la insulină. Șoarecii ChREBPLiverKO prezintă toleranță la glucoză înrăutățită, în timp ce sunt protejați de steatoza hepatică. Ștergerea ChREBP hepatică a dus, de asemenea, la modificări ale expresiei genelor în țesuturile adipoase albe și maronii, sugerând comunicarea între țesuturi. Prin urmare, contribuția ChREBP la echilibrul energetic al întregului corp se poate baza pe reglarea speciilor lipidice și/sau a producției de hepatokină care contribuie la coordonarea inter-tisulară a homeostaziei energetice (Jois și colab., 2017).
Chrebp adipos leagă lipogeneza de sensibilitatea la insulină
semnalizarea insulinei afectate în țesutul adipos este o caracteristică critică a rezistenței la insulină. Studiile au raportat că activarea ChREBP în țesutul adipos alb poate îmbunătăți homeostazia metabolică prin producerea de semnale circulante de protecție (Yore și colab., 2014; Tang și colab., 2016). O clasă de lipide de mamifere caracterizată printr-o legătură esterică ramificată între un acid gras și un acid hidroxi-gras, acidul palmitic hidroxil stearic acid (PAHSA), a fost raportată că exercită efecte benefice asupra homeostaziei glucozei prin modularea directă și mediată de incretină a funcției celulare a celulelor, absorbția glucozei și reducerea inflamației (Yore și colab., 2014). În mod similar, knockout-ul ChREBP specific adipos (ChREBPadiposeKO), care prezintă rate scăzute de lipogeneză în țesutul adipos, sunt rezistente la insulină, cu acțiune insulinică afectată în ficat, mușchi și țesut adipos alb, atât în condiții de dietă chow, cât și în condiții de dietă bogată în grăsimi. Șoarecii ChREBPadiposeKO au niveluri serice mai scăzute de PAHSAs, în timp ce suplimentarea cu PAHSA, în special izomerul 9-PAHSA, salvează rezistența globală la insulină ChREBPadiposeKO și inflamația țesutului adipos, confirmând că pierderea adipos-ChREBP este suficientă pentru a provoca rezistență la insulină (Vijayakumar și colab., 2017). Un studiu recent a identificat ținta mecanicistă a complexului rapamicină 2 (mTORC2) ca un regulator nou al ChREBP (în special izoforma de la XV) în celulele adipoase. Ablația specifică a companionului insensibil la rapamicină al mTOR (Rictor) în adipocitele mature a afectat absorbția glucozei stimulată de insulină în țesutul adipos, ceea ce duce la reglarea în jos a Chrebp și a expresiei genei țintă implicate în controlul lipogenezei (Tang și colab., 2016). În acord cu o crosstalk importantă a ficatului adipos mediată de ChREBP, aceste efecte sunt asociate cu rezistența la insulină hepatică și gluconeogeneza îmbunătățită. În total, aceste studii susțin un rol important pentru ChREBP adipos în declanșarea semnalelor sensibile la insulină (Tang și colab., 2016).
interacțiunea Nouă între lipaza sensibilă la hormoni și ChREBP în țesutul adipos
ChREBP a fost identificată recent ca partener al enzimei lipolitice lipaza sensibilă la hormoni (HSL) în țesutul adipos (Morigny și colab., 2019). S-a demonstrat că eliminarea HSL în adipocitele umane și țesutul adipos de șoarece îmbunătățește sensibilitatea la insulină și induce alungirea enzimei acidului gras cu lanț foarte lung (Elovl6). Elov16 este o enzimă microzomală care reglează alungirea acizilor grași saturați și mononesaturați C12-16 într-o manieră dependentă de ChREBP (Morigny și colab., 2019). La nivel mecanicist, interacțiunea fizică dintre HSL și ChREBP a afectat translocarea nucleară a ChREBPa și inducerea ulterioară a Chrebp-ului și a genelor țintă, în special Elovl6 (Morigny și colab., 2019). Acest studiu relevă o nouă reglementare pentru ChREBP în țesutul adipos. Inhibarea interacțiunii dintre HSL și ChREBP poate duce la strategii terapeutice potențiale pentru îmbunătățirea sensibilității la insulină în celulele adipoase.
concluzie și direcții viitoare
ChREBP este acum un senzor de carbohidrați bine stabilit. Deși majoritatea studiilor au fost dedicate implicării sale în controlul căilor glicolitice și lipogene, datele recente au dezvăluit, de asemenea, contribuții noi ale ChREBP în hepatocite și în celulele grase, unde ar putea fi instrumentale în producerea hepatokinelor și/sau lipokinelor declanșând inter-organ crosstalk. După cum sa discutat, co-factorii nou identificați (modificatori epigenetici) și/sau partenerii (HSL adipos) din aceste țesuturi pot reprezenta, de asemenea, strategii terapeutice potențiale pentru NAFLD și/sau pentru îmbunătățirea sensibilității sistemice la insulină. Studii recente au susținut, de asemenea, importanța ChREBP în reglarea metabolismului fructozei și au subliniat necesitatea unei mai bune înțelegeri a rolului și reglementării sale în intestinul subțire. În cele din urmă, identificarea țintelor specifice și/sau care se suprapun ale ChREBPa și Chrebp pentru tipurile cheie de celule, precum și determinarea impactului specific al acestora asupra sensibilității la insulină vor avea o importanță deosebită în următorii ani.
contribuții autor
toți autorii enumerați au adus o contribuție substanțială, directă și intelectuală la lucrare și au aprobat-o pentru publicare.
finanțare
Laboratorul Postic (U1016-Institut Cochin) este susținut de granturi din rețeaua ChroME (Marie Curie sk acțiunea H2020-MSCA-ITN-2015-675610), Fundația pentru Cercetare Medicală (FRM) (DEQ20150331744) și ANR-15-Ce14-0026-hepatocind.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.