- Introducere
- materiale și metode
- recoltarea ovocitelor și microinjecției cRNA
- izolarea fracțiilor membranare și imunoblotting
- imunohistochimie
- microscopie electronică cu fractură de îngheț
- analiza ovocitelor pereche și cuantificarea zonelor de Contact
- testul impulsului de presiune hidrostatică
- incubația cu Caprați
- analiza statistică
- rezultate
- expresia Claudin-5 și integrarea în X. membrana plasmatică a ovocitelor laevis
- patch-uri de catene cu joncțiune strânsă sunt vizibile în ovocitele care exprimă Claudin-5
- test ovocitar asociat pentru analiza interacțiunii Trans-Claudin
- testul impulsului de presiune hidrostatică relevă joncțiunea specifică Claudinei a perechilor de ovocite
- incubare cu Caprate
- discuție
- Claudinele contribuie la Proprietăți de aderență mai puternice
- concluzie
- Declarație privind disponibilitatea datelor
- declarație de etică
- contribuții autor
- finanțare
- Conflict de interese
- mulțumiri
- material suplimentar
Introducere
familia de proteine cu joncțiune strânsă este crucială pentru fiziologia celulară, deoarece lipsa sau afectarea este asociată cu boli și disfuncții ale multor organe și țesuturi, așa cum se arată, de exemplu, în urechea internă (Wilcox și colab., 2001; Florian și colab., 2003), rinichi (Konrad și colab., 2006; g., 2009), tractul gastro-intestinal (Resnick și colab., 2005; Amasheh și colab., 2009), epidermă (Furuse și colab., 2002; Tebbe și colab., 2002) și capilarele creierului (Nitta și colab., 2003; Wolburg și colab., 2003). Claudinele reprezintă o familie de proteine transmembranare care cuprinde cel puțin 27 de membri (Mineta și colab., 2011). În plus față de cele patru domenii de helix transmembranar, ele conțin două bucle extracelulare (ECL1 și ECL2), un N-terminal scurt și un C-terminal (Suzuki și colab., 2014). Modelele specifice de expresie a Claudinei determină și reflectă permeabilitatea selectivă a epiteliilor, iar capacitatea proteinelor Claudinei de a interacționa în cis (în cadrul aceleiași membrane) și în trans (între membranele celulei vecine) permite formarea de barieră și formarea porilor care formează fire de joncțiune strânse (Van Itallie și Anderson, 2006).
Claudina-5 este puternic exprimată în endotelia capilară și domină joncțiunea strânsă (TJ) a barierei hematoencefalice (BBB), deoarece expresia este > de 100 de ori mai mare comparativ cu orice altă claudină (Ohtsuki și colab., 2007). Mai mult, este exprimată într-o varietate de țesuturi epiteliale, inclusiv plămân (Soini, 2011), țesuturi exocrine (Comper și colab., 2009), intestinal (Garcia-Hernandez și colab., 2017) și tractul urinar (Koda și colab., 2011). Cu toate acestea, claudin-5 provoacă o barieră mai puternică în capilarele creierului decât în alte țesuturi (Reinhold și Rittner, 2017) și funcția sa este afectată în tulburările neurodegenerative și neuroinflamatorii (Greene și colab., 2019). Prin urmare, claudin-5 este crucial pentru menținerea BBB. Dar BBB nu este doar protector, ci limitează și opțiunile terapeutice, deoarece medicamentele sunt împiedicate să pătrundă această barieră.
Nitta și colab. (2003) a raportat că BBB este mai permeabil la molecule de 800 Da în mărime la șoarecii cu deficit de claudin-5 comparativ cu șoarecii de tip sălbatic (Nitta și colab., 2003). Acest lucru a fost în conformitate cu experimentele de transfecție care demonstrează un efect de etanșare al Claudinei-5 în Monostraturile celulare Caco-2 (Amasheh și colab., 2005).
o altă claudină majoră care formează bariera este Claudina-3, despre care s-a raportat că sigilează selectiv bariera împotriva trecerii ionilor fie de sarcină, fie de substanțe dizolvate neîncărcate (Milatz și colab., 2010). Se exprimă, de asemenea, în joncțiunea strânsă endotelială a capilarelor cerebrale, iar pierderea sa funcțională se observă în fazele inflamației microvaselor, glioblastomului și plexului coroid al pacienților cu scleroză multiplă (Engelhardt și colab., 2001; Wolburg și colab., 2003).
proprietățile barierei pot fi modificate dinamic, de ex., s-a demonstrat că incubarea cu caprat de sodiu scade rapid și reversibil rezistența electrică transepitelială în linia celulară intestinală umană HT-29/B6 (Krug și colab., 2013). Capratul de sodiu deschide tranzitoriu barierele care conțin claudin-5 la joncțiunile strânse ale celulelor epiteliale și endoteliale (Del Vecchio și colab., 2012).
acest lucru indică faptul că claudin-5 este o țintă promițătoare pentru îmbunătățirea livrării de medicamente în BBB.
în acest studiu, ne-am propus să folosim sistemul de Expresie heterologă a ovocitelor Xenopus laevis (Vitzthum și colab., 2019) pentru analiza interacțiunii și pertubării claudin-5 și claudin-3. Din cauza lipsei de celule endogene-celule-contacte, acest sistem de Expresie cu o singură celulă permite analiza claudinelor specifice fără interferența altor proteine de joncțiune strânse.
materiale și metode
recoltarea ovocitelor și microinjecției cRNA
ovocitele au fost colectate de la broaștele adulte cu gheare africane prin laparotomie chirurgicală. Pentru anasthesia, 0.2% MS222 (metansulfonat de etil 3-aminobenzoat, Sigma-Aldrich, Taufkirchen, Germania) a fost utilizat ca soluție de baie timp de 5-10 min la 20 C. Odată atinsă anastezia chirurgicală, s-au făcut incizii ale pielii și mușchilor abdominali și masa ovariană a fost exteriorizată și țesutul ovarial îndepărtat. Izolarea ovocitelor a fost efectuată prin digestie enzimatică la temperatura camerei timp de 90 min în 1,5 mg/ml colagenază Fisher BioReagents BP2649-1 (Fisher Scientific, Schwerte, Germania) dizolvată în soluție de sonerie de ovocite (ORi) așa cum este descris de Vitzthum și colab. (2019). Celulele foliculare au fost îndepărtate prin incubare în Ca2 + – Free ORi conținând (în mM): NaCl (90), KCl (1), EGTA (acid trietilenglicol diamin tetraacetic) (1), 5 HEPES (5); pH 7,4 timp de 10 min pe un agitator mecanic cu 50 rpm. Au fost injectate ovocite din etapele V și VI (>1000 MMC) (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Statele Unite) cu 1 ng cRNA care codifică apa umană claudin-5, claudin-3 sau fără Rnază ca controale. Volumul injectării a fost de 50,6 nl per ovocit. După injectare, ovocitele au fost incubate la 16 centi C În ORi 3 zile pentru exprimarea proteinelor.
izolarea fracțiilor membranare și imunoblotting
zece ovocite injectate au fost reunite pentru analiza western blot și omogenizate în tampon de omogenizare de 500 ilqql conținând (în mM) MgCl2 (5), NaH2PO4 (5), EDTA (acid etilendiaminotetraacetic) (1), zaharoză (80) și Tris (Tris(hidroximetil)aminometan) (20); pH 7.4. Extractele de ovocite au fost centrifugate de două ori la 200 rpm timp de 10 min la 4 centimetric C pentru a arunca resturile celulare. Supernatantul a fost centrifugat la 13.000 rpm Timp de 30 min la 4 centi C pentru a peleta membrana celulară așa cum este descris de Leduc-Nadeau și colab. (2007). Peletele au fost omogenizate într-un tampon de omogenizare de 80 lqql. Cuantificarea proteinelor s-a făcut colorimetric folosind setul de testare a proteinelor Pierce 600 nm (Thermo Fisher Scientific, Hennigsdorf, Germania) conform instrucțiunilor producătorului într-o placă de 96 de puțuri. Cititorul de plăci (PerkinElmer EnSpire Multimode Plate Reader, Waltham, MA, Statele Unite) a fost ajustat la 562 nm, iar standardul de albumină serică bovină (Thermo Fisher Scientific, Hennigsdorf, Germania) a fost utilizat pentru evaluare între 125 și 2000 de kilograme/ml. Înainte de imunoblotting, probele au fost amestecate cu 4 tampoane laemmli (laboratoare Bio-Rad, Munchen, Germania), încărcate pe un gel de poliacrilamidă 10% SDS și electroforezate. Pentru transferul de proteine, membranele PVDF au fost utilizate și blocate în 5% lapte uscat fără grăsimi în soluție salină tamponată Tris timp de 120 min. Proteinele au fost detectate prin imunoblotting folosind anticorpi primari crescuți împotriva claudin-3 sau claudin-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Statele Unite).
anticorpii anti-iepure și anti-șoarece conjugați cu peroxidază (#7074, #7076 Cell Signaling Technology, Danvers, MA, Statele Unite) au fost utilizați pentru a se lega de anticorpii primari și, prin urmare, incubați timp de minimum 45 de minute la temperatura camerei. Pentru detecție, a fost utilizat substratul blotting Clarity Western ECL (#1705061, Bio-Rad Laboratories GmbH, Munchen, Germania) și semnalele au fost vizualizate de un sistem ChemiDoc MP (Bio-Rad Laboratories).
imunohistochimie
ovocitele injectate au fost fixate în 4% PFA (16% paraformaldehidă, E15700, Science Service, Munchen, Germania) timp de 4 ore la temperatura camerei, urmate de gradient de deshidratare de la 70% etanol la xilol (Carl Roth, Karlsruhe, Germania) în decurs de 48 de ore. probele au fost încorporate în parafină și secționate transversal (5 (Leica Microsystems Heidelberg, Germania). Cu puțin timp înainte de tratamentul imunohistochimic, parafina a fost îndepărtată prin gradient de xilol până la etanol. Locurile de legare nespecifice au fost blocate utilizând ser de capră 5% în soluție salină tamponată cu fosfat și incubate cu aceiași anticorpi primari ca pentru imunoblotting. Probele au fost incubate cu anticorpii secundari Alexa Fluor-488 goat anti-rabbit și Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, Statele Unite) și examinate prin microscopie de imunofluorescență cu scanare laser confocală (lsm 710, Zeiss, Oberkochen, Germania).
microscopie electronică cu fractură de îngheț
microscopia electronică cu fractură de îngheț a fost efectuată așa cum s-a raportat recent (Greene și colab., 2019). Pentru fixare, ovocitele injectate au fost incubate în glutaraldehidă (2,5% în tampon de cacodilat 0,1 M) peste noapte la 4 centimetrii C. După spălarea cu tampon de cacodilat, ovocitele au fost pregătite pentru fracturarea prin îngheț. Probele au fost crioprotectate în 30% glicerol și congelate în azot lichid. După fracturare și umbrire cu platină și carbon (BAF400D; Balzers, Liechtenstein), materialul organic rămas a fost îndepărtat printr-o spălare cu hipoclorit de sodiu. Ovocitele au fost analizate într-un microscop electronic de transmisie (EM-10, Zeiss, Oberkochen, Germania) și fotografiate cu un aparat de fotografiat digital (TR Xvndle GmbH). Analiza morfometrică a catenelor de joncțiune strânsă a fost efectuată la o mărire de 20.000 de centimetrii.
analiza ovocitelor pereche și cuantificarea zonelor de Contact
manitolul a fost implementat pentru a micșora ovocitele injectate și a permite îndepărtarea mecanică a membranei vitelline folosind forceps fără a deteriora membrana plasmatică. 5-10 ovocite au fost plasate într-un vas petri (diametru 35 mm, Thermo Fisher, Henningsdorf, Germania, #153066) umplut cu ORi. Manitolul a fost adăugat și dizolvat până când s-a obținut micșorarea hipertonică a celulelor (aproximativ 400 mOsmol/l timp de 10 minute). După devitelinizarea manuală, ovocitele au fost transferate imediat pe o placă cu 24 de godeuri (1. 86 cm2 suprafață, TPP Techno Plastic Products, Trasadingen, Elveția, # 92024) conținând 2 ml de ORi. În fiecare godeu, două celule au fost grupate ușor prin împingerea lor împreună cu o pipetă Pasteur (1 ml, Thermo Fisher, Henningsdorf, Germania, #PP88SB) și o sondă bulbică.
perechi de ovocite de claudin-5-exprimând (cldn5 − cldn5), claudin-3-exprimând (cldn3 − cldn3), claudin-3 și claudin-5 coexprimând (cldn3,5 − cldn3,5) și ovocite de control (control − control) au fost ținute împreună timp de până la 48 de ore în ORi la 16 cuantificarea ariei de contact a ovocitelor grupate după 1, 24 și 48 h. imagini ale perechilor de ovocite na oquve în 24 de vase de cultură au fost luate în aceste momente cu ajutorul unui microscop Leica dmi6000 b (Leica Microsystems, Wetzlar, Germania). Diametrul zonei de contact a fost măsurat utilizând scala micronică (LAS-AF 3.2.0). Zonele de Contact sunt considerate circulare și, prin urmare, aria de contact a fost calculată utilizând ecuația cercului a=R2.
testul impulsului de presiune hidrostatică
membranele Vitelline au fost îndepărtate mecanic așa cum s-a descris anterior și ovocitele s-au grupat analagos la testul ovocitar asociat. În plus, au fost testate perechi de ovocite mixte (control–cldn5 și control–cldn3) în testul impulsului de presiune hidrostatică (HPI). După 24 de ore de stabilizare, a fost creat un impuls hidrostatic definit folosind o pipetă electronică cu un singur canal (EE-300r, Eppendorf Research Pro, versiunea software 2.06.00, Hamburg, Germania).
ovocitele au fost păstrate în 24 de plăci de sondă conținând 2 ml ORi, iar poziționarea centrală a fost verificată înainte de aplicarea volumului de pipetare 250 unktil ORi. Viteza de distribuire a fost reglată uniform la viteza maximă, echivalând cu o viteză de distribuire de 0,9 s. în plus, unghiul (45%) și distanța de aplicare (1,3%) au fost aplicate uniform. Presiunea ambientală, vâscozitatea ORi și diametrul deschiderii vârfului pipetei au fost menținute în condiții constante. Microscopia cu câmp luminos a fost utilizată pentru cuantificarea zonelor de contact la 30 de minute după aplicarea presiunii hidrostatice și comparată cu zonele de contact înainte de aplicare. Configurația experimentală este descrisă în Figura 1.
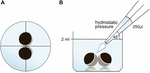
Figura 1. Configurarea experimentală a testului impulsului de presiune hidrostatică (A) vedere schematică de sus a puțului: poziționarea centrală a perechii de ovocite a fost verificată înainte de aplicarea presiunii hidrostatice. (B) vedere laterală schematică a puțului: s-a adăugat o pipetă electronică cu un singur canal de 250 unqutl ORi. Viteza de distribuire a fost setată uniform la viteza maximă. Unghiul (45 centimetri) și distanța de aplicare au fost aplicate uniform. Presiunea ambientală, vâscozitatea ORi și diametrul deschiderii vârfului pipetei au fost menținute în condiții constante.
incubația cu Caprați
pentru incubația cu caprați, capratul de sodiu (#C4151, Sigma Aldrich, Taufkirchen, Germania) în concentrații finale de 50, 100 și 500 de centimetrii, sau ORi ca grup de referință, a fost adăugat la ovocite la 24 de ore după împerechere. Ovocitele au fost păstrate în 24 de plăci de sondă conținând 2 ml ORi, iar soluția de caprat a fost dizolvată într-un volum de adiție definit de 250 XQL ORi per godeu. Lățimea zonei de contact a fost cuantificată la 30, 60 și 120 de minute după adăugare.
analiza statistică
analiza statistică a fost efectuată cu JMP Pro 14.0.0 (NC, Statele Unite). Datele sunt prezentate ca medii și afișate ca modificări procentuale pe baza combinației grupate la primele puncte de examinare. Figurile 4, 5 sunt prezentate ca parcele de cutii, reprezentând prima quartilă (25%), mediana (50%) și a doua quartilă (75%). Mustățile sunt trase până la percentila a 10-a și până la percentila a 90-a. Distribuția normală a fost verificată utilizând testul Shapiro–Wilk.
testul Kruskal–Wallis a fost utilizat pentru comparații multiple, urmat de o corecție Dunn-Bonferroni. valorile p sunt date ca numere continue.
rezultate
expresia Claudin-5 și integrarea în X. membrana plasmatică a ovocitelor laevis
pentru a testa exprimarea și integrarea cu succes a proteinei de joncțiune strânsă claudin-5 în membrana plasmatică a ovocitelor, la 3 zile după injectarea claudin-5 cRNA, fracțiunile membranare au fost analizate prin imunoblotting. Toate probele de la trei animale individuale (d1–d3) au evidențiat semnale specifice claudin-5 la 23 kDa, în timp ce ovocitele injectate cu apă fără Rnază nu au prezentat niciun semnal specific pentru expresia claudin-5 (Figura 2a).
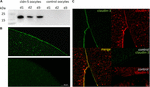
Figura 2. Detectarea claudinelor exprimate heterolog în ovocitele Xenopus laevis. (A) analiza imunoblot a proteinei de joncțiune strânsă claudin-5 în ovocitele X. laevis a trei animale (d1–d3). Lizele membranei celulare au fost supuse SDS-PAGE urmate de imunoblot pe membranele PVDF. Membranele au fost incubate cu anticorpi primari și anticorpi secundari conjugați cu peroxidază (n = 3). (B) colorarea imunofluorescentă a evidențiat semnale specifice de claudină-5 (verde) în membranele ovocitare ale tuturor ovocitelor injectate cu cRNA, în timp ce în controalele injectate cu apă, nu au fost detectate semnale specifice Claudinei în microscopia confocală. Imagini reprezentative ale ovocitelor derivate din trei animale. Barete de cantar: 50 unftm. (C) colorarea imunofluorescentă a ovocitelor care exprimă claudin-5 și claudin-3 a evidențiat semnale specifice claudin-3 (verde) și semnale claudin-5 (roșu) în membranele ovocitare ale ovocitelor injectate cu cRNA, în timp ce în controalele injectate cu apă nu au fost detectate semnale specifice Claudinei. Colocalizarea proteinelor claudinice exprimate în membrana plasmatică a ovocitelor este evidențiată prin colorarea dublă imunofluorescentă (galbenă). Bar de scara: 10 unftm.
pentru vizualizarea proteinelor exprimate în membrana plasmatică, s-au efectuat colorări imunohistochimice și analizate prin microscopie confocală cu scanare laser (figura 2b). Au fost detectate semnale specifice și distribuite uniform pe toată membrana plasmatică a ovocitelor care exprimă claudin-5. În conformitate cu imunobloții, nu au fost detectate semnale specifice în membranele plasmatice ale ovocitelor de control.
astfel, după injectarea cRNA, claudin-5 a fost exprimat cu succes și integrat în membrana plasmatică a ovocitelor X. laevis.
Coexprimarea claudin-3 și claudin-5 în perechi de ovocite a evidențiat semnale specifice pentru claudin-5 (roșu) și claudin-3 (verde) în ambele celule (figura 2c). Membranele plasmatice ale ovocitelor au arătat o fuziune a celulelor vecine furnizate de interacțiunea directă cldn3,5-cldn3, 5 (Galben).
patch-uri de catene cu joncțiune strânsă sunt vizibile în ovocitele care exprimă Claudin-5
membranele plasmatice ale ovocitelor au fost analizate și vizualizarea catenelor cu joncțiune strânsă a avut succes (figura 3). Microscopia electronică cu fractură de îngheț a arătat plasturi de morfologie a catenei în membranele plasmatice ale ovocitelor injectate cu claudin-5, iar organizarea catenei ovocitelor care exprimă claudin-5 a fost foarte organizată și de formă unghiulară (figura 3a). Firele de joncțiune strânse au fost detectate în primul rând în fața protoplasmică (P-) a membranei. Ovocitele injectate cu Claudin-3 au prezentat fire de joncțiune strânse foarte bine organizate, așa cum s-a raportat anterior (Vitzthum și colab., 2019; figura 3B). Microscopia electronică a fracturii de înghețare a ovocitelor coexprimate claudin-3 și claudin-5 a relevat fibrile care poartă ambele proprietăți ale claudin-3 și claudin-5. Arhitectura firului Fibril al ovocitelor coexprimate a apărut atât rotunjite, cât și complexe ca ovocite care exprimă claudin-3, dar și discontinue și mai înclinate, așa cum se arată pentru celulele care exprimă claudin-5 (Figura 3c). Ovocitele de Control au avut o suprafață tipică netedă (figura 3D).
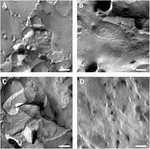
Figura 3. Înghețați fractura microscopie electronică. (A) microscopia electronică cu fractură de îngheț relevă proteina de joncțiune strânsă cldn-5 ca o rețea de fibrile discontinue unghiulare în rânduri în ovocitele Xenopus laevis. (B) microscopia electronică cu fractură de îngheț relevă proteina de joncțiune strânsă cldn-3 ca o rețea de fibrile rotunjite în ovocitele X. laevis. (C) microscopia electronică a fracturii de înghețare a ovocitelor coexprimate claudin-3 și claudin-5 dezvăluie fibrile care poartă ambele proprietăți ale claudin-3 și claudin-5. (D) ovocitele martor injectate cu apă au o suprafață netedă. Imagini reprezentative ale ovocitelor derivate din trei animale. Bar scară: 250 nm.
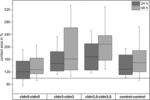
Figura 4. Zonele de contact mediane ale combinațiilor de ovocite grupate cldn5-cldn5, cldn3–cldn3,cldn3,5–cldn3, 5 și control–control 24 și 48 h după grupare în % din zonele de contact inițiale la scurt timp după grupare (n = 8-38).

Figura 5. Zonele de Contact ale ovocitelor claudin-5, claudin-3 și coexprimând claudin-3 și claudin-5 în provocarea impulsului de presiune hidrostatică (HPI) după perioada de stabilizare și la 30 de minute după HPI (n = 16-70, *p < 0,05, **p < 0.01, Kruskal-Wallis urmat de o corecție Dunn–Bonferroni).
test ovocitar asociat pentru analiza interacțiunii Trans-Claudin
toate combinațiile grupate au arătat o creștere dependentă de timp a ariei de contact pe perioada de timp măsurată (Figura 4 și Tabelul 1).
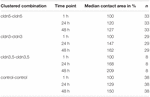
Tabelul 1. Zonele de contact ale ovocitelor în decurs de 48 de ore după grupare.
aria de contact a ovocitelor martor injectate cu apă a crescut la 129% după 24 de ore și la 150% după 48 de ore. Perechile grupate de ovocite care exprimă claudin-3 au arătat, de asemenea, o creștere a zonelor de contact la 147% (24 h) și 162% (48 h). Perechile grupate de ovocite coexprimând claudin-3 și claudin-5 au prezentat zone de contact de 168% (24 ore) și 209% (48 ore). Perechile grupate de ovocite care exprimă numai claudin-5 au prezentat zone de contact de 120% (24 ore) și 127% (48 ore). Prin urmare, zonele de contact din toate combinațiile testate au fost comparabile.
testul impulsului de presiune hidrostatică relevă joncțiunea specifică Claudinei a perechilor de ovocite
într-o abordare separată, ovocitele care exprimă claudin-3 sau claudin-5 sau coexprimând ambele Claudine au fost grupate după devitelinizare mecanică. Ovocitele au fost provocate prin utilizarea unui HPI, iar zonele de contact au fost măsurate și calculate la 30 de minute după provocare și comparate cu zonele inițiale după perioada de stabilizare de 24 de ore (Figura 5 și Tabelul 2). După provocarea presiunii hidrostatice, zona de contact a ovocitelor de control injectate cu apă a scăzut la 89%. Perechile grupate de ovocite care exprimă claudin-5, claudin-3 sau coexprimând claudin-3 și claudin-5 au păstrat zone de contact mai mari (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Zonele de contact ale ovocitelor de control mixte injectate cu apă și ovocitelor care exprimă claudină (control-cldn5 și control–cldn3) nu au diferit semnificativ de ovocitele de control (93%, p = 0,2900; 83%, p = 0,4455).
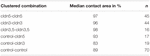
Tabelul 2. Testul impulsului de presiune hidrostatică.
incubare cu Caprate
într-un experiment pilot de incubare, ovocitele au fost injectate și împerecheate în combinații fie exprimând claudin–5 (cldn5–cldn5), fie injectate cu apă fără Rnază ca martor (control-control). Perechile au fost incubate cu concentrații finale de caprat de sodiu de 50, 100 sau 500 MMC. Incubarea perechilor de ovocite cu ORi a servit ca grup de referință. Ovocitele au fost grupate și după 24 de ore de stabilizare, incubația a început și lățimile de contact au fost măsurate la 30, 60 și 120 de minute după adăugare (figura suplimentară S1).
adăugarea de ORi a dus la o scădere inițială a zonelor de contact atât în perechile de ovocite care exprimă claudină, cât și în cele injectate cu apă, care sunt dispersate la 60 sau 120 de minute după adăugare. Acest lucru este subliniat de forma parabolică a liniei de legătură dintre zonele de contact mediane în timp (curbe roșii în figura suplimentară S1). Cu toate acestea, incubare cu 100 și 500 µM de sodiu caprate crescut zone de contact ușor (100 µM) sau puternic (500 µM) 30 min după caprate plus de la 5,1 × 105 la 5,2 × 105 µm2 și 4.3 × 105 la 4,9 × 105 µm2.
discuție
în studiul de față, am folosit modelul clasic pentru transportori și modelarea bolilor umane (Tammaro și colab., 2009; Nenni și colab., 2019), ovocitele X. laevis, pentru o analiză aprofundată a interacțiunii claudin-5 și a contribuției funcționale la sigiliul de joncțiune. În acest scop, a fost stabilită o abordare nouă, care introduce un HPI pentru interacțiunea provocatoare în zona de contact a ovocitelor Xenopus grupate.
Claudinele contribuie la Proprietăți de aderență mai puternice
în conformitate cu rezultatele anterioare de la Vitzthum și colab. (2019), claudinele unice exprimate în ovocite nu au dus la o creștere a zonelor de contact de interacțiune comparativ cu ovocitele de control. Cu toate acestea, imunoblotul și vizualizarea imunohistochimică au dovedit expresia și integrarea cu succes în membrana plasmatică a ovocitelor X. laevis. Mai mult, utilizarea microscopiei de scanare laser confocală a permis o localizare precisă a claudinelor exprimate în membrana plasmatică, deoarece orificiul a blocat fluorescența în afara focalizării. Nu a fost urmărită o cuantificare a semnalelor imunohistochimice, deoarece afinitatea anticorpilor pentru legarea țintelor lor diferă.
Vedula și colab. (2009) a folosit o tehnică de aspirație micropipetă pentru a investiga aspecte ale interacțiunii claudin-claudin folosind l-fibroblaste transfectate cu occludină marcată cu GFP, cldn-1 și cldn-2. Forța de separare necesară pentru detașarea a două celule una de cealaltă a fost mai mare în celulele transfectate cldn-1 și cldn-2 (respectiv 2,8 și 2,3 NN). Deși această abordare ar putea părea promițătoare și pentru analiza interacțiunii claudin-claudin a ovocitelor care exprimă, testele preliminare au arătat că o detașare a ovocitelor grupate nu este posibilă fără întreruperea membranelor plasmatice ale ovocitelor.
prin urmare, ca o abordare nouă, forța conexiunilor a fost măsurată printr-un HPI. Deși HPI nu oferă o cuantificare a forței de separare în valori absolute (de exemplu, în newton), permite o analiză rapidă și rentabilă a interacțiunii Claudinei fără perturbarea altor proteine de joncțiune strânsă (de ex., occludină, tricelulină, gem-A). Claudinele contribuie la joncțiunea perechilor de ovocite, deoarece prezintă o zonă de contact mai mare în comparație cu ovocitele injectate cu apă după HPI. Aceasta indică o interacțiune trans-homofilă puternică între celulele care exprimă Claudina.
Strand fibril arhitectura este specific pentru claudins unice (Colegio și colab., 2002). În microscopia electronică cu fractură de îngheț, claudin-3 a fost raportat că asamblează o rețea de fire mai rotunjite în forme de buclă în ovocitele Xenopus (Vitzthum și colab., 2019; Figura 3B) în timpul studiului nostru, claudin-5 a format o rețea mai unghiulară și ordonată în rânduri. Imaginile au arătat că proteina de joncțiune strânsă claudin-5 formează o rețea de fibrile în rânduri discontinue, în formă unghiulară, în ovocitele X. laevis. Acest lucru este în conformitate cu catenele claudin-5 cunoscute a apărea ca lanțuri de particule asociate fazei P (Piontek și colab., 2011). În experimentele noastre, forma geometrică a fibrilelor părea să nu aibă niciun efect asupra proprietăților de adeziune a ovocitelor. În conformitate cu aceasta, s-a raportat că rezistența paracelulară nu are legătură cu numărul fibrililor și proprietățile de formare a fibrilelor (Colegio și colab., 2002). Mai mult, claudin-3 și claudin-5 s-au dovedit a avea o capacitate similară de interacțiune trans homofilă în celulele HEK293 (Piontek și colab., 2011).
acest model de ovocite X. laevis, care exprimă proteine unice de joncțiune strânsă, permite observarea efectului substanțelor precum capratul de sodiu asupra formării zonelor de contact între ovocitele grupate. Prin urmare, acesta poate oferi un instrument util pentru o examinare eficientă din punct de vedere al timpului și al costurilor pentru substanțele care afectează bariera de joncțiune strânsă.
concentrațiile de caprat de sodiu de 100 și 500 MMC pot avea un efect protector asupra ovocitelor care exprimă claudin-5, ceea ce duce la creșterea zonelor de contact după 30 de minute de incubare.
Krug și colab. (2013) a demonstrat că incubarea cu caprat de sodiu a dus la o scădere rapidă și reversibilă a rezistenței transepiteliale în linia celulară intestinală umană HT-29/B6. Mai mult, microscopia confocală cu scanare laser a evidențiat o reducere marcată a Claudinei-5 în celulele HT-29/B6 tratate cu lauratul acidului gras cu lanț mediu (Dittmann și colab., 2014). Prima buclă extracelulară a claudinelor (ECL1) este importantă pentru proprietățile de barieră ale joncțiunii strânse, în timp ce a doua buclă extracelulară (ECL2) este implicată în formarea catenei de interacțiune trans (Piontek și colab., 2008; Rossa și colab., 2014; Greene și colab., 2019). Lianții Claudin-5 care vizează ECL1 sau ECL2 de claudin-5 pot induce absorbția intracelulară a proteinei de joncțiune strânsă, împiedicând astfel interacțiunile trans claudin-5 în sigiliul de joncțiune strânsă dintre celulele adiacente și slăbind spațiul paracelular (Hashimoto și colab., 2017).
astfel, am emis ipoteza că incubarea cu caprat de sodiu ar duce la o scădere a zonei de contact a ovocitelor claudin-5 grupate care exprimă X. laevis. În mod neașteptat, creșterea concentrațiilor de caprat de sodiu (100 și 500 xqqm) a dus la creșterea zonelor de contact ale ovocitelor grupate care exprimă claudin-5 indicând un efect protector al capratului de sodiu asupra sigiliului de joncțiune strâns. Mai mult, capratul de sodiu este descris pentru a induce contracția inelului perijuncțional actomiozin, lărgind spațiul paracelular (Lindmark și colab., 1998; Maher și colab., 2009). Acest efect se bazează pe fosforilarea lanțului ușor reglator al miozinei printr-o activare a fosfolipazei C care duce la scindarea fosfatidilinozitolului 4,5-bifosfat (PIP2) în inozitol trifosfat (IP3) și diacilglicerol (Tomita și colab., 1995). Complexul de joncțiune strâns legat de proteina schelă ZO-1 la citoscheletul actinei este apoi redistribuit de la joncțiunea strânsă la citoplasmă (Lindmark și colab., 1998; Turner, 2000). Citoarhitectura ovocitului X. laevis este crucială pentru regionalizarea citoplasmatică în timpul oogenezei (Wylie și colab., 1985). Deși, înainte de fertilizare, expresia genei tjp-1, gena care codifică ZO-1 este exprimată doar 1,9 TPM în stadiile de ovocite V–VI (sesiune și colab., 2016). Prin urmare, o interacțiune redusă a claudinelor cu schela citoscheletală poate explica rezultatul neașteptat al incubației caprate. Este domeniul de aplicare al studiilor viitoare pentru a verifica baza mecanicistă a constatării.
cu toate acestea, un efect variant al capratului de sodiu asupra permeabilității paracelulare a fost descris în literatura de specialitate anterior. În țesutul de plasture al lui Peyer luat din intestinul porcilor adulți, a fost detectat un efect de întărire similar. Claudin-5 a crescut semnificativ după incubare cu caprat de 5 mM. În acest studiu caprate a condus la o rezistență electrică transepitelială semnificativ mai mare (TEER) în epiteliul asociat foliculului (Radloff și colab., 2019).
concluzie
în concluzie, expresia heterologă a proteinei de joncțiune strânsă claudin-5 în X. ovocitele laevis permit noi perspective asupra contribuției claudinelor unice la interacțiunea celulă-celulă și proprietățile aderențelor celulelor adiacente. Astfel, utilizarea modelului de joncțiune strânsă X. laevis pentru claudin-5 permite analiza componentelor BBB într-un model cu o singură celulă.
Declarație privind disponibilitatea datelor
seturile de date generate pentru acest studiu sunt disponibile la cerere autorului corespondent.
declarație de etică
tratamentele pe animale au fost în conformitate cu liniile directoare ale legislației germane, cu aprobarea ofițerului pentru bunăstarea animalelor din cadrul Freie Universit XVT Berlin și sub guvernarea Inspectoratului Sanitar Veterinar din Berlin (Landesamt F oectr Gesundheit und Soziales Berlin, permis G0025/16).
contribuții autor
toți autorii au citit și aprobat manuscrisul. NB și SA au proiectat, planificat și supravegheat experimentele și au scris manuscrisul. NB, LS, VC, RK și PF-B au efectuat experimentele și analiza datelor.
finanțare
acest studiu a fost finanțat de Deutsche Forschungsgemeinschaft, Grant Nr. AM141 / 11-1 și H. Wilhelm Schaumann Stiftung.
Conflict de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
mulțumim lui Martin Grunau, Gisela Manz, Katharina s Unixtllig și Susanne Trappe pentru asistență tehnică excelentă. Recunoaștem sprijinul acordat de inițiativa de publicare cu acces deschis a Freie Universit XVT Berlin.
material suplimentar
materialul suplimentar pentru acest articol poate fi găsit online la: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
figura S1 / zonele de Contact ale perechilor de ovocite claudin – 5 care exprimă inqqm2 în timpul incubării cu caprat de sodiu în concentrații diferite (n = 6-8, respectiv) și ovocite injectate cu apă ca martor (n = 5-7, respectiv).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J. și Kroesen, A. J. (2009). Mucoasa pungii inflamate posedă joncțiuni strânse modificate care indică reapariția bolii inflamatorii intestinale. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed rezumat / CrossRef Text Complet / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S. și colab. (2005). Contribuția claudin-5 la proprietățile de barieră în joncțiunile strânse ale celulelor epiteliale. Țesutul Celular Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed rezumat / CrossRef Text Complet / Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C. și Anderson, J. M. (2002). Rolul domeniilor extracelulare claudin în arhitectura fibrilă a joncțiunii strânse și selectivitatea încărcării paracelulare. Celula Mol Biol. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P. și colab. (2009). Modelul de Expresie al claudinelor 5 și 7 distinge solid-pseudopapillary de pancreatoblastomul, celulele acinare și tumorile endocrine ale pancreasului. Am. J. Surg. Pathol. 33, 768–774. doi: 10.1097/pas.0b013e3181957bc4
PubMed rezumat / CrossRef text integral / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R. și colab. (2012). Capratul de sodiu deschide tranzitoriu barierele care conțin claudin-5 la joncțiunile strânse ale celulelor epiteliale și endoteliale. Mol. Pharm. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed rezumat / CrossRef Text Complet / Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M. și Amasheh, S. (2014). Laurate pătrunde calea paracelulară pentru molecule mici în modelul celular epitelial intestinal HT-29 / B6 prin deschiderea joncțiunilor strânse prin relocarea reversibilă a Claudinei-5. Pharm. Res. Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed rezumat / CrossRef Text Complet / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K. și Wolburg, H. (2001). Implicarea plexului coroidian în inflamația sistemului nervos central. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::ajutor-jemt13>3.0.co;2-5
CrossRef Text Complet / Google Scholar
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A. și colab. (2003). Claudins în joncțiunile strânse ale celulelor marginale stria vascularis. Biochem. Biophys. Res.Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
CrossRef Text Complet / Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y. și colab. (2002). Joncțiunile strânse pe bază de Claudin sunt cruciale pentru bariera epidermică a mamiferelor: o lecție de la șoarecii cu deficit de claudin-1. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed rezumat / CrossRef text integral / Google Scholar
Garcia-Hernandez, V., Quiros, M. și Nusrat ,A. (2017). Claudine epiteliale intestinale: expresie și reglare în homeostazie și inflamație. Ann. N. Y. Acad. Sci. 1397, 66–79. doi: 10.1111 / nyas.13360
rezumat PubMed / CrossRef Text Complet / Google Scholar
Greene, C., Hanley, N. și Campbell, M. (2019). Claudin-5: gatekeeper al funcției neurologice. Fluide Barr. CNS 16: 4321.
Google Scholar
G. N., D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W. și colab. (2009). Claudin-16 afectează secreția CL transcelulară în celulele MDCK. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
rezumat PubMed / CrossRef Text Complet / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M. și colab. (2017). Claudin-5-lianți spori permeație de substanțe dizolvate peste bariera hematoencefalică într-un model de mamifere. J. Pharmacol. Exp. Acolo. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed rezumat / CrossRef text integral / Google Scholar
koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A. și colab. (2011). Expresia nouă a Claudinei-5 în podocitele glomerulare. Țesutul Celular Rez. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed rezumat / CrossRef Text Complet / Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A. și colab. (2006). Mutațiile genei de joncțiune strânsă claudin 19 (CLDN19) sunt asociate cu risipa renală de magneziu, insuficiență renală și implicare oculară severă. Am. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed rezumat / CrossRef Text Complet / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M. și Amasheh, S. (2013). Capratul de sodiu ca potențator al permeației macromoleculelor prin joncțiunile strânse tricelulare ale celulelor intestinale. Biomateriale 34, 275-282. doi: 10.1016 / j. biomateriale.2012.09.051
PubMed rezumat / CrossRef text integral / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y. și Bichet, D. G. (2007). Elaborarea unei noi tehnici de purificare a membranelor plasmatice din ovocitele Xenopus laevis. Am. J. Physiol. Celula. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y. și Artursson, P. (1998). Creșterea absorbției prin reglarea intracelulară a permeabilității joncțiunii strânse de către acizii grași cu lanț mediu din celulele Caco-2. J. Pharmacol. Exp. Acolo. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J. și Brayden, D. J. (2009). Siguranța și eficacitatea capratului de sodiu în promovarea absorbției orale a medicamentelor: de la in vitro la clinică. Adv. Livrare De Droguri. 61, 1427-1449. doi: 10.1016 / j.ADR.2009.09.006
rezumat PubMed / CrossRef Text Complet / Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D. și colab. (2010). Claudin-3 acționează ca o componentă de etanșare a joncțiunii strânse pentru ionii fie de încărcare, fie de substanțe dizolvate neîncărcate. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j. bbamem.2010.07.014
PubMed rezumat / CrossRef text integral / Google Scholar
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K. și colab. (2011). Extinderea prezisă a familiei multigene claudin. FEBS Lett. 585, 606–612. doi: 10.1016/j.febslet.2011.01.028
PubMed rezumat / CrossRef text integral / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S. și colab. (2019). Xenbase: facilitarea utilizării Xenopus pentru a modela boala umană. În față. Physiol. 10:154. doi: 10.3389 / fphys.2019.00154
rezumat PubMed / CrossRef Text Complet / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N. și colab. (2003). Slăbirea selectivă a dimensiunii barierei hematoencefalice la șoarecii cu deficit de claudin-5. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed rezumat / CrossRef Text Complet / Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T. și Terasaki, T. (2007). Expresia exogenă a Claudinei-5 induce proprietăți de barieră în celulele endoteliale capilare ale creierului de șobolan cultivat. J. Cell Physiol. 210, 81–86. doi: 10.1002 / jcp.20823
Rezumat PubMed / CrossRef Text Complet / Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M. și colab. (2011). Elucidarea principiilor organizării moleculare a firelor de joncțiune strânse heteropolimerice. Cell Mol. Life Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed rezumat / CrossRef Text Complet / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C. și colab. (2008). Formarea joncțiunii strânse: determinanți ai interacțiunii homofile între claudinele clasice. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed rezumat / CrossRef Text Complet / Google Scholar
Radloff, J., Cornelius, V., Markov, A. G. și Amasheh, S. (2019). Caprate modulează funcția de barieră intestinală în epiteliul asociat foliculului patch-ului porcin Peyer. Int. J. Mol. Sci. 20:1418. doi: 10.3390 / ijms20061418
PubMed rezumat / CrossRef text integral / Google Scholar
Reinhold, A. K. și Rittner, H. L. (2017). Funcția de barieră în sistemul nervos periferic și central-o revizuire. Pflug. Arch. Eur. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Plierea și asamblarea proteinelor Claudin-3 și Claudin-5 în joncțiunea strânsă sunt controlate de reziduuri neconservate în segmentele transmembranare 3 (TM3) și buclă extracelulară 2 (ECL2). J. Biol. Chem. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed rezumat / CrossRef Text Complet / Google Scholar
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S. și colab. (2016). Evoluția genomului în broasca allotetraploidă Xenopus laevis. Natură 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins în bolile pulmonare. Resp. Res. 12: 70.
Google Scholar
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R. și colab. (2014). Structura cristalină a unui claudin oferă o perspectivă asupra arhitecturii joncțiunilor strânse. Știință 344, 304-307. doi: 10.1126 / știință.1248571
rezumat PubMed / CrossRef Text Complet / Google Scholar
Tammaro, P., Shimomura, K. și Proks, P. (2009). „Ovocitele Xenopus ca sistem de Expresie heterologă pentru studierea canalelor ionice cu tehnica patch-clamp”, în canalele de potasiu: metode și protocoale, ed. J. D. Lippiat( Totowa, NJ: Humana Press), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C. și colab. (2002). Proteine de joncțiune strânse: o nouă clasă de proteine membranare integrale – expresie în epiderma umană și în keratinocitele HaCaT. Arch Dermatol. Rezoluția 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed rezumat / CrossRef Text Complet / Google Scholar
Tomita, M., Hayashi, M. și Awazu ,S. (1995). Mecanismul de creștere a absorbției capratului de sodiu și a decanoilcarnitinei în celulele Caco-2. J. Pharmacol. Exp. Acolo. 272, 739–743.
Google Scholar
Turner, J. R. (2000). ‘Punerea stoarcerii’ pe joncțiunea strânsă: înțelegerea reglării citoscheletice. Semin. Cell Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
rezumat PubMed / CrossRef Text Complet / Google Scholar
Van Itallie, C. M. și Anderson, J. M. (2006). Claudins și transportul paracelular epitelial. Anu. Părinte Physiol. 68, 403–429. doi: 10.1146/annurev.physiol.68.040104.131404
PubMed rezumat / CrossRef text integral / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W. și colab. (2009). Forțele cuantificatoare mediate de proteine de joncțiune strânse integrale în adeziunea celulă-celulă. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutațiile genei care codifică joncțiunea strânsă claudin-14 provoacă surditate autosomală recesivă DFNB29. Celula 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
CrossRef Text Complet / Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S. și colab. (2003). Localizarea claudin-3 în joncțiunile strânse ale barierei hematoencefalice este pierdută selectiv în timpul encefalomielitei autoimune experimentale și a glioblastomului uman multiform. Acta Neuropatol. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
PubMed rezumat / CrossRef Text Complet / Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J. și Heasman, J. (1985). Citoscheletul ovocitelor Xenopus și rolul său în dezvoltare. J. Embryol. Exp. Morph. 89, 1–15.
Google Scholar