- Introducere
- funcțiile multiple ale Chimazei
- Chimazei în celulele mastocite
- funcții enzimatice Multiple ale Chimazei
- funcția enzimatică a Chimazei în NASH
- implicarea Chimazei în modelele animale NASH
- efectul inhibitorului Chimazei la modelele animale NASH
- efectul inhibitorului Chimazei la modelele animale NASH
- mecanismul inflamației hepatice atenuat de inhibitorul Chimazei
- mecanismul steatozei hepatice atenuat de inhibitorul Chimazei
- mecanismul fibrozei hepatice atenuat de inhibitorul Chimazei
- concluzie
- contribuții autor
- Declarație privind conflictul de interese
Introducere
boala hepatică grasă nealcoolică (NAFLD) a fost recunoscută ca cea mai comună formă de boală hepatică (Angulo, 2002; Clark și colab., 2002). Steatohepatita nealcoolică (NASH) imită hepatita alcoolică, în ciuda absenței unui istoric de băut (Ludwig și colab., 1980). NAFLD și NASH sunt asociate cu sindromul metabolic rezultat din obezitate, rezistență la insulină, hiperlipidemie și hipertensiune arterială. NAFLD este considerată a fi cea mai frecventă boală hepatică și se prezintă de obicei ca steatoză hepatică simplă (Tiniakos și colab., 2010). În schimb, NASH se caracterizează prin steatoză severă, inflamație lobulară și fibroză a ficatului (Powell și colab., 1990; Bertot și Adams, 2016). Deși mecanismul responsabil pentru dezvoltarea NASH rămâne neclar, se propune ca NASH să fie cauzat de un proces de lovitură multiplă, cu steatoza hepatică ca primă lovitură și hit-uri ulterioare, cum ar fi inflamația, stresul oxidativ și endotoxinele (Tilg și Moschen, 2010). NASH este strâns legat de sindromul metabolic, iar mai multe studii clinice au investigat tratamentul terapeutic al NASH concentrându-se pe simptomele diabetului, hiperlipidemiei și hipertensiunii (Georgescu și colab., 2009; Park și colab., 2010; Mahady și colab., 2011). Cu toate acestea, nu s-au stabilit agenți terapeutici acceptați în mod obișnuit.
Chimaza poate fi implicată în patogeneza fibrozei hepatice. Activitatea chimazei a fost semnificativ crescută în ficatul pacienților cu fibroză sau ciroză și a existat o corelație semnificativă între nivelul chimazei și gradul de fibroză (Komeda și colab., 2008). Deși nu a fost raportată o activitate crescută a chimazei la pacienții cu NASH, aceasta a fost observată la modelele animale de NASH (Tashiro și colab., 2010; Masubuchi și colab., 2013; Miyaoka și colab., 2017). În schimb, inhibarea chimazei folosind inhibitori cu molecule scăzute a dus la o reducere semnificativă a inflamației, steatozei și fibrozei la modelele Nash de șobolan și hamster (Tashiro și colab., 2010; Masubuchi și colab., 2013; Miyaoka și colab., 2017). Aceste constatări indică faptul că chimaza poate fi implicată în inflamație, steatoză și fibroză în timpul dezvoltării și progresiei NASH (Figura 1).
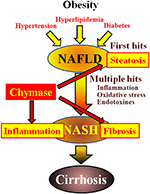
FIGURA 1. NAFLD și NASH sunt legate de sindromul metabolic prin obezitate, rezistență la insulină, hiperlipidemie și hipertensiune arterială. Se crede că NASH se dezvoltă printr-un proces de „lovire multiplă”, cu steatoza hepatică ca „prima lovitură” și loviturile ulterioare, cum ar fi inflamația, stresul oxidativ și endotoxinele și se caracterizează prin steatoză severă, inflamație și fibroză. Chimaza poate fi implicată în progresia steatozei, inflamației și fibrozei în ficat.
funcțiile multiple ale Chimazei
Chimazei în celulele mastocite
Chimazei (EC 3.4.21.39) este exprimată în granulele secretoare ale mastocitelor. Chimaza este produsă ca o prochimază inactivă în granulele secretoare și necesită dipeptidil peptidază I (DPPI) pentru activare. DPPI este o proteinază tiol și pH-ul său optim este de 6,0. Valoarea optimă a pH-ului este în concordanță cu funcția propusă de DPPI pentru a activa prochimaza, deoarece pH-ul din granulele secretoare este reglat la pH 5,5 (De Young și colab., 1987) (Figura 2). Cu toate acestea, chimaza nu are activitate enzimatică în celulele mastocite la acest pH, deoarece pH-ul optim pentru chimază este între 7 și 9 (Takai și colab., 1996, 1997). În urma activării granulelor mastocitare de către stimuli precum inflamația și leziunea, chimaza este eliberată și prezintă funcție enzimatică la pH-ul OPTIM 7,4 (Figura 2).
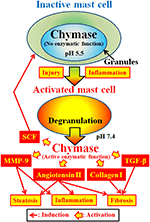
FIGURA 2. Chimaza este stocată în granulele secretoare ale mastocitelor inactive. PH-ul din granule este menținut la pH 5,5, o afecțiune în care chimaza nu are activitate enzimatică. Chimaza prezintă funcțiile sale enzimatice, cum ar fi formarea de angiotensină II, MMP-9, TGF-XV, colagen I și SCF, la eliberarea din granulele mastocitare, în urma activării prin inflamație și leziuni.
funcții enzimatice Multiple ale Chimazei
Chimaza este o serină protează și scindează partea C-terminală a proteinelor după aminoacizii aromatici precum Phe, Tyr și Trp în general. Chimaza poate scinda legătura Phe8-His9 a peptidei non-bioactive angiotensina I și poate forma peptida bioactivă angiotensina II în țesuturile mamiferelor, inclusiv umane (Urata și colab., 1990; Takai și colab., 1996, 1997). În plus, chimaza scindează enzimatic precursorii metaloproteinazei matriciale (MMP)-9, transformând factorul de creștere (TGF)-inkt și colagenul I în formele lor active (Kofford și colab., 1997; Takai și colab., 2003; Furubayashi și colab., 2008). Mai mult, funcția enzimatică a chimazei poate produce factor de celule stem (SCF) prin scindarea enzimatică a formei inactive legate de membrană a SCF, care induce formarea mastocitelor mature din mastocitele imature prin stimularea receptorului C-kit (Longley și colab., 1997). Astfel, chimaza are mai multe funcții enzimatice, inclusiv activarea angiotensinei II, MMP-9, TGF-XV, colagenului I și SCF (Figura 2).
funcția enzimatică a Chimazei în NASH
angiotensina II poate favoriza steatoza hepatică și inflamația prin creșterea speciilor reactive de oxigen (ROS) după stimularea receptorilor angiotensinei II la modelele NASH animale (Hirose și colab., 2007; Nabeshima și colab., 2009). Angiotensina II a indus, de asemenea, fibroza hepatică prin inducerea actinei musculare netede (SMA) în celulele stelate hepatice (HSCs) (Yoshiji și colab., 2001). S-a raportat că MMP-9 induce infiltrarea neutrofilelor și macrofagelor prin degradarea matricelor intercelulare, cum ar fi vitronectina și fibronectina, ducând la mărirea inflamației (Medina și colab., 2006). La pacienții NASH, o creștere semnificativă a expresiei genei MMP-9 a fost observată în ficat comparativ cu controalele normale (Ljumovic și colab., 2004). Supraexprimarea hepatică a TGF-XV la șoarecii transgenici a produs fibroză hepatică severă prin mărirea expresiei genei procollagen I (Casini și colab., 1993). Se știe că atât formarea TGF-XV, cât și acumularea de colagen I induc fibroza hepatică. Activarea SCF induce creșteri ale numărului de mastocite, iar funcția sa enzimatică poate duce la o creștere a activității chimazei în țesuturile fibrotice (Maruichi și colab., 2004). Aceste funcții enzimatice ale chimazei pot fi implicate în steatoză, inflamație și fibroză, toate acestea fiind observate la ficatul pacienților NASH și la modelele animale (Figura 2).
implicarea Chimazei în modelele animale NASH
dieta cu deficit de metionină și colină (MCD) a fost utilizată pe scară largă pentru a induce un model tipic NASH. La hamsterii hrăniți cu dieta MCD, s-au observat creșteri semnificative ale bilirubinei totale, trigliceridelor și acidului hialuronic în plasmă (Tashiro și colab., 2010). Mai mult, acumularea de celule inflamatorii și creșterea zonei de depunere a lipidelor și a zonei fibrotice au fost observate în ficat. În acest model NASH indus de dieta MCD, activitatea chimazei hepatice și factorii înrudiți, cum ar fi angiotensina II, MMP-9 și colagenul I, au fost semnificativ crescute (Tashiro și colab., 2010; Masubuchi și colab., 2013). Recent, a fost dezvoltat un nou model NASH în care șobolanii hipertensivi 5/Dmcr (SHRSP5/Dmcr) predispuși la accident vascular cerebral au fost hrăniți cu o dietă bogată în grăsimi și colesterol (hfc) (Kitamori și colab., 2012). Acest model a prezentat simptome ale sindromului metabolic despre care se crede că seamănă clinic cu cele ale pacienților NASH (Kitamori și colab., 2012). În modelul NASH indus de dieta HFC, s-au observat hipertensiune arterială și hiperlipidemie, iar steatoza severă, fibroza și acumularea de celule inflamatorii au fost detectate în ficat (Miyaoka și colab., 2017). Mai mult, s-a observat o creștere semnificativă a activității chimazei împreună cu MMP-9, TGF-XV și colagenul I în ficat (Miyaoka și colab., 2017). Astfel, se pare că există o relație strânsă între chimaza și patogeneza NASH în modelele animale ale NASH.
efectul inhibitorului Chimazei la modelele animale NASH
efectul inhibitorului Chimazei la modelele animale NASH
un inhibitor chimazei cu molecule scăzute a atenuat semnificativ activitatea chimazei și a scăzut nivelul angiotensinei II, MMP-9 și colagenului I în ficat într-un model de hamster NASH alimentat cu dietă MCD, când administrarea inhibitorului a fost inițiată în același timp cu dieta MCD (Tashiro și colab., 2010; Masubuchi și colab., 2013). Inhibitorul chimazei a prevenit în mod semnificativ steatoza hepatică, fibroza și acumularea de celule inflamatorii în acest model NASH (Tashiro și colab., 2010; Masubuchi și colab., 2013). Se crede că stresul oxidativ joacă un rol în teoria dezvoltării NASH, iar augmentarea markerului de stres oxidativ malondialdehida a fost atenuată semnificativ în ficat de inhibitorul chimazei (Masubuchi și colab., 2013). Într-un model NASH indus de dieta mcd de hamster, inhibitorul chimazei a arătat un efect ameliorativ atunci când a fost administrat în Nash stabilit (Masubuchi și colab., 2013). Gradele de steatoză și fibroză în ficat au fost reduse comparativ cu înainte de administrarea inhibitorului chimazei (Masubuchi și colab., 2013).
în ficatul unui model NASH indus de dieta hfc de șobolan hipertensiv, un inhibitor de chimază cu moleculă scăzută a atenuat nivelurile de chimază, precum și MMP-9, TGF-XV și colagen I, care sunt toți factori asociați chimazei (Miyaoka și colab., 2017). Inhibitorul chimazei a atenuat semnificativ steatoza hepatică și fibroza și a redus mieloperoxidaza ca marker al inflamației, în special al infiltrării neutrofilelor (Miyaoka și colab., 2017). În acest model indus de dieta HFC, supraviețuirea grupului tratat cu placebo a fost de 0% la 14 săptămâni după începerea dietei HFC și a rezultat din insuficiență hepatică severă (Miyaoka și colab., 2017). Cu toate acestea, grupul tratat cu inhibitor de chimază, în care șobolanii au fost tratați cu inhibitor de chimază imediat după începerea dietei HFC, a arătat o supraviețuire de 100% la 14 săptămâni. Mai mult, a fost raportată o rată de supraviețuire de 50% pentru șobolanii tratați cu inhibitor de chimază începând cu 8 săptămâni după începerea hrănirii cu dietă HFC, moment în care NASH a fost stabilit (Miyaoka și colab., 2017).
prin urmare, inhibitorii chimazei ar putea fi agenți utili pentru prevenirea și îmbunătățirea NASH la modelele animale. Pe de altă parte, angiotensina II promovează, de asemenea, indirect inflamația hepatică, steatoza și fibroza prin creșterea expresiei genei MMP-9 și TGF-liftf. Atât MMP-9, cât și TGF-XV sunt implicați îndeaproape în patogeneza NASH, dar acești factori nu sunt neapărat induși doar de angiotensina II (Takai și colab., 2010). Alți factori în afară de stimularea angiotensinei II contribuie la creșterea expresiei genei MMP-9 și TGF-XV (Takai și colab., 2010). În astfel de cazuri, blocantul receptorilor de angiotensină II (ARB) nu este capabil să atenueze acțiunile MMP-9 și TGF-XV; cu toate acestea, un inhibitor al chimazei ar putea avea efecte atenuante prin inhibarea activării MMP-9 și TGF-XV, indicând un potențial curs de tratament pentru prevenirea progresiei NASH.
mecanismul inflamației hepatice atenuat de inhibitorul Chimazei
inhibitorul Chimazei a fost capabil să reducă inflamația în modelele NASH induse de dieta MCD de hamster și de dieta HFC de șobolan (Tashiro și colab., 2010; Masubuchi și colab., 2013; Miyaoka și colab., 2017). Tratamentul cu inhibitor al chimazei a atenuat semnificativ activitatea chimazei în ficat, precum și nivelurile reduse de angiotensină II și MMP-9 (Tashiro și colab., 2010; Masubuchi și colab., 2013; Miyaoka și colab., 2017). În HSC, angiotensina II induce generarea de ROS, cum ar fi peroxidul de hidrogen și superoxidul prin activarea nicotinamidei adenină dinucleotid fosfat (NADPH) oxidază (de Minicis și Brenner, 2007). Inhibitorul chimazei a dus la reducerea expresiei genice a componentei NADPH oxidază Rac-1 și a markerului de stres oxidativ malondialdehidă în plus față de o reducere a nivelurilor de angiotensină II într-un model NASH indus de hamster MCD (Masubuchi și colab., 2013). Creșterea ROS indusă de angiotensină II a promovat expresia genei MMP-9 în neutrofile și macrofage (Yaghooti și colab., 2011; Kurihara și colab., 2012). Prin urmare, inhibitorul chimazei inhibă direct activarea proMMP-9 la MMP-9 și reduce indirect expresia genei MMP-9 prin scăderea angiotensinei II. MMP-9 scindează constituenții matricei extracelulare, cum ar fi vitronectina și fibronectina, conduce la dezintegrarea integrității hepatice și induce infiltrarea macrofagelor și neutrofilelor (Medina și colab., 2006). Într-un model NASH indus de dieta HFC, o creștere semnificativă a expresiei mieloperoxidazei în macrofage și neutrofile a fost observată în ficat și a fost redusă de inhibitorul chimazei (Miyaoka și colab., 2017). Prin urmare, mecanismul inflamației atenuat de inhibitorul chimazei poate fi dependent de reducerea nivelurilor de angiotensină II și MMP-9 din ficat.
mecanismul steatozei hepatice atenuat de inhibitorul Chimazei
angiotensina II poate influența steatoza hepatică prin producerea de ROS. În HSC murin, un inhibitor al NADPH oxidazei a scăzut semnificativ producția de ROS și un ARB a încetinit dezvoltarea steatozei hepatice prin atenuarea producției de ROS (Hirose și colab., 2007; Guimar Oktifes și colab., 2010). Într-un model de șoarece NASH indus de dieta MCD, a fost observată o atenuare semnificativă a steatozei la șoarecii cu deficit de receptor al angiotensinei II (Nabeshima și colab., 2009). Atât experimentele in vivo, cât și cele in vitro au arătat că angiotensina II a reglat în sus proteina care leagă elementul de reglementare a sterolului (srebp)-1C și sintaza acidului gras (FAS) expresia genei, ambele fiind factori importanți în reglarea lipogenezei, în urma augmentării ROS (Kim și colab., 2001; Hongo și colab., 2009). În schimb, ARB a atenuat steatoza hepatică împreună cu reglarea în jos a expresiei genice a SREBP-1C și FAS prin atenuarea ROS într-un model NASH de șoarece (Kato și colab., 2012). Într-un model NASH indus de dieta mcd de hamster, s-a observat o atenuare semnificativă a expresiei genei srebp-1C și FAS în urma tratamentului cu un inhibitor de chimază cu moleculă mică (Masubuchi și colab., 2013). Prin urmare, mecanismul de ameliorare a steatozei hepatice de către inhibitorul chimazei poate fi dependent de reducerea producției de ROS prin reducerea generării de angiotensină II în ficat.
mecanismul fibrozei hepatice atenuat de inhibitorul Chimazei
Chimaza poate fi strâns asociată cu progresia fibrozei tisulare, deoarece contribuie la formarea TGF-uri din precursorul non-bioactiv TGF-uri, iar TGF-uri este cunoscut pentru inducerea puternică a creșterii fibroblastelor (Takai și colab., 2003; Oyamada și colab., 2011). Este cunoscut faptul că TGF-XV joacă un rol central în progresia fibrozei la pacienții cu NASH prin HSC activat (Williams și colab., 2000). Inhibarea funcției TGF-VIII prin expresia și semnalizarea genelor a dus la îmbunătățirea fibrozei hepatice în modelele experimentale (George și colab., 1999; Arias și colab., 2003). Într-un model NASH indus de dieta HFC de șobolan, atenuarea activității chimazei de către inhibitorul chimazei a dus la reduceri ale nivelului TGF-VIII și a zonei fibrotice din ficat (Miyaoka și colab., 2017). Astfel, reducerea TGF-XV de către inhibitorul chimazei poate contribui la prevenirea fibrozei hepatice.
angiotensina II poate fi, de asemenea, implicată în inducerea fibrozei hepatice. Angiotensina II induce contracția și proliferarea HSC și, de asemenea, induce expresia genică a TGF-XV în fibroblaste in vitro (Kagami și colab., 1994; Bataller și colab., 2000). Atât nivelurile de TGF-XV, cât și gradul de acumulare a colagenului și leziunile fibrotice au fost observate prin ligarea ductului biliar la șoarecii de tip sălbatic, cu toate acestea, acestea au fost atenuate la șoarecii cu deficit de receptor al angiotensinei II (Yang și colab., 2005). Într-un model NASH de șobolan, ARB a atenuat, de asemenea, fibroza hepatică prin reducerea expresiei genei TGF-XV (Hirose și colab., 2007). De asemenea, poate exista o relație între angiotensina II și fibroza hepatică, alta decât expresia genei induse de angiotensina II a genei TGF-inkt. La pacienții cu hepatită cronică C, ARB a redus expresia genei de colagen prin expresia genei Rac-1 (Colmenero și colab., 2009). HSC sunt recunoscute ca fiind principalele celule producătoare de colagen din ficat, iar augmentarea în expresia actinei musculare netede (SMA) din HSC induce puternic depunerea matricei extracelulare, inclusiv colagenul I (de Minicis și Brenner, 2007). Angiotensina II poate induce expresia genei in-SMA la șobolanii HSC. În schimb, blocada angiotensinei II are ca rezultat atenuarea fibrozei hepatice împreună cu reducerea numărului de SMA (yoshiji și colab., 2001). Deși nu au fost evaluate la pacienții cu NASH, atât activitățile de formare a chimazei, cât și a angiotensinei II au fost semnificativ crescute în regiunile fibrotice ale ficatului de la pacienții cu ciroză și s-au observat corelații semnificative între activitatea de formare a chimazei, angiotensinei II și fibroza hepatică (Komeda și colab., 2008). Într-un model de ciroză hepatică indusă de tetraclorură de hamster, s-au observat creșteri semnificative ale activității de formare a chimazei și angiotensinei II, care au fost semnificativ atenuate împreună cu ciroza hepatică în urma tratamentului cu un inhibitor de chimază cu moleculă mică (Komeda și colab., 2010).
stabilizatorul mastocitar tranilast ar putea inhiba activarea mastocitelor, blocând eliberarea chimazei și prevenind astfel dezvoltarea fibrozei hepatice într-un diabet de șobolan și modelul NASH indus de dieta HFC (Uno și colab., 2008). Chimaza promovează proliferarea celulelor mastocite prin activarea SCF prin funcția sa enzimatică (Longley și colab., 1997). La modelele animale NASH, inhibitorul chimazei a redus creșterea numărului de mastocite în ficat, rezultând o activitate chimazei redusă în urma inhibării directe de către inhibitorul chimazei și o reducere indirectă a expresiei chimazei în mastocite (Masubuchi și colab., 2013; Miyaoka și colab., 2017).
prin urmare, inhibitorul chimazei poate contribui la prevenirea fibrozei hepatice prin inhibarea activării TGF-FIV prin inhibarea chimazei și/sau atenuarea nivelului TGF-FIV prin reducerea angiotensinei II și a proliferării celulelor mastocite.
concluzie
sindromul Metabolic care cuprinde obezitatea, rezistența la insulină, hiperlipidemia și hipertensiunea arterială este strâns legat de dezvoltarea NASH și au fost efectuate studii cu agenți antidiabetici, anti-hiperlipidemici și antihipertensivi pentru tratamentul NASH. Conceptul din spatele acestor agenți este de a atenua simptomele sindromului metabolic (Georgescu și colab., 2009; Park și colab., 2010; Mahady și colab., 2011). Rapoartele anterioare au demonstrat că inhibitorul chimazei atenuează inflamația și fibroza fără a influența nivelurile de glucoză și lipide din sânge și tensiunea arterială la modelele animale de diabet, hiperlipidemie și, respectiv, hipertensiune (Inoue și colab., 2009; Takai și colab., 2014; Zhang și colab., 2016). Prin urmare, conceptul din spatele inhibării chimazei este de a atenua direct inflamația hepatică și fibroza NASH. Propunem ca inhibitorul chimazei care vizează sindromul metabolic este o strategie potențial puternică pentru atenuarea progresiei NASH.
contribuții autor
ST și DJ: a scris manuscrisul. Ambii autori au citit și aprobat manuscrisul final.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.