Holger J Sch Inktivnemann, Julian PT Higgins, Gunn e Vist, Paul Glasziou, Elie a Akl, Nicole Skoetz, Gordon h Guyatt; în numele Cochrane GRADEing Methods Group (fostă aplicabilitate și recomandări Methods Group) și Cochrane Statistical Methods Group
- puncte cheie:
- 14.1 ‘Rezumatul constatărilor’ tabelele
- 14.1.1 Introducere în ‘Rezumatul constatărilor’ tabelele
- 14.1.2 selectarea rezultatelor pentru tabelele ‘rezumat al constatărilor’
- 14.1.3 model General pentru tabelele’ rezumat al constatărilor ‘
- 14.1.4 elaborarea tabelelor’ rezumat al constatărilor ‘
- 14.1.5 considerații statistice în tabelele rezumat al constatărilor
- 14.1.5.1 rezultate dihotomice
- 14.1.5.2 rezultatele timpului până la eveniment
- 14.1.6 conținutul detaliat al unui ‘rezumat al constatărilor’ tabelul
- 14.1.6.1 titlul și antetul tabelului
- 14.1.6.2 rezultate
- 14.1.6.3 cea mai bună estimare a riscului cu intervenția comparatorului
- 14.1.6.4 risc cu intervenție
- 14.1.6.5 diferența de risc
- 14.1.6.6 efect relativ (IÎ 95%)
- 14.1.6.7 Numărul de participanți (studii)
- 14.1.6.8 certitudinea dovezilor (grad)
- 14.1.6.9 Comentarii
- 14.1.6.10 explicații
- 14.2 evaluarea certitudinii sau a calității unui corp de probe
- 14.2.1 abordarea gradelor
puncte cheie:
- un tabel de sinteză a constatărilor pentru o comparație dată a intervențiilor oferă informații esențiale privind magnitudinea efectelor relative și absolute ale intervențiilor examinate, cantitatea de dovezi disponibile și certitudinea (sau calitatea) probelor disponibile.
- ‘Rezumatul constatărilor’ tabelele includ un rând pentru fiecare rezultat important (până la maximum șapte). Formatele acceptate ale tabelelor ‘ rezumat al constatărilor ‘și tabelele interactive’ rezumat al constatărilor ‘ pot fi produse folosind software-ul GRADEPRO GDT.
- Cochrane a adoptat abordarea gradelor (evaluarea, dezvoltarea și evaluarea recomandărilor) pentru evaluarea certitudinii (sau calității) unui corp de dovezi.
- abordarea grad specifică patru niveluri de certitudine pentru un corp de dovezi pentru un anumit rezultat: ridicat, moderat, scăzut și foarte scăzut.
- evaluările gradului de certitudine sunt determinate prin luarea în considerare a cinci domenii: risc de părtinire, inconsecvență, indirectitate, imprecizie și părtinire de publicare. Pentru dovezi din studii non-randomizate și studii rar randomizate, evaluările pot fi apoi actualizate prin luarea în considerare a altor trei domenii.
citați acest capitol ca: Sch Hj, Higgins JPT, Vist GE, Glasziou P, Akl EA, Skoetz N, Guyatt GH. Capitolul 14: completarea tabelelor de sinteză a constatărilor și clasificarea certitudinii probelor. În: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, pagina MJ, Welch VA (editori). Manual Cochrane pentru Revizuiri Sistematice ale intervențiilor versiunea 6.2 (actualizat în februarie 2021). Cochrane, 2021. Disponibil de la www.antrenament.cochrane.org/handbook.
14.1 ‘Rezumatul constatărilor’ tabelele
14.1.1 Introducere în ‘Rezumatul constatărilor’ tabelele
‘Rezumatul constatărilor’ tabelele prezintă principalele constatări ale unei revizuiri într-un format tabelar transparent, structurat și simplu. În special, acestea furnizează informații esențiale privind certitudinea sau calitatea probelor (și anume încrederea sau certitudinea în intervalul unei estimări a efectului sau al unei asocieri), amploarea efectului intervențiilor examinate și suma datelor disponibile privind principalele rezultate. Evaluările Cochrane ar trebui să includă tabele de sinteză a constatărilor în timpul planificării și publicării și ar trebui să conțină cel puțin un tabel-cheie de sinteză a constatărilor, reprezentând cele mai importante comparații. Unele revizuiri pot include mai mult de un tabel rezumat al constatărilor, de exemplu dacă revizuirea abordează mai multe comparații majore sau include populații substanțial diferite care necesită tabele separate (de exemplu, deoarece efectele diferă sau este important să se arate rezultatele separat). În baza de date Cochrane a revizuirilor sistematice (Cdsr), tabelul principal al rezumatului constatărilor unei revizuiri apare la început, înainte de secțiunea de fundal. Alte tabele de rezumat al constatărilor apar între secțiunile rezultate și discuții.
14.1.2 selectarea rezultatelor pentru tabelele ‘rezumat al constatărilor’
planificarea tabelului ‘rezumat al constatărilor’ începe la începutul revizuirii sistematice, selecția rezultatelor urmând să fie inclusă în: (i) revizuirea; și (ii) tabelul ‘rezumat al constatărilor’. Acesta este un pas crucial și unul pe care autorii revizuirii trebuie să îl abordeze cu atenție.
pentru a asigura producerea de informații utile în mod optim, evaluările Cochrane încep prin dezvoltarea unei întrebări de revizuire și prin listarea tuturor rezultatelor principale care sunt importante pentru pacienți și alți factori de decizie (vezi capitolul 2 și Capitolul 3). Abordarea grad pentru evaluarea certitudinii dovezilor (a se vedea secțiunea 14.2) definește și operaționalizează un proces de evaluare care ajută la separarea rezultatelor în cele care sunt critice, importante sau nu importante pentru luarea deciziilor. Consultarea și feedback-ul cu privire la Protocolul de revizuire, inclusiv din partea consumatorilor și a altor factori de decizie, pot îmbunătăți acest proces.
este posibil ca rezultatele critice să includă obiective finale clar importante; exemplele tipice includ mortalitatea și morbiditatea majoră (cum ar fi accidentele vasculare cerebrale și infarctul miocardic). Cu toate acestea, ele pot reprezenta, de asemenea, frecvente efecte secundare minore și rare majore, simptome, calitatea vieții, sarcini asociate tratamentului și probleme de resurse (Costuri). Sarcinile reprezintă impactul volumului de muncă din domeniul asistenței medicale asupra funcției și bunăstării pacientului și includ cerințele de aderare la o intervenție pe care pacienții sau îngrijitorii (de exemplu, familia) le pot displace, cum ar fi necesitatea de a fi supuși unor teste mai frecvente sau restricțiile privind stilul de viață pe care anumite intervenții le necesită (Spencer-Bonilla et al 2017).
frecvent, atunci când formulează întrebări care includ toate rezultatele importante pentru pacient pentru luarea deciziilor, autorii revizuirii se vor confrunta cu rapoarte ale studiilor care nu au inclus toate aceste rezultate. Acest lucru este valabil mai ales pentru rezultatele negative. De exemplu, studiile randomizate ar putea contribui la dovezi privind efectele intenționate și efectele secundare frecvente, relativ minore, dar nu raportează rezultate adverse rare, cum ar fi încercările de sinucidere. Capitolul 19 discută strategiile de abordare a efectelor adverse. Pentru a obține date pentru toate rezultatele importante, poate fi necesar să se examineze rezultatele studiilor non-randomizate (vezi capitolul 24). Cochrane, în colaborare cu alții, a dezvoltat îndrumări pentru autorii de recenzii pentru a-și susține decizia cu privire la momentul în care trebuie să caute și să includă studii non-randomizate (Sch 2013).
dacă o revizuire include numai studii randomizate, este posibil ca aceste studii să nu abordeze toate rezultatele importante și, prin urmare, este posibil să nu fie posibilă abordarea acestor rezultate în limitele revizuirii. Autorii revizuirii ar trebui să recunoască aceste limitări și să le facă transparente pentru cititori. Autorii revizuirii sunt încurajați să includă studii non-randomizate pentru a examina efectele adverse rare sau pe termen lung care nu pot fi studiate în mod adecvat în studiile randomizate. Acest lucru ridică posibilitatea ca rezultatele prejudiciului să provină din studii în care participanții diferă de cele din studiile utilizate în analiza beneficiilor. Autorii revizuirii vor trebui apoi să ia în considerare cât de multe astfel de diferențe pot avea impact asupra constatărilor, iar acest lucru va influența certitudinea dovezilor din cauza preocupărilor legate de indirectitate legate de populație (a se vedea secțiunea 14.2.2).
studiile non-randomizate pot furniza informații importante nu numai atunci când studiile randomizate nu raportează un rezultat sau studiile randomizate suferă de indirectitate, dar și atunci când dovezile din studiile randomizate sunt evaluate ca fiind foarte scăzute, iar studiile non-randomizate oferă dovezi de certitudine mai mare. Discutarea ulterioară a acestor aspecte apare și în capitolul 24.
14.1.3 model General pentru tabelele’ rezumat al constatărilor ‘
au fost elaborate mai multe versiuni standard alternative ale tabelelor’ rezumat al constatărilor ‘ pentru a asigura coerența și ușurința utilizării în cadrul revizuirilor, includerea celor mai importante informații necesare factorilor de decizie și prezentarea optimă (a se vedea exemplele din figurile 14.1.a și 14.1.b). Aceste formate sunt susținute de cercetări care s-au concentrat pe o mai bună înțelegere a informațiilor pe care intenționează să le transmită (Carrasco-Labra et al 2016, Langendam et al 2016, Santesso et al 2016). Acestea sunt disponibile prin pachetul software oficial GRADE dezvoltat pentru a sprijini abordarea grad: GRADEpro GDT (www.gradepro.org).
tabelele standard Cochrane ‘sumarul constatărilor’ includ următoarele elemente care utilizează unul dintre formatele acceptate. Orientări suplimentare privind fiecare dintre acestea sunt furnizate în secțiunea 14.1.6.
- o scurtă descriere a populației și a situației abordate de dovezile disponibile (care pot fi ușor diferite sau mai restrânse decât cele definite de întrebarea de revizuire).
- o scurtă descriere a comparației abordate în tabelul rezumat al constatărilor, incluzând atât intervențiile experimentale, cât și cele de comparație.
- o listă cu cele mai critice și/sau importante rezultate în materie de sănătate, atât de dorit, cât și de nedorit, limitată la șapte sau mai puține rezultate.
- o măsură a sarcinii tipice a fiecărui rezultat (de exemplu, riscul ilustrativ sau media ilustrativă a intervenției comparatorului).
- magnitudinea absolută și relativă a efectului măsurată pentru fiecare (dacă ambele sunt adecvate).
- numărul de participanți și studii care contribuie la analiza fiecărui rezultat.
- o evaluare de grad a certitudinii globale a corpului de dovezi pentru fiecare rezultat (care poate varia în funcție de rezultat).
- spațiu pentru comentarii.
- explicații (cunoscute anterior ca note de subsol).
în mod ideal, tabelele rezumate ale constatărilor sunt susținute de tabele mai detaliate (cunoscute sub numele de profiluri de dovezi) la care poate fi legată revizuirea, care oferă explicații mai detaliate. Profilurile de dovezi includ aceleași rezultate importante în materie de sănătate și oferă mai multe detalii decât tabelele sumare ale constatărilor, atât ale considerațiilor individuale care contribuie la clasificarea certitudinii, cât și ale rezultatelor studiilor (Guyatt et al 2011a). Acestea asigură utilizarea unei abordări structurate pentru evaluarea certitudinii dovezilor. Deși sunt rareori publicate în Cochrane Reviews, profilurile dovezilor sunt adesea utilizate, de exemplu, de către dezvoltatorii de ghiduri în luarea în considerare a certitudinii dovezilor pentru a susține recomandările orientative. Autorii revizuirii vor găsi mai ușor să dezvolte tabelul ‘rezumat al constatărilor’ completând evaluarea certitudinii dovezilor în profilul dovezilor mai întâi în GRADEpro GDT. Ei pot apoi să convertească automat acest lucru într-unul din formatele’ sumarul constatărilor ‘din GRADEpro GDT, inclusiv un’ rezumat al constatărilor ‘ interactiv pentru publicare.
ca măsură a amplorii efectului pentru rezultatele dihotomice, tabelul rezumat al constatărilor ar trebui să furnizeze o măsură relativă a efectului (de exemplu, rata riscului, rata șanselor, riscul) și măsuri ale riscului absolut. Pentru alte tipuri de date, ar putea fi suficientă o singură măsură absolută (cum ar fi o diferență de mijloace pentru datele continue). Este important ca amploarea efectului să fie prezentată într-un mod semnificativ, ceea ce poate necesita o anumită transformare a rezultatului unei meta-analize (a se vedea, de asemenea, Capitolul 15, secțiunea 15.4 și secțiunea 15.5). Evaluările cu mai multe comparații principale ar trebui să includă un tabel separat pentru fiecare comparație.
figura 14.1.a oferă un exemplu de tabel ‘rezumat al constatărilor’. Figura 15.1.b oferă un format alternativ care poate facilita și mai mult înțelegerea și interpretarea de către utilizatori a constatărilor revizuirii. Dovezile care evaluează diferite formate sugerează că tabelul rezumat al constatărilor ar trebui să includă o diferență de risc ca măsură a efectului absolut, iar autorii ar trebui să utilizeze, de preferință, un format care să includă o diferență de risc .
o descriere detaliată a conținutului unui tabel ‘rezumat al constatărilor’ apare la punctul 14.1.6.
figura 14.1.un exemplu de’ rezumat al constatărilor ‘ tabel
rezumat al constatărilor (pentru versiunea interactivă click aici)
|
Ciorapi de compresie în comparație cu ciorapi de compresie pentru persoanele care iau zboruri lungi |
||||||
|
pacienți sau populație: oricine efectuează un zbor lung (care durează mai mult de 6 ore) Setări: călătorii aeriene internaționale intervenție: Ciorapi de compresiea comparație: fără ciorapi |
||||||
|
rezultate |
riscuri comparative ilustrative* (IÎ 95%) |
efect relativ (IÎ 95%) |
numărul de participanți (studii) |
certitudinea dovezilor (grad) |
||
|
risc asumat |
riscul corespunzător |
|||||
|
fără ciorapi |
cu ciorapi |
|||||
|
tromboză venoasă profundă simptomatică (TVP) |
vezi comentariu |
vezi comentariul |
nu este estimabil |
(9 studii) |
vezi comentariul |
0 participanții au dezvoltat TVP simptomatic în aceste studii |
|
TVP fără simptome |
populație cu risc Scăzutb |
RR 0.10 (0.04 la 0.26) |
(9 studii) |
⊕⊕⊕⊕ mare |
||
|
10 pe 1000 |
1 la 1000 (0 până la 3) |
|||||
|
populație cu risc Ridicatb |
||||||
|
20 pe 1000 |
2 la 1000 (1 până la 8) |
|||||
|
tromboză venoasă superficială |
13 pe 1000 |
6 la 1000 (2 până la 15) |
RR 0.45 (0.18 până la 1.13) |
(8 studii) |
⊕⊕⊕◯ Moderatec |
|
|
edeme valori Post-zbor măsurate pe o scară de la 0, fără edeme, la 10, edeme maxime |
scorul mediu al edemului a variat între grupurile de control de la 6 până la 9 |
scorul mediu al edemelor la grupurile de intervenție a fost în medie 4, 7 mai mic (IÎ 95% -4, 9 până la -4.5) |
(6 studii) |
⊕⊕◯◯ Lowd |
||
|
embolie pulmonară |
vezi comentariul |
vezi comentariul |
nu este estimabil |
(9 studii) |
vezi comentariul |
0 participanții au dezvoltat embolie pulmonară în aceste studiese |
|
moarte |
vezi comentariul |
vezi comentariul |
nu estimabil |
(9 studii) |
vezi comentariul |
0 participanții au murit în aceste studii |
|
efecte Adverse |
vezi comentariul |
vezi comentariul |
nu este estimabil |
(4 studii) |
vezi comentariul |
tolerabilitatea ciorapilor a fost descrisă ca fiind foarte bună, fără plângeri de efecte secundare în 4 studiif |
|
*baza pentru riscul asumat este furnizată în note de subsol. Riscul corespunzător (și intervalul său de încredere de 95%) se bazează pe riscul asumat în grupul de intervenție și pe efectul relativ al intervenției (și IÎ de 95%). IÎ: interval de încredere; RR: raport de risc; Grad: Grad grup de lucru grade de dovezi (a se vedea explicațiile). |
||||||
a toate ciorapii din cele nouă studii incluse în această revizuire au fost Ciorapi de compresie sub genunchi. În patru studii, rezistența la compresie a fost de 20 mmHg până la 30 mmHg la gleznă. A fost de 10 mmHg până la 20 mmHg în celelalte patru studii. Ciorapi vin în diferite dimensiuni. Dacă un ciorap este prea strâns în jurul genunchiului, acesta poate preveni revenirea venoasă esențială, determinând sângele să se adune în jurul genunchiului. Ciorapii de compresie trebuie montați corespunzător. Un ciorap care este prea strâns ar putea tăia în piele pe un zbor lung și ar putea provoca ulcerații și risc crescut de TVP. Unele ciorapi pot fi puțin mai groase decât acoperirea normală a picioarelor și pot fi potențial restrictive cu uzura strânsă a piciorului. Este o idee bună să purtați ciorapi în jurul casei înainte de a călători pentru a vă asigura o potrivire bună și confortabilă. Participanții își pun ciorapii cu două-trei ore înainte de zbor în majoritatea studiilor. Disponibilitatea și costul ciorapilor pot varia.
b două studii au recrutat participanți cu risc ridicat definiți ca cei cu episoade anterioare de TVP, tulburări de coagulare, obezitate severă, mobilitate limitată din cauza problemelor osoase sau articulare, boală neoplazică în ultimii doi ani, varice mari sau, într-unul dintre studii, participanți mai înalți de 190 cm și mai grei de 90 kg. Incidența pentru cele șapte studii care au exclus participanții cu risc ridicat a fost de 1.45%, iar incidența pentru cele două studii care au recrutat participanți cu risc ridicat (cu cel puțin un factor de risc) a fost de 2,43%. Am folosit 10 și 30 la 1000 pentru a exprima diferite straturi de risc, respectiv.
c intervalul de încredere nu traversează nicio diferență și nu exclude o creștere mică.
d măsurarea edemului nu a fost validată (indirectă a rezultatului) sau orbită de intervenție (risc de părtinire).
e dacă există foarte puține sau deloc evenimente și numărul de participanți este mare, judecata cu privire la certitudinea dovezilor (în special judecățile despre imprecizie) se poate baza pe efectul absolut. Aici evaluarea certitudinii poate fi considerată ‘ridicată’ dacă rezultatul a fost evaluat în mod corespunzător și evenimentul, de fapt, nu a avut loc la 2821 de participanți studiați.
f niciunul dintre celelalte studii nu a raportat efecte adverse, în afară de patru cazuri de tromboză venoasă superficială la varice în regiunea genunchiului care au fost comprimate de marginea superioară a ciorapului într-un studiu.
figura 14.1.B exemplu de tabel alternativ de sinteză a constatărilor
|
Rezumatul constatărilor (pentru versiunea interactivă click aici): |
||||||
|
probioticele comparativ cu lipsa probioticelor ca adjuvant la antibiotice la copii |
||||||
|
pacient sau populație: copii cărora li s-au administrat antibiotice Setări: pacienți internați și ambulatoriu intervenție: probiotice comparație: fără probiotice |
||||||
|
rezultate nr. participanți (studii) |
efecte Relative |
efecte absolute anticipate* (IÎ 95%) |
certitudinea dovezilor |
|||
|
fără probiotice |
cu probiotice |
diferență |
||||
|
incidența diareei: doza probiotică 5 miliarde UFC / zi urmărire: 10 zile până la 3 luni copii < 5 ani |
copii < 5 ani |
⊕⊕⊕⊝ moderateb din cauza riscului de părtinire |
probabil scade incidența diareei. |
|||
|
1474 (7 studii) |
RR 0,41 (0,29 până la 0.55) |
22.3%a |
8.9% (6.5 la 12.2) |
13.4% mai puțini copiia (10, 1 până la 15.8 mai puține) |
||
|
copii > 5 ani |
copii > 5 ani |
⊕⊕⊝⊝ lowb, c din cauza riscului de părtinire și imprecizie |
poate reduce incidența diareei. |
|||
|
624 (4 studii) |
RR 0,81 (0,53 până la 1.21) |
11.2%a |
9% (5.9 la 13.6) |
2.2% mai puțini copiia (5, 3 mai puțini la 2.4 mai mult) |
||
|
evenimente Adversedd urmărire: 10 până la 44 de zile 1575 (11 studii) |
1.8%a |
2.3% (0.8 la 3.8) |
0.5% mai multe evenimente adverse (1 Mai puțin până la 2 mai mult) |
⊕⊕⊝⊝ lowf, g din cauza riscului de părtinire și inconsecvență |
este posibil să existe o diferență mică sau deloc în ceea ce privește evenimentele adverse. |
|
|
durata diareei urmărire: 10 zile până la 3 luni 897 (5 studii) |
durata medie a diareei fără probiotice a fost de 4 zile. |
0.6 mai puține zile (1,18 până la 0,02 mai puține zile) |
⊕⊕⊝⊝ lowh, i din cauza impreciziei și inconsecvenței |
poate reduce durata diareei. |
||
|
scaune pe zi urmărire: 10 zile până la 3 luni 425 (4 studii) |
scaunele medii pe zi fără probiotice au fost de 2,5 scaune pe zi. |
0.3 mai puține scaune pe zi (0,6 până la 0 Mai puține) |
⊕⊕⊝⊝ lowj, k din cauza impreciziei și inconsecvenței |
este posibil să existe o diferență mică sau deloc în scaune pe zi. |
||
|
*baza pentru riscul din grupul de control (de exemplu, riscul median al grupului de control în cadrul studiilor) este prezentată în notele de subsol. Riscul în grupul de intervenție (și intervalul său de încredere de 95%) se bazează pe riscul asumat în grupul de comparație și pe efectul relativ al intervenției (și IÎ de 95%). IÎ: interval de încredere; RR: raport de risc. |
||||||
|
explicații un grup de Control estimările riscului provin din estimările cumulate ale grupurilor de control. Efect relativ bazat pe analiza de caz disponibilă b risc ridicat de părtinire din cauza pierderii mari de urmărire. c imprecizia datorată câtorva evenimente și intervalele de încredere includ beneficii sau daune apreciabile. d reacții adverse: erupții cutanate, greață, flatulență, vărsături, creșterea flegmei, dureri în piept, constipație, tulburări ale gustului și apetit scăzut. riscurile au fost calculate pe baza diferențelor de risc cumulate. f risc ridicat de părtinire. Doar 11 din 16 studii au raportat evenimente adverse, sugerând o părtinire selectivă de raportare. g inconsecvență gravă. Numeroși agenți probiotici și doze au fost evaluate într-un număr relativ mic de studii, limitând capacitatea noastră de a trage concluzii cu privire la siguranța multor agenți probiotici și a dozelor administrate. h inconsecvență inexplicabilă gravă (eterogenitate mare I2 = 79%, valoarea P , estimările punctelor și intervalele de încredere variază considerabil). i imprecizie gravă. Limita superioară de 0,02 zile mai puțin de diaree nu este considerată importantă pentru pacient. j inconsecvență inexplicabilă gravă (eterogenitate mare I2 = 78%, valoarea P , estimările punctelor și intervalele de încredere variază considerabil). k imprecizie gravă. Intervalul de încredere de 95% nu include niciun efect, iar limita inferioară de 0,60 scaune pe zi are o importanță discutabilă pentru pacient. |
||||||
14.1.4 elaborarea tabelelor’ rezumat al constatărilor ‘
software-ul grupului de lucru grad, GRADEpro GDT (www.gradepro.org), inclusiv manualul interactiv al lui GRADE, este disponibil pentru a ajuta autorii revizuirii în pregătirea tabelelor de rezumat al constatărilor. GRADEpro poate utiliza datele privind riscul grupului comparator și estimarea efectului (introduse de autorii recenziei sau importate din fișierele generate în RevMan) pentru a produce efectele relative și riscurile absolute asociate intervențiilor experimentale. În plus, conduce utilizatorul prin procesul de evaluare a gradului și produce un tabel care poate fi utilizat ca tabel independent într-o recenzie (inclusiv prin import direct în software precum RevMan sau integrare cu RevMan Web) sau un tabel interactiv ‘rezumat al constatărilor’ (vezi resurse de ajutor în GRADEpro).
14.1.5 considerații statistice în tabelele rezumat al constatărilor
14.1.5.1 rezultate dihotomice
tabelele rezumat al constatărilor ar trebui să includă atât măsuri absolute, cât și relative ale efectului pentru rezultatele dihotomice. Ratele de risc, ratele de cote și diferențele de risc sunt moduri diferite de a compara două grupuri cu datele de rezultat dihotomice (a se vedea capitolul 6, secțiunea 6.4.1). În plus, există două rate de risc distincte, în funcție de evenimentul (de exemplu, da sau nu) care se află în centrul analizei (a se vedea capitolul 6 secțiunea 6.4.1.5). În prezența unui efect de intervenție diferit de zero, orice variație între studiile din grupul comparator riscă (adică. variația riscului ca evenimentul să aibă loc fără intervenția interesului, de exemplu în diferite populații) face imposibil ca mai multe dintre aceste măsuri să fie cu adevărat aceleași în fiecare studiu.
s-a presupus mult timp în epidemiologie că măsurile relative de efect sunt mai consistente decât măsurile absolute de efect de la un scenariu la altul. Există dovezi empirice care susțin această ipoteză (Engels și colab.2000, Deeks și Altman 2001, Furukawa și colab. 2002). Din acest motiv, meta-analizele ar trebui să utilizeze, în general, fie un raport de risc, fie un raport de Cote ca măsură a efectului (a se vedea capitolul 10, secțiunea 10.4.3). În mod corespunzător, o singură estimare a efectului relativ este probabil să fie un rezumat mai adecvat decât o singură estimare a efectului absolut. Dacă un efect relativ este într-adevăr consecvent în cadrul studiilor, atunci riscurile diferite ale grupului comparator vor avea implicații diferite pentru un beneficiu absolut. De exemplu, dacă raportul de risc este în mod constant 0.75, atunci intervenția experimentală ar reduce un risc de grup comparator de 80% până la 60% în grupul de intervenție (o reducere absolută a riscului de 20 de puncte procentuale), dar ar reduce și un risc de grup comparator de 20% până la 15% în grupul de intervenție (o reducere absolută a riscului de 5 puncte procentuale).
‘Rezumatul constatărilor’ tabelele sunt construite în jurul presupunerii unui efect relativ consistent. Prin urmare, este important să se ia în considerare implicațiile acestui efect pentru diferite riscuri ale grupului comparator (acestea pot fi derivate sau estimate dintr-o serie de surse, a se vedea secțiunea 14.1.6.3), care poate necesita o evaluare a certitudinii dovezilor pentru dovezile prognostice (Spencer et al 2012, Iorio et al 2015). Pentru orice risc de grup comparator, este posibil să se estimeze un risc de grup de intervenție corespunzător (adică riscul absolut cu intervenția) din raportul de risc meta-analitic sau raportul de cote. Rețineți că numerele furnizate în coloana’ risc corespunzător ‘sunt specifice’ riscurilor ‘ din coloana adiacentă.
pentru raportul de risc meta-analitic (RR) și riscul comparator presupus (ACR), riscul de intervenție corespunzător se obține ca:
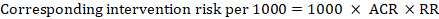 .
.
ca exemplu, în figura 14.1.a, raportul de risc meta-analitic pentru tromboza venoasă profundă fără simptome (TVP) este RR = 0,10 (IÎ 95% 0,04 până la 0,26). Presupunând un risc comparator de ACR = 10 la 1000 = 0,01, obținem:
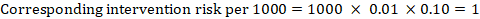 .
.
pentru raportul cotelor meta-analitice (OR) și riscul comparator presupus, ACR, riscul de intervenție corespunzător se obține ca:
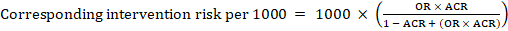 .
.
limitele superioare și inferioare de încredere pentru riscul de intervenție corespunzător sunt obținute prin înlocuirea RR sau sau prin limitele lor superioare și inferioare de încredere (de exemplu, înlocuirea 0.10 cu 0,04, apoi cu 0,26, în exemplu). Astfel de intervale de încredere nu încorporează incertitudinea în riscurile asumate de comparator.
atunci când se tratează ratele de risc, este esențial să se utilizeze aceeași definiție a ‘evenimentului’ ca și cea utilizată pentru meta-analiză. De exemplu, dacă meta-analiza s-a concentrat pe ‘moarte’ (spre deosebire de supraviețuire) ca eveniment, atunci riscurile corespunzătoare din tabelul ‘rezumat al constatărilor’ trebuie să se refere și la ‘moarte’.
în circumstanțe (rare) în care există motive clare de asumare a unei diferențe consistente de risc în meta-analiză, în principiu este posibil să se prezinte acest lucru pentru ‘riscurile asumate’ relevante și riscurile corespunzătoare acestora și să se prezinte efectele relative (diferite) corespunzătoare pentru fiecare risc asumat.
diferența de risc exprimă diferența dintre ACR și riscul de intervenție corespunzător (sau diferența dintre intervenția experimentală și cea comparatoare).
pentru raportul de risc meta-analitic (RR) și riscul comparator presupus (ACR) se obține diferența de risc corespunzătoare ca (rețineți că riscurile pot fi exprimate și folosind procente sau puncte procentuale):
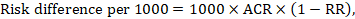
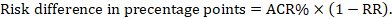
de exemplu, în figura 14.1.b raportul de risc meta-analitic este de 0,41 (IÎ 95% 0,29 până la 0,55) pentru diaree la copiii cu vârsta sub 5 ani. Presupunând un risc de grup comparator de 22,3% obținem:
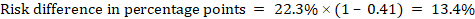 .
.
pentru raportul cotelor meta-analitice (OR) și riscul comparator presupus (ACR), diferența de risc absolută se obține ca (puncte procentuale):
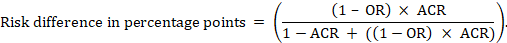
limitele de încredere superioare și inferioare pentru diferența de risc absolută sunt obținute prin reluarea calculului de mai sus în timp ce se înlocuiește RR sau sau prin limitele lor de încredere superioare și inferioare (de exemplu, înlocuirea 0,41 cu 0,28, apoi cu 0,55, în exemplu). Astfel de intervale de încredere nu încorporează incertitudinea în riscurile asumate de comparator.
14.1.5.2 rezultatele timpului până la eveniment
rezultatele timpului până la eveniment măsoară dacă și când are loc un anumit eveniment (de exemplu, moartea) (van Dalen et al 2007). Impactul intervenției experimentale în raport cu grupul de comparație asupra rezultatelor timpului până la eveniment este de obicei măsurat folosind un risc relativ (RR) (vezi capitolul 6, secțiunea 6.8.1).
un risc relativ exprimă o estimare relativă a efectului. Acesta poate fi utilizat în diferite moduri pentru a obține riscuri absolute și alte cantități interpretabile pentru o anumită populație. Aici descriem modul de re-exprimare a ratelor de pericol în termeni de: (i) riscul absolut de supraviețuire fără evenimente într-o anumită perioadă de timp; (ii) riscul absolut al unui eveniment într-o anumită perioadă de timp; și (iii) timpul median până la eveniment. Toate metodele sunt construite pe o presupunere a efectelor relative consistente (adică rata de risc nu variază în timp).
(i) riscul absolut de supraviețuire fără evenimente într-o anumită perioadă de timp supraviețuirea fără evenimente (de exemplu supraviețuirea globală) este frecvent raportată de studii individuale. Pentru a obține efecte absolute pentru rezultatele timpului până la eveniment măsurate ca supraviețuire fără evenimente, rezumatul HR poate fi utilizat împreună cu o proporție presupusă de pacienți care nu au evenimente în grupul comparator (Tierney et al 2007). Această proporție de pacienți va fi specifică unei perioade de timp de observație. Cu toate acestea, nu este strict necesar să se precizeze această perioadă de timp. De exemplu, o proporție de 50% dintre pacienții fără evenimente s-ar putea aplica pacienților cu o rată ridicată a evenimentelor observată pe parcursul a 1 an sau pacienților cu o rată scăzută a evenimentelor observată pe parcursul a 2 ani.

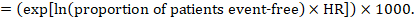
de exemplu, să presupunem că raportul de risc meta-analitic este de 0,42 (IÎ 95% 0,25 până la 0,72). Presupunând un risc de grup comparator de supraviețuire fără evenimente (de exemplu, pentru supraviețuirea globală a persoanelor în viață) la 2 ani de ACR = 900 la 1000 = 0,9 obținem:

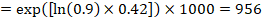
așa că 956 la 1000 de persoane vor fi în viață cu intervenția experimentală la 2 ani. Derivarea riscului trebuie explicată într-un comentariu sau notă de subsol.
(ii) riscul absolut al unui eveniment într-o anumită perioadă de timp pentru a obține acest efect absolut, din nou rezumatul HR poate fi utilizat (Tierney și colab 2007):

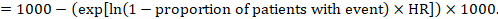
în exemplu, să presupunem că presupunem un grup comparator risc de evenimente (de exemplu, pentru mortalitate, oameni morți) la 2 ani de ACR = 100 la 1000 = 0,1. Obținem:

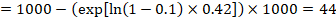
astfel că 44 la 1000 de persoane vor fi moarte cu intervenția experimentală la 2 ani.
(iii) timpul Median până la eveniment în loc de numere absolute, timpul până la eveniment în grupurile de intervenție și comparație poate fi exprimat ca timp median de supraviețuire în luni sau ani. Pentru a obține timpul median de supraviețuire, RR cumulat poate fi aplicat unui timp median de supraviețuire presupus în grupul comparator (Tierney și colab 2007):
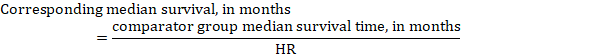
în exemplu, presupunând un timp de supraviețuire median al grupului comparator de 80 de luni, obținem:
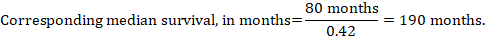
pentru toate aceste trei opțiuni de re-exprimare a rezultatelor analizelor de timp până la eveniment, limitele de încredere superioare și inferioare pentru riscul de intervenție corespunzător sunt obținute prin înlocuirea HR cu limitele sale de încredere superioare și, respectiv, inferioare (de exemplu, înlocuirea 0,42 cu 0,25, apoi cu 0,72, în exemplu). Din nou, în ceea ce privește rezultatele dihotomice, astfel de intervale de încredere nu încorporează incertitudinea în riscurile asumate ale grupului comparator. Acest lucru prezintă o preocupare specială pentru supraviețuirea pe termen lung, cu o rată de mortalitate scăzută sau moderată și un număr mare corespunzător de pacienți cenzurați (adică un număr scăzut de pacienți cu risc și o rată ridicată de cenzurare).
14.1.6 conținutul detaliat al unui ‘rezumat al constatărilor’ tabelul
14.1.6.1 titlul și antetul tabelului
titlul fiecărui tabel ‘rezumat al constatărilor’ ar trebui să specifice problema asistenței medicale, încadrată în funcție de populație și să clarifice exact ce comparație a intervențiilor se face. În Figura 14.1.a, populația este oameni care iau zboruri lungi de avion, intervenția este Ciorapi de compresie, iar controlul nu este Ciorapi de compresie.
primele rânduri ale fiecărui tabel ‘rezumat al constatărilor’ ar trebui să furnizeze următoarele informații ‘antet’:
pacienți sau populație Acest lucru clarifică în continuare populația (și, eventual, subpopulațiile) de interes și, în mod ideal, amploarea riscului celui mai crucial rezultat advers către care este direcționată o intervenție. De exemplu, persoanele aflate într-un zbor pe distanțe lungi pot prezenta riscuri diferite pentru TVP; cei care utilizează inhibitori selectivi ai recaptării serotoninei (ISRS) pot prezenta un risc diferit de reacții adverse; în timp ce cei cu fibrilație atrială pot avea un risc anual scăzut (< 1%), moderat (1% până la 4%) sau ridicat (> 4%) de accident vascular cerebral.
Setare aceasta ar trebui să indice orice caracteristici specifice ale setărilor problemei asistenței medicale care ar putea limita aplicabilitatea rezumatului constatărilor la alte setări (de exemplu, asistența medicală primară în Europa și America de Nord).
intervenție intervenția experimentală.
comparație intervenția comparatorului (inclusiv nicio intervenție specifică).
14.1.6.2 rezultate
rândurile unui tabel de rezumat al constatărilor ar trebui să includă toate rezultatele dorite și nedorite în materie de sănătate (enumerate în ordinea importanței) care sunt esențiale pentru luarea deciziilor, până la maximum șapte rezultate. Dacă există mai multe rezultate în revizuire, autorii revizuirii vor trebui să omită rezultatele mai puțin importante din tabel, iar decizia de selectare a rezultatelor care sunt critice sau importante pentru revizuire ar trebui luată în timpul elaborării protocolului (a se vedea capitolul 3). Autorii revizuirii ar trebui să furnizeze intervale de timp pentru măsurarea rezultatelor (de exemplu, 90 de zile sau 12 luni) și tipul scorurilor instrumentului (de exemplu, variind de la 0 la 100).
rețineți că autorii revizuirii ar trebui să includă rezultatele critice și importante pre-specificate în tabel dacă datele sunt disponibile sau nu. Cu toate acestea, aceștia ar trebui să fie atenți la posibilitatea ca importanța unui rezultat (de exemplu, un efect advers grav) să devină cunoscută numai după redactarea protocolului sau după efectuarea analizei și ar trebui să ia măsurile corespunzătoare pentru a le include în tabelul rezumat al constatărilor.
tabelul rezumat al constatărilor poate include efecte în subgrupuri ale populației pentru diferite riscuri comparatoare și mărimi ale efectelor separat. De exemplu, în figura 14.1.efectele b sunt prezentate separat pentru copiii mai mici și mai mari de 5 ani. Autorii revizuirii pot opta, de asemenea, pentru a produce tabele separate de rezumat al constatărilor pentru diferite populații.
autorii revizuirii ar trebui să includă evenimente adverse grave, dar ar putea fi posibilă combinarea evenimentelor adverse minore ca rezultat unic și să descrie acest lucru într-o notă de subsol explicativă (rețineți că nu este adecvat să adăugați evenimente împreună decât dacă sunt independente, adică un participant care a prezentat un eveniment advers are o șansă neafectată de a experimenta celălalt eveniment advers).
rezultatele măsurate în mai multe momente de timp reprezintă o problemă particulară. În general, pentru a menține tabelul simplu, autorii revizuirii ar trebui să prezinte mai multe puncte de timp numai pentru rezultatele critice pentru luarea deciziilor, unde fie rezultatul, fie decizia luată pot varia în timp. Restul trebuie prezentat la un moment comun, dacă este posibil.
autorii revizuirii pot prezenta măsuri continue de rezultat în tabelul ‘rezumat al constatărilor’ și ar trebui să depună eforturi pentru a le face interpretabile publicului țintă. Acest lucru necesită ca unitățile să fie clare și ușor de interpretat, de exemplu, zilele de durere sau frecvența durerilor de cap, iar numele și scara oricăror instrumente de măsurare utilizate ar trebui să fie indicate (de exemplu, o scară analogică vizuală, cuprinsă între 0 și 100). Cu toate acestea, multe instrumente de măsurare nu sunt ușor interpretabile de către clinicieni sau pacienți nespecialiști, de exemplu, puncte pe un inventar al depresiei Beck sau scorul calității vieții. Pentru acestea, o prezentare mai interpretabilă ar putea implica transformarea unui rezultat continuu într-un rezultat dihotomic, cum ar fi îmbunătățirea >50% (a se vedea capitolul 15, secțiunea 15.5).
14.1.6.3 cea mai bună estimare a riscului cu intervenția comparatorului
autorii revizuirii ar trebui să furnizeze până la trei riscuri tipice pentru participanții care primesc intervenția comparatorului. Pentru rezultatele dihotomice, recomandăm ca acestea să fie prezentate sub forma numărului de persoane care experimentează evenimentul la 100 sau 1000 de persoane (frecvență naturală) în funcție de frecvența rezultatului. Pentru rezultatele Continue, acest lucru ar fi declarat ca o valoare medie sau mediană a rezultatului măsurat.
riscurile de intervenție ale comparatorului Estimate sau presupuse s-ar putea baza pe evaluări ale riscurilor tipice pentru diferite grupuri de pacienți derivate din analiza propriu-zisă, din studii reprezentative individuale din revizuire sau din riscuri derivate dintr-o analiză sistematică a studiilor de prognostic sau a altor surse de dovezi care, la rândul lor, pot necesita o evaluare a certitudinii pentru dovezile de prognostic (Spencer et al 2012, Iorio et al 2015). În mod ideal, riscurile ar reflecta grupuri pe care clinicienii le pot identifica cu ușurință pe baza caracteristicilor lor de prezentare.
o notă de subsol explicativă ar trebui să specifice sursa sau justificarea fiecărui risc al grupului comparator, inclusiv perioada de timp căreia îi corespunde, după caz. În Figura 14.1.a, clinicienii pot diferenția cu ușurință persoanele cu factori de risc pentru tromboza venoasă profundă de cei fără. Dacă se cunoaște o variație mică a riscului inițial, autorii revizuirii pot utiliza riscul median al grupului comparator în cadrul studiilor. Dacă riscurile tipice nu sunt cunoscute, o opțiune este alegerea riscului din studiile incluse, oferind al doilea cel mai mare pentru o populație cu risc ridicat și al doilea cel mai mic pentru o populație cu risc scăzut.
14.1.6.4 risc cu intervenție
pentru rezultatele dihotomice, autorii revizuirii ar trebui să furnizeze un risc absolut corespunzător pentru fiecare risc al grupului comparator, împreună cu un interval de încredere. Acest risc absolut cu intervenția (experimentală) va fi de obicei derivat din rezultatul meta-analizei prezentat în coloana efectului relativ (vezi secțiunea 14.1.6.6). Formulele sunt prezentate la punctul 14.1.5. Autorii revizuirii ar trebui să prezinte efectul absolut în același format ca și riscurile cu intervenția comparatorului (a se vedea secțiunea 14.1.6.3), de exemplu ca număr de persoane care se confruntă cu evenimentul la 1000 de persoane.
pentru rezultate continue, trebuie prezentată o diferență de mijloace sau o diferență standardizată de mijloace cu intervalul său de încredere. Acestea vor fi obținute de obicei direct dintr-o meta-analiză. Textul explicativ ar trebui utilizat pentru a clarifica semnificația, ca în figurile 14.1.a și 14.1.b.
14.1.6.5 diferența de risc
pentru rezultatele dihotomice, diferența de risc poate fi furnizată utilizând unul dintre formatele tabelului sumar al constatărilor ca opțiune suplimentară (a se vedea figura 14.1.b). Această diferență de risc exprimă diferența dintre intervenția experimentală și cea comparativă și va fi de obicei derivată din rezultatul meta-analizei prezentat în coloana efectului relativ (vezi secțiunea 14.1.6.6). Formulele sunt prezentate la punctul 14.1.5. Autorii revizuirii ar trebui să prezinte diferența de risc în același format ca riscurile asumate și riscurile corespunzătoare cu intervenția comparatorului (a se vedea secțiunea 14.1.6.3); de exemplu, ca număr de persoane care se confruntă cu evenimentul la 1000 de persoane sau ca puncte procentuale dacă riscurile asumate și riscurile corespunzătoare sunt exprimate în procente.
pentru rezultate continue, dacă tabelul ‘rezumat al constatărilor’ include această opțiune, diferența medie poate fi prezentată aici și coloana ‘risc corespunzător’ lăsată necompletată (a se vedea figura 14.1.b).
14.1.6.6 efect relativ (IÎ 95%)
efectul relativ va fi de obicei un raport de risc sau un raport de risc (sau ocazional un raport de risc) cu intervalul său de încredere de 95% însoțitor, obținut dintr-o meta-analiză efectuată pe baza aceleiași măsurători a efectului. Ratele de risc și cotele sunt similare atunci când riscurile de intervenție ale comparatorului sunt scăzute și efectele sunt mici, dar pot diferi considerabil atunci când riscurile grupului comparator cresc. Meta-analiza poate implica o presupunere a efectelor fixe sau aleatorii, în funcție de ceea ce autorii revizuirii consideră adecvat și implicând că efectul relativ este fie o estimare a efectului intervenției, fie o estimare a efectului mediu al intervenției între studii.
14.1.6.7 Numărul de participanți (studii)
această coloană trebuie să includă numărul de participanți evaluați în studiile incluse pentru fiecare rezultat și numărul corespunzător de studii care au contribuit cu acești participanți.
14.1.6.8 certitudinea dovezilor (grad)
autorii recenziei ar trebui să comenteze certitudinea dovezilor (cunoscută și sub numele de calitatea corpului de dovezi sau încrederea în estimările efectului). Autorii revizuirii ar trebui să utilizeze sistemul specific de notare a dovezilor dezvoltat de grupul de lucru GRADE (Atkins et al 2004, Guyatt et al 2008, Guyatt et al 2011a), care este descris în detaliu în secțiunea 14.2. Abordarea grad clasifică certitudinea într-un corp de dovezi ca fiind ‘ridicat’, ‘moderat’, ‘scăzut’ sau ‘foarte scăzut’ după rezultat. Acesta este un rezultat al judecății, dar procesul de judecată funcționează într-o structură transparentă. De exemplu, certitudinea ar fi ‘ridicată’ dacă rezumatul ar fi al mai multor studii randomizate cu risc scăzut de părtinire, dar ratingul certitudinii devine mai mic dacă există îngrijorări cu privire la riscul de părtinire, inconsecvență, indirectitate, imprecizie sau părtinire de publicare. Hotărârile, altele decât cele de înaltă certitudine, ar trebui să devină transparente, utilizând note explicative de subsol sau coloana de comentarii din tabelul rezumat al constatărilor (a se vedea secțiunea 14.1.6.10).
14.1.6.9 Comentarii
scopul câmpului ‘comentarii’ este de a ajuta la interpretarea informațiilor sau datelor identificate în rând. De exemplu, acest lucru poate fi pe validitatea măsurii de rezultat sau prezența variabilelor care sunt asociate cu magnitudinea efectului. Avertismente importante cu privire la rezultate ar trebui semnalate aici. Nu toate rândurile vor avea nevoie de comentarii și cel mai bine este să lăsați un gol dacă nu există nimic care să garanteze un comentariu.
14.1.6.10 explicații
explicații detaliate ar trebui incluse ca note de subsol pentru a sprijini hotărârile din tabelul rezumat al constatărilor, cum ar fi evaluarea generală a gradului. Explicațiile ar trebui să descrie rațiunea aspectelor importante ale conținutului. Tabelul 14.1.a liste de orientare pentru explicații utile. Explicațiile trebuie să fie concise, informative, relevante, ușor de înțeles și exacte. Dacă explicațiile nu pot fi descrise suficient în notele de subsol, autorii revizuirii ar trebui să furnizeze detalii suplimentare despre problemele din secțiunile rezultate și discuții ale revizuirii.
tabelul 14.1.un ghid pentru furnizarea de explicații utile în tabelele rezumat al constatărilor (SoF). Adaptat de la Santesso și colab (2016)
orientări generale
- introduceți informațiile pentru cititori direct în tabel, dacă este posibil (de exemplu, informații despre durata urmăririi sau scala utilizată).
- în general, nu citați referințe în secțiunea explicații, cu excepția cazului în care există motive specifice, de exemplu, pentru furnizarea de informații despre sursele riscurilor de referință (a se vedea punctul 3).
- furnizează sursa de informații despre riscurile de referință utilizate pentru calcularea efectelor absolute.
- la finalizarea tabelului, examinați toate explicațiile pentru a determina dacă unele ar putea fi referite de mai multe ori dacă sunt reformulate sau combinate.
- furnizați motive pentru actualizarea și retrogradarea dovezilor (consultați îndrumările specifice domeniului de mai jos) și utilizați software-ul GRADEpro GDT pentru a adera la îndrumările de grad.
- corpul de dovezi pentru un anumit rezultat poate fi determinat să aibă probleme grave sau foarte grave pentru domeniul afectat (sau critic grav pentru riscul de părtinire atunci când este utilizat ROBINS-I). Astfel, poate fi util să se indice numărul de niveluri pentru retrogradare (de exemplu, retrogradat cu un nivel pentru riscul de părtinire), dar să se evite repetarea a ceea ce este în tabel (și impresia de raportare formulică sau algoritmică). În profilurile de dovezi, aceste informații se află deja în celulele tabelului.
- deși explicațiile cu privire la certitudinea probelor sunt necesare în primul rând atunci când modifică certitudinea, luați în considerare adăugarea unei explicații atunci când certitudinea probelor nu a fost modificată, dar când această decizie poate fi pusă la îndoială de alții. Acest lucru va ajuta la înțelegerea motivelor dezacordului.
- asigurați-vă că tabelul nu este utilizat ca o descriere a metodelor reexaminării (de exemplu, nu descrieți motivele analizei statistice).
- introduceți rezultatele pentru rezultatele care nu au putut fi combinate statistic într-o meta-analiză (adică. rezultate narative) direct în tabelul SoF din coloanele rezultate. O explicație nu poate fi necesară pentru a comunica aceste rezultate. În cazul în care se consideră că este benefic pentru publicul vizat, se adaugă estimări complementare ale efectelor intervenției (de exemplu, numărul necesar pentru a trata beneficiile și daunele, diferența de risc exprimată în procente, rezultatul continuu exprimat în unități de diferență minimă importantă) în coloana de comentarii.
- utilizați informațiile prezentate în explicațiile despre procesul de evaluare pentru a informa alte părți cheie ale revizuirii, inclusiv versiunile sumare și discuția.
îndrumări specifice domeniului pentru scrierea explicațiilor utile
risc de părtinire
- descrieți numărul de studii sau cantitatea de informații pe care le furnizează în meta-analiză, care prezintă un risc ridicat de părtinire și pentru ce criteriu.
- folosiți termeni precum majoritate, minoritate, toți, unii sau niciunul; sau numărul de studii ca studii X/X.
- pentru studiile randomizate, menționați criteriile specifice, inclusiv ascunderea secvenței de alocare, raportarea selectivă a rezultatelor etc. Pentru studiile non-randomizate, descrieți criteriul din instrumentul utilizat (de exemplu, folosind instrumentul ROBINS-I).
- indicați dacă efectul riscului de părtinire a fost examinat într-o analiză de sensibilitate. Atunci când este cazul, menționați contribuția studiilor cu risc ridicat de părtinire la estimări.
- informațiile privind proiectarea studiului pot fi incluse în explicații, în special în FOS, atunci când sunt incluse diferite modele de studiu.
inconsecvența
- indică măsura utilizată pentru a judeca inconsecvența, cum ar fi testul sau măsura statistică (I2, Chi2, Tau) sau suprapunerea intervalelor de încredere sau similitudinea estimărilor punctuale.
- dacă inconsecvența se bazează pe I2, descrieți-o ca fiind considerabilă, substanțială, moderată sau nesemnificativă.
- dacă este cazul, menționați dacă eterogenitatea a fost explorată în analizele subgrupului de către PICO (pacienți, intervenție, comparație, rezultat) și dacă există alte motive potențiale pentru eterogenitate.
- în cazul unui singur studiu pentru un rezultat, să spunem că nu există ‘nici unul’ mai degrabă decât ‘Neaplicabil’.
imprecizia
- indică unde dimensiunea eșantionului sau numărul de evenimente nu corespunde dimensiunii optime a informațiilor calculate sau ‘regulile generale’ (de exemplu, 400 de evenimente). Evitați referirea la numărul de studii ca motiv pentru imprecizie.
- indicați dacă intervalele de încredere includ posibilitatea unui efect mic sau deloc și beneficii sau daune importante. Dacă este cunoscut, furnizați valoarea numerică a pragului de beneficiu important.
- evitați raportarea rezultatului ca fiind statistic sau non-statistic semnificativ.
actualizarea
- menționați motivul actualizării: datorită efectului mare; un gradient doză-răspuns; sau o confuzie reziduală plauzibilă crește certitudinea dovezilor.
- pentru efecte mari, raportați dacă efectul relativ este >2 sau > 5. Pentru gradienții doză-răspuns, furnizați nivelul de intervenție și efectul asupra rezultatului. Pentru domeniul ‘plauzibil rezidual opposing confounding’, descrieți efectul factorului de confuzie asupra estimării.
14.2 evaluarea certitudinii sau a calității unui corp de probe
14.2.1 abordarea gradelor
gradele de recomandare, evaluare, dezvoltare și evaluare grupul de lucru (grupul de lucru gradelor) a dezvoltat un sistem de clasificare a certitudinii probelor (Sch Xvictnemann și colab.2003, Atkins și colab. 2004, Sch Xvictnemann și colab. 2006, Guyatt și colab. 2008, Guyatt și colab. 2011a). Peste 100 de organizații, inclusiv Organizația Mondială a Sănătății (OMS), Colegiul American al medicilor, Societatea Americană de Hematologie (ASH), Agenția Canadiană pentru medicamente și tehnologie în sănătate (CADTH) și Institutele Naționale de sănătate și Excelență Clinică (NICE) din Marea Britanie au adoptat sistemul de GRADE (www.gradeworkinggroup.org).
Cochrane a adoptat, de asemenea, în mod oficial această abordare, iar toate evaluările Cochrane ar trebui să utilizeze grad pentru a evalua certitudinea dovezilor pentru rezultate importante (a se vedea caseta MECIR 14.2.a).
caseta MECIR 14.2.o așteptări relevante pentru efectuarea revizuirilor de intervenție
|
C74: evaluarea certitudinii corpului de probe (obligatoriu) |
|
|
utilizați considerațiile de cinci GRADE (risc de părtinire, consecvență a efectului, imprecizie, indirectitate și părtinire de publicare) pentru a evalua certitudinea corpului de dovezi pentru fiecare rezultat și pentru a trage concluzii cu privire la certitudinea probelor din textul revizuirii. |
gradul este cea mai utilizată abordare pentru rezumarea încrederii în efectele intervențiilor prin rezultate în cadrul studiilor. Este de preferat să utilizați instrumentul GRADEpro online și să îl utilizați așa cum este descris în sistemul de ajutor al software-ului. Acest lucru ar trebui să contribuie la asigurarea faptului că echipele de autori accesează aceleași informații pentru a-și informa hotărârile. În mod ideal, două persoane care lucrează independent ar trebui să evalueze certitudinea corpului de dovezi și să ajungă la o opinie consensuală cu privire la orice decizie de retrogradare. Considerațiile de cinci GRADE ar trebui abordate indiferent dacă revizuirea include un tabel de sinteză a constatărilor. Este util să ne bazăm pe aceste informații în discuție, în concluziile autorilor și să transmitem certitudinea dovezilor din rezumatul limbajului Abstract și simplu. |
|
C75: justificarea evaluărilor privind certitudinea corpului de probe (obligatoriu) |
|
|
justificați și documentați toate evaluările privind certitudinea corpului de probe (de exemplu, retrogradarea sau modernizarea folosind gradul). |
adoptarea unei abordări structurate asigură transparența în formularea unei interpretări a dovezilor, iar rezultatul este mai informativ pentru utilizator. |
pentru revizuiri sistematice, abordarea grad definește certitudinea unui corp de dovezi ca măsura în care se poate avea încredere că o estimare a efectului sau a asocierii este apropiată de cantitatea de interes specific. Evaluarea certitudinii unui corp de dovezi implică luarea în considerare a riscului de părtinire în cadrul și în cadrul studiului (limitări în proiectarea și execuția studiului sau calitatea metodologică), inconsecvența (sau eterogenitatea), indirectitatea dovezilor, imprecizia estimărilor efectului și riscul de părtinire a publicării (a se vedea secțiunea 14.2.2), precum și domenii care pot crește încrederea noastră în estimarea efectului (așa cum este descris în secțiunea 14.2.3). Sistemul de note implică o evaluare a certitudinii unui corp de dovezi pentru fiecare rezultat individual. Judecățile cu privire la domeniile care determină certitudinea dovezilor ar trebui descrise în secțiunea Rezultate sau discuții și ca parte a tabelului rezumat al constatărilor.
abordarea grad specifică patru niveluri de certitudine (figura 14.2.a). Pentru intervenții, inclusiv teste de diagnostic și alte teste care sunt evaluate ca intervenții (Sch Xvnemann și colab. 2008b, Sch Xvnemann și colab. 2008a, Balshem și colab. 2011, Sch Xvnemann și colab. 2012), punctul de plecare pentru evaluarea certitudinii dovezilor este clasificat în două tipuri:
- studii randomizate; și
- studii non-randomizate de intervenții (NRSI), inclusiv studii observaționale (inclusiv, dar fără a se limita la studii de cohortă și studii de caz-control, studii transversale, serii de cazuri și rapoarte de caz, deși nu toate aceste modele sunt de obicei incluse în recenziile Cochrane).
există multe cazuri în care autorii revizuirii se bazează pe informații din NRSI, în special pentru a evalua potențialele daune (vezi capitolul 24). În plus, autorii revizuirii pot obține date relevante atât din studii randomizate, cât și din NRSI, fiecare tip de dovezi completându-l pe celălalt (Sch 2013).
în Grad, un corp de dovezi din studiile randomizate începe cu un rating de înaltă certitudine, în timp ce un corp de dovezi din NRSI începe cu un rating de certitudine scăzut. Evaluarea mai mică cu NRSI este rezultatul prejudecății potențiale induse de lipsa randomizării (adică confuzie și părtinire de selecție).
cu toate acestea, atunci când se utilizează noul risc de părtinire în studiile non-randomizate ale intervențiilor (ROBINS-I) (Sterne et al 2016), un instrument de evaluare care acoperă riscul de părtinire din cauza lipsei de randomizare, toate studiile pot începe ca o certitudine ridicată a dovezilor (Sch 2018). Abordarea de a începe toate proiectele de studii (inclusiv NRSI) ca certitudine ridicată nu intră în conflict cu abordarea inițială a gradului de pornire a ratingului NRSI ca dovadă de certitudine scăzută. Acest lucru se datorează faptului că un corp de dovezi din NRSI ar trebui, în general, să fie retrogradat cu două niveluri din cauza riscului inerent de părtinire asociat cu lipsa randomizării, și anume confuzia și părtinirea selecției. Nu retrogradarea NRSI de la o certitudine ridicată la una scăzută necesită o justificare transparentă și detaliată pentru ceea ce atenuează preocupările legate de prejudecățile de confuzie și de selecție (Sch Inktictnemann et al 2018). În prezent, există foarte puține exemple în care nu este adecvată o evaluare cu două niveluri.
cel mai înalt grad de certitudine este un corp de dovezi atunci când nu există preocupări în niciunul dintre factorii de grad enumerați în figura 14.2.a. autorii revizuirii retrogradează adesea dovezile la dovezi de certitudine moderate, scăzute sau chiar foarte scăzute, în funcție de prezența celor cinci factori din Figura 14.2.a. de obicei, ratingul de certitudine va scădea cu un nivel pentru fiecare factor, până la maximum trei niveluri pentru toți factorii. Dacă există probleme foarte grave pentru un domeniu (de ex. la evaluarea riscului de părtinire, toate studiile au fost nedezvăluite, neacoperite și au pierdut peste 50% dintre pacienți la urmărire), dovezile pot scădea cu două niveluri numai datorită acestui factor. Nu este posibil să se evalueze dovezi mai mici decât dovezi de certitudine foarte scăzute.
autorii revizuirii vor clasifica, în general, dovezile din studiile non-randomizate solide ca certitudine scăzută, chiar dacă ROBINS-I este utilizat. Dacă, totuși, astfel de studii produc efecte mari și nu există o prejudecată evidentă care să explice aceste efecte, autorii revizuirii pot evalua dovezile ca fiind moderate sau – dacă efectul este suficient de mare – chiar și ca o certitudine ridicată (figura 14.2.a). Nivelul de certitudine foarte scăzut este adecvat pentru, dar nu se limitează la, studii cu probleme critice și observații clinice nesistematice (de exemplu, serii de cazuri sau rapoarte de caz).