nume Generic: clonidina clorhidrat
forma de dozare: comprimat
medical revizuite de către Drugs.com. Ultima actualizare la 1 iulie 2020.
- Prezentare generală
- efecte secundare
- dozare
- profesional
- sfaturi
- interacțiuni
- mai mult
- comprimate clorhidrat de clonidină, USP
- clonidină descriere
- Clonidina – Farmacologie Clinică
- farmacocinetica
- indicații și utilizare pentru clonidină
- contraindicații
- Atenționări
- întrerupere
- Precauții
- General
- utilizare perioperatorie
- informații pentru pacienți
- interacțiuni medicamentoase
- Toxicologie
- carcinogeneza, mutageneza, afectarea fertilității
- sarcina
- mamele care alăptează
- utilizare pediatrică
- reacții Adverse
- supradozaj
- dozare și administrare de clonidină
- cum se administrează Clonidina
- panoul principal de afișare
- panoul principal de afișare
- PRINCIPAL DISPLAY PANEL
- mai multe despre clonidină
- resurse pentru consumatori
- resurse profesionale
- ghiduri de tratament conexe
comprimate clorhidrat de clonidină, USP
antihipertensiv oral
comprimate de 0, 1 mg, 0, 2 mg și 0.3 mg
numai Rx
informații de prescriere
clonidină descriere
clorhidrat de clonidină, USP este un agent hipotensiv alfa-agonist cu acțiune centrală disponibil sub formă de comprimate pentru administrare orală în trei concentrații de dozare: 0, 1 mg, 0, 2 mg și 0, 3 mg. Comprimatul de 0,1 mg este echivalent cu 0,087 mg din baza liberă.
ingredientele inactive sunt dioxid de siliciu coloidal, amidon de porumb, fosfat de calciu dibazic, hidroxipropilceluloză, celuloză microcristalină, lactoză monohidrat și stearat de magneziu. În plus, 0.Comprimatele de 1 mg conțin FD &C Red No. 40, iar comprimatele de 0,2 mg și 0,3 mg conțin FD&C Yellow no.6 ca aditivi de culoare.
clorhidratul de clonidină este un derivat de imidazolină și există ca un compus mezomeric. Denumirea chimică este clorhidratul de 2-(2,6-diclorfenilamino)-2-imidazolină. Următoarea este formula structurală:
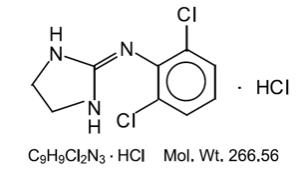
clorhidratul de clonidină este o substanță cristalină inodoră, amară, albă, solubilă în apă și alcool.
Clonidina – Farmacologie Clinică
Clonidina stimulează alfa-adrenoreceptorii din trunchiul cerebral. Această acțiune are ca rezultat scăderea fluxului simpatic din sistemul nervos central și scăderea rezistenței periferice, a rezistenței vasculare renale, a ritmului cardiac și a tensiunii arteriale. Comprimatele de clorhidrat de clonidină acționează relativ rapid. Tensiunea arterială a pacientului scade în decurs de 30 până la 60 de minute după o doză orală, scăderea maximă apărând în decurs de 2 până la 4 ore. Fluxul sanguin Renal și rata de filtrare glomerulară rămân în esență neschimbate. Reflexele posturale normale sunt intacte; prin urmare, simptomele ortostatice sunt ușoare și rare.
studiile Acute cu clorhidrat de clonidină la om au demonstrat o reducere moderată (15% până la 20%) a debitului cardiac în poziția culcat pe spate, fără modificări ale rezistenței periferice: la o înclinare de 45′ există o reducere mai mică a debitului cardiac și o scădere a rezistenței periferice. În timpul terapiei pe termen lung, debitul cardiac tinde să revină la valorile de control, în timp ce rezistența periferică rămâne scăzută. Încetinirea ritmului pulsului a fost observată la majoritatea pacienților cărora li s-a administrat clonidină, dar medicamentul nu modifică răspunsul hemodinamic normal la efort.
toleranța la efectul antihipertensiv poate să apară la unii pacienți, necesitând o reevaluare a tratamentului.
alte studii efectuate la pacienți au evidențiat o reducere a activității reninei plasmatice și a excreției aldosteronului și catecolaminelor. Relația exactă a acestor acțiuni farmacologice cu efectul antihipertensiv al clonidinei nu a fost pe deplin elucidată.
Clonidina stimulează acut eliberarea hormonului de creștere atât la copii, cât și la adulți, dar nu produce o creștere cronică a hormonului de creștere cu utilizare pe termen lung.
farmacocinetica
farmacocinetica clonidinei este proporțională cu doza în intervalul 100 până la 600 mcg. Biodisponibilitatea absolută a clonidinei la administrarea orală este de 70% până la 80%. Concentrațiile plasmatice maxime de clonidină sunt atinse în aproximativ 1 până la 3 ore.
după administrarea intravenoasă, Clonidina prezintă dispunere bifazică cu un timp de înjumătățire prin distribuție de aproximativ 20 minute și un timp de înjumătățire prin eliminare cuprins între 12 și 16 ore. Timpul de înjumătățire crește până la 41 de ore la pacienții cu insuficiență renală severă. Clonidina traversează bariera placentară. S-a demonstrat că traversează bariera hematoencefalică la șobolani.
după administrarea orală, aproximativ 40% până la 60% din doza absorbită este recuperată în urină sub formă de medicament nemodificat în 24 de ore. Aproximativ 50% din doza absorbită este metabolizată în ficat. Nici alimentele, nici rasa pacientului nu influențează farmacocinetica clonidinei.
efectul antihipertensiv este atins la concentrații plasmatice cuprinse între aproximativ 0, 2 și 2, 0 ng/mL la pacienții cu funcție excretoare normală. O creștere suplimentară a concentrațiilor plasmatice nu va spori efectul antihipertensiv.
indicații și utilizare pentru clonidină
comprimate de clorhidrat de clonidină, USP sunt indicate în tratamentul hipertensiunii. Comprimatele de clorhidrat de clonidină, USP pot fi utilizate singure sau concomitent cu alte medicamente antihipertensive.
contraindicații
comprimatele de clorhidrat de clonidină nu trebuie utilizate la pacienții cu hipersensibilitate cunoscută la clonidină (vezi precauții).
Atenționări
întrerupere
pacienții trebuie instruiți să nu întrerupă tratamentul fără consultarea medicului. Încetarea bruscă a tratamentului cu clonidină a dus, în unele cazuri, la simptome precum nervozitate, agitație, cefalee și tremor însoțite sau urmate de o creștere rapidă a tensiunii arteriale și concentrații crescute de catecolamină în plasmă. Probabilitatea unor astfel de reacții la întreruperea tratamentului cu clonidină pare să fie mai mare după administrarea unor doze mai mari sau continuarea tratamentului concomitent cu beta-blocante și, prin urmare, se recomandă prudență specială în aceste situații. Au fost raportate cazuri Rare de encefalopatie hipertensivă, accidente vasculare cerebrale și deces după întreruperea tratamentului cu clonidină. La întreruperea tratamentului cu clonidină, medicul trebuie să reducă treptat doza în decurs de 2 până la 4 zile pentru a evita simptomatologia de sevraj.
o creștere excesivă a tensiunii arteriale după întreruperea tratamentului cu clonidină poate fi inversată prin administrarea de clorhidrat de clonidină pe cale orală sau prin Fentolamină intravenoasă. Dacă tratamentul trebuie întrerupt la pacienții cărora li se administrează concomitent un beta-blocant și clonidină, beta-blocantul trebuie întrerupt cu câteva zile înainte de întreruperea treptată a clonidinei.
deoarece copiii au frecvent boli gastro-intestinale care duc la vărsături, aceștia pot fi deosebit de susceptibili la episoade hipertensive care rezultă din incapacitatea bruscă de a lua medicamente.
Precauții
General
la pacienții care au dezvoltat sensibilizare de contact localizată la clonidina transdermică, continuarea tratamentului cu clonidină transdermică sau înlocuirea tratamentului cu clorhidrat de clonidină orală poate fi asociată cu dezvoltarea unei erupții cutanate generalizate.
la pacienții care dezvoltă o reacție alergică la clonidina transdermică, înlocuirea clorhidratului de clonidină pe cale orală poate provoca, de asemenea, o reacție alergică (incluzând erupții cutanate generalizate, urticarie sau angioedem.)
acțiunea simpatolitică a clonidinei poate agrava disfuncția nodului sinusal și blocul atrioventricular (AV), în special la pacienții care iau alte medicamente simpatolitice. Există raportări după punerea pe piață a pacienților cu anomalii de conducere și/sau care iau alte medicamente simpatolitice care au dezvoltat bradicardie severă care necesită atropină IV, izoproterenol IV și ritm cardiac temporar în timpul tratamentului cu clonidină.
în hipertensiunea cauzată de feocromocitom, nu se poate aștepta niciun efect terapeutic al comprimatelor de clorhidrat de clonidină.
utilizare perioperatorie
administrarea comprimatelor de clorhidrat de clonidină trebuie continuată în decurs de patru ore de la operație și reluată cât mai curând posibil după aceea. Tensiunea arterială trebuie monitorizată cu atenție în timpul intervenției chirurgicale și, dacă este necesar, trebuie să fie disponibile măsuri suplimentare pentru controlul tensiunii arteriale.
informații pentru pacienți
pacienții trebuie avertizați împotriva întreruperii tratamentului cu clorhidrat de clonidină comprimate fără sfatul medicului.
deoarece pacienții pot prezenta un posibil efect sedativ, amețeli sau tulburări de acomodare în cazul utilizării clonidinei, atenționați pacienții cu privire la implicarea în activități precum conducerea unui vehicul sau utilizarea de aparate sau utilaje. De asemenea, informați pacienții că acest efect sedativ poate fi crescut prin utilizarea concomitentă de alcool, barbiturice sau alte medicamente sedative.
pacienții care poartă lentile de contact trebuie avertizați că tratamentul cu comprimate de clorhidrat de clonidină poate provoca uscăciunea ochilor.
interacțiuni medicamentoase
Clonidina poate potența efectele depresive ale SNC ale alcoolului, barbituricelor sau altor medicamente sedative. Dacă un pacient care primește clorhidrat de clonidină ia și antidepresive triciclice, efectul hipotensiv al clonidinei poate fi redus, necesitând o creștere a dozei de clonidină. Dacă un pacient care primește clonidină ia și neuroleptice, pot fi induse sau exacerbate tulburări de reglare ortostatică (de exemplu hipotensiune ortostatică, amețeli, oboseală).
monitorizarea frecvenței cardiace la pacienții cărora li se administrează clonidină concomitent cu medicamente despre care se știe că afectează funcția nodului sinusal sau conducerea nodului AV, de exemplu digitalice, blocante ale canalelor de calciu și beta-blocante. Bradicardia sinusală care a dus la spitalizare și inserarea stimulatorului cardiac a fost raportată în asociere cu utilizarea clonidinei concomitent cu diltiazem sau verapamil.
Amitriptilina în asociere cu clonidina îmbunătățește manifestarea leziunilor corneene la șobolani (vezi Toxicologie).
pe baza observațiilor efectuate la pacienții aflați în stare de delir alcoolic, s-a sugerat că dozele intravenoase mari de clonidină pot crește potențialul aritmogen (prelungirea intervalului QT, fibrilația ventriculară) al dozelor intravenoase mari de haloperidol. Relația de cauzalitate și relevanța pentru comprimatele orale de clonidină nu au fost stabilite.
Toxicologie
în mai multe studii cu clorhidrat de clonidină oral, s-a observat o creștere dependentă de doză a incidenței și severității degenerării retiniene spontane la șobolanii albinoși tratați timp de șase luni sau mai mult. Studiile de distribuție tisulară la câini și maimuțe au arătat o concentrație de clonidină în coroid.
având în vedere degenerarea retinei observată la șobolani, s-au efectuat examinări oculare în timpul studiilor clinice la 908 pacienți înainte și periodic după începerea tratamentului cu clonidină. La 353 dintre acești 908 pacienți, examinările oculare au fost efectuate pe perioade de 24 de luni sau mai mult. Cu excepția unor uscăciuni ale ochilor, nu au fost înregistrate descoperiri oftalmologice anormale legate de medicamente și, conform testelor specializate, cum ar fi electroretinografia și orbirea maculară, funcția retinei a rămas neschimbată.
în asociere cu amitriptilină, administrarea clorhidratului de clonidină a dus la apariția leziunilor corneene la șobolani în decurs de 5 zile.
carcinogeneza, mutageneza, afectarea fertilității
administrarea cronică în dietă a clonidinei nu a fost carcinogenă la șobolani (132 săptămâni) sau șoareci (78 săptămâni) cărora li s-au administrat doze de până la 46 sau 70 de ori mai mari decât doza zilnică maximă recomandată la om, în mg/kg (de 9 sau 6 ori mai mari decât MDRD în mg/m2). Nu au existat dovezi de genotoxicitate în testul Ames pentru mutagenitate sau testul micronucleilor de șoarece pentru clastogenitate.
fertilitatea șobolanilor masculi sau femele nu a fost afectată de doze de clonidină de până la 150 mcg/kg (de aproximativ 3 ori MRDHD). Într-un experiment separat, fertilitatea șobolanilor femele părea să fie afectată la niveluri de doză de 500 până la 2000 mcg/kg (de 10 până la 40 de ori MRDHD oral pe bază de mg/kg; de 2 până la 8 ori MRDHD pe bază de mg/m’.)
sarcina
efecte teratogene: sarcina categoria C. Studiile asupra funcției de reproducere efectuate la iepuri la doze de până la aproximativ 3 ori mai mari decât doza zilnică maximă recomandată orală la om (MRDHD) de comprimate de clorhidrat de clonidină nu au evidențiat un potențial teratogen sau embriotoxic la iepuri. Cu toate acestea, la șobolani, doze de până la 1/3 CMDR oral (1/15 CMDR raportat la mg/m2) de clonidină au fost asociate cu resorbții crescute într-un studiu în care barajele au fost tratate continuu cu 2 luni înainte de împerechere. Resorbțiile crescute nu au fost asociate cu tratamentul în același timp sau la doze mai mari (de până la 3 ori MRDHD oral) atunci când barajele au fost tratate în zilele de gestație 6 până la 15. S-au observat creșteri ale resorbției la doze mult mai mari (de 40 de ori mai mari decât MDRD pe cale orală, în mg / kg; De 4 până la 8 ori MRDHD pe bază de mg/m2) la șoareci și șobolani tratați în zilele de gestație 1 până la 14 (cea mai mică doză utilizată în studiu a fost de 500 mcg/kg).
nu s-au efectuat studii adecvate, bine controlate la femeile gravide. Clonidina traversează bariera placentară (vezi farmacologie clinică, farmacocinetică). Deoarece studiile de reproducere la animale nu sunt întotdeauna predictive pentru răspunsul uman, acest medicament trebuie utilizat în timpul sarcinii numai dacă este clar necesar.
mamele care alăptează
deoarece clorhidratul de clonidină este excretat în laptele uman, se recomandă prudență atunci când comprimatele de clorhidrat de clonidină sunt administrate unei femei care alăptează.
utilizare pediatrică
siguranța și eficacitatea la pacienții pediatri nu au fost stabilite în studii adecvate și bine controlate (vezi avertismente, retragere).
reacții Adverse
cele mai multe reacții adverse sunt ușoare și tind să se diminueze odată cu continuarea tratamentului. Cele mai frecvente (care par a fi legate de doză) sunt uscăciunea gurii, care apare la aproximativ 40 din 100 de pacienți; somnolență, aproximativ 33 din 100; amețeli, aproximativ 16 din 100; constipație și sedare, fiecare aproximativ 10 din 100.
următoarele reacții adverse mai puțin frecvente au fost, de asemenea, raportate la pacienții care au primit comprimate de clorhidrat de clonidină, dar în multe cazuri pacienții au primit medicamente concomitente și nu a fost stabilită o relație de cauzalitate.
corpul în ansamblu: oboseală, febră, cefalee, paloare, slăbiciune și sindrom de sevraj. De asemenea, au fost raportate un test Coombs slab pozitiv și o sensibilitate crescută la alcool.
cardiovasculare: Bradicardie, insuficiență cardiacă congestivă, anomalii electrocardiografice (adică stoparea nodului sinusal, bradicardie joncțională, bloc AV de grad înalt și aritmii), simptome ortostatice, palpitații, fenomen Raynaud, sincopă și tahicardie.
au fost raportate cazuri de bradicardie sinusală și bloc atrioventricular, atât cu cât și fără utilizarea concomitentă de digitalis.
Sistemul Nervos Central: Agitație, anxietate, delir, percepție delirantă, halucinații (inclusiv vizuale și auditive), insomnie, depresie mentală, nervozitate, alte modificări comportamentale, parestezii, neliniște, tulburări de somn și vise vii sau coșmaruri.
dermatologic: alopecie, edem angioneurotic, urticarie, prurit, erupție cutanată și urticarie.
gastro-intestinale: dureri abdominale, anorexie, constipație, hepatită, stare generală de rău, anomalii tranzitorii ușoare ale testelor funcției hepatice, greață, parotită, pseudo-obstrucție (inclusiv pseudo-obstrucție a colonului), dureri ale glandelor salivare și vărsături.
genito-urinar: scăderea activității sexuale, dificultate în micțiune, disfuncție erectilă, pierderea libidoului, nocturie și retenție urinară.
Hematologic: Trombocitopenie.
metabolice: ginecomastie, creșterea tranzitorie a glicemiei sau a creatinfosfokinazei serice și creșterea în greutate.
musculo-scheletice: crampe la nivelul picioarelor și dureri musculare sau articulare.
Oro-otolaringeal: uscăciunea mucoasei nazale.
oftalmologic: tulburări de acomodare, vedere încețoșată, arsură a ochilor, scăderea lacrimării și uscăciunea ochilor.
supradozaj
hipertensiunea arterială se poate dezvolta precoce și poate fi urmată de hipotensiune arterială, bradicardie, deprimare respiratorie, hipotermie, somnolență, reflexe scăzute sau absente, slăbiciune, iritabilitate și mioză. Frecvența depresiei SNC poate fi mai mare la copii decât la adulți. Supradozele mari pot duce la defecte reversibile de conducere cardiacă sau disritmii, apnee, comă și convulsii. Semnele și simptomele supradozajului apar în general în decurs de 30 de minute până la două ore după expunere. Doar 0,1 mg de clonidină a produs semne de toxicitate la copii.
nu există un antidot specific pentru supradozajul cu clonidină. Supradozajul cu clonidină poate duce la dezvoltarea rapidă a depresiei SNC; de aceea, nu se recomandă inducerea vărsăturilor cu sirop de ipecac. Lavajul Gastric poate fi indicat în urma ingerărilor recente și / sau mari. Administrarea cărbunelui activ și / sau a unui cathartic poate fi benefică. Tratamentul de susținere poate include sulfat de atropină pentru bradicardie, fluide intravenoase și/sau agenți vasopresori pentru hipotensiune și vasodilatatoare pentru hipertensiune. Naloxona poate fi un adjuvant util pentru tratamentul depresiei respiratorii, hipotensiunii arteriale și/sau comei induse de clonidină; tensiunea arterială trebuie monitorizată deoarece administrarea naloxonei a dus ocazional la hipertensiune paradoxală. Administrarea tolazolinei a dat rezultate inconsistente și nu este recomandată ca terapie de primă linie. Este puțin probabil ca dializa să sporească semnificativ eliminarea clonidinei.
cea mai mare supradoză raportată până în prezent a implicat un bărbat de 28 de ani care a ingerat 100 mg de pulbere de clorhidrat de clonidină. Acest pacient a dezvoltat hipertensiune arterială urmată de hipotensiune arterială, bradicardie, apnee, halucinații, semicom și contracții ventriculare premature. Pacientul sa recuperat complet după un tratament intensiv. Concentrațiile plasmatice de clonidină au fost de 60 ng/mL după 1 oră, 190 ng/mL după 1,5 ore, 370 ng/mL după 2 ore și 120 ng / mL după 5,5 și 6,5 ore. La șoareci și șobolani, LD50 oral al clonidinei este de 206 și, respectiv, 465 mg/kg.
dozare și administrare de clonidină
adulți
doza de comprimate de clorhidrat de clonidină trebuie ajustată în funcție de răspunsul individual al tensiunii arteriale al pacientului. Următorul este un ghid general pentru administrarea sa.
doza inițială
0,1 mg comprimat de două ori pe zi (dimineața și înainte de culcare). Pacienții vârstnici pot beneficia de o doză inițială mai mică.
doza de întreținere
creșteri suplimentare de 0, 1 mg pe zi pot fi făcute la intervale săptămânale, dacă este necesar, până când se obține răspunsul dorit. Administrarea porțiunii mai mari a dozei zilnice orale la culcare poate reduce la minimum efectele tranzitorii de ajustare ale uscăciunii gurii și somnolenței. Dozele terapeutice utilizate cel mai frecvent au variat între 0,2 mg și 0,6 mg pe zi, administrate în doze divizate.
studiile au indicat că doza zilnică maximă eficace este de 2,4 mg, dar rareori au fost utilizate doze atât de mari ca aceasta.
insuficiență renală
pacienții cu insuficiență renală pot beneficia de o doză inițială mai mică. Pacienții trebuie monitorizați cu atenție. Deoarece numai o cantitate minimă de clonidină este eliminată în timpul hemodializei de rutină, nu este necesară administrarea de clonidină suplimentară după dializă.
cum se administrează Clonidina
comprimate clorhidrat de clonidină, USP sunt furnizate după cum urmează:
0,1 mg: un comprimat roz, sub forma ” 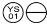 „.
„.
NDC 58657-647-01 (flacon de 100)
NDC 58657-647-50 (flacon de 500)
NDC 58657-647-10 (flacon de 1000)
0, 2 mg: un comprimat portocaliu, în formă de ” 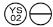 „.
„.
NDC 58657-648-01 (flacon de 100)
NDC 58657-648-50 (flacon de 500)
NDC 58657-648-10 (flacon de 1000)
0, 3 mg: un comprimat portocaliu deschis, sub forma ” 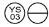 „.
„.
NDC 58657-649-01 (Sticlă de 100)
NDC 58657-649-50 (Sticlă de 500)
NDC 58657-649-10 (Sticlă de 1000)
Magazin la 25°C (77°F); excursii permise la 15°C-30°C (59°F-86°F) . Se distribuie într-un recipient etanș, rezistent la lumină.
fabricat de:
Yung Shin Pharmaceutical Ind. Co., Ltd.
Tachia, Taichung 43769
TAIWAN
distribuit de:
metoda Pharmaceuticals, LLC
7333 Jack Newell Blvd. Nord, Suite 300
Fort Worth, Texas 76118
pentru a raporta experiența de droguri ADVERSE, vă rugăm să sunați metoda farmaceutice la 1-877-250-3427
revizuit: 06/20
panoul principal de afișare
NDC 58657-647-10
clonidină
clorhidrat
comprimate, USP
0,1 mg
numai RX
1000 comprimate

panoul principal de afișare
NDC 58657-648-10
clonidină
clorhidrat
comprimate, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| clorhidrat de clonidină comprimat de clorhidrat de clonidină |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| clorhidrat de clonidină comprimat de clorhidrat de clonidină |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-metoda Pharmaceuticals, LLC (060216698)
mai multe despre clonidină
- efecte secundare
- în timpul sarcinii sau alăptării
- informații privind dozajul
- Sfaturi pentru pacienți
- imagini medicamentoase
- interacțiuni medicamentoase
- comparați alternativele
- grupul de sprijin
- prețuri& cupoane
- 619 recenzii
- clasa de medicamente: agenți antiadrenergici, cu acțiune centrală
- alerte FDA (1)
resurse pentru consumatori
- informații pentru pacienți
- … +5 mai
resurse profesionale
- informații de prescriere
- clonidină (sfaturi profesionale pentru pacienți)
- comprimate cu eliberare prelungită de clonidină (FDA)
- injecție de clonidină (FDA)
- plasture de clonidină (FDA)
- comprimate de clonidină (FDA)
alte mărci Catapres, kapvay, Catapres-TTS, Duraclon, Nexiclon XR
ghiduri de tratament conexe
- anxietate
- ADHD
- retragerea alcoolului
- fibrilație atrială
- … + 19 mai mult
Disclaimer Medical