rezumat
cardiomiopatia cirotică este o afecțiune recunoscută recent constând în disfuncție miocardică manifestată la pacienții cirotici în absența bolii cardiace anterioare. Mecanismele patogenetice subiacente includ un mediu” miocardiotoxic ” care duce la un răspuns cardiac tocit la stres, fizic sau farmacologic. Această afecțiune este acum mai bine înțeleasă și poate fi diagnosticată susținută clinic, prin criterii de electrocardiografie de laborator și ecocardiografie. Din punct de vedere clinic, incompetența sistolică este cea mai evidentă atunci când pacienții cirotici sunt plasați sub stres, fizic sau farmacologic. În ciuda faptului că este bine înțeles, există o lipsă de cunoștințe pentru o aplicare practică adecvată. Rapoartele recente de caz au sugerat că CCM trebuie tratat devreme, deoarece poate fi un factor declanșator pentru complicațiile cirozei. Sunt necesare studii pentru a identifica tratamentele potențiale care modifică istoricul natural al bolilor de inimă la pacienții cirotici, în special în fazele în care pacienții sunt asimptomatici.
cuvinte cheie
ciroză hepatică, insuficiență cardiacă, cardiomiopatie
Introducere
cardiomiopatia cirotică (CCM) este o disfuncție cardiacă caracterizată prin răspuns contractil suboptimal la stres și funcție diastolică afectată în absența bolii cardiace anterioare . În zilele noastre, cercetările au propus că pacienții cirotici au o disfuncție cardiacă intrinsecă care poate influența dezvoltarea insuficienței renale în boala hepatică avansată .
din 2002, constatările despre disfuncția circulatorie în bolile hepatice au evoluat prin metode de diagnostic, subliniind importanța identificării CCM în practica clinică . Cu toate acestea, există încă un decalaj de cunoștințe în ceea ce privește gestionarea acestei condiții . Prezența disfuncției miocardice în ciroză crește riscul de sindrom hepatorrenal (HRS) și evenimente cardiace adverse și este legată de o mortalitate mai mare .
am analizat literatura de specialitate disponibilă în PubMed cu privire la markerii complicațiilor cirozei și interacțiunile inimii și ficatului. Scopul acestei revizuiri este de a discuta despre necesitatea de a urmări și trata precoce CCM, deoarece poate fi un factor declanșator pentru complicațiile cirozei, aducând astfel noi perspective în practica clinică.
definiție și prevalență
CCM descrie disfuncția cronică cardiacă la pacienții cirotici, în ciuda lipsei unei boli cardiace structurale anterioare . Este definit de una sau mai multe dintre următoarele: anomalii structurale în camerele cardiace; disfuncție diastolică; funcție sistolică normală sau mărită în repaus, dar răspuns contractil slab la stres; și modificări electrofiziologice . Aceste anomalii pot fi observate la până la 50% dintre pacienții cirotici .
Fiziopatologie
ciroză fiziopatologia este cunoscută prin supraproducția de oxid nitric (NO) în vasele splanchnice și vasodilatația sistemică consecutivă. Acest mecanism declanșează activarea sistemului rennină-angiotensină-aldosteron (RAAS) și a sistemului nervos simpatic și crește nivelul seric de vasopresină, ducând la o stare hiperdinamică care poate repercuta de la setările celulare la cele clinice.
acești pacienți prezintă o creștere a monoxidului seric de carbon (CO) secundar hiperactivității simpatice și citokinelor inflamatorii. Există o creștere a CO, asociată cu niveluri ridicate de NO, acumularea de endocanabinoide și alte vasodilatatoare. Aceste substanțe cresc nivelurile ciclice de guanozin monofosfat (cGMP), care inhibă adenozin monofosfatul ciclic (cAMP) în cardiomiocite, responsabile de afluxul de calciu și de o forță contractilă mai mare (figura 1,2) . Analiza celulelor miocardice arată o reducere a fluidității membranei plasmatice datorită depunerii colesterolului, ceea ce îngreunează interacțiunea substanțelor precum receptorii beta-adrenergici și proteinele G. Miocitul ventricular poate avea, de asemenea, o scădere a funcției canalelor de potasiu, ceea ce duce la o relaxare cardiacă suboptimă și disfuncție diastolică în consecință .
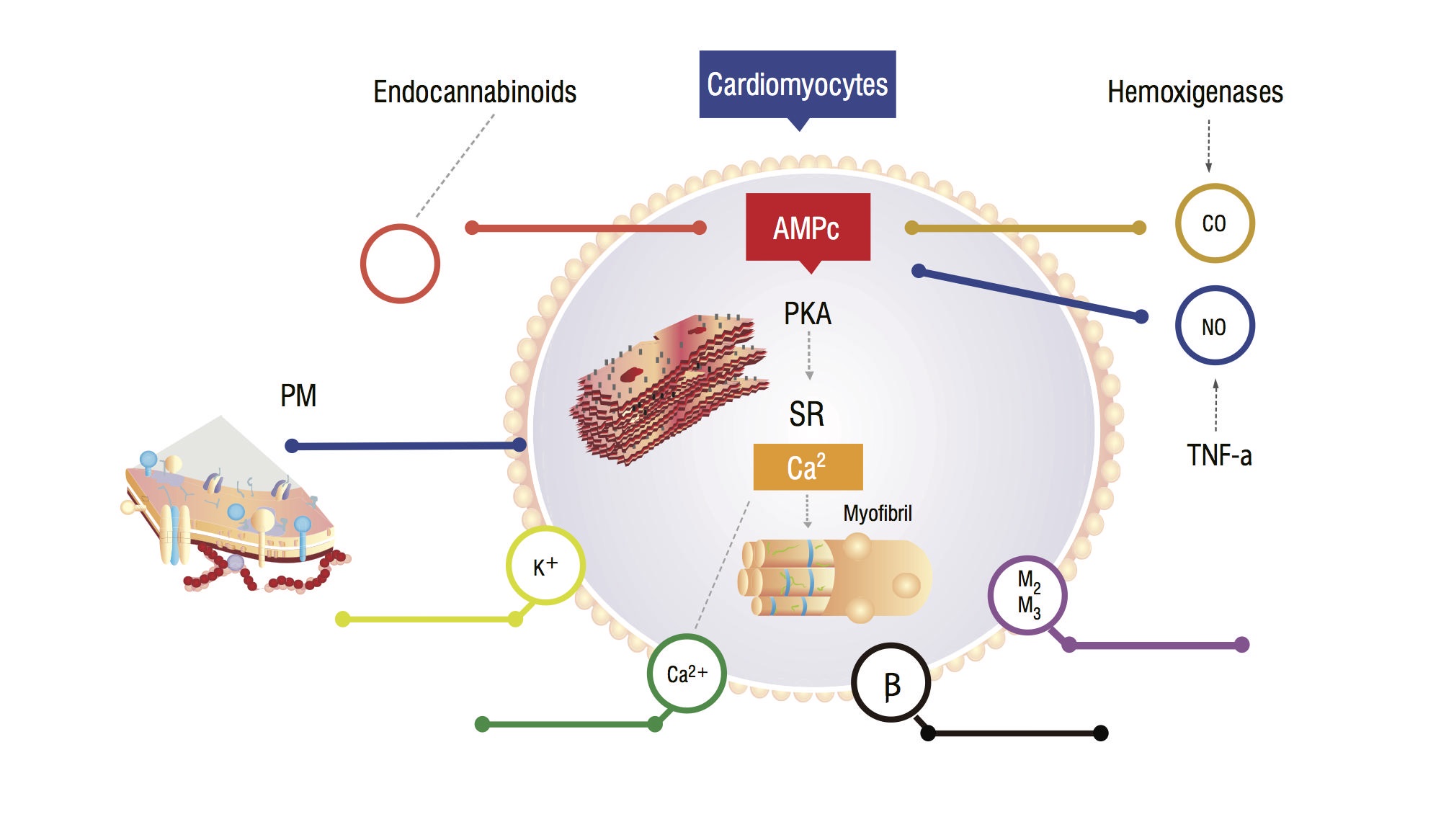
Figura 1. Modelul fiziopatologic al cardiomiocitelor care prezintă principalele căi de semnalizare care conduc la un răspuns miocardic blunded la stres. PM: membrană plasmatică; CO: oxid de Carbon; NO: oxid Nitric; TNF-a: factor de necroză tumorală alfa; SR: reticul Sarcoplasmatic; AMPc: adenozin monofosfat ciclic; PKA: Protein kinază A.
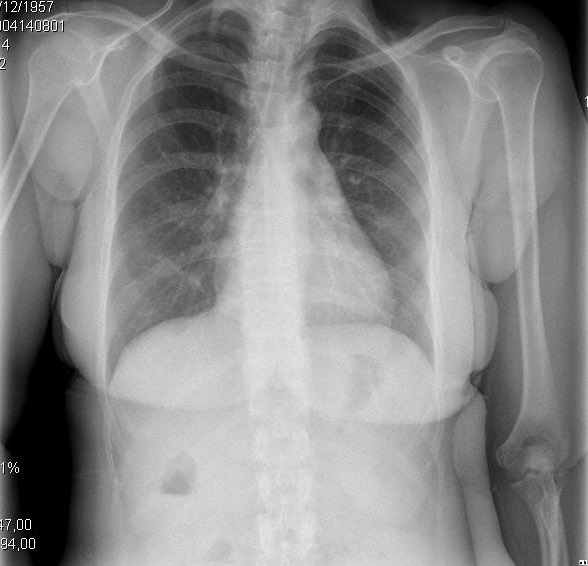
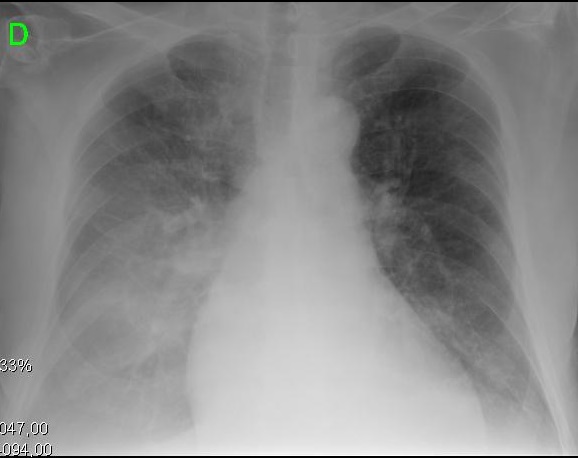
Figura 2. Prezentări clinice și radiologice ale diferitelor stadii evolutive ale cardiomiopatiei cirotice. A. imaginea din stânga prezintă efuziune pleurală mică și CTI de 0,50. B. imaginea din dreapta prezintă o congestie pulmonară severă și CTI de 0,67.
Tabelul 1. Criterii clinice și complementare pentru diagnosticul CCM. Adaptat de la referință 29 cu permisiune.
stimulii beta-adrenergici persistenți induc reglarea în jos și reduc densitatea receptorilor cardiaci, modificând cascadele de semnalizare responsabile de activarea canalului de calciu ; rezultatul este o funcție contractilă afectată . Repercusiunea clinică a acestei căi este o funcție miocardică tocită și o creștere a biomarkerilor cardiaci .
identificarea CCM se bazează pe caracteristici clinice subtile care pot fi demascate pe măsură ce boala progresează sau pot deveni clar evidente în scenarii clinice specifice de tulpină și devine o provocare cu privire la dacă și când să se trateze.
istoricul Natural și diagnosticul
criteriile de Diagnostic sunt rezumate în tabelul 1 și se bazează pe clinice, imagistice și biomarkeri.
caracteristici clinice
caracteristicile clinice ale CCM pot apărea la pacienții cu o funcție cardiacă aparent normală, deoarece adaptarea cronică a cardiomiocitelor la mediul cirotic duce la toate aceste modificări celulare .
pacienții cirotici evoluează cu retenție de sodiu și lichide, vasodilatație periferică, hiperactivitate simpatică și acumulare de substanțe „miocardiotoxice”, necesitând un proces adaptiv de cardiomiocite. Acest echilibru continuu poate fi rupt și demasca o insuficiență cardiacă latentă în situații de stres, cum ar fi transplantul de ficat, șuntul portosistemic intrahepatic transjugular sau infecțiile .
deși cardiomiopatia cirotică tinde să fie o afecțiune cronică, studiile arată că semnele clinice ale disfuncției miocardice se pot inversa până la 15 luni după transplantul de ficat reușit, precum și prelungirea QT .
constatări de laborator
deoarece disfuncția cardiacă poate fi reflectată de biomarkerii inflamatori, markerii cardiaci și proinflamatori noi sunt studiați recent și corelați cu dezvoltarea complicațiilor care duc la creșterea mortalității .
studii recente descriu corelația dintre nivelurile de pro-hormon al ANP (proANP) și peptida natriuretică de tip B (BNP), copeptina și troponina T de înaltă sensibilitate (HS-TnT), precum și receptorul activator de plasminogen solubil de tip urokinază (suPAR) și proteina C reactivă sensibilă (hs-CRP) și complicațiile cardiovasculare în ciroză. Cu toate acestea, utilizarea sa clinică este încă evaluată .
peptidele natriuretice sunt secretate de cardiomiocite ca răspuns la supraîncărcarea volumului sau presiunii sau ischemia miocardică, pentru a compensa efectul RAAS în echilibrul de sodiu și apă . BNP poate fi unul dintre cei mai disponibili biomarkeri care permite o recunoaștere timpurie a implicării cardiace . Concentrația serică este mai mare cu cât sunt mai severe bolile hepatice și cardiace .
studiile promițătoare afirmă că nivelurile ridicate de adrenomedullin sunt observate și în ciroză cu sau fără implicare cardiacă clinică; această substanță este eliberată în fluxul sanguin pentru a acționa ca un vasodilatator și are ca scop reducerea încărcăturii ulterioare . Galectina-3, cel mai recent biomarker studiat crescut la pacienții cirotici, a fost asociat cu fibroza miocardică și se poate corela cu severitatea cirozei. Acest marker se dovedește a fi mai sensibil decât BNP în evaluarea disfuncției diastolice, deși este mai puțin specific .
electrocardiograma
anomaliile electrocardiografice (ECG) pot fi observate precoce la un pacient cu CMC asimptomatic și se pot corela cu aritmii ventriculare și moarte subită . Cea mai frecventă constatare ECG este prelungirea intervalului QT, care poate fi observată la aproximativ 30-40% dintre pacienții cirotici, în principal Child-Pugh B sau C, indiferent de etiologia cirozei .
acest model ECG poate fi secundar anomaliilor de repolarizare a cardiomiocitelor în canalele de potasiu și reducerea concentrației acestor canale în membrana plasmatică, ca răspuns la modificări minore ale presiunii portale . Disfuncțiile canalelor ionice determină astfel prelungirea potențialului de acțiune al celulelor miocardice, rezultând sistol ventricular mai lung și QT . Timpul de contracție mai lung implică relaxarea afectată, provocând disfuncție diastolică .
decuplarea electromecanică este descrisă ca o disincronie între stimulul electric și răspunsul mecanic sistolic al inimii, ducând la pierderea progresivă a funcției miocardice și insuficiența cardiacă congestivă1 la acești pacienți . Incompetența cronotropă se caracterizează prin incapacitatea nodului sinusal de a răspunde la stimuli fiziologici sau farmacologici , fapt determinant în fiziopatologia CCM. Aceste modificări sunt, de asemenea, secundare hipertensiunii portale, disfuncției autonome, circulației hiperdynamice și prezenței factorilor proinflamatori care afectează miocardul pacientului .
ecocardiograma
ecocardiograma oferă date relevante despre funcția cardiacă și este utilizată ca criterii de diagnostic pentru cardiomiopatia cirotică .
principalele constatări la acești pacienți sunt mărirea ventriculului stâng diastolic (LV), reducerea vitezei maxime și a ratei de deformare sistolică; creșterea presiunii ventriculare stângi diastolice finale, fără o expansiune adecvată a LVEF. Extinderea atriului stâng (LA) Pentru mai mult de 34 mL/m2poate sugera disfuncție diastolică cronică și, atunci când este asociată cu reducerea masei LV, poate sugera un prognostic mai rău . La evaluarea se poate face prin ecocardiografie cu două dimensiuni și urmărirea petelor .
constatările frecvente observate în ecocardiografia Doppler cardiacă indică afectarea relaxării miocardice la pacienții cirotici: scăderea raportului E / A (<1) și timpul de decelerare a undei e prelungit (DT) și timpul de relaxare izovolumetric (IVRT) > 80ms .Cu cât este mai severă disfuncția diastolică, mai scurtă este IVRT și DT mitrală și mai mare este raportul de viteză E/A, care caracterizează disfuncția diastolică avansată, presiunea crescută LA și clasa funcțională mai slabă.
studii recente cu evaluarea tulpinii longitudinale globale (GLS) arată că aceasta poate fi o metodă utilă pentru depistarea precoce a disfuncției cardiace la pacienții cirotici, în principal disfuncția sistolică în repaus .
raportul E/A poate fi un parametru fiabil în diagnosticul disfuncției diastolice la pacienții cirotici, chiar și cu valori influențate de gradul de hidratare al pacientului, deși poate varia din cauza ascitei și a supraîncărcării volumului . Între timp, timpul de relaxare izovolumetric, deși foarte sensibil, nu reprezintă umplerea LV și variază pe măsură ce ritmul cardiac se schimbă .
o disfuncție sistolică ușoară și o disfuncție diastolică pot fi prezentate independent de gradul de ciroză. Cu toate acestea, disfuncția diastolică se găsește cel mai frecvent la pacienții cirotici și, în general, o precede pe prima .
discuție
această analiză abordează o identificare și înțelegere crescândă a fiziopatologiei pe CCM, corelarea cu prognosticul slab la pacienții cirotici și apare îngrijorarea cu privire la abordarea terapeutică.
acest articol a rezumat criteriile de diagnostic (Tabelul 1) deja stabilite în literatura medicală, cu accent pe noii biomarkeri care au fost studiați pentru completarea diagnosticului. Studiile au arătat că disfuncția miocardică există în diferite stadii ale cirozei hepatice. S-a descris că, dacă pacientul are BNP ridicat și disfuncție ventriculară pe ecocardiogramă, tratarea insuficienței renale este foarte dificilă; pe de altă parte, intervenția timpurie la pacienții care nu au încă boli de inimă este o zonă care nu a fost încă explorată.
Tabelul 1. Criterii clinice și complementare pentru diagnosticul CCM. Adaptat de la referință 29 cu permisiune.
caracteristici clinice
fără simptome cardiopulmonare în repaus
rezervă cardiacă funcțională scăzută
stare Hiperadrenergică cu retenție de sodiu și lichide
biomarkeri (troponina I, pro-BNP și BNP, altele)
Eletrocardiografie
anomalii electrofiziologice (prelungirea intervalului QT și altele)
criterii ecocardiografice
evaluare diastolică
raport E/A <1.0 (vârsta corectată)
timp de relaxare izovolumic prelungit (> 80msec)
timp de decelerare prelungit (> 200msec)
hipertrofia ventriculară stângă
evaluarea sistolică
fracția de ejecție în repaus < 55%
deficit contractil în stres
semnele și simptomele insuficienței hepatice tind să fie târzii, cu manifestări clinice și de laborator subtile, uneori dificil de interpretat. Specialistul, sau chiar medicul generalist, se poate confrunta cu un pacient cu plângere de dispnee, fără umflare jugulară patologică, examene cardiologice inițiale normale, dar cu BNP ridicat, care poate reprezenta un caz de CCM.
spre deosebire de alte studii, grupul nostru propune un progres în acest domeniu, deoarece înțelegerea bolilor de inimă concomitente cu ciroza poate permite o intervenție terapeutică timpurie a complicațiilor atribuibile insuficienței miocardice nediagnosticate. Transplantul hepatic și sfaturile sunt setări clinice speciale care pot deflagra insuficiența cardiacă la acești pacienți. Pe măsură ce pacienții supraviețuiesc mai mult după aceste proceduri, clinicienii s-ar confrunta cu agravarea parametrilor cardiaci .
considerăm că intervenția terapeutică timpurie în CCM este promițătoare, atunci când se manifestă prin complicații precum HRS refractar, înainte de a prezenta congestie pulmonară clară atribuibilă insuficienței miocardice. Literatura susține că situațiile de stres fizic sau farmacologic sau infecțiile asociate cardiomiopatiei cirotice latente pot duce la HRS, care pot fi refractare la tratamentele convenționale și asociate cu un prognostic mai rău dacă este prezentă disfuncția sistolică .
experiența noastră sugerează că prezentarea HRS este un indiciu pentru inițierea tratamentului componentei miocardice. Această progresie către HRS este înțeleasă deoarece existența CCM este un factor declanșator și perpetuant al HRS, deci dacă CCM este abordat devreme în acest context, HRS poate avea un prognostic mai bun .
grupul nostru a fost pionier în tratamentul pacienților cu diagnostic clinic de CCM în progresie spre SHR refractar la tratamentele convenționale, în care utilizarea dobutaminei ca terapie de salvare pentru funcția renală a avut succes. Scopul este de a aplica aceste cunoștințe teoretice anticipând această complicație la pacienții cu boală hepatică în stadiu final .
în ciuda faptului că este bine înțeles, există o lipsă de cunoștințe pentru o aplicare practică adecvată. Un grad ridicat de suspiciune clinică este necesar pentru a recunoaște CCM la pacientul asimptomatic, fără limitări funcționale aparente, dar cu boli cardiace celulare și structurale subclinice.
sunt necesare studii pentru identificarea tratamentelor potențiale care modifică istoricul natural al bolilor de inimă la pacienții cirotici, în special în fazele în care pacienții sunt asimptomatici. Aceasta reprezintă un domeniu de cunoaștere care nu a fost încă explorat, în special în ceea ce privește opțiunile terapeutice viitoare.
conflicte de interese
autorii au declarat că nu există conflicte de interese în ceea ce privește publicarea acestei lucrări.
sprijin financiar
niciuna.
- Sampaio F, Pimenta J (2016) evaluarea funcției ventriculului stâng în ciroză: metode actuale și direcții viitoare. Lumea J Gastroenterol 22: 112-125.
- Shin WJ, Song JG, Jun IG, Moon YJ, Kwon HM și colab. (2016) efectul cuplării ventriculo-arteriale asupra rezultatelor transplantului la cirotici: analiza relațiilor curbei presiune-volum. J Hepatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H și colab. (2016) disfuncția diastolică în ciroza hepatică: Predictor Prognostic în transplantul hepatic? Transplant Proc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, și colab. (2016) supraviețuirea la 2 ani în rândul pacienților cu ciroză hepatică este influențată de volumul atriului stâng și de masa ventriculului stâng. Ficat Int.
- m Okticller s, Henriksen JH (2002) cardiomiopatie cirotică: o revizuire fiziopatologică a disfuncției circulatorii în bolile hepatice. Inimă 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, și colab. (2016) cardiomiopatie cirotică: un alt caz de abordare reușită a tratamentului sindromului Hepatorenal. Caz Rep Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) o perspectivă asupra cardiomiopatiei cirotice. Transplant Proc 43: 1649-1653.
- Ma Z, Lee SS (1996) cardiomiopatie cirotică: a ajunge la inima problemei. Hepatologie 24: 451-459.
- Zardi EM, Abbate a, Zardi DM, Dobrina a, Margiotta D și colab. (2010) cardiomiopatie cirotică. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) cardiomiopatie cirotică și transplant hepatic. Ficat Transpl 6: S44-52.
- Wiese S, Mortensen C, G Inktze jp, Christensen e, Andersen O, și colab. (2014) markerii cardiaci și proinflamatori prezic prognosticul în ciroză. Ficat Int 34: e19-30.
- Fattouh am, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) evaluarea funcțiilor cardiace ale copiilor cirotici utilizând peptida natriuretică a creierului seric și imagistica Doppler tisulară. Ann Pediatr Cardiol 9: 22-8.
- Rahman s, Mallett S V (2015) cardiomiopatie cirotică?: Implicații pentru managementul perioperator al pacienților cu transplant hepatic 7: 507-20.
- Farr M, Schulze PC (2015) progrese recente în diagnosticul și gestionarea cardiomiopatiei asociate cirozei la candidații la transplantul de ficat: imagistică ecou avansată, biomarkeri cardiaci și terapie avansată cu insuficiență cardiacă. Clin Med Insights Cardiol 8: 67-74.
- Licata a, Corrao S, Petta S, Genco C, Cardillo M și colab. (2013) nivelul plasmatic NT Pro BNP și volumul atrial sunt legate de severitatea cirozei hepatice. PLoS Unul 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA și colab. Galactina – 3 și peptida natriuretică a creierului față de ecocardiografia convențională în detectarea precoce a cardiomiopatiei cirotice. Turk J Gastroenterol 27: 367-74.
- Wong F, Siu s, Liu P, Blendis lm (2001) peptida natriuretică a creierului: este un predictor al cardiomiopatiei în ciroză? Clin Sci (Lond) 101: 621-628.
- Wong F (2009) cardiomiopatie cirotică. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, și colab. (2003) prelungirea intervalului QTc la pacienții cu ciroză. Ann Gastroenterol 16: 155-8.
- Mozos I (2015) risc de aritmie în ciroza hepatică. Lumea J Hepatol 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, și colab. (2016) cardiomiopatie cirotică: un alt caz de abordare reușită a tratamentului sindromului Hepatorenal. Caz Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) dispersia QT: măsurare și interpretare.
- P Okticll A, Czifra A, vit Okticlis Z, Papp M, Paragh G și colab. (2014) abordare fiziopatologică și clinică a cardiomiopatiei cirotice. J Gastrointestin Ficat Dis 23: 301-310.
- Castro Hevia J, Antzelevitch C, Torn Xixt B Xixtrzaga F, Dorantes s Xixtnchez m, Dortic Xixt Bâlea F, și colab. (2006) dispersia Tpeak-Tender și Tpeak-Tender ca factori de risc pentru tahicardia ventriculară/fibrilația ventriculară la pacienții cu sindrom Brugada. J Am Coll Cardiol 47 (9): 1828-34.
- Demir c, Demir M (2013) evaluarea intervalului Tp-e și a raportului Tp-e/QT la pacienții cu hepatită cronică B. Praga Med Rep 114: 239-245.
- Jewell DP (2006) pacienți noi, lecții noi, gândire nouă în boala inflamatorie intestinală: Simpozionul Congresului Mondial de Gastroenterologie, Montreal, Canada. Dis Colorectal 8 Suppl 1(s1): 1-2.
- Gassanov n, Caglayan E, Semmo n, Massenkeil G, Er F (2014) cardiomiopatie cirotică: perspectiva unui cardiolog. Lumea J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) cardiomiopatie cirotică: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.