materiał genetyczny jest przechowywany wewnątrz komórek w strukturach zwanych chromosomami, które mają powtarzającą się sekwencję znaną jako telomer na każdym końcu. Wyspecjalizowane białka wiążą się z tymi sekwencjami, tworząc ochronną „czapkę”, która chroni chromosom i zapobiega jego fuzji z innymi chromosomami. Enzym telomeraza pomaga również utrzymać chromosomy poprzez dodawanie powtarzalnych sekwencji DNA do końców telomerów.
jedną z najszerzej badanych cząsteczek zamykających jest białko zwane Cdc13, które wiąże się z pewnymi typami jednoniciowego DNA w pączkujących drożdżach i tworzy kompleks z dwoma innymi białkami (Stn1 i Ten1), który rekrutuje telomerazę (Wellinger and Zakian, 2012). Kilka linii dowodów sugeruje, że ten kompleks CST rekrutuje również enzym do replikacji DNA o nazwie primase-Pola i może regulować aktywność tego enzymu na końcach chromosomów ,a także inne lokalizacje w genomie (Giraud-Panis et al., 2010; Price et al., 2010; Barbero Barcenilla i Shippen, 2019).
podobne kompleksy zostały również zidentyfikowane u innych eukariotów, w tym ssaków, które zawierają Stn1, Ten1 i inne białko zwane CTC1 w ich kompleksie CST (Giraud-Panis et al., 2010; Price et al., 2010). Okazało się jednak trudne, aby wypracować role wykonywane przez różne białka w kompleksie CST, ponieważ komórki, którym brakuje tylko jednego z tych białek, walczą o przetrwanie (rysunek 1a). Teraz, w eLife, Jin-Qiu Zhou i współpracownicy z Chińskiej Akademii Nauk i Uniwersytetu ShanghaiTech-w tym Zhi-Jing Wu jako pierwszy autor-zgłaszają wyniki eksperymentów, które pomagają poprawić nasze zrozumienie kompleksu CST (Wu et al., 2020).
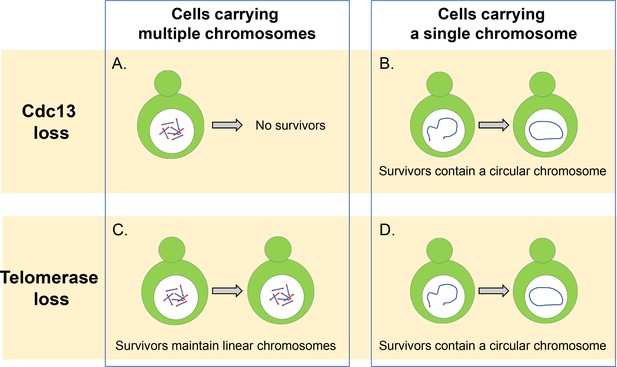
Cdc13 i telomeraza są niezbędne do utrzymania liniowych chromosomów.
(a) komórki drożdży z wieloma liniowymi chromosomami wymagają białka ograniczającego Cdc13 w celu ochrony ich telomerów i zapobiegania fuzji chromosomów. Bez tego białka komórki te nie mogą przetrwać. (B) komórki, które mają pojedynczy liniowy chromosom mogą przetrwać bez Cdc13 poprzez połączenie końców chromosomu razem tworząc okrągły pierścień. C) w przypadku braku enzymu telomerazy, komórki z wieloma liniowymi chromosomami są w stanie przetrwać poprzez zastosowanie szlaków rekombinacji DNA, które mogą wzmacniać sekwencję telomerów lub segmenty DNA znajdujące się pomiędzy sekwencją chromatyny i telomerów. (D) komórki z pojedynczym chromosomem liniowym przeżywają utratę telomerazy przez łączenie się ze sobą, tworząc okrągły chromosom przy użyciu rekombinacji homologicznej, podobnie jak dzieje się to w komórkach pozbawionych białka Cdc13.
zdjęcie: Constance Nugent i Katsunori Sugimoto.
po pierwsze, Wu et al. zbadano, w jaki sposób usunięcie kompleksu CST wpłynęło na żywotność szczepu pączkujących drożdży, w których wszystkie jego 16 chromosomów zostały połączone razem, tworząc pojedynczy okrągły chromosom (Shao et al., 2019). Odkryli, że usunięcie CST nie powstrzymało komórek przed proliferacją ani nie doprowadziło do większej liczby zgonów komórek, nawet gdy kolisty chromosom zawierał powtarzające się sekwencje telomerów. Wydaje się zatem, że główną rolą kompleksu CST jest utrzymanie liniowych chromosomów i zapobieganie ich fuzji z innymi chromosomami, oraz że nie jest on niezbędny do replikacji wewnętrznych sekwencji telomerów.
oprócz tworzenia okrągłego pierścienia, 16 chromosomów pączkujących drożdży może być również połączonych ze sobą, tworząc pojedynczy liniowy chromosom (Shao et al., 2018). Wu et al. okazało się, że usunięcie kompleksu CST znacznie zmniejszyło żywotność tych komórek, ale niektóre z tych komórek były w stanie przetrwać poprzez połączenie końców ich liniowego chromosomu w okrągły pierścień (Fig.1B). Indywidualne usunięcie genów kodujących różne białka kompleksu CST ujawniło, że komórki pozbawione Cdc13 wykazywały wyższe tempo fuzji niż komórki pozbawione genów dla stn1 i Ten1. Sugeruje to, że Cdc13 odgrywa dominującą rolę w hamowaniu fuzji chromosomów, a Stn1 i Ten1 przyczyniają się do ochrony telomerów niezależnie od Cdc13. Szczegóły tego mechanizmu pozostają jednak niejasne i wymagają dalszych badań.
w komórkach typu dzikiego, które zawierają wiele chromosomów, rzadko można znaleźć zrośnięte lub okrągłe chromosomy, nawet gdy aktywność telomerazy została naruszona: dzieje się tak dlatego, że komórki mogą rozszerzać i utrzymywać telomery za pomocą mechanizmu zwanego rekombinacją skierowaną homologią, który naprawia dwuniciowe pęknięcia w DNA (Fig.1C). Jednak Wu et al. okazało się, że zmniejszenie liczby chromosomów doprowadziło do wykrycia większej liczby fuzji w komórkach pozbawionych enzymu telomerazy. Sugeruje to, że zmniejszenie liczby chromosomów zwiększa prawdopodobieństwo, że komórki będą w stanie produkować krążące chromosomy i przetrwać utratę telomerazy.
uważano, że połączenie dwóch końców pojedynczego liniowego chromosomu będzie polegać na ścieżce naprawy DNA zwanej niehomologiczną ścieżką łączenia końca (NHEJ) (Haber, 2016). Jednak Wu et al. wykazano, że przy braku telomerazy fuzja chromosomów zależała od Rad52, który odgrywa kluczową rolę w rekombinacji homologicznej pęknięć DNA w drożdżach pączkujących (Fig.1D). Jest możliwe, że komórki użyte w tym badaniu polegają na szlaku Rad52 do cyrkularyzacji chromosomu, ponieważ pojedynczy chromosom ma odwróconą sekwencję telomerów w pobliżu jednego końca chromosomu. Jeśli taka sekwencja zostanie usunięta, komórki mogą przejść fuzję end-to-end poprzez szlak NHEJ, który jest bardziej powszechny w komórkach ludzkich (Palm and de Lange, 2008). Dodatkowe eksperymenty wykazały, że to odkrycie nie było spowodowane utratą aktywności NHEJ i że ten szlak jest w stanie łączyć linearyzowane plazmidy w pączkujących komórkach drożdży.
praca Wu et al. zapewnia nowy wgląd w to, jak chromosomy łączą się ze sobą i jak telomery są utrzymywane niezależnie od enzymu telomerazy. Co więcej, Wyniki tego badania mogą wykraczać poza drożdże i poprawić nasze zrozumienie różnych ludzkich zespołów medycznych spowodowanych przez końce chromosomów łączących się w kształty pierścieni (Pristyazhnyuk and Menzorov, 2018).