wprowadzenie
Helicobacter pylori (H. pylori) to Gram-ujemna bakteria mikroaerofilowa, której naturalnym środowiskiem jest żołądek. Chociaż zwykle ma formę pałeczkowatą z kilkoma wiciami na jednym końcu, w niesprzyjających warunkach środowiskowych przyjmuje wygląd kokosowy.1,2
H. pylori jest głównym czynnikiem etiologicznym czynnego przewlekłego zapalenia żołądka, wrzodu trawiennego, chłoniaka tkanki limfatycznej związanej z błoną śluzową żołądka (MALT) i raka żołądka. Chociaż szacuje się, że bakteria jest obecna w błonie śluzowej żołądka połowy światowej populacji, choroby te rozwijają się tylko u około 15-20% skolonizowanych osobników.2,3
najczęstsze schematy leczenia powodowały eradykację na poziomie około 85% w wielu obszarach geograficznych,4-6, ale skuteczność została obniżona, zwłaszcza w ostatnich latach, z powodu szybkiego pojawienia się szczepów opornych na antybiotyki i złego przestrzegania zasad leczenia.5,7
należy wziąć pod uwagę, że wyleczenie (jak również zapobieganie powikłaniom) czynnego przewlekłego zapalenia żołądka i wrzodu trawiennego oraz niektórych postaci chłoniaka słodowego o niskim stopniu złośliwości zależy od powodzenia eradykacji H. pylori. Ponadto zapewnienie i utrzymanie skutecznej eliminacji tego mikroorganizmu we wszystkich jego formach biologicznych zapobiegłoby ponownemu rozwojowi infekcji, a tym samym nawrotom choroby.
celem niniejszego przeglądu jest przedstawienie ogólnego przeglądu kokkoidalnej postaci H. pylori, podkreślając jej profil mikrobiologiczny, podatność na antybiotyki i zjadliwość. Jego udział w chorobie żołądka będzie również analizowany, a stopień, w jakim jest związany z ponownym zakażeniem i nawrotem choroby, zostanie zbadany.
przeżywalność i komórkowa adaptacja H. pylorigeneral considerations
wszystkie organizmy żywe są wyposażone w mechanizmy umożliwiające im przetrwanie w niekorzystnych warunkach. Dla niektórych, ich odpowiedź implikuje (oprócz adaptacji metabolicznych) zmiany morfologii komórek.8,9 kilka mikroorganizmów ma zdolność do różnicowania się w żywotny, ale niezwiązany z kulturą stan (VBNC) w odpowiedzi na warunki środowiskowe, które są niekorzystne dla przetrwania i wzrostu. Strategia ta jest szeroko stosowana przez mikroorganizmy, takie jak Salmonella, Campylobacter i Escherichia.10,11
w stanie VBNC bakterie zwykle zmniejszają swój rozmiar i zmieniają kształt, stając się małymi kulistymi ciałami. Zmniejszają szybkość oddychania i transport składników odżywczych oraz zmieniają ekspresję genów i syntezę molekularną. W tym stanie nie można ich wykryć przy użyciu konwencjonalnych technik hodowli. Jednak zmiany warunków środowiskowych mogą prowadzić te mikroorganizmy do „ożywienia” (i ponownego nawrócenia do stanu aktywnego) lub degeneracji.10-13
pylori, gdy doświadcza szkodliwych warunków środowiskowych (w swoim naturalnym środowisku lub poza nim), zmienia swoją klasyczną formę bacillarną I wchodzi w stan VBNC, który prowadzi do zmian morfologicznych i metabolicznych, a także modyfikacji zachowań wzrostowych.14,15
żywotny, ale niekulturalny stan H. pylori
chociaż niektórzy autorzy początkowo próbowali wykazać, że konwersja z formy bacillarnej do kokkoidalnej była procesem pasywnym, który doprowadził do śmierci komórki, a zatem, że formy kokkoidalne były zdegenerowanymi szczątkami martwych bakterii, 16, 17 trzy formy H. obecnie uważa się, że pylori istnieją, a mianowicie (w kolejności od najbardziej do najmniej zjadliwej), żywotna, kulturowa forma bacillary, forma kokkoidalna vbnc i nieżywotna forma degeneracyjna.18-20
morfologicznie konwersja z formy prątkowej do kokkoidalnej zachodzi poprzez pośrednie formy V i U13 ,14 (Fig. 1 i 2), w których struktury komórkowe,takie jak cytoplazma i błona komórkowa, pozostają nienaruszone, 15, 21 podczas gdy wić ma tendencję do owijania się wokół kokkoidalnej struktury komórkowej, stając się w ten sposób prawie niewidoczne. Inne modyfikacje ultrastrukturalne formy kokkoidalnej skutkują dwoma podtypami. Typ A ma nieregularne krawędzie o chropowatej powierzchni i jest uważany za martwą komórkę, podczas gdy Typ B ma gładszą powierzchnię, jest mniejszy i jest uważany za żywą komórkę.21,22
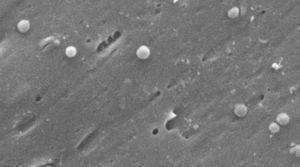
Zdjęcia kokkoidalnej postaci Helicobacter pylori. Skaningowy mikroskop elektronowy Zdjęcie dzięki uprzejmości Dr. Nuno F. Azevedo. LEPABE-Wydział Inżynierii Chemicznej Wydziału Inżynierii Uniwersytetu w Porto (Portugalia).
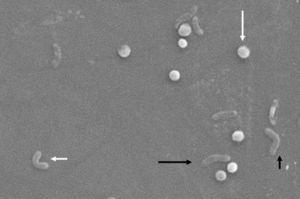
zmiany morfologiczne w Helicobacter pylori. Forma spiralna (długa czarna strzałka), forma V (krótka czarna strzałka), Forma U (krótka biała strzałka) i forma kokosowa (długa biała strzałka). Skaningowy mikroskop elektronowy Zdjęcie dzięki uprzejmości Dr. Nuno F. Azevedo. LEPABE-Wydział Inżynierii Chemicznej Wydziału Inżynierii Uniwersytetu w Porto (Portugalia).
w skaningowym mikroskopie elektronowym (sem) analizy powierzchniowej śluzowej warstwy żelowej chorych na raka żołądka zakażonych H. pylori, Ogata i in.23 obserwowano współistnienie zarówno form prątkowych, jak i kokkoidalnych. Inni autorzy potwierdzili obecność formy kokkoidalnej zarówno w ludzkim żołądku,jak i dwunastnicy, 24-26, chociaż wydaje się, że odsetek form kokkoidalnych jest wyższy w dwunastnicy niż w żołądku, do tego stopnia, że tylko postać kokkoidalna jest obserwowana w niektórych biopsjach dwunastnicy.26,27 fakt ten sugeruje, że H. pylori jest zmuszony do przystosowania się do warunków biologicznych w dwunastnicy lub że Warunki te są idealne dla H. pylori do schronienia się tam w stanie VBNC.
eksperymenty in vitro i in vivo wykazały, że w niekorzystnych warunkach,takich jak aerobioza,28,29 zasadowe pH,29,30 wysoka temperatura,31 długie okresy inkubacji,29,32 przedłużona inkubacja w wodie33 lub leczenie inhibitorami pompy protonowej32 lub antybiotykami, 34 fenotyp kokkoidalny może utrzymać pewien poziom aktywności metabolicznej,ponieważ wyraża szeroką gamę genów obecnych w postaci bacillarnej,35 utrzymuje wykrywalny poziom aktywności ureazy, 36 kontynuuje syntezę białek, choć w mniejszych ilościach (mniej niż 1% ilości białek syntetyzowanych przez 29, 38 wszystkie te dane podkreślają fakt, że zmiany biologiczne u H. pylori w odpowiedzi na szkodliwe bodźce odzwierciedlają jego potężną zdolność do zachowania gatunku w czasie jego życia użytkowego.
tworzenie biofilmu
podobnie jak w przypadku innych bakterii, zdolność H. pylori do utrzymywania się jako jednostka zakaźna i opierania się arsenałowi środków przeciwdrobnoustrojowych mających na celu wyeliminowanie go wynika z zmienności genetycznej, która umożliwia jej rozwój oporności bakterii. Jego strategia przetrwania jest dodatkowo wzmocniona, gdy komórki bakteryjne tworzą tzw. biofilmy.20 biofilmów to rodzaj mikrobiologicznej „wspólnoty”, w której bakterie mocno przylegają do powierzchni biotycznych lub abiotycznych za pomocą własnej matrycy. Matryca ta, złożona z pozakomórkowych substancji polimerowych, 39,40 tworzy środowisko, które jest bardzo tolerancyjne na środki przeciwdrobnoustrojowe i silnie odporne na fagocytozę. W związku z tym unika się różnych mechanizmów obronnych gospodarza, co utrudnia jego eliminację. Biofilmy są uważane za naprawdę złożone, dynamiczne systemy, które ułatwiają poziomy transfer genów między bakteriami. W ten sposób nadają populacjom bakterii nowe zmodyfikowane genomy, które znacząco przyczyniają się do odporności bakterii, zmienności szczepów i zdolności adaptacyjnych.41-43
w badaniu obejmującym 21 biopsji pacjentów, u których bakteria została wcześniej wykorzeniona, H. pylori wyizolowano przez hodowlę w 7 z biopsji, podczas gdy techniki ekspresji genów wykryły żywotne komórki H. pylori w większości biopsji. Sem, w międzyczasie, wykazywał skupione bakterie kokkoidalne ułożone w biofilm mikrobiologiczny, sugerując, że formy kokkoidalne mogą ułatwić przetrwanie bakterii i odporność na antybiotyki.
wrażliwość na antybiotyki postaci kokkoidalnej
wiele badań wykazało, że H. pylori może zmieniać się z postaci kokkoidalnej na kokkoidalną po ekspozycji (in vitro) na różne środki przeciwdrobnoustrojowe. Różne stężenia amoksycyliny, klarytromycyny, metronidazolu i erytromycyny (aby wymienić tylko kilka dostępnych antybiotyków) mogą wywołać tę transformację morfologiczną.34,35,45 największy efekt indukcyjny zaobserwowano w przypadku amoksycyliny, 27,34, 46 wiadomo, że jest wysoce skuteczny in vitro przeciwko H. pylori; jednak obserwacje morfologiczne kultur pokazują, że formy bacillarne zmniejszają się na korzyść form kokkoidalnych.34,46 Faghri et al., 47 uzyskiwało działanie bakteriobójcze dla form kokkoidalnych, w ponad 60% z metronidazolem przy dwukrotnym minimalnym stężeniu hamującym (MIC) i w 80-90% z klarytromycyną w Mic; jednakże leczenie amoksycyliną za pomocą MIC i Mic× 2 nie hamowało żywotnych form kokkoidalnych. Podobnie Berry et al.34 zaobserwował, że podczas gdy amoksycylina w MIC× 10 eliminowała bacillarne formy H. pylori, indukowała również tworzenie form kokkoidalnych. Perkins et al.W badaniu kotów naturalnie zakażonych H. pylori zaobserwowano, że 6 tygodni po leczeniu eradykacyjnym, soki żołądkowe były dodatnie na obecność H. pylori u tylko jednego kota, jednak analiza łańcuchowej reakcji polimerazy (PCR) zidentyfikowała materiał genetyczny H. pylori u wszystkich kotów biorących udział w badaniu. Nawet jeśli H. pylori wykryto u pojedynczego KOTA, zmiany histologiczne były zgodne z przewlekłym zapaleniem żołądka i charakteryzowały się obecnością pęcherzyków limfatycznych.
mając na uwadze te mikrobiologiczne i podstawowe dane badawcze, w poprzednim badaniu przeprowadzonym u pacjentów zakażonych H. pylori-gdzie wcześniej oznaczano wrażliwość wyizolowanych szczepów na amoksycylinę-terapia Podwójna (inhibitory pompy protonowej i amoksycylina) uzyskała wskaźnik wyleczenia szczepów wrażliwych na amoksycylinę tylko 66%. Wynik ten pokazuje obecność ważnych dodatkowych niezależnych czynników oporności bakterii związanych z skutecznym zastosowaniem tego antybiotyku.Jest to szczególnie ważne, jeśli weźmiemy pod uwagę, że wydaje się niemożliwe, aby formy kokkoidalne mogły być wrażliwe na antybiotyki β-laktamowe, ponieważ formy kokkoidalne mają różne profile białek wiążących penicylinę niż formy bacillarne.Jest zatem prawdopodobne, że nie wszystkie organizmy H. pylori zostaną całkowicie wyeliminowane po leczeniu eradykacyjnym; niektóre z nich prawdopodobnie przekształcą się w formy kokkoidalne, a tym samym staną się odporne na leki przeciwbakteryjne. To by wyjaśniało niepowodzenie leczenia i ponowny wzrost.13,34,45
warto podkreślić, że niektóre bardzo niedawne badania wykazały, że wolne kwasy tłuszczowe, takie jak kwas linolenowy i liposomalny kwas linolenowy, mają działanie bakteriobójcze na obie formy H. pylori, niezależnie od ich odporności na antybiotyki.51,52 cząsteczki te mogą zatem mieć potencjalnie skuteczne działanie przeciwbakteryjne w leczeniu zakażenia H. pylori, zwłaszcza w postaci kokkoidalnej.
zjadliwość i patogenność postaci kokkoidalnej
czynniki zjadliwości dla postaci pałeczkowej H. pylori i mechanizmy, za pomocą których ta bakteria bierze udział w rozwoju chorób przewodu pokarmowego, zostały szeroko zbadane.1,3,4 jednak niewiele wiadomo na temat zjadliwości i patogenności postaci kokkoidalnej. Poniżej przedstawiamy najistotniejsze ustalenia na ten temat.
podobnie jak forma pałeczkowata, forma kokkoidalna wyraża główne geny zjadliwości, takie jak mocznik, ureB, hpaA, vacA i cagA, cagE i BabA.35,53,54 to wyrażenie, które występuje w długim okresie, prawdopodobnie odgrywa ważną rolę w przewlekłych ciężkich chorobach żołądka.
wiadomo, że pylori do nabłonka żołądka i dwunastnicy jest ważnym krokiem w indukcji aktywnego przewlekłego zapalenia warstwy śluzówki. Badania SEM wykazały, że kokkoidalna forma H. pylori może występować na powierzchni błony plazmatycznej komórek nabłonka żołądka i, podobnie jak forma bacillarna, ma zdolność do inwazji tych komórek.15,55 w przypadku inwazji komórek formy kokosowe są zamknięte w dwuwarstwowych pęcherzykach błonowych, a komórki nabłonka żołądka wydają się nabrzmiałe i lityczne, wykazując erozję warstwy śluzówki.Biorąc pod uwagę, że postać kokkoidalna jest mniej podatna na antybiotyki, uważa się, że te utajone formy błon osoczowych mogą się rozprzestrzeniać i infekować inne sąsiednie komórki nabłonkowe w przypadku braku skutecznego stężenia antybiotyków.
zakażenie H. pylori wywołuje również miejscową odpowiedź immunologiczną, która nie zwalcza bakterii, umożliwiając w ten sposób przewlekłą chorobę żołądka. Odpowiedź immunologiczną można określić poprzez wykrywanie przeciwciał przy użyciu metod serologicznych opracowanych przy użyciu bacilarnej postaci H. pylori.W rzeczywistości obecność tych swoistych przeciwciał może być stosowana jako epidemiologiczny wskaźnik zakażenia i potwierdzający powodzenie leczenia. Nie istnieją jednak metody serologiczne, które wykrywałyby formy kokkoidalne. W celu ustalenia, czy formy kokkoidalne miały jakikolwiek wpływ na odpowiedź immunologiczną u osób skolonizowanych, Figueroa et al.Opracowano specyficzną technikę testu immunosorbentu związanego z enzymami (ELISA) w celu oceny i porównania odpowiedzi immunologicznej na formy kokkoidalne i prątkowe z zestawem surowic od osób zakażonych objawowo i bezobjawowo. Kokkoidalne formy H. wykazano, że pylori indukuje humoralną odpowiedź immunologiczną podobną do tej indukowanej przez formy bakteryjne u osób zakażonych. W innym badaniu przeprowadzonym u dzieci z bólem nadbrzusza, możliwą rolę postaci kokkoidalnej w zakażeniu H. pylori zbadano przy użyciu techniki ELISA i antygenów przygotowanych z form komórek bacillary i coccoid. Stwierdzono, że 13,3% i 55,8% komórek było seropozytywnych dla antygenów postaci pałeczkowej i kokkoidalnej, podczas gdy wartości seropozytywności dla dzieci z astmą wynosiły odpowiednio 7,0% i 26,5%. Ta Około czterokrotna różnica w seropozytywności między antygenami kokkoidalnymi i bacillarnymi u pacjentów objawowych i bezobjawowych może sugerować możliwą rolę zakaźną kokkoidalnej postaci H. pylori.60
Cellini i in.Intragastrially inoculated concentrated suspensions of H. pylori in coccoid form in a BALB / c mouse model. H. pylori wyizolowano 2 tygodnie później, zmiany histopatologiczne wystąpiły 1 miesiąc później, a wszystkie skolonizowane myszy wykazywały układową odpowiedź przeciwciała Na H. pylori. W innych eksperymentach z myszami BALB / c zwierzęta zaszczepione formami kokkoidalnymi rozwinęły znaczące zmiany patologiczne w żołądku, w tym zmiany erozyjne i infiltrację komórek zapalnych błony śluzowej żołądka.36 She i in., 53 w celu porównania zjadliwości i zakaźności, wewnątrzgastrycznie zaszczepiono myszy BALB/c z H. pylori, jedną grupą z formą pałeczkową i drugą grupą z formą kokkoidalną. W badaniu SEM próbek z 2 grup zaobserwowano przyleganie zarówno form prątkowych, jak i kokkoidalnych do komórek nabłonkowych ściany żołądka i obecność Wici w formach kokkoidalnych. Badanie histologiczne wykazało różne stopnie zmian w błonie śluzowej żołądka, od łagodnego nacieku komórek zapalnych po nadżerki i owrzodzenia. Uszkodzenie błony śluzowej było łagodniejsze u myszy zakażonych formą kokkoidalną, podczas gdy pozytywny wynik nie został uzyskany w grupie kontrolnej, która otrzymała sterylną wodę.53 Rabelo-Gonçalves et al.62 wykazały, że kokkoidalne formy H. pylori wywołał ostrą reakcję zapalną w żołądku myszy od najwcześniejszych stadiów infekcji. Powyższe wyniki podkreślają zdolność form kokkoidalnych do kolonizacji i infekcji błony śluzowej żołądka in vivo.
kilka badań wykazało obecność formy kokkoidalnej w wodzie.33,63 jedno z takich badań—przeprowadzone przez naszą grupę-porównało 2 grupy odsadzonych od maciory myszy Wistar, z których jedna podawała wodę ze studni i wodę z kranu przez dłuższy czas, a druga podawała jałową wodę destylowaną, stwierdzając, że u myszy z grupy badanej rozwinął się przewlekły proces zapalny z tworzeniem płytek limfocytowych i obecnością prątków zgodnych z H. pylori.64
jak wcześniej wspomniano, logiczne byłoby przypuszczenie, że w niekorzystnych warunkach H. pylori wchodzi w stan „spoczynkowy”, modyfikując swoją klasyczną formę pałeczkową do formy kokkoidalnej bez wywoływania zmian degeneracyjnych w genomie i zachowując zdolność do powrotu do formy pałeczkowej po poprawie warunków środowiskowych lub naturalnych.
udział postaci kokkoidalnej w ponownym dojrzewaniu
nawrót H. pylori po udanej eradykacji jest rzadki w krajach rozwiniętych w porównaniu z krajami rozwijającymi się, z rocznymi wskaźnikami nawrotów odpowiednio 2,67% i 13%.65,66
istnieją dwa rodzaje nawrotów zakażenia H. pylori: recrudescence, gdy szczep bakteryjny odpowiedzialny za nawrót jest genetycznie identyczny z tym wyizolowanym przed eradykacją; i ponowna infekcja, gdy nawrót jest spowodowany przez inny szczep.Odróżnianie odrastania od ponownej infekcji wymaga analizy PCR lub polimorfizmu genetycznego w celu identyfikacji szczepów bakteryjnych.67,68 Ponieważ Metody te nie są rutynowo stosowane, w rutynowej praktyce klinicznej często nie jest możliwe rozróżnienie między ponownym zakażeniem a ponownym ponownym zakażeniem.
H. nawrót pylori ma znaczenie kliniczne, ponieważ nawrót choroby wrzodowej można zaobserwować u znacznej części zakażonych pacjentów, podczas gdy ponowne pojawienie się mikroorganizmów może wyjaśniać nawroty chłoniaka słodowego po leczeniu.Uważa się, że czynniki takie jak picie wody z kranu, choroby zębów i dziąseł, nawracające zapalenie migdałków, hospitalizacja, sprzęt dentystyczny i medyczny oraz kontakt z członkami rodziny wpływają na nawrót H. pylori.Inne czynniki związane z nawrotem zakażenia to: młodszy wiek, cukrzyca u młodych pacjentów, niski roczny dochód i długotrwałe hamowanie kwasu żołądkowego po eradykacji.73-76
za najbardziej prawdopodobną przyczynę nawrotu uważa się nawrót w pierwszym roku po eradykacji, natomiast ponowne zakażenie może wystąpić po dłuższym okresie.68,77 wiele przypadków nawrotów w krajach rozwiniętych w rzeczywistości wynika z odradzania się. Ponowna infekcja jest bardziej powszechna w krajach rozwijających się, ponieważ ludzie są najwyraźniej stale narażeni na H. pylori.65,78
stosując techniki elektroforezy białek żelu poliakrylamidowego, Costas i wsp.79 stwierdziło, że pacjenci z nawrotem po 4 tygodniach od leczenia eradykacyjnego nie byli w rzeczywistości zakażeni innym szczepem H. pylori; raczej szczep, który spowodował pierwotne zakażenie, nie został całkowicie wyeliminowany przez leczenie, co prowadziło do nawrotu zakażenia. Dlatego ważne jest, aby wziąć pod uwagę skuteczność schematu terapeutycznego: H. nawrót pylori jest częsty u pacjentów leczonych terapiami o niskiej skuteczności, ale występuje rzadko, gdy stosuje się terapie o wysokiej skuteczności. Wykazano to w badaniu dotyczącym częstości występowania nawrotów H. pylori w Hiszpanii przeprowadzonym przez Gisberta i wsp., 80 who stwierdziła, że nawrót H. pylori w 6 miesięcy po eradykacji wynosił 8,2% u pacjentów leczonych terapiami o niskiej skuteczności, ale tylko 1,7% u pacjentów leczonych terapiami o wysokiej skuteczności.
w badaniu przeprowadzonym w Korei w latach 2007-2010, H. wskaźniki nawrotów pylori analizowano po 6 miesiącach udanej terapii eradykacyjnej pierwszego i drugiego rzutu, z roczną obserwacją—do końca okresu badania-na podstawie testów oddechowych, biopsji żołądka i szybkich testów ureazowych.Stwierdzono, że roczne wskaźniki nawrotów w ciągu i po 2-letniej obserwacji wynosiły odpowiednio 9,3% i 2,0% po terapii pierwszego rzutu oraz odpowiednio 4,5% i 2,9% po terapii drugiego rzutu. Autorzy doszli do wniosku, że roczne H. częstość nawrotów pylori u pacjentów leczonych eradykacją wykazywała gwałtowny spadek po 2-letnim okresie obserwacji. Uznano, że jest to wystarczający czas po leczeniu, aby potwierdzić eradykację, a także wystarczający czas, aby umożliwić rozróżnienie między nawrotem a ponownym dojrzewaniem szczepów H. pylori.81
ostateczne rozważania i wnioski
biorąc pod uwagę zdolność H. pylori aby wejść w stan VBNC, gdy zostanie poddany niekorzystnym warunkom w jego siedlisku lub poza nim, rozsądne jest przypuszczenie, że schematy leczenia antybiotykami stosowane w celu wyeliminowania bacilarnej formy H. pylori mogą indukować formy Kokosowe vbnc zdolne do przetrwania przez długi czas w środowisku żołądkowo-jelitowym. Stąd mogą mieć bezpośredni i pośredni potencjał chorobotwórczy, który prowadzi do nawrotu zakażenia, awarie leczenia, nawroty infekcji i nawrót choroby żołądka i dwunastnicy. Skuteczne wyeliminowanie może zatem wymagać nie tylko wyeliminowania form bakteryjnych, ale także form kokosowych lub zapewnienia, że formy Kokosowe nie są indukowane.
mając na uwadze, że ponieważ rutynowe metody stosowane obecnie w praktyce klinicznej w celu potwierdzenia eradykacji H. pylori nie mogą wykryć form kokkoidalnych, gospodarze mogą być nieprawidłowo zdiagnozowani jako wolne od infekcji; ponadto metody te mogą nie być w stanie dostarczyć pełnych dowodów na potencjał kliniczny leków stosowanych do eradykacji H. pylori. Tak więc, aby eradykacja została uznana za udaną, zaleca się coroczne monitorowanie-przy użyciu technik nieinwazyjnych lub, jeśli są dostępne, metod molekularnych—w celu ustalenia, czy bakterie zostały całkowicie wyeliminowane, szczególnie w obszarach o dużym rozpowszechnieniu i u pacjentów z ryzykiem nawrotu.
wreszcie, konieczne są dalsze badania kokkoidalnej postaci VBNC H. pylori, jej potencjału chorobotwórczego, jej udziału w infekcji i ponownym dojrzewaniu oraz jej roli w tworzeniu biofilmów w żołądku i innych miejscach w obrębie gospodarza. Takie badania umożliwiłyby opracowanie zarówno bardziej skutecznych protokołów diagnostycznych, które unikną niedoceniania kolonizacji przez H. pylori, jak i nowych strategii terapeutycznych mających na celu wyeliminowanie form kokkoidalnych i „rozbrojenie” biofilmów.
konflikt interesów
autorzy oświadczają, że nie mają konfliktu interesów.