wprowadzenie
infekcje związane z opieką zdrowotną (Hais), takie jak bakteremia wywołana przez wielolekooporne szczepy Pseudomonas aeruginosa, powodują zwiększoną zachorowalność i śmiertelność, wydłużając hospitalizację i wyższe koszty w porównaniu z infekcjami wywołanymi przez wrażliwe szczepy.1-3 Zakażenia wywołane przez te odporne mikroorganizmy są często związane z wiekiem, rakiem, chorobami serca, cukrzycą, intensywnym stosowaniem antybiotyków i inwazyjnymi procedurami, takimi jak hemodializa, cewnik wentylacyjny mechaniczny, tracheostomia i inne.
zwiększenie częstości występowania opornych na wiele leków P. aeruginosa jako przyczyna zakażenia szpitalnego jest globalnym problemem, konsekwencją zdolności tego mikroorganizmu do rozwijania oporności na prawie wszystkie inne środki przeciwdrobnoustrojowe podczas chemioterapii przeciwdrobnoustrojowej, albo przez wybór mutacji w genach chromosomowych, albo przez poziomy transfer genów.5,6 w Brazylii problem ten jest jeszcze bardziej znaczący, ponieważ istnieje bardzo duża gęstość stosowania antybiotyków, zwłaszcza β-laktamów, karbapenemów i fluorochinolonów.7,8 opór w P. aeruginosa do karbapenemów wynosi do 60% W niektórych brazylijskich szpitalach9, 10 i występuje głównie w wyniku produkcji metallo-β-laktamaz (MBL).
znanych jest dziesięć podklas enzymów MBL: Imp (Imipenemase), Vim (Verona Imipenemase), SPM-1 (São Paulo MBL), gim (German Imipenemase), SIM-1 (Seul Imipenemase),11 aim-1 (Australian Imipenemase),12 KHM (Kyorin University Hospital),13 NDM-1 (New Delhi MBL),14 Dim-1 (Dutch imipenemase),15 i TMB (Tripoli MBL).16 w Brazylii najbardziej rozpowszechnionymi podklasami są IMP – 1 i SPM-1.
kilka innych genów zjadliwości, jak również tworzenie biofilmu mogą przyczyniać się do patogenności ciężkich zakażeń, w szczególności związanych z procedurami inwazyjnymi.17 wśród głównych czynników zjadliwości opisanych w literaturze, podkreślamy te związane z przyleganiem mikroorganizmów do komórek gospodarza przez wici, fimbriae i alginate18 oraz te, które ułatwiają zakłócenie integralności nabłonka i zakłócają układ odpornościowy, takie jak elastaza, fosfolipaza C i proteaza alkaliczna, dalej egzotoksyna a, piocyjanina i piowerdyna.19 produkcja biofilmu jest szczególnie związana z trudnością antybiotyków w przenikaniu do komórek, ponieważ wydzielają one matrycę polimerową złożoną z polisacharydów, białek i DNA.20,21
celem niniejszego badania była identyfikacja czynników ryzyka związanych z bakteriemią wywołaną przez oporną na karbapenem P. aeruginosa, jak również z wytwarzaniem MBL. Dodatkowo zbadaliśmy częstotliwość występowania genów zjadliwości i ich zdolność do tworzenia biofilmu.
materiały i metodyspacjenci i Szpital
P. szczepy aeruginosa zostały odzyskane od pacjentów przyjętych do Szpitala Uniwersyteckiego Uberlandia (Brazylia), Federalnego Uniwersytetu Uberlândia (HC-UFU) i uzyskane z laboratorium mikrobiologicznego HC-UFU, w okresie od maja 2009 do grudnia 2012, biorąc pod uwagę tylko pierwszy epizod zakażenia.
projekt badania
przeprowadziliśmy przypadek (pacjenci z bakteriemią wywołaną przez P. aeruginosa oporną na karbapenemy) w porównaniu z grupą kontrolną (pacjenci z bakteriemią wywołaną przez P. aeruginosa wrażliwą na karbapenemy) w celu identyfikacji czynników ryzyka u pacjentów zakażonych P. aeruginosa. aeruginosa oporna na karbapenemy. Dodatkowo ocenialiśmy wtórne wyniki, w tym okresy hospitalizacji, przyjęcia na oddział intensywnej terapii (OIOM) oraz stosowanie zabiegów inwazyjnych. Cechy demograficzne, kliniczne i epidemiologiczne każdego pacjenta włączonego do badania zostały odzyskane z dokumentacji klinicznej.
definicje
infekcje związane z opieką zdrowotną (Hais) są definiowane jako wszelkie zakażenia nabyte po przyjęciu pacjenta do szpitala. HAIs mogą objawiać się podczas hospitalizacji lub po wypisie, ponieważ są one związane z hospitalizacją lub procedurami wykonywanymi podczas hospitalizacji.Bakteriemia, według Centers for Disease Control and Prevention,23 można zdefiniować jako obecność żywych bakterii we krwi udokumentowaną pozytywnym wynikiem posiewu krwi. Bakteremia została sklasyfikowana jako pierwotna, gdy nie była związana z innym ogniskiem zakażenia lub gdy była związana z cewnikiem dożylnym, i wtórna, gdy była klinicznie związana z zakażeniem w innym miejscu anatomicznym.Oporność Wielolekowa definiowana jest jako nabyta niewrażliwość na co najmniej jeden środek z trzech lub więcej kategorii środków przeciwdrobnoustrojowych.Leczenie przeciwdrobnoustrojowe uznano za niewłaściwe, gdy wyizolowany mikroorganizm wykazywał in vitro oporność na środki przeciwdrobnoustrojowe stosowane w leczeniu pacjenta i (lub) brak leczenia przez 24 godziny po rozpoznaniu zakażeń drobnoustrojowych.25
kliniczne badania mikrobiologiczne i molekularne
Kultury zebrano zgodnie z protokołem stosowanym przez laboratorium mikrobiologiczne HC-UFU i przetworzono przy użyciu zautomatyzowanego systemu BACT / Alert® (BioMérieux, Durham, USA). Testy identyfikacji i wrażliwości na środki przeciwdrobnoustrojowe przeprowadzono automatyzując przy użyciu systemu VITEK II, a szczepy wykazujące średnią wrażliwość uznano za oporne. Protokoły kontroli jakości zostały wykorzystane zgodnie ze standardami Clinical and Laboratory Standard Institute.26-28 oporny na karbapenem P. Izolaty aeruginosa zostały fenotypowo przebadane pod kątem produkcji MBL przy użyciu podwójnych testów synergii, jak opisano wcześniej.29,30 ponadto, w celu oceny obecności genów MBL w szczepach P. aeruginosa, przeprowadzono multiplex PCR, jak opisano wcześniej.31 warunki cykli to: 94°C przez 5 minut, następnie 30 cykli denaturacji w 94°C przez 30 sekund, wyżarzanie w 53°C przez 45 sekund i przedłużanie w 72°C przez 30 sekund, a następnie końcowe przedłużanie w 72°C przez 10 minut, wszystko w mastercycler personal (Eppendorf). Wykrywanie genów zjadliwości kodujących proteazę alkaliczną (aprA), elastazę a (lasA), elastazę (lasB),32 hemolityczną fosfolipazę C (plcH), niehemolityczną fosfolipazę C (plcN), egzotoksynę a (toxA) i alginian (algD)33 oznaczono metodą uniplex PCR, stosując następujący protokół: 94°C dla 3min, 30 cykli w 94°C dla 30s, 55°C dla 1min i 72 dla 1min i 30s i 72°C przez 5min.
Test początkowej adhezji 34
w celu oceny początkowej adhezji do 96-studzienkowych płyt polistyrenowych dodano 200 µl zawiesiny komórkowej zawierającej 1×107 komórek/mL przygotowanej w TSB. Początkową adhezję pozostawiono na 2 godziny w temperaturze 37°C z obrotem przy 120 obr. / min. Bakterie przyklejone do 96-studzienkowych płyt polistyrenowych przemyto dwukrotnie 0,9% roztworem NaCl i zebrano przez skrobanie studzienek przez lata 90. otrzymaną zawiesinę komórek platerowano na TSA w celu wyliczenia jednostek tworzących kolonie (CFU). Wszystkie eksperymenty przeprowadzono w trzech egzemplarzach w trzech niezależnych eksperymentach. Szczep ATCC15692 (PAO1) zastosowano jako kontrolę pozytywną, a TSB bez bakterii jako kontrolę negatywną.
badanie tworzenia Biofilmu35
do 96-studzienkowych płyt polistyrenowych dodano 200 µl zawiesiny komórkowej zawierającej 1×107 komórek/mL przygotowanej w TSB. Tworzenie biofilmu pozostawiono na 24 godziny w 37°C z obrotem przy 120 obr. / min. Bakterie wyhodowane w 96-studziennych płytkach z polistyrenu przemyto dwukrotnie 0,9% roztworem NaCl i pozostawiono do wyschnięcia w pozycji odwróconej. Całkowitą biomasę mierzono za pomocą wiązania metanolu (Merck), barwienia fioletu krystalicznego (Merck) i elucji kwasu octowego (Merck), jak opisano wcześniej. Eluowany barwnik usunięto z każdej studzienki i umieszczono w nowej 96-studzienkowej płytce mikrotitru, a jego absorbancję odczytano na czytniku płyt ELISA (BioTek Instruments Inc., Vermont, USA) na 570nm. Eksperymenty przeprowadzono z ośmioma replikatami dla każdego szczepu w trzech niezależnych eksperymentach. Jako negatywną kontrolę zastosowano TSB bez bakterii. Wartość odcięcia gęstości optycznej (ODc) ustalono jako trzy odchylenia standardowe (SD) Powyżej średniej gęstości optycznej (OD) kontroli negatywnej: ODc=średnia OD kontroli negatywnej+3X SD kontroli negatywnej. Dla łatwiejszej interpretacji wyników szczepy podzielono na następujące kategorie według gęstości optycznej: (ODi): ODi≤ODc lub ODc
ODi2x ODc=producent nie biofilmu/producent słabego biofilmu; 2x ODcODi4x ODc=producent umiarkowanego biofilmu; 4x ODcODi=producent silnego biofilmu.Koncentracja komórek biofilmu36
stężenie komórek biofilmu oznaczono przez wyliczenie CFU. Po utworzeniu biofilmu biofilmy przemyto dwukrotnie 0,9% roztworem NaCl i zebrano po zeskrobaniu studzienek przez 90 sekund. otrzymaną zawiesinę komórek pokryto płytkami TSA. Wszystkie eksperymenty przeprowadzono w trzech egzemplarzach, przy trzech niezależnych okazjach.
analiza statystyczna
analiza statystyczna została wykonana przy użyciu GraphPad Prism V.5 (GraphPad Software, San Diego, CA). Testy ilościowe porównano przy użyciu Kruskal-Wallis, stosując Dunn ’ s multiple comparison test. Wszystkie testy przeprowadzono z poziomem ufności 95%, a istotność statystyczną zdefiniowano jako P
0,05.Etyczna akceptacja
komisja etyki badań Uniwersytetu Federalnego Uberlandia oceniła i zatwierdziła nasz projekt badania.
wyniki
od 1 maja 2009 r.do 31 grudnia 2012 r. w laboratorium mikrobiologicznym Szpitala Uniwersyteckiego przeprowadzono szpitalny nadzór nad występowaniem bakterii P. aeruginosa. W tym okresie do badania włączono 157 nie powtarzających się pacjentów z bakteriemią P. aeruginosa. Szczegółowe informacje na temat czynników związanych z rozwojem bakteriemii oraz cech klinicznych i demograficznych, a także rozmieszczenia pacjentów w oddziałach przedstawiono w tabelach 1 i 2. Pierwotna bakteremia wystąpiła u 75,8%, a osoby o nieznanym ognisku u 62.4% przypadków. Wtórna bakteriemia stanowiła 24,2% chorych, gdzie głównym ogniskiem zakażenia były drogi oddechowe (17,2%). Ponadto 43,9% pacjentów miało bakteriemię z opornym na karbapenem P. aeruginosa, a większość z tych pacjentów została przyjęta na OIOM. Większość pacjentów stanowili mężczyźni (66,8%), ze średnim pobytem w szpitalu wynoszącym 63,2±80,17 dni i średnim wiekiem 52,01±20,24 lat.
Dystrybucja pacjentów zakażonych Pseudomonas aeruginosa w różnych jednostkach Szpitala Klinicznego Federalnego Uniwersytetu Uberlândia od maja / 2009 do grudnia / 2012.
| kliniki | ogółem | Pseudomonas aeruginosa oporny na Karbapenem |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Chirurgia | 35 (22.3) | 16 (23.2) |
| Przychodnia Lekarska | 24 (15.3) | 10 (14.5) |
| Onkologia | 14 (8.9) | 2 (2.9) |
| Izba Przyjęć | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| OIOM noworodków | 2 (1.3) | 0 |
| OIOM u dzieci | 2 (1.3) | 1 (1.5) |
| przeszczep | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
oddział intensywnej terapii.
oparzenia, oddział bólu klatki piersiowej.
czynniki ryzyka związane z opornością na karbapenem u pacjentów z bakteriemią wywołaną przez Pseudomonas aeruginosa.
| Czynniki ryzyka | Tylko | Odporność na карбапенему | Мультичувствительность | Однофакторный | Wielowariantowy | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORB (CIC 95%) | pd | LUB (CI 95%) | p | |
| Średni wiek (lata) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Mężczyzna / Kobieta | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| czas hospitalizacji, średnia (dni) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| oddział intensywnej terapii | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Chirurgia | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| zabiegi inwazyjne (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| cewnik centralny żylny | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| drenaż chirurgiczny | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| sondy żywienie dojelitowe / żołądkowe | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hemodialysis | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| żywienia Pozajelitowego | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Warunki współwystępowania | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| niewydolność serca | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| rak | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| cukrzyca | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| przewlekła niewydolność nerek | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| ludzki wirus niedoboru odporności | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| Primary bacteremia | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| cewnik Centralny związany | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| nieznany | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| bakteremia wtórna | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| drogi oddechowe | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| układ moczowy | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| nieodpowiednia terapia | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| wcześniejsze stosowanie antybiotyków | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| śmiertelność | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
szczepy Wieloczułe uznano za szczepy, u których stwierdzono wrażliwość na wszystkie badane środki przeciwdrobnoustrojowe.
iloraz szans.
przedział ufności.
wartość P.
statystycznie znamienne (P≤0, 05).
wcześniejsze stosowanie antybiotyków (78,3%), procedury inwazyjne (88,5%), choroby współistniejące (77,7%) i wcześniejsze operacje chirurgiczne (43,9%) były częste. Stwierdzono, że 31,2% pacjentów otrzymywało nieodpowiednie leczenie, a śmiertelność wynosiła 58,6%. Kilka wewnętrznych i zewnętrznych czynników rozwoju bakteriemii przez szczepy P. aeruginosa oporny na karbapenemy wykryto metodą analizy jednostkowej. Jednak tylko wentylacja mechaniczna, przewody dojelitowe/nosowo-żołądkowe, pierwotna bakteremia o nieznanym ognisku i niewłaściwe leczenie były czynnikami ryzyka niezależnie związanymi z rozwojem bakteriemii P. aeruginosa opornej na karbapenem.
analizowano wytwarzanie MBL dla 56 izolatów P. aeruginosa opornych na karbapenem. 9 (25,0%) izolatów było fenotypowo dodatnich i łącznie 16,1% (n= 9/56) było zgodne z genami amplicons MBL, co stanowiło 10,71% blaSPM-1 i 5.3% genów blavima ogólnie szczepy wykazywały profil oporności wielolekowej. W przypadku innych ocenianych genów zjadliwości (aprA, plcH, plcN, lasA, lasB, toxA i algD) wszystkie szczepy wykazywały wysoką częstość występowania (88%).
spośród 88 wrażliwych na karbapenem szczepów P. aeruginosa, 21 (23,9%) było opornych na inne β-laktamy. Dla 69 szczepów opornych na karbapenemy profil oporności był wysoki: β-laktam 50/69 (72,5%), fluorochinolony 48/69 (69,6%) i aminoglikozydy 50/69 (72,5%) (Tabela 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
oprócz badań MBL wybrano pięć szczepów (dwa zawierające SPM-1, jeden zawierający VIM i dwa fenotypowo dodatnie dla MBL) do oceny tworzenia biofilmu za pomocą testów ilościowych całkowitej biomasy poprzez barwienie fioletem krystalicznym. Biorąc pod uwagę obecność genów MBL, wszystkie szczepy zostały zidentyfikowane jako producenci silnie biofilmu ze średnią biomasą wynoszącą 0,90±0,61. Nie obserwowano różnic w początkowej przyczepności poszczególnych szczepów. Jednak dla szczepu zawierającego Gen blaVIM był mniejszy OD (Fig. 1).
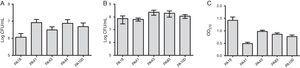
(a) liczba komórek przyklejonych do powierzchni polistyrenu po 2 godzinach, wyrażona jako log CFU/mL dla 5 próbek Pseudomonas aeruginosa wyizolowanych z krwi. B) Liczba żywych komórek w biofilmie (log CFU / mL). C) Biomasa biofilmu wyrażona jako gęstość optyczna fioletu krystalicznego (OD570nm).
dyskusja
bakteriemia Szpitalna wywołana przez wielo-oporne mikroorganizmy, czy to Gram-dodatnie, czy Gram-ujemne, często była opisywana jako znaczący problem zdrowotny, który zwiększa koszty szpitala i utrudnia ustalenie odpowiedniej terapii przeciwdrobnoustrojowej, co prowadzi do gorszego rokowania.Wysoki udział bakteriemii szpitalnej wywołanej przez P. aeruginosa oporną na karbapenemy wskazuje na znaczenie tego organizmu jako istotnej przyczyny tej infekcji w naszym szpitalu. Wysoki udział bakteriemii szpitalnej wywołanej przez P. aeruginosa oporną na karbapenemy wskazuje na znaczenie tego organizmu jako istotnej przyczyny tej infekcji w naszym szpitalu. Wyniki różnych badań sugerują, że wewnętrzne czynniki ryzyka, takie jak wentylacja mechaniczna, zastosowanie rurki nosowo-żołądkowej i wcześniejsze zastosowanie antybiotyków zwiększają ryzyko rozwoju bakteriemii wywołanej przez P. aeruginosa oporną na karbapenemy, a także ryzyko zachorowalności i śmiertelności.38
w badaniu tym, zgodnie z analizą jednostkową, ponad 50% czynników ryzyka było związanych z zakażeniem tym mikroorganizmem. Jednak tylko wentylacja mechaniczna, Przewody do karmienia dojelitowego/żołądkowego, pierwotna bakteriemia nieznanego pochodzenia i niewłaściwe leczenie uznano za niezależne czynniki ryzyka w analizie wielowymiarowej.
centralny cewnik żylny jest jednym z najważniejszych czynników ryzyka nabytej bakteriemii w szpitalu, ponieważ był związany z ponad 90% tych zakażeń.Chociaż nie był to istotny czynnik ryzyka w tym badaniu, 85,5% pacjentów z bakteriemią oporną na karbapenem P. aeruginosa miało tę inwazyjną procedurę.
często bakteriemia wywołana przez P. aeruginosa oporna na antybiotyki ma wyższy wskaźnik śmiertelności, w szczególności z powodu podania niewłaściwej antybiotykoterapii.40 W tym badaniu zbadaliśmy kohortę 157 pacjentów z bakteriemią wywołaną przez szczepy P. aeruginosa, z czego 69 zakażonych jest opornymi na karbapenem izolatami P. aeruginosa. Całkowita śmiertelność była wyższa w grupie opornej na karbapenem; jednak obecność szczepów opornych była znacząco związana z niewłaściwym leczeniem przeciwdrobnoustrojowym, co dowodzi, że ta grupa zwykle ma gorsze rokowanie. Podobnie jak nasze ustalenia, poprzednie badania wykazały, że P. aeruginosa izolowany od pacjentów, którzy otrzymali niewłaściwą terapię, miał gorsze rokowanie, z odsetkami 46,1% 41 i 53,8%.
poza tym, że jest związana z ciężkimi zakażeniami, oporność na karbapenemy u P. aeruginosa często powoduje wytwarzanie MBL.Nasze wyniki wykazały, że p oporny na karbapenem. aeruginosa były rozpowszechnione w całym szpitalu z genami kodującymi te enzymy w 16,1% szczepów, stanowiących 10,7% genotypu blaSPM-1 i 5,4% genotypu blaVIM. Ponieważ częstość występowania szczepów wielolekoopornych była wysoka, wyniki te sugerują, że w tych szczepach współistnieją inne mechanizmy oporności, takie jak pompy wypływowe i nieprzepuszczalność membrany.44
częstość występowania MBL jako mechanizmu oporności wzrosła, szczególnie w Ameryce Łacińskiej.45 w Brazylii rozpowszechnienie P wytwarzającego MBL. aeruginosa różni się w zależności od regionu i szpitali, a wskaźniki wahają się od 7,5% do 44%.11
enzym SPM-1 jest uważany za najczęstszy w Brazylii, a następnie IMP-1,11,46, jednak zaobserwowano również wzrost częstości występowania izolatów P. aeruginosa zawierających enzym VIM.45,47 w naszym badaniu enzym SPM-1 wykryto w 16,7% fenotypowo wytwarzających się próbek MBL, a następnie enzym VIM, który wykryto w 8,3% przypadków. Wyniki te wskazują na znaczne rozprzestrzenianie się genów kodujących MBL w naszym regionie.
biorąc pod uwagę obecność MBL i produkcję biofilmu, 100% szczepów zostało sklasyfikowanych jako silni producenci. Inne badanie przeprowadzone w Brazylii wykazało, że 40% P. aeruginosa sklasyfikowanych jako wytwarzające silny biofilm było również producentami MBL.35 uważamy, że wyniki te są ważne, gdy te cechy (produkcja biofilmu i MBL) nakładają się na siebie i infekcje wywołane przez te bakterie są trudne do wyleczenia. Jest to częściowo uzasadnione, ponieważ wzrost bakterii w biofilmie jest około 64 razy bardziej odporny na działanie środków przeciwdrobnoustrojowych.48
P. aeruginosa ma dużą liczbę zewnątrzkomórkowych czynników zjadliwości, które również przyczyniają się do patogenności i nasilenia tych zakażeń, takich jak kodowane przez geny aprA, plcH, plcN, lasA, lasB, Toxa i algD.32,33 nasze dane wykazały, że obecność profilu multiresistant w większości szczepów (88%) była dodatnia dla genów zjadliwości aprA, plcH, plcN, lasA, lasB, toxA i algD, z wyjątkiem jednego szczepu, który nie wykazywał genów Toxa i plcH, co może dodatkowo przyczyniać się do gorszego rokowania związanego z ciężkimi infekcjami.
nasze wyniki potwierdzają wcześniejsze ustalenia dotyczące czynników ryzyka rozwoju bakteriemii opornej na karbapenem P. aeruginosa, a także rozpowszechniania szczepów wytwarzających MBL typu SPM-1. Jednak badanie to przyczynia się do dalszych dowodów na rozprzestrzenianie się szczepów wytwarzających MBL, szczególnie typu VIM, u wysoce zjadliwych szczepów i producentów silnie biofilmu.
konflikty interesów
autorzy nie deklarują konfliktu interesów.